含C?肽的用于預防或治療糖尿病性血管生成損傷的組合物的制作方法與工藝
含C-肽的用于預防或治療糖尿病性血管生成損傷的組合物技術領域本發明涉及使用C-肽預防或治療糖尿病相關疾病。更具體的,本發明涉及使用C-肽預防或治療糖尿病性血管生成損傷的方法,使用C-肽預防或治療糖尿病性傷口愈合損傷的方法,和包括C-肽的用于預防或治療損傷的組合物。
背景技術:
糖尿病是一組具有多種病因的代謝性疾病,特征在于由胰島素活性的完全或功能性缺乏引起的慢性高血糖。維持很長時間的高血糖水平會引起慢性代謝性障礙并且引起血管的損傷,并伴隨各種并發癥的隨后發病。這些典型地在10年糖尿病之后顯現,因為幾乎身體所有的器官都受到了損傷。在糖尿病患者中尤其觀察到不足的血管生成。血管生成是傷口愈合和治療缺血性組織損害的關鍵步驟,但是在糖尿病患者中血管生成不能正常進行。相應的,需要一種糖尿病性血管生成障礙的療法,但是迄今為止還沒有報道有引人注目的成果。這些糖尿病并發癥與VEGF(血管內皮生長因子)相關。已知VEGF誘導ERK1/2和Akt的磷酸化以及NO的產生,促進血管生成,并且用作血管滲漏因子以引發肌肉水腫。人類的C-肽是從胰島素原中切下的短肽,并且以與胰島素等摩爾的濃度被胰腺β細胞分泌到循環中。伴隨胰島素的C-肽缺乏是I型糖尿病和II型糖尿病晚期的典型特征,并且隨后出現各種并發癥的發病,包括受損的傷口愈合。在糖尿病中,受損的傷口愈合是嚴重的并發癥,導致系統性感染、疼痛、潰瘍和截肢,并且甚至可能是致命的。C-肽用于診斷糖尿病,但是還沒有報道C-肽在治療糖尿病性血管生成障礙中的應用的引人注目的成果。在此背景下,本發明人對治療糖尿病性血管生成損傷進行了深入且徹底的研究,并且發現C-肽可以用于在糖尿病中保護生理血管生成損傷或刺激傷口愈合,從而得到了本發明。
技術實現要素:
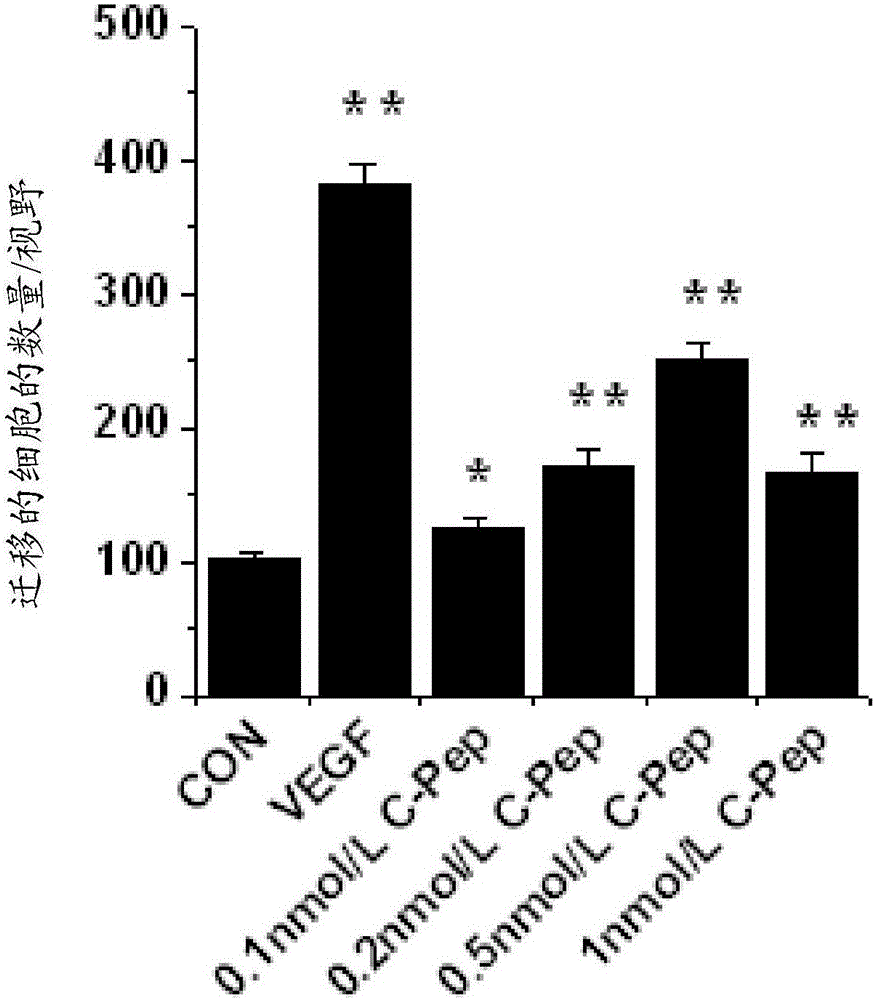
因此,本發明的一個目的是提供一種使用C-肽預防或治療糖尿病性血管生成損傷的方法,或用于該方法的組合物。本發明的另一個目的是提供一種使用C-肽預防或治療糖尿病性傷口愈合損傷的方法,或用于該方法的組合物。根據本發明的一個方面,本發明提供了一種預防或治療糖尿病性血管生成損傷的方法,所述方法包括給予有需要的動物有效量的C-肽,也就是說,給予易于受糖尿病性血管生成損傷影響或受到糖尿病性血管生成損傷影響的動物有效量的C-肽。根據本發明的另一方面,本發明提供了一種預防或治療糖尿病性血管生成損傷的藥物組合物,該藥物組合物包括作為活性成分的C-肽。根據本發明的又一方面,本發明提供了一種預防或治療糖尿病性傷口愈合損傷的方法,所述方法包括給予有需要的動物有效量的C-肽,也就是說,給予易于受糖尿病性傷口愈合損傷影響或受到糖尿病性傷口愈合損傷影響的動物有效量的C-肽。根據本發明的再一方面,本發明提供了預防或治療糖尿病性傷口愈合損傷的藥物組合物,該藥物組合物包括作為活性成分的C-肽。根據本發明的被發現能夠誘導血管生成的包括C肽的藥物組合物在治療需要血管生成的廣譜的癥狀中,諸如糖尿病性傷口愈合損傷,以及包括糖尿病性血管生成損傷的各種糖尿病并發癥中,都具有預防或治療應用。附圖說明圖1提供了如通過轉板遷移測定法(A、B)和通過傷口愈合測定法(C、D)分析,示出C-肽在HUVEC中誘導細胞遷移和傷口愈合的圖像和曲線圖。HUVEC被接種在可滲透支撐物的上孔上,并且在下孔中存在10ng/mlVEGF或有預定濃度的C-肽(C-Pep)的情況下,孵育12h:圖1A示出在過濾器的下表面上的遷移的細胞的圖像;圖1B是柱狀圖,其中通過對遷移細胞進行計數量化了趨化性遷移(n=3);圖1C示出了融合的細胞層的共聚焦顯微圖像,該融合的細胞層是受傷的并且與10ng/mlVEGF或0.5nMC-肽孵育24h;以及圖1D是柱狀圖,其中通過對遷移至刮擦區的細胞進行計數量化了細胞遷移(n=3),并且結果表示為三次獨立實驗的平均值±S.D.。*p<0.05,**p<0.01。CON,對照。圖2提供了根據劑量依賴性的小管形成(A、B)、小管形成(C)和體內基質膠塞測定(D),示出C-肽在體外和體內誘導血管生成的圖像和曲線圖。將HUVEC在具有示出濃度的C-肽(C-Pep)的基質膠層上培養24h(n=3)(A,B):圖2A示出小管形成的共聚焦顯微圖像;圖2B是曲線圖,其中通過測量來自圖2A中的圖像的小管長度確定相對小管長度(%),以檢驗C-肽誘導的、劑量依賴性的小管形成;圖2C是示出通過10ng/mlVEGF或0.5ng/mlC-肽誘導的小管形成的柱狀圖;以及圖2D示出在進行體內基質膠塞測定之后的基質膠的圖片,在該體內基質膠塞測定中,小鼠經含100ng/mlVEGF或5nMC-肽的0.5ml基質膠皮下感染7d(n=8/組)。圖3提供了示出C-肽在HUVEC中誘導ERK1/2和Akt磷酸化以及NO產生的圖像和柱狀圖。圖3A和3B示出在使用10ng/mlVEGF或0.5nMC-肽處理HUVEC預定時間之后的結果:圖3A示出ERK1/2磷酸化的蛋白印記分析的結果,其中,使用蛋白的總量對蛋白磷酸化的水平進行標準化,并且相對于未經刺激的對照水平(CON)進行表示;圖3B示出Akt磷酸化的蛋白印記分析的結果,其中,使用蛋白的總量對蛋白磷酸化的水平進行標準化,并且相對于未經刺激的對照水平(CON)進行表示;以及圖3C示出在使用10ng/mlVEGF或0.5nMC-肽處理HUVEC2h之后獲得的結果,以及使用本領域已知的方法通過共聚焦顯微檢查確定的細胞內NO的水平。結果表示為來自三次獨立實驗的平均值±S.D.。*p<0.05,**p<0.01。圖4提供了示出各種抑制劑防止由C-肽和VEGF誘導的小管形成的柱狀圖:圖4A是在將HUVEC接種在基質膠層上,并且在所示濃度的L-NAME、PD98058和渥曼青霉素的存在下與0.5nMC-肽(C-pep)孵育24至30h之后,通過共聚焦顯微檢查量化的小管形成的柱狀圖,并且結果表示為來自三次獨立實驗的平均值±S.D.;圖4B是在將HUVEC接種在基質膠層上,并且在所示濃度的L-NAME、PD98058和渥曼青霉素的存在下與10ng/mlVEGF孵育24至30h之后,通過共聚焦顯微檢查量化的小管形成的柱狀圖,并且結果表示為來自三次獨立實驗的平均值±S.D.。圖5提供了示出C-肽修復糖尿病受損的傷口愈合的柱狀圖:圖5A是在皮膚受損之后4d和12d,在健康小鼠(健康;n=12/組)、糖尿病小鼠(糖尿病;n=12/組)和給予C-肽的糖尿病小鼠(糖尿病+C-pep;n=12/組)的傷口愈合之間進行對比的柱狀圖。**,p<0.01,N.S.沒有顯著性差異,以及圖5B是使用數碼照相觀察4mm直徑的皮膚傷口愈合之后的柱狀圖。圖6提供了通過轉板遷移測定法(A、B)和通過傷口愈合測定法(C、D)進行測量,示出C-肽在NIH3T3細胞中誘導細胞遷移和VEGF表達的圖像和曲線圖。在圖6A和圖6B中,將NIH3T3細胞接種在可滲透支撐物的上孔上,并且在下孔中存在1ng/mlFGF-2或者所示濃度的C-肽(C-Pep)的情況下孵育12h:圖6A示出在過濾器的下表面上的遷移細胞的圖像;圖6B是通過對遷移細胞進行計數量化了趨化性遷移(n=3)的柱狀圖;圖6C示出了融合的細胞層的共聚焦顯微圖像,該融合的細胞層是受傷的并且與1ng/mlFGF-2或0.5nMC-肽孵育24h;以及圖6D是通過對遷移到刮擦區的細胞進行計數量化了細胞遷移(n=3)的柱狀圖。圖7提供了示出C-肽增加了受傷部位周圍毛囊再生和血管形成的圖像:圖7A示出來自移除正常小鼠(n=6)、糖尿病小鼠(n=6)和糖尿病+C-肽小鼠(n=6)的后肢的背部皮膚的代表性照片,其中正方形區域顯示為每一圖像的底部的放大圖像。毛囊和血管在正常小鼠和糖尿病+C-肽小鼠中得到發育,但在糖尿病小鼠中沒有發育(由箭頭所示);以及圖7B示出經PECAM-1抗體可視化的血管的圖像(上半部分),及在背部皮膚中可視化的毛囊(中間部分)。C-肽增加了毛囊和血管的數量。比例尺=200mm。圖8是示出C-肽誘導的血管生成和防止糖尿病受損的傷口愈合的可能的信號傳導通路,暗示C-肽經由涉及ERK1/2、Akt和NO生成的通路激活血管生成,并且通過提高血管生成改進延遲的傷口愈合。具體實施方式本發明對預防和治療在糖尿病患者中的血管生成失調和隨后受損的傷口愈合的深入且徹底的研究,最終發現了:通過誘導內皮細胞遷移并且刺激毛細管樣網絡的形成(對于血管生成都是不可或缺的),C-肽可以在體外和體內激活血管生成;并且,C-肽通過引起ERK1/2和PI3K/AKT磷酸化和NO生成的信號傳導通路刺激血管生成,并且這些信號傳導通路參與C-肽誘導的血管生成。還發現了,C-肽的預防性或治療性效果在糖尿病性傷口愈合損傷上誘導血管生成。因此,本發明涉及使用C-肽預防或治療糖尿病性血管生成損傷的方法或組合物;以及預防或治療糖尿病性傷口愈合損傷的方法或組合物。根據本發明的一個方面,本發明解決了一種使用C-肽預防或治療糖尿病性血管生成損傷的方法,或用于該方法的組合物。更具體的,本發明提供了一種預防或治療糖尿病性血管生成損傷的方法,該方法包括給予有需要的動物有效量的C-肽。另外,本發明提供了預防或治療糖尿病性血管生成損傷的藥物組合物,該藥物組合物包括作為活性成分的C-肽。在本發明中,觀察到C-肽引起血管內皮細胞和成纖維細胞的趨化性遷移中劑量依賴性的升高(圖1A、圖1B、圖6A和圖6B),刺激細胞遷移至受傷區域(圖1C、圖1D、圖6C和圖6D),并且以劑量依賴的方式誘導毛細管樣網絡的形成(圖2A和圖2B),并且誘導在基質膠中的新的血管的形成(圖2D)。此外,實驗證明C-肽在HUVEC中通過ERK1/2和Akt的磷酸化和NO的生成,刺激血管生成和VEGF(圖3)。因此,根據本發明,C-肽或包括C-肽的組合物可以用于預防或治療糖尿病性血管生成損傷的方法或藥物組合物中。C-肽或本發明的組合物對血管生成損傷的預防性或治療效果,可以應用于可能遭受糖尿病性血管生成損傷的任何動物,包括人類。如本文所使用的,術語“C-肽”指在哺乳動物和鳥中發現的胰島素原的短的蛋白成分,該胰島素原由胰島的胰腺β細胞生成。它的長度依賴于它的來源在21個氨基酸至31個氨基酸之間變化。來自各種哺乳動物(包括狗、貓、大鼠、黑猩猩、小鼠、母牛等)的哺乳動物的C-肽,以及人類的C-肽,和來自例如鶇的鳥類C-肽,都在本發明的范圍內。例如,來源于人類(Homosapiens,SEQIDNO:1)、大鼠(Rattusnorvegicus,SEQIDNO:2)和黑猩猩(Pantroglodytes,SEQIDNO:3)的所有C-肽都由31個氨基酸構成,同時發現C-肽在小鼠(Musmusculus,SEQIDNO:4)中為29-mer肽,在牛(Bostaurus,SEQIDNO:5)中為26-mer肽,在鶇(Turdusmerula,SEQIDNO:6)和紅腳鰹鳥(Sulasula,SEQIDNO:7)中為21-mer肽。本發明的C-肽可以具有選自由SEQIDNO:1至SEQIDNO:7組成的組中的氨基酸序列。為了本發明的目的,C-肽在本發明提供的方法或組合物中用作活性成分。所述方法或組合物可以應用于可能受糖尿病性血管生成損傷引起的疾病影響的任何動物,以及人類。在此上下文中,C-肽優選應用于它的來源的動物。例如,如果它應用于人類,則本發明的方法或組合物優選包括人來源的C-肽(SEQIDNO:1)。在本發明的一個實施方式中,發現C-肽在糖尿病的模型小鼠中誘導血管生成,這樣C-肽或包括C-肽的組合物可應用于預防或治療糖尿病性血管生成損傷。如本文所使用的,術語“糖尿病性血管生成損傷”指糖尿病引起的自身受損的血管生成,或者由糖尿病性血管生成損傷引起的疾病,該疾病可以選自由中風、腎臟疾病、心臟疾病、足部潰瘍,及它們的組合組成的組中。詳細來講,本發明的方法或組合物對糖尿病性血管生成損傷引起的疾病的預防性或治療性效果,可以歸因于C-肽的如下活性中的至少一種:誘導內皮細胞的趨化性遷移,誘導細胞遷移至受傷區域,誘導毛細管樣網絡的形成,及誘導ERK1/2和Akt的磷酸化和NO的生成。因此,在各種糖尿病并發癥的發病之后,本發明的方法或組合物可以應用于預防或治療在任何糖尿病患者(動物或人類)中出現的糖尿病性血管生成損傷。本發明的組合物是藥物組合物,該藥物組合物可進一步包括藥學上可接受的遞送劑、賦形劑或稀釋劑。如本文所使用的,術語“藥學上可接受的遞送劑、賦形劑或稀釋劑”旨于包括任何和所有的溶劑,分散介質,包衣劑,佐劑,穩定劑,防腐劑,抗菌劑和抗真菌劑,等滲劑,和吸收延遲劑。在本發明中有用的遞送劑、賦形劑或稀釋劑的實例包括乳糖、右旋葡萄糖、蔗糖、山梨醇、甘露醇、木糖醇、麥芽糖醇、葡萄糖、甘油、阿拉伯膠、藻酸鹽、明膠、磷酸鈣、硅酸鈣、纖維素、甲基纖維素、微晶纖維素、聚乙烯吡咯烷酮、水、甲基羥基苯甲酸鹽、丙基羥基苯甲酸鹽、滑石、硬脂酸鎂、礦物油等。使用常規方法,可以將本發明的藥物組合物配制成口服劑型(諸如粉劑、顆粒劑、片劑、膠囊、懸浮液、乳液、糖漿和噴霧劑),或配制成無菌的注射劑。為了配制根據本發明的組合物,通常使用稀釋劑或賦形劑,諸如填充劑、增稠劑、粘合劑、濕潤劑、崩解劑和表面活性劑。用于口服劑量的固體制劑包括片劑、丸劑、粉劑、顆粒劑和膠囊。使用卵磷脂樣的乳化劑與諸如淀粉、碳酸鈣、蔗糖、乳糖或明膠的至少一種賦形劑的組合,制備這些固體制劑。除了賦形劑之外,可以使用潤滑劑,諸如鎂、硬脂酸鹽、滑石等。用于口服給藥的液體制劑包括懸浮液、內部溶液、乳液和糖漿。在這些液體制劑中,可以含有各種賦形劑(諸如濕潤劑、甜味劑和防腐劑),以及簡單的稀釋劑(諸如水和液體石蠟)。用于非口服劑量的制劑的代表可以是無菌水溶液、非水溶液、懸浮液、乳夜、凍干劑和栓劑。對于非水溶液和懸浮液,可以使用植物油(諸如丙二醇、聚乙二醇和橄欖油),或可注射的酯(諸如油酸乙酯)。只要導向靶組織,則根據本發明的使用C-肽的方法或組合物可采用任何口服或非口服的給藥途徑。優選的是使用滲透泵的皮下注射,皮內注射,靜脈注射,腹膜內注射或玻璃體內注射。在本發明中,C-肽可以以“有效量”或“藥學上的有效量”給予。如本文所使用的,術語“有效量”或“藥學上的有效量”指在不引發顯著或過度的免疫應答的情況下,足以提供預防或治療效果的量。它是依賴于藥學或藥物領域中已知的各種因素確定的,該已知的各種因素包括疾病的種類和嚴重程度,藥物活性,給藥途徑,流量比,給藥時間段,共給予或組合的其它藥物,患者的年齡、體重、性別、飲食習慣、健康狀態等。在確定“有效量”或“藥學上的有效量”時考慮到的各種因素對于本領域技術人員來說是已知的,并且例如在Gilman等人編輯的GoodmanAndGilman's:ThePharmacologicalBasesofTherapeutics(第8版,培格曼出版社(PergamonPress),1990)和Remington'sPharmaceuticalSciences(第17版,馬克出版有限公司(MackPublishingCo.),伊斯頓(Easton),Pa.,1990)中進行了解釋。本發明的組合物可以單獨給予,或者與其它療法組合給予。本發明的組合物和其它療法的共給予可以同時進行或順序進行。可以有單一劑量或多種劑量。重要的是,以足以獲得最大治療效果且沒有副作用的盡可能最小的量使用組合物,本領域技術人員可以容易地確定這樣的量。此外,可以使用裝置進行組合物的給予,該裝置幫助活性成分導向靶細胞。根據本發明的另一方面,本發明解決了一種使用C-肽預防或治療糖尿病性傷口愈合損傷的方法和組合物。更具體的,本發明提供了一種預防或治療糖尿病性傷口愈合損傷的方法,該方法包括給予有需要的動物有效量的C-肽。本發明還提供了預防或治療糖尿病性傷口愈合損傷的藥物組合物,該藥物組合物包括作為活性成分的C-肽。如上所述,發現了C-肽有效治療糖尿病性傷口愈合損傷(如在下面的工作實施例2中的糖尿病模型小鼠中證實的),從而C-肽或包括C-肽的組合物適用于預防或治療糖尿病性傷口愈合損傷。C-肽對糖尿病性傷口愈合損傷的預防性或治療效果可以應用于人類,以及會受到糖尿病影響的任何動物。如本文所使用的,術語“糖尿病性血管生成損傷”指糖尿病引起的受損的血管生成自身,或者由糖尿病性血管生成損傷引起的疾病,該疾病可以選自由中風、腎臟疾病、心臟疾病、足部潰瘍,及它們的組合組成的組中。詳細來講,本發明的方法或組合物對糖尿病性血管生成損傷的預防性或治療性效果,可以歸因于C-肽的如下活性中的至少一種:誘導內皮細胞的趨化性遷移,誘導細胞遷移至受傷區域,誘導毛細管樣網絡的形成,及誘導ERK1/2和Akt的磷酸化和NO的生成。在糖尿病性血管生成損傷或糖尿病性傷口愈合損傷的預防或治療的背景中使用的術語“C-肽”、“劑量”、“給藥”和“有效量(藥學上的有效量)”如在本發明的在先方面中所述。通過以下實施例可以獲得對本發明的更好的理解,其中給出以下實施例以例示本發明,但不應理解為限制本發明。實例1:實驗的準備實例1-1:實驗動物六周齡的雄性C57BL/6小鼠購自奈良生物科技(首爾,韓國)。在溫度受控的清潔的架子上飼養這些小鼠,該架子具有12-h的光/暗周期。所有實驗都依據江原大學校的實驗動物管理與使用委員會的指標進行。實例1-2:細胞培養根據公知的方法從人類的臍帶靜脈中分離HUVEC,并且在以下的實驗中使用來自傳代3至6次的細胞。將細胞接種在2%明膠包被的蓋玻片、盤或板中的M199培養基(補充有20%FBS,3ng/mlbFGF,5U/ml肝素,100U/ml青霉素,和100μg/ml鏈霉素)中,并且在37℃潮濕的5%CO2的恒溫箱中生長。從ATCC(美國模式培養物保藏所)獲得的NIH3T3成纖維細胞生長在補充有10%小牛血清、100U/ml青霉素和100μg/ml鏈霉素的DMEM培養基中。對于實驗,通過將細胞培養在低血清的培養基(如上補充的M199,但僅具有1%FBS)中,對細胞血清饑餓處理6h,并且在存在或不存在各種濃度的C-肽的情況下使用10ng/mlVEGF處理適當的時間。在低血清的培養基(如上補充的DMEM,但僅具有0.1%的小牛血清)中,對NIH3T3進行血清饑餓處理12h。實例1-3:統計學分析使用Origin6.1(OriginLab,北安普敦(Northampton),MA,USA)對在每一實例中獲得的數據進行處理,并用圖表表示出來。使用t-檢驗和ANOVA確定統計學的顯著性。認為小于0.05的p-值是有統計學顯著性的。實例2:C-肽對血管生成的效果實例2-1:轉板遷移測定(Transwellmigrationassay)血管生成伴隨有內皮細胞的遷移和毛細管樣網絡的形成。為了通過檢驗C-肽是否刺激內皮細胞的遷移來評價C-肽誘導血管生成的能力,使用可滲透支撐物(科斯塔(Costar),科寧(Corning),NY)測定HUVEC和NIH3T3細胞的趨化性運動。詳細來講,使過濾器的下表面包被有5μl2%的明膠。將含VEGF、FGF-2或C-肽的低血清培養基放置在下孔中。在每一個上孔中,以每200μl低血清培養基1x105個細胞的密度接種HUVEC或NIH3T3細胞,并且在37℃培養12h。使用100%甲醇固定細胞15min,使用蘇木精和曙紅進行染色,并且干燥。使用熒光倒置顯微鏡(奧林帕斯(Olympus)),獲得每種添加物的三個隨機選擇的視野中的遷移細胞的平均數量,以量化遷移程度。結果示于圖1A和圖1B中。如從結果中所理解的,C-肽在內皮細胞的趨化性遷移中誘導了劑量依賴型的增加,并且在0.5nM具有最大效果(圖1A和圖1B)。實例2-2:傷口愈合測定通過傷口愈合測定,對C-肽對血管生成的效果進行檢驗。將HUVEC和NIH3T3細胞培養在包被有明膠的6孔培養板上。在獲得之后,用低血清培養基使融合的細胞層饑餓6h,經1μM鈣黃綠素-AM染色30min,并且用塑料刮刀使融合的細胞層受傷。去除低血清培養基和細胞碎片,然后為細胞培養重新裝滿含VEGF或C-肽的2ml低血清培養基。然后在37℃培養細胞24h。根據使用共聚焦顯微鏡(FV-300,Olympus)獲得的圖像,對遷移的細胞進行計數。結果示于圖1C和圖1D中。如在圖1C和圖1D中所示,C-肽(0.5nM)顯著刺激了細胞遷移至受傷區域(p<0.01)。如之前所報道的,VEGF也刺激內皮細胞中的趨化性遷移和傷口愈合(p<0.01;圖1)。因此,C-肽刺激內皮細胞的遷移,而內皮細胞的遷移對血管生成是必要的。實例3:小管形成測定為了檢驗C-肽是否能夠體外激活血管生成,使用HUVEC在基質膠層中進行了小管形成測定。使用本領域已知的方法,實現了HUVEC在生長因子減少的基質膠(BDBiosciences,富蘭克林湖(FranklinLakes),NJ)上形成毛細管樣網絡。簡單來講,根據制造商的說明書,將24孔培養板包被有基質膠。HUVEC以4x105個細胞/孔的密度接種在基質膠層上,并且在37℃使用VEGF或C-肽處理24h至30h。使用FV-300軟件,通過由圖像測量小管的長度來量化小管形成的程度。結果示于圖2A、圖2B和圖2C中。與實例2的細胞遷移測定的結果一致,C-肽以劑量依賴的方式刺激毛細管樣網絡的形成,并且在0.5nM具有最大效果(圖2A和圖2B)。與C-肽的效果類似,VEGF誘導毛細管樣網絡的形成(圖2C)。因此,證實了C-肽激活內皮細胞的遷移和毛細管樣網絡的形成,這對體外血管生成是必要的。實例4:體內基質膠塞測定使用基質膠塞測定,以檢驗C-肽是否能夠誘導體內的血管生成。在這一方面,根據本領域已知的方法進行體內基質膠塞測定。簡單來講,小鼠經皮下注射含100ng/mlVEGF或5nMC-肽的0.5ml基質膠,和10U肝素。7天之后,從皮下區移出基質膠塞,并且使用相機(索尼(Sony),日本(Japan))進行拍照。結果示于圖2D中。在基質膠塞植入后一周,含C-肽的基質膠顯示出顯著高于對照的新血管形成的誘導,并且該結果與VEGF處理期間看到的結果類似(圖2D)。相應的,這些結果表明C-肽激活體外和體內的血管生成。實例5:C-肽相關的細胞內信號傳導通路實例5-1:C-肽對ERK1/2和Akt磷酸化的影響因為ERK1/2和Akt的活化是誘導細胞遷移和小管形成的關鍵,因此檢驗了在HUVEC中C-肽對ERK1/2和Akt磷酸化的影響。通過蛋白印跡分析,確定ERK1/2和Akt的磷酸化。簡單來講,使用冰冷的裂解緩沖液(50mMTris-HCl,pH7.5,1%TritonX-100,150mMNaCl,1mMEDTA,0.1mMPMSF,10μg/mL抑肽酶(aprotinin),和10μg/mL亮抑酶肽(leupeptin))刮掉HUVEC,并且在4℃,18,000g離心10min。得到的細胞裂解物通過十二烷基硫酸鈉聚丙烯酰胺凝膠電泳(SDS-PAGE)進行分離,并且轉移至聚偏氟乙烯膜上。通過曝光于x射線膠片和化學發光底物(Pierce,羅克福(Rockford),IL),使蛋白條帶可視化。在圖3A和圖3B中,使用蛋白總量對蛋白磷酸水平進行標準化,并且相對于未經刺激的對照水平(CON)表示蛋白磷酸化水平。可以看出,C-肽以時間依賴的方式增加了ERK1/2的磷酸化,并且在15min具有最大的刺激,并且該ERK1/2的活化維持到60min(圖3A)。類似的,C-肽以時間依賴的方式誘導Akt磷酸化,并且在15min具有最大效果(圖3B)。VEGF也以時間依賴的方式誘導ERK1/2和Akt的磷酸化(圖3A和圖3B)。實例5-2:C-肽對NO產生的作用因為Akt的磷酸化通過VEGF(是介導血管生成的重要因子)增加了NO的產生,因此進行了檢驗,以確定C-肽是否能夠刺激NO的產生。為此,根據本領域已知的方法,使用DAF-FMDA(二氨基熒光素-FM雙乙酸鹽,分子探針(MolecularProbes),尤金市(Eugene),OR)測量了細胞內的NO水平。簡單來講,在不含酚紅的低血清培養基中,使用VEGF或C-肽處理HUVEC預示的時間,并且使用2μMDAF-FMDA培養最后的1h。之后,在共聚焦顯微觀察之前用低血清培養基對細胞進行洗滌。通過對比經處理的細胞與未經處理的對照細胞的熒光強度來測定細胞內NO的水平,其中測定的值表示為倍數差異。使用C-肽對HUVEC的處理顯著提高了細胞內NO的水平(圖3,p<0.05)。基于VEGF的處理,也產生了較高水平的細胞內NO(p<0.01)。實例5-3:ERK1/2、PI3K/Akt和NO產生在C-肽誘導的血管生成中的作用使用PD98059、渥曼青霉素(wortmannin)和L-NG-硝基精氨酸甲酯(L-NAME)分別檢驗ERK1/2、PI3K/Akt和NO在C-肽誘導的血管生成中的作用。PD98059(ERK1/2的抑制劑)以劑量依賴的方式抑制了HUVEC的C-肽刺激的小管形成,并且在10μM具有最大的抑制。PI3K/Akt的抑制劑渥曼青霉素和NOS的抑制劑L-NAME也顯示出對C-肽誘導的小管形成的劑量依賴的抑制(圖4A)。通過PD98059、渥曼青霉素和L-NAME的處理,防止了VEGF誘導的小管形成(圖4B)。總之,上面獲得的數據表明C-肽經由涉及ERK1/2、PI3P/AKT和NO產生的信號傳導通路刺激血管生成,并且涉及ERK1/2、Akt和NO產生的信號傳導通路可能參與到C-肽誘導的血管生成中。實例7:C-肽對糖尿病性傷口愈合損傷的治療效果通過以150mg/kg體重的量,單次腹膜內注射含鏈脲霉素的100mM檸檬酸鹽緩沖液(pH4.5),生成糖尿病小鼠。在注射之后,為小鼠過夜供給10%的蔗糖,以防止發生突然的低血糖休克。如通過Accu-Chek活力血糖監測儀(羅氏診斷(RochDiagnostics),德國)測量血糖,并且通過Uriscan(TD診斷(TDDiagnostics),Young-In,韓國)測量糖尿,在注射之后觀察到足夠的高血糖癥。在1周之后,將具有高于16mM的非空腹血糖水平、多尿和糖尿的小鼠定義為糖尿病,并且用于實驗。在鏈脲霉素注射之后2周,為一組糖尿病小鼠皮下移植Alzet微型滲透泵2004(DIRECT,庫比蒂諾(Cupertino),CA),該Alzet微型滲透泵2004含有在PBS中的C-肽,以35pmol/kg/min的遞送速率遞送C-肽兩周。其它糖尿病組和正常組進行假手術。在造成傷口之前,使用薇婷(Veet)乳膏剃去脊柱的背部皮膚上的毛。使用活檢穿孔器在后肢的背部表面上造成直徑為4mm的全層性皮膚傷口,并且使用數碼照相機監測閉合。使用游標卡尺以兩天的有規律的時間間隔追蹤傷口邊緣,測量開放的傷口尺寸,并且使用數碼相機進行監測。為了確定C-肽是否能夠在糖尿病小鼠中誘導傷口閉合,經移植在糖尿病小鼠中的皮下滲透微型泵,以35pmol/kg/min的遞送速率持續給予C-肽。在正常小鼠、糖尿病小鼠和給予C-肽的糖尿病小鼠(STZ誘導的糖尿病4周)中,在后肢的背部表面上造成直徑4mm的傷口。糖尿病小鼠的傷口已經顯示出比正常小鼠的傷口顯著低的愈合率。但是,在皮膚損害之后的4天和10天,在使用滲透泵補充C-肽的糖尿病小鼠中的傷口面積中沒有觀察到顯著差異(圖5A)。在第4天和第10天,正常小鼠、糖尿病小鼠和給予C-肽的糖尿病小鼠的傷口面積之間的對比示出顯著差異(圖5B)。實例8:成纖維細胞遷移的C-肽活化為了解釋C-肽在趨化性成纖維細胞遷移中的作用,使用C-肽處理NIH3T3細胞12h。C-肽在成纖維細胞的趨化性遷移中誘導劑量依賴的增加,并且在1nM具有最大效果(圖6A和圖6B)。通過傷口愈合測定,進一步研究C-肽誘導的細胞遷移。C-肽(0.5nM)顯著刺激細胞遷移至受傷區域(p<0.01;圖6C和圖6D)。FGF-2也在成纖維細胞中刺激趨化性遷移和傷口愈合(p<0.01;圖6)。因此,C-肽刺激成纖維細胞的遷移,這對受損皮膚中的傷口愈合過程是必要的。實例9:毛囊再生和血管形成的C-肽刺激通過整體(whole-mount)免疫染色,觀察C-肽對毛囊再生和血管形成的效果。在這方面,在受傷之后14天,處死小鼠,并且移除背部皮膚以觀察毛囊和血管。為了避免破壞它的愈合邊緣,使用剪刀切割來自所有死亡小鼠的皮膚組織,隨即在PBS中的4%多聚甲醛中固定過夜,并且在-20℃的甲醇中儲存過夜。對于免疫組化,使用在TBS中的0.1%TritonX-100中的2%BSA封閉組織樣品,并且與山羊多克隆血小板內皮細胞粘附分子-I的抗體孵育2d,接著用Alexa-546綴合的兔抗山羊IgG的抗體探查,并且然后進行共聚焦顯微檢查。結果示于圖7中。依據從圖片(圖7A)以及通過PECAM-1染色(圖7B)進行的評價,在環繞糖尿病小鼠的傷口的皮下組織中的毛囊和血管的數量顯著低于正常小鼠。與那些糖尿病小鼠相比,給予C-肽的小鼠皮膚示出顯著增加了毛囊再生和血管形成,并且同時加速了傷口閉合。這些結果暗示C-肽對治療糖尿病延遲的傷口愈合,尤其在患有受損的微循環的糖尿病患者中對治療糖尿病延遲的傷口愈合的潛在的治療價值。工業實用性根據本發明的被發現能夠誘導血管生成的包括C-肽的藥物組合物在治療需要血管生成的廣譜的癥狀中,諸如糖尿病性傷口愈合損傷,以及包括糖尿病性血管生成損傷的各種糖尿病并發癥中,都具有預防或治療應用。
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1