一種用于治療心肌梗死的混合細胞制劑及制備方法與應用與流程
本發明涉及一種用于治療心肌梗死的混合細胞制劑及制備方法與應用,屬于生物醫藥領域。
背景技術:
目前無論基礎和臨床,盡管近幾十年對心肌梗死的治療有了很大的進步,目前尚沒有任何能夠根治心肌梗死的藥物和療法。細胞治療被認為是治療心肌梗死最有希望的方法之一。無論是基礎和臨床研究均證明:不同類型的干細胞(包括:骨髓間充質干細胞、心臟內源性干細胞,胚胎干細胞及iPS等)對梗死心肌治,被證明是可行和安全的。但其療效只體現在減小梗死面積,提高射血分數,改善心功能,及改善病理性左心室重構,但經移植入的干細胞大部分死亡,未能分化成熟的心肌以再生梗死心肌,因此,目前的研發瓶頸和前沿是:研發具有促進心梗缺血區和邊緣區心肌再生,有效減小梗死面積,改善心功能,改善缺血心肌纖維化、以改善梗死心臟病理重構,及有效減小心梗后心衰發生的細胞療法及細胞治療制劑。
造成目前干細胞療法對心梗治療療效未如理想的原因之一,是目前的細胞療法往往只是單獨移植不同種類的干細胞,而往往忽略了構成心肌層各類細胞存在彼此互為調控的協同作用,從而能更有效促進心梗邊緣區不同來源干細胞增殖和向心肌分化,促進心梗缺血區和邊緣區的血管新生、心肌再生,減小梗死面積,改善心功能,改善缺血心肌纖維化、以改善梗死心臟病理重構,及有效減小心梗后心衰發生的療法方面,將會取得比現有單獨干細胞療法更好的療效。
技術實現要素:
本發明的首要目的在于克服現有技術的缺點與不足,即目前所有干細胞治療均不具備修復缺血心肌梗死區被破壞,由心臟Teloytes細胞(CTs)構成的細胞網絡結構的同時,又能有效促進經移植入的心臟內源性干細胞(CSCs)有效分化為心肌細胞,從而有效再生梗死心肌,而提供一種用于治療心肌梗死的混 合細胞制劑。
本發明的另一目的在于提供所述用于治療心肌梗死的混合細胞制劑的制備方法。
本發明的再一目的在于提供所述用于治療心肌梗死的混合細胞制劑的應用。
本發明的目的通過下述技術方案實現:一種用于治療心肌梗死的混合細胞制劑,由活性成分和溶劑組成;活性成分主要為心臟Teloytes細胞(CTs)和心臟內源性干細胞(CSCs)。
所述的活性成分還包括上述CTs和CSCs分別分泌的功能因子和小RNA中的一種或兩種。即所述的用于治療心肌梗死的細胞制劑優選由如下成分組成:CTs和CSCs分別分泌的功能因子和小RNA中的一種或兩種、CTs、CSCs和溶劑組成。兩種細胞與及其分泌的功能因子、小RNA經混合培養,彼此相互作用對該兩種細胞本身的表型和分泌表型改變,使其在向心肌分化能力、增殖能力、移行能力、抗細胞死亡、存活能力、抗缺血與缺氧能力、抗炎癥反應能力、促進血管新生能力、抗纖維化能力的增強,以及該兩種細胞及分泌功能分子彼此協同作用,在上述特性而獲得的提高。
所述的功能因子優選為能促進經移植細胞、心肌細胞、心臟血管內皮細胞、心臟CTs,心臟內源性干細胞及其它來源干細胞的增殖和分化、移行、存活,抗死亡、抗缺血與缺氧、抗炎癥,及促進心肌血管新生,抗心肌纖維化,及其彼此的協同作用。
所述的小RNA包括microRNA、LncRNA和piRNA等,其作用也是對心肌細胞、心臟血管內皮細胞、心臟CTs,心臟內源性干細胞和內源性骨髓間充質干細胞的抗死亡與促進存活、促進增殖和誘導分化。
所述的CTs和所述的CSCs按細胞數1:1配比。
所述的CTs的純度優選為在95%以上。
所述的CTs在所述的用于治療心肌梗死的細胞制劑中的濃度為至少2.5×105個細胞/mL。
所述的CSCs的純度優選為在95%以上。
所述的CSCs在所述的用于治療心肌梗死的細胞制劑中的濃度為至少2.5×105個細胞/mL。
所述的溶劑是維持細胞生理狀態的溶液,如生理鹽水、PBS或含血清的培養液;優選為含血清的培養液。
所述的血清優選為胎牛血清。
所述的血清的濃度優選為體積百分比20%。
所述的培養液優選為DMEM培養液。
所述用于治療心肌梗死的混合細胞制劑的制備方法,包括如下步驟:將CTs和CSCs混勻,得到用于治療心肌梗死的混合細胞制劑;優選包括如下步驟:將CTs和CSCs在溶劑中混勻,于37℃、5%CO2、95%空氣的無菌培養箱中培養48小時,然后對混合培養后的細胞消化,回收,得到用于治療心肌梗死的混合細胞制劑。
所述的CTs和所述的CSCs按細胞數1:1配比。
所述的CTs的純度優選為在95%以上。
所述的CTs在所述的用于治療心肌梗死的細胞制劑中的濃度為至少2.5×105個細胞/mL。
所述的CSCs的純度優選為在95%以上。
所述的CSCs在所述的用于治療心肌梗死的細胞制劑中的濃度為至少2.5×105個細胞/mL。
所述的溶劑為含血清的培養液。
所述的消化為通過使用胰酶溶液進行消化。
所述的胰酶溶液的濃度優選為0.25(w/v)%。
所述的用于治療心肌梗死的混合細胞制劑的應用,是將其直接用于治療心肌梗死或是將其制備成用于治療心肌梗死的藥物或醫療器械進行應用;具體包括如下方式與途徑:可通過對缺血心肌的缺血區和邊緣區同時進行注射,或通過介入的方式對缺血心肌的缺血區和邊緣區同時進行注射,但實施治療的途徑不僅限于上述兩種方式,還包括與不同生物體內可降解材料相混合,制備成含不同濃度該細胞制劑的各種細胞制片,通過手術覆蓋在缺血心肌缺血區,以發揮治療作用;也可以把該細胞制劑的細胞使用各類特異性靶向心臟的靶向子(如:抗體或短肽等)進行表面修飾,然后通過靜脈注射使用,以實施經靜脈使用的心臟靶向細胞治療。
所述的制劑發揮療效實現途徑包括但不限于如下闡述:①促進經移植的CSCs或心肌內源性CSCs,及其它來源干細胞在心梗邊緣區和梗死區存活、分化與增殖;②促進缺血心肌梗死區CTs構成網狀結構的修復與再生;③促進缺血心肌缺血區和邊緣區的血管新生;④改善缺血心肌纖維化、以改善梗死心臟的病理重構;⑤減小缺血心肌的梗死面積,改善心功能,及有效減小心梗后心 衰的發生率,從而實現有效促進心梗心臟缺血區和邊緣區心肌再生。
本發明相對于現有技術具有如下的優點及效果:
(1)本發明提供的細胞制劑經心肌內直接注射或介入心肌內注射,對急性心肌梗死心臟的缺血區和缺血邊緣區實施該混合細胞制劑移植,有效促進經移植的CSCs或心肌內源性CSCs,及其它來源干細胞在心梗邊緣區存活、分化與增值,從而能更有效再生缺血梗死心肌的功能。
(2)該細胞制劑經心肌內直接注射或介入心肌內注射,對急性心肌梗死心臟的缺血區和缺血邊緣區實施該細胞制劑移植,能有效修復與再生缺血心肌缺血區嚴重受損的由CTs構成的細胞網絡,以修復有利于梗死心肌再生的細胞結構微環境,從而有利于梗死心肌的再生。
(3)該細胞制劑對急性心肌梗死實施移植治療后,在減小梗死面積,改善心梗心臟心功能方面的療效要優于目前常用的單獨使用CSCs,BMSCs和CTs的療效。
(4)該細胞制劑對急性心肌梗死實施移植治療后,在改善缺血心肌纖維化、促進缺血區和邊緣區血管新生,以及改善梗死心臟病理重構,減小心梗后心衰發生率方面的療效要優于目前常用的單獨使用BMSCs,CSCs和CTs的療效。
附圖說明
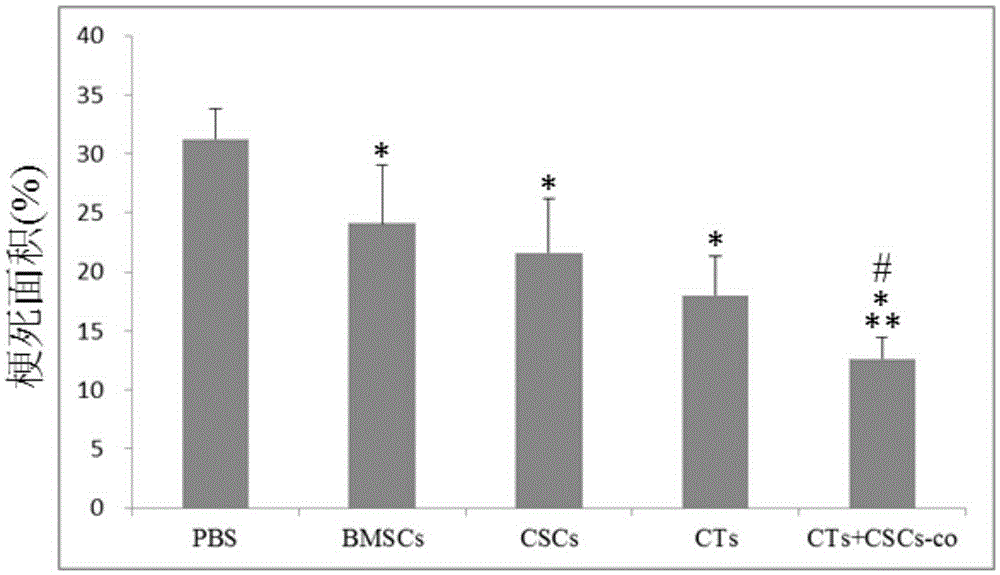
圖1是使用PBS和不同的細胞制劑注射心肌梗死模型4周后的心臟梗死面積統計結果圖;其中,*表示CTs+CSCs混合細胞制劑組,BMSCs組、CSCs組和CTs組分別相對于PBS組,p<0.01;**表示CTs+CSCs混合細胞制劑組相對于BMSCs組和CSCs組,p<0.01;#表示CTs+CSCs混合細胞制劑組相對于CTs組,p<0.05。
圖2是使用PBS和不同的細胞制劑注射心肌梗死模型4周后的心功能檢測結果圖;其中,圖(A)為各組細胞治療梗死心臟的射血分數圖,心功能越好,其值就越大,*表示CTs+CSCs混合細胞制劑組,BMSCs組、CSCs組和CTs組分別相對于PBS組,p<0.01;**表示CTs+CSCs混合細胞制劑組相對于BMSCs組和CSCs組,p<0.01;#表示CTs+CSCs混合細胞制劑組相對于CTs組,p<0.05;圖(B)為各組細胞治療梗死心臟的收縮末期的左心室最小直徑結果圖,心功能越好,其值就越小,*表示CTs+CSCs混合細胞制劑組,BMSCs組、CSCs組和CTs組分別相對于PBS組,p<0.01;**表示CTs+CSCs混合細胞制劑組相對于BMSCs組、CSCs組和CTs組,p<0.05;圖(C)為各組細胞治療梗死心臟的舒 張末期的左心室最小直徑結果圖,心功能越好,其值就越小,*表示CTs+CSCs混合細胞制劑組,BMSCs組、CSCs組和CTs組分別相對于PBS組,p<0.01;**表示CTs+CSCs混合細胞制劑組相對于BMSCs組和CTs組,p<0.05。
圖3是使用PBS和不同的細胞制劑注射心肌梗死模型4周后的梗死邊緣區和梗死區心肌增殖統計結果圖;其中,*表示CTs+CSCs混合細胞制劑組相對于PBS組、BMSCs組、CSCs組和CTs組,p<0.01。
圖4是使用PBS和不同的細胞制劑注射心肌梗死模型4周后的心肌層纖維化程度結果圖;其中,圖(A)為梗死區纖維化面積結果圖,*表示CTs+CSCs混合細胞制劑組、BMSCs組、CSCs組和CTs組分別相對于PBS組,p<0.05;**表示CTs+CSCs混合細胞制劑組相對于BMSCs組、CSCs組和CTs組,p<0.05;圖(B)為非梗死區血管周邊纖維化面積結果圖,*表示CTs+CSCs混合細胞制劑組、BMSCs組、CSCs組和CTs組分別相對于PBS組,p<0.01;**表示CTs+CSCs混合細胞制劑組相對于BMSCs組和CSCs組,p<0.01。
圖5是使用PBS和不同的細胞制劑注射心肌梗死模型4周后的肌成纖維細胞的數目檢測結果圖;其中,*表示CTs+CSCs混合細胞制劑組、BMSCs組、CSCs組和CTs組分別相對于PBS組,p<0.01;**表示CTs+CSCs混合細胞制劑組相對于BMSCs組、CSCs組和CTs組,p<0.01。
圖6是使用PBS和不同的細胞制劑注射心肌梗死模型4周后的心肌層血管單位密度結果圖;其中,圖(A)為梗死區陽性血管密度的半定量分析結果圖,圖(B)為邊緣區陽性血管密度的半定量分析結果圖;其中,*表示CTs+CSCs混合細胞制劑組、BMSCs組、CSCs組和CTs組分別相對于PBS組,p<0.05;**表示CTs+CSCs混合細胞制劑組相對于BMSCs組、CSCs組和CTs組,p<0.01。
圖7是使用PBS和不同的細胞制劑注射心肌梗死模型4周后的梗死區CTs檢測結果圖;其中,*表示CTs+CSCs混合細胞制劑組、BMSCs組、CSCs組和CTs組分別相對于PBS組,p<0.01;**表示CTs+CSCs混合細胞制劑組相對于BMSCs組、CSCs組和CTs組,p<0.05。
具體實施方式
下面結合實施例及附圖對本發明作進一步詳細的描述,但本發明的實施方式不限于此。
實施例1
一、CTs的制備
1、SD雌性大鼠(250-300g)(廣東省醫學實驗動物中心)乙醚麻醉后拉頸處死,在70(v/v)%乙醇中浸泡消毒5min,迅速轉移至生物安全柜內。
2、無菌條件下迅速剪開胸腔取出心臟,將心臟放入無菌PBS溶液(0.01M,pH7.4)中清洗3次,除去心臟中殘余的血液,在無菌平皿中剪碎心臟組織(1-2mm3),然后將心臟組織塊轉移至50ml無菌離心管,加入37℃預熱的經過濾除菌的消化酶液[0.05(w/v)%膠原酶+0.1(w/v)%胰酶,下同]2.5ml,密閉管蓋后,于37℃水浴搖床內(300rpm)消化10min,然后在生物安全柜內靜置2min,棄上層懸液。
3、在生物安全柜內,往沉淀組織塊中加入消化酶液2.5ml,密閉管蓋后,于37℃水浴搖床(300rpm)內再消化15min,然后在生物安全柜內使用移液槍充分吹打經消化的組織塊,至細胞充分分離,離心管靜置2min后,取上層懸液置于一支新的15mL無菌離心管,并加入等體積的含20%胎牛血清的DMEM培養液混勻終止酶消化反應。
4、往沉淀組織中再重新加入消化酶液2.5ml,密閉管蓋后轉移至37℃水浴搖床(300rpm)內消化15min,重復步驟3、4收集含經分離細胞的懸液,直至組織完全消化。
5、將所有經分離細胞的懸液收集,分別使用無菌孔徑為100μm和40μm的尼龍膜濾過,去除體積大組織碎片,然后將細胞懸液置50×g離心力下離心2min,將上層細胞懸液轉移至一新的15ml無菌離心管,在458×g離心力下離心5min,棄上清,收集經分離細胞。
6、往含細胞沉淀的離心管內加入5ml無菌PEB液[稱取牛血清白蛋白(BSA)1.00g、乙二胺四乙酸(EDTA)0.12g,溶于200ml PBS緩沖液中,溶解混勻后調節pH值至7.2,用0.22μm無菌濾膜過濾除菌,分裝于無菌瓶中,4℃冰箱中保存;下同]重懸細胞沉淀,并將懸液在38×g離心力下離心2min,將上層細胞懸液轉移至新的15ml無菌離心管,在200×g離心力下離心10min,收集細胞,然后加入1ml PEB液混勻細胞,獲得目標分離單細胞懸液。
7、向所獲目標分離單細胞懸液中加入兔抗大鼠c-Kit抗體5μl(終濃度為體積比稀釋1:200),混勻后密閉管蓋,4℃旋轉孵育40min后,向細胞懸液中加入2ml PEB液輕微吹打,洗去未結合抗體,然后在458×g離心力下離心5min,棄上清。
8、向離心管內加入180μl PEB液并混勻細胞,然后加入羊抗兔lgG免疫磁珠 20μl,密閉管蓋置4℃孵育25min后,往細胞懸液中加入2ml PEB液輕微吹打,洗去未結合二抗磁珠,然后在458×g離心力下離心5min,以收集細胞,然后加入500μl PEB混懸細胞。
9、使用磁珠分選系統,按陽性分選獲得C-kit+的CTs。
10、經分離的CTs在含20%胎牛血清的DMEM培養液,37℃、5%CO2、95%空氣的無菌培養箱進行培養,對經分離的細胞CTs進行傳代擴增,經該法分離的細胞近95%的細胞為c-Kit+/CD34+,達到較高的純度。按步驟1~10,能重復得到CTs。
11、所有用于制備混合細胞制劑的CTs均為傳代低于五代,以確保細胞核型沒有發生改變。
二、CSCs制備
1、灌注系統消毒:消毒水浸泡灌注管道系統,同時打開紫外燈照射30min,排凈消毒水、無菌去離子水充分沖洗灌注管道。
2、實驗前20min,大鼠腹腔注射肝素鈉(500u/kg)。
3、打開胸腔取出心臟,使用冰浴的灌注液清洗后,迅速將心臟懸掛于Langendorff灌注系統上,無鈣離子灌注液(稱取NaCl 3.46g、KCl 0.175g、MgSO40.145g、KH2PO40.08g、NaHCO31.05g、葡萄糖1.05g,加去離子水容量瓶定容至500ml,調節pH7.38-7.42,過濾除菌)灌注5min。
4、加入酶液[含0.025%(v/v)膠原酶P,0.004%(v/v)蛋白酶的無鈣離子灌注液]在37℃,6ml/min恒定流速條件進行灌注消化10min,待心臟變白,且心肌層呈現塌陷狀時,取下心臟。
5、在生物安全柜內將取下的心臟剪碎(1-2mm3),加入酶消化液充分吹打,靜置1min,吸出上懸液后,加入等體積含10%(v/v)胎牛血清的DMEM培養液終止消化,未完全消化的組織加入相同的酶消化液,于37℃水浴搖床中繼續消化15min。
6、將收集到的經消化分離的細胞懸液,依次使用無菌的100μm尼龍膜、41μm尼龍膜濾過,去除較大組織碎片,濾液于50×g離心2min后,棄沉淀,上層細胞懸液在300×g離心10min,棄上清液以收集經分離的細胞。
7、加入5ml PEB液懸浮細胞,并把懸液在38×g離心力的作用下離心2min,棄沉淀,取上清在200×g離心力的作用下離心10min收集經分離的細胞,加入1ml PEB液重懸細胞,獲得細胞懸液。
8、往上述制備的細胞懸液中加入兔抗大鼠c-Kit抗體5μl(終濃度為1:200), 混勻后,于4℃旋轉孵育40min,孵育完成后加入2ml PEB液輕微吹打,在458×g離心力下離心4min,棄上清。
9、加入160μl PEB液懸浮細胞,加入羊抗兔lgG免疫磁珠20μl,在4℃孵育25min后,加入2ml PEB液輕微吹打,在458×g離心力下離心4min,收集沉淀,向沉淀中加入500μl PEB懸浮細胞。
10、利用美天旎磁珠分選系統陽性分選獲得c-Kit+心臟干細胞,并使用心臟干細胞培養液[DMEM/F12培養液添加15%胎牛血清、bFGF(20μg/L)、LIF(10μg/L)],在37℃、5%CO2、95%空氣的無菌培養箱進行培養,對經分離的CSCs進行傳代擴增,經該法分離的細胞大于95%的細胞為c-Kit+,達到較高的純度。
11、所有用于制備混合細胞制劑的CSCs均為傳代低于5代,以確保細胞核型沒有發生改變。
三、BMSCs制備
1、SD雌性大鼠(250-300g)(廣東省醫學實驗動物中心),乙醚麻醉后拉頸處死,放入70(v/v)%酒精中浸泡5min。
2、在生物安全柜中,剪開大鼠股骨外面的皮膚、剔除肌肉,收集股骨。
3、剪開股骨兩端露出骨髓腔,用無菌注射器吸取4ml 10(v/v)%FBS的L-DMEM培養液,插入骨髓腔一端將骨髓沖出。收集液用200無菌目尼龍膜過濾,然后加入4ml Tris-NH4Cl(稱取3.735g氯化銨、三羥甲基氨基甲烷(Tris)1.3g加水溶解并稀釋至500ml。0.22μm濾膜過濾除菌,4℃保存)溶液吹打均勻,靜置5min。
4、在458×g離心力下離心4min,棄上清液,用含2ml 10(v/v)%FBS的L-DMEM重懸經收集的細胞,并接種到35mm培養皿中,置于37℃、5%CO2、95%空氣的無菌培養箱進行培養,48小時換液除去未貼壁細胞,以后每隔一天換液一次。
5、待細胞生長至90%融合時用0.25(w/v)%胰酶消化,將細胞按照5×105個/ml的密度接種到35mm培養皿進行擴增培養,以獲得足夠數量的BMSCs以進行下一步實驗。經該法分離擴增得到的細胞超過97%為CD90+、CD73+和CD105+陽性,低于0.5%的細胞為CD45+、CD14+和CD34+陽性,純度達到95%的BMSCs。
6、所有用于制備細胞制劑的BMSCs均為傳代低于五代,以確保細胞核型沒有發生改變。
實施例2
(一)CTs+CSCs混合細胞制劑的制備
將CTs和CSCs用含20%(v/v)胎牛血清的無菌DMED培養液混勻,并按1.25×105:1.25×105的比例將兩種細胞均勻混合成體積為2mL、細胞濃度為1.25×105/mL的細胞混合液。
把該混合細胞液置于37℃、5%CO2、95%空氣的無菌培養箱培養48小時,然后使用0.25(w/v)%胰酶消化回收經混合培養的細胞,并使用含20%(v/v)胎牛血清的DMEM把細胞濃度調制為1×107/mL供移植使用。
(二)CTs+CSCs混合細胞制劑對心肌梗死實施移植治療
使用雌性(250克)S.D.大鼠,行冠狀動脈前降支(LAD)結扎術致左心室前壁缺血,進行心肌梗死建模,LAD結扎后30分鐘后,左心室前壁缺血區和缺血邊緣區分別行心肌內注射步驟(一)制備好的CTs+CSCs混合細胞制劑,其中,在缺血區注射10μl,且分別在缺血邊緣區的12點、3點、6點和9點位置各注射10μl。其中同等體積PBS(0.01M,pH7.4),BMSCs(濃度為1×107/mL),CTs(濃度為1×107/mL)和CSCs(濃度為1×107/mL)分別按相同的注射方法進行心肌內注射作為對照組,每組動物為5-9只。
(三)檢測指標
所有上述經心肌內細胞移植組別的模型鼠,于注射后4周使用B超對其進行心功能指標進行測定后,取出心臟,進行常規的石蠟包埋和組織切片,并使用Massion Trichrome染色對纖維化及梗死面積進行染色,以對不同組別梗死面積和纖維化進行比較分析;使用抗vWF(血管內皮細胞標記物)抗體進行免疫組化染色,以對不同組別的缺血區和缺血邊緣區的血管密度進行比較分析,使用抗c-Kit/CD34抗體(CTs標記物)對梗死區CTs密度進行比較分析,使用抗PH3抗體和抗α骨骼肌蛋白抗體熒光免疫雙標雙標對梗死邊緣區和梗死區的增殖心肌細胞進行分析(上述方法學均是本領域廣泛認可的常規方法學)。
(四)CTs+CSCs混合細胞制劑對心肌梗死治療的療效
1、CTs+CSCs混合細胞制劑能顯著性減小缺血心肌的梗死面積,且其療效優于單獨使用BMSCs,CSCs和CTs。
對各組梗死面積進行半定量比較柱狀圖(如圖1所示),PBS:PBS對照組;BMSCs:骨髓間充質干細胞組;CTs:心臟CTs組;CTs+BMSCs:心臟CTs+骨髓間充質干細胞組(如下其它部分的均使用該相同的簡寫符號)。CTs+CSCs混合細胞制劑組,BMSCs、CSCs和CTs組組梗死面積均顯著性小于PBS對照組,差 異有顯著性統計學意義(p<0.01)。且CTs+CSCs混合細胞制劑組的梗死面積,顯著性小于BMSCs、CSCs和CTs組的梗死面積,差異有顯著性統計學意義(p<0.01:vs.BMSCs、CSCs;p<0.05:vs.CTs)。上述結果證明:使用CTs+CSCs混合細胞制劑,BMSCs,CSCs和CTs均能顯著性減小缺血心肌的梗死面積,且CTs+CSCs混合細胞制劑療效優于單獨使用BMSCs,CSCs和CTs。
2、CTs+CSCs混合細胞制劑能顯著性改善缺血梗死心臟的心功能,且其療效優于單獨使用BMSCs,CSCs和CTs。
左心室射血分數,左心室收縮末期直徑,左心室舒張末期直徑是衡量心臟功能的常用主要指標。檢測結果如圖2所示:
①對左心室射血分數指標的研究發現(如圖2(A)所示):CTs+CSCs混合細胞制劑,CSCs,BMSCs和CTs組的左心室射血分數均顯著性大于PBS對照組,差異有顯著性統計學意義(p<0.05)。CTs+CSCs混合細胞制劑組的左心室射血分數顯著性大于,CSCs,BMSCs和CTs組,差異有顯著性統計學意義(p<0.01:vs.BMSCs和CSCs;p<0.05:vs.CTs)。上述結果證明:使用CTs+CSCs混合細胞制劑,CSCs,BMSCs和CTs均能顯著性改善缺血心臟的射血分數,且CTs+CSCs混合細胞制劑療效優于單獨使用CSCs,BMSCs和CTs。
②對左心室收縮末期直徑指標的研究發現(如圖2(B)所示):CTs+CSCs混合細胞制劑組,CSCs,BMSCs和CTs組的左心室收縮末期直徑均顯著性小于PBS對照組,差異有顯著性統計學意義(p<0.01)。CTs+BMSCs混合細胞治療用制劑組的左心室收縮末期直徑的均值小于CSCs,CTs和BMSCs組,差異有顯著性統計學意義(p<0.05)。上述結果證明:使用CTs+CSCs混合細胞制劑,CSCs,BMSCs和CTs能顯著性改善缺血心臟的左心室收縮末期直徑,且CTs+BMSCs混合細胞治療用制劑療效也顯示優于單獨使用CSCs,BMSCs和CTs。
③對左心室舒張末期直徑指標的研究發現(如圖2(C)所示):CTs+CSCs混合細胞治療用制劑組,CSCs,BMSCs和CTs組的左心室舒張末期直徑均顯著性小于PBS對照組,差異有顯著性統計學意義(p<0.01)。CTs+CSCs混合細胞治療用制劑組的左心室舒張末期直徑的均值小于CTs和BMSCs組,差異有顯著性統計學意義(p<0.05)。CTs+CSCs混合細胞治療用制劑組的左心室舒張末期直徑的均值小于CSCs組。上述結果證明:使用CTs+CSCs混合細胞制劑,CSCs,BMSCs和CTs均能顯著性改善缺血心臟的左心室舒張末期直徑,且CTs+CSCs混合細胞治療用制劑療效也顯示優于單獨使用CTs或BMSCs,也有優于單獨使用CSCs的趨勢。
綜合上述三個指標證明:CTs+CSCs混合細胞治療用制劑能顯著性改善缺血梗死心臟的心功能,且其療效優于單獨使用CSCs,BMSCs和CTs(。
3、CTs+CSCs混合細胞制劑能顯著提高梗死邊緣區和梗死區的心肌增殖,且其療效優于單獨使用CSCs,BMSCs和CTs。
使用抗PH3(細胞增殖標記物)抗體和抗α骨骼肌肌動蛋白抗體的熒光雙標,對各組心臟切片進行免疫組化染色,以比較梗死區處于分裂狀態下的心肌細胞密度。對該指標研究發現(如圖3所示):CTs+CSCs混合細胞制劑組梗死邊緣區和梗死區處于分裂狀態下的心肌細胞的密度均顯著性高于PBS對照組,差異有顯著性統計學意義(p<0.01)。CSCs,BMSCs和CTs組梗死邊緣區和梗死區處于分裂狀態下的心肌細胞的密度均高于PBS對照組,但差異沒有統計學意義。且CTs+CSCs混合細胞制劑組梗死區處于分裂狀態下的心肌細胞密度的均值均大于CSCs,BMSCs和CTs組,差異有顯著性統計學意義(p<0.01)。上述結果證明:使用CTs+CSCs混合細胞制劑,CSCs,BMSCs和CTs均能促進缺血邊緣區心肌細胞增殖,且其療效優于單獨使用CSCs,BMSCs和CTs。
4、CTs+CSCs混合細胞制劑能顯著性改善缺血梗死心臟的纖維化,且其療效優于單獨使用CSCs,BMSCs和CTs。檢測結果如圖4所示:
梗死區纖維化面積,及非梗死區血管周邊纖維化面積是衡量心肌層纖維化程度的常用主要指標。
①對梗死區纖維化面積指標的研究發現(如圖4(A)所示):CTs+CSCs混合細胞制劑組,CSCs,BMSCs和CTs組的梗死區纖維化面積均顯著性小于PBS對照組,差異有顯著性統計學意義(p<0.05)。CTs+CSCs混合細胞制劑組的梗死區纖維化面積顯著性小于CSCs,BMSCs和CSCs組,差異有顯著性統計學意義(p<0.05)。上述結果證明:使用CTs+CSCs混合細胞制劑組,CSCs,BMSCs和CTs均能顯著性改善缺血心臟的梗死區纖維化面積,且CTs+CSCs混合細胞制劑的療效優于單獨使用CSCs,BMSCs和CTs。②對非梗死區血管周邊纖維化面積指標的研究發現(如圖4(B)所示):CTs+CSCs混合細胞制劑組,CSCs,BMSCs和CTs組的非梗死區血管周邊纖維化面積均顯著性小于PBS對照組,差異有顯著性統計學意義(p<0.05)。CTs+CSCs混合細胞制劑組的非梗死區血管周邊纖維化面積的均值小于BMSCs和CSCs組,差異有顯著性統計學意義(p<0.05)。CTs+CSCs混合細胞制劑組的非梗死區血管周邊纖維化面積的均值小于CTs組。上述結果證明:使用CTs+CSCs混合細胞制劑,CSCs,BMSCs和CTs均能顯著性改善缺血心臟的非梗死區血管周邊纖維化面積,且CTs+CSCs混合細胞制劑療 效也顯示優于單獨使用BMSCs和CSCs。
綜合上述二個指標證明:CTs+CSCs混合細胞制劑能顯著性改善缺血梗死心臟的纖維化,且其療效優于單獨使用CSCs,BMSCs和CTs。
5、CTs+CSCs混合細胞制劑能顯著性減小缺血心肌梗死區,產生膠原纖維的來源細胞――肌成纖維細胞的數目,從而有效改善缺血心肌的纖維化,且其療效優于單獨使用CSCs,BMSCs和CTs。
心肌缺血缺氧會誘導心肌層的成纖維細胞分化成為肌成纖維細胞,該細胞能大量合成膠原纖維,導致心肌層纖維化。因此,評價心肌層肌成纖維細胞的單位密度,是目前常用的改善心肌纖維化的一個指標。使用抗α平滑肌肌動蛋白(肌成纖維細胞的標記物)抗體對各組心臟切片進行免疫組化染色。該指標的研究發現(如圖5所示):CTs+CSCs混合細胞制劑組,CSCs,BMSCs和CTs組的梗死區的肌成纖維細胞密度均顯著性小于PBS對照組,差異有顯著性統計學意義(p<0.01)。CTs+CSCs混合細胞制劑組的肌成纖維細胞密度,顯著性小于CSCs,BMSCs和CTs,差異有顯著性統計學意義(p<0.01)。上述結果證明:使用CTs+CSCs混合細胞制劑,CSCs,BMSCs和CTs均能顯著性減少缺血心肌梗死區肌型成纖維細胞密度,且CTs+CSCs混合細胞制劑療效優于單獨使用CSCs,BMSCs和CTs。
6、CTs+CSCs混合細胞制劑能促進缺血心肌梗死區和邊緣區的血管新生,且其療效優于單獨使用CSCs,BMSCs和CTs。
心肌層血管單位密度是評價心肌層血管新生的一個常用指標。使用抗vWF(血管內皮細胞的標記物)抗體對各組心臟切片進行免疫組化染色。對該指標研究發現(如圖6所示):1)CTs+CSCs混合細胞制劑組,CSCs和CTs組的梗死區的血管密度均顯著性高于PBS對照組,差異有顯著性統計學意義(p<0.05)。BMSCs組的梗死區的血管密度均值高于PBS對照組,差異沒有統計學意義(p>0.05)。且CTs+CSCs混合細胞制劑組梗死區的血管密度均顯著性高于CSCs,BMSC和CTs組,差異有顯著性統計學意義(p<0.01);2)CTs+CSCs混合細胞制劑組,CSCs,BMSCs和CTs組的梗死邊緣區的血管密度均顯著性高于PBS對照組,差異有顯著性統計學意義(p<0.05)。且CTs+CSCs混合細胞制劑組梗死邊緣區的血管密度均顯著性高于CSCs,BMSCs和CTs組,差異有顯著性統計學意義(p<0.01)。上述結果提示:使用CTs+CSCs混合細胞制劑,CSCs,BMSCs和CTs均能顯著性促進缺血心肌梗死區和邊緣區的血管新生,且其療效優于單獨使用CSCs,BMSCs和CTs。
7、CTs+CSCs混合細胞制劑能促進缺血心肌梗死區CTs的再生,且其療效優于單獨使用CSCs,BMSCs和CTs。
缺血心肌的梗死區的CTs在心肌梗死時大部分死亡,影響缺血梗死心肌的結構完整和缺血心肌的再生。使用抗c-Kit/CD34(CTs標記物)抗體對各組心臟切片進行免疫組化染色,以比較梗死區CTs密度。對該指標研究發現(如圖7所示):CTs+CSCs混合細胞制劑組,CSCs,BMSCs和CTs組梗死區的CTs密度均顯著性高于PBS對照組,差異有顯著性統計學意義(p<0.01)。且CTs+CSCs混合細胞制劑組梗死區CTs密度的均值均大于CSCs,BMSCs和CTs組,差異有顯著性統計學意義(p<0.05)。上述結果證明:使用CTs+CSCs混合細胞制劑,CSCs,BMSCs和CTs均能顯著性促進缺血心肌梗死區CTs的再生,且其療效優于單獨使用CSCs,BMSCs和CTs。
綜合上述1~7的結果證明:使用CTs+CSCs混合細胞治療制劑對缺血梗死心肌實施移植治療,能顯著減小缺血心肌的梗死面積,改善缺血心臟的心功能,及減少心肌梗死后心衰的風險,實現上述療效的部分機理是:有效促進經移植的CSCs或心肌內源性CSCs,及其它來源干細胞在心梗邊緣區和梗死區存活、分化與增殖,有效減小梗死區產生膠原纖維來源細胞――肌成纖維細胞的數目,減小梗死區和邊緣區的纖維化,以減小缺血心臟的不良左心室重構,及促進梗死區和邊緣區的血管新生,促進梗死區CTs的再生,從而促進梗死心肌的修復及減少心梗死后心衰的風險。CTs+CSCs混合細胞制劑對缺血梗死心肌的上述指標的綜合療效優于單獨使用CSCs,BMSCs和CTs。
上述實施例為本發明較佳的實施方式,但本發明的實施方式并不受上述實施例的限制,其他的任何未背離本發明的精神實質與原理下所作的改變、修飾、替代、組合、簡化,均應為等效的置換方式,都包含在本發明的保護范圍之內。
- 還沒有人留言評論。精彩留言會獲得點贊!