一種凝血酶緩釋內鏡下止血夾及其制備方法與流程
本發明涉及醫療器械及其制備領域,特別是涉及一種凝血酶緩釋內鏡下止血夾及相關醫療器械的制備方法。
背景技術:
目前,隨著醫療技術的飛速發展與創新,各種內鏡技術、微創技術等診療合一的醫學手段逐步成為主流醫療技術不斷出現,但內鏡與微創器械也帶來一些上消化道出血是常見的消化道疾病,同時也是內鏡下治療中常見的手術并發癥。對于上消化道出血的傳統內科治療手段主要有局部噴灑或注射止血、靜脈應用止血藥物等,目前內鏡下止血廣泛應用靶向藥物凝血酶局部作用于病灶表面,血液很快形成穩定的凝血塊。但靶向噴灑后存在凝血酶被組織液快速稀釋的問題,使藥效降低。后隨著內鏡下器械的不斷發展與改良,用于局部止血及封閉穿孔的各種吻合夾開始出現。鈦夾作為內鏡下治療的重要器械之一,目前只對局部損傷承擔物理封閉治療作用。很多學者嘗試在醫用金屬基材上靶向緩釋凝血酶,目前所有的緩釋研究都基于生物惰性材料表面,不但生物活性差,而且重金屬離子毒性會造成凝血酶失效。羥基磷灰石(hydroxyapatite,簡寫為HA或HAP,分子式為Ca10(OH)2(PO4)6)是牙齒和骨骼的主要(無機)成分,在前沿醫學上也作為人造骨的最佳成分。羥基磷灰石生物兼容性好,是能刺激或者誘導骨組織生長并能與骨組織形成骨性結合的天然陶瓷材料,生物兼容性及生物活性均優于磷酸三鈣及其它磷鈣陶瓷材料。羥基磷灰石的使用,有助于細胞的粘附、增殖及功能發揮,在直接作為骨、牙等替代或缺損修復材料的基礎上,不但是優異的骨組織工程載體材料,也可作為其它醫學功能材料或藥物的載體材料。
技術實現要素:
本發明的目的是解決現有凝血酶緩釋醫療器械領域中存在的部分問題,提供一種凝血酶緩釋內鏡下止血夾。
本發明的目的是通過以下技術方案實現的:
一種凝血酶緩釋內鏡下止血夾的制備方法,包括如下步驟:
(1)將金屬基底用去離子水超聲洗滌干燥后浸泡于磷化液中,取出進行二次干燥后洗滌;
(2)將步驟(1)處理后的金屬基底浸泡于羥基磷灰石懸濁液中,取出干燥;
(3)將步驟(2)處理后的金屬基底浸泡于凝血酶溶液中取出即得;
所述金屬基底為金屬基質的內鏡下止血夾。
優選地,所述步驟(1)和步驟(2)中的干燥是在干燥箱中55-65℃干燥6-8分鐘或25-28℃空氣中干燥1.2-1.8小時。
優選地,所述步驟(1)中的浸泡溫度為25-28℃,時間為1-2分鐘。
優選地,所述步驟(1)中的二次干燥為干燥箱中60-65℃干燥5-8分鐘或25-28℃空氣中干燥1.2-1.8小時。
優選地,所述步驟(1)中的磷化液為5mol/l的羥基乙叉二膦酸溶液10-20份、0.5mol/l的焦磷酸溶液1-2份、檸檬酸或六次甲基四胺1.5-5份混合而成。
優選地,所述步驟(2)中的羥基磷灰石懸濁液濃度為25g/l,浸泡溫度為28-30℃,時間為6-8分鐘。
優選地,所述步驟(3)中的凝血酶溶液中凝血酶濃度為4500-4800U/l,由凝血酶凍干粉與0.9%生理鹽水制備。
優選地,所述步驟(3)中的浸泡溫度為20-25℃,時間為1-1.5小時。
本發明的另方面為一種凝血酶緩釋內鏡下止血夾,包括內鏡下止血夾的金屬基底,所述金屬基底的金屬表面上依次覆蓋有化學轉換膜層、磷酸鹽層、羥基磷灰石層和凝血酶層。
優選地,所述金屬基底的厚度為1-50毫米,磷酸鹽層的厚度為0.02-2微米,化學轉換膜層的厚度為0.4-100納米,羥基磷灰石層的厚度為0.1-0.6毫米,凝血酶層的厚度為0.1-1微米。
優選地,所述金屬基底為不銹鋼,碳鋼,螺紋鋼,冷軋鋼,熱軋鋼,錳鋼,鋁,鋁合金,鈦,鈦合金,鈷合金,鎂鋁合金的一種。
本發明的有益效果:
1.本發明實現了內鏡下止血夾金屬基的生物活性表面的凝血酶緩釋涂層制備,可實現從單純“裸”器械到“功能性”藥物復合器械的升級。
2.本發明可實現凝血酶等僅能局部應用的藥物的靶向緩釋,可用于制備的“功能性”藥物復合內鏡下止血夾可直接放置于人體靶器官以及手術靶部位。
3.本發明可實現凝血酶等藥物在金屬基涂層體系上的穩定緩釋,藥物可實現在指定部位緩釋從而可持續增加周圍組織濃度,解決了局部噴灑的藥物被組織液快速稀釋而影響藥效的問題。
附圖說明
圖1是本申請凝血酶緩釋內鏡下止血夾的產品圖示;
圖2是制備的穩定羥基磷灰石納米/亞微米涂層;
圖3是羥基磷灰石納米/亞微米涂層表面的凝血酶層;
圖4是羥基磷灰石層的XPS曲線;
圖5是凝血酶層的XPS曲線;
圖6是不同時間下凝血酶平均濃度曲線圖;
圖7是不同時間段凝血酶的柱圖。
具體實施方式
為了更好地說明本發明,下面結合本發明實施例中的附圖,對本發明實施例中的技術方案進行清楚、完整地描述。
本發明的凝血酶緩釋內鏡下止血夾,如圖1所示,包括內鏡下止血夾的金屬基底12、金屬表面13、磷酸鹽層14、化學轉換膜層15、羥基磷灰石層16和凝血酶層17。所述金屬基底12的厚度為1-50毫米,磷酸鹽層15的厚度為0.02-2微米,化學轉換膜層14的厚度為0.4-100納米,羥基磷灰石層16的厚度為0.1-0.6毫米,凝血酶層17的厚度為0.1-1微米。
具體實施例1:
1.1.SU304奧氏體不銹鋼樣品用去離子水超聲洗滌5分鐘,清除表面的油污或銹蝕。待表面干凈后,放置于干燥箱中60℃干燥8分鐘,以表面無殘留水滴為合格,所述不銹鋼樣品的厚度為10毫米。
2.將5mol/l的羥基乙叉二膦酸溶液15份、0.5mol/l的焦磷酸溶液1份、六次甲基四胺2份制備磷化液。將不銹鋼樣品浸泡于25℃上述磷化液中2分鐘,在金屬表面形成磷酸鹽層15和化學轉換膜層14,所述溶液的1份為1l,六次甲基四胺1份為1g。
3.取出后待多余溶液流下后,放置于干燥箱中60℃干燥8分鐘,使制備的磷酸鹽層15和化學轉換膜層14干燥。所述化學轉換膜層14為金屬表面13上很薄的一層薄膜。
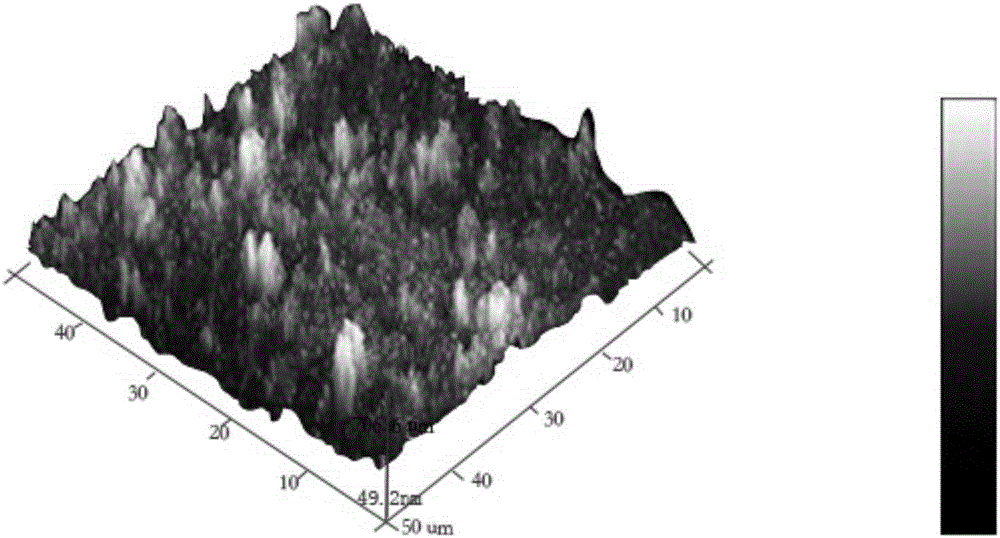
4.待樣品表面無明顯液體或膠體,用去離子水沖洗金屬表面5分鐘,沖洗掉多余的磷化結晶殘留,剩下不易被沖洗掉的化學轉換膜層14表面的磷酸鹽層15,其厚度為10納米,磷酸鹽層15的厚度為0.1微米。放置于25g/l不斷進行攪拌的羥基磷灰石(HA)懸濁液中,28℃浸泡8分鐘。完成金屬表面化學轉換膜層14和磷酸鹽層15上的羥基磷灰石層的自組裝制備,所得羥基磷灰石層的厚度為0.3毫米。保留一部分樣品進行羥基磷灰石層的光電子能譜與原子力顯微鏡表征,見附圖2-5。
5.取出步驟4制備好的產品放入干燥箱中60℃干燥8分鐘,待表面無殘留水滴后。放入凝血酶凍干粉與0.9%生理鹽水制備4800U/l凝血酶溶液中,25℃浸泡1.5小時,制備凝血酶層,其厚度為0.5微米。
6.取出在30℃空氣中干燥2小時,進行光電子能譜與原子力顯微鏡表征,原子力顯微鏡表征測試結果見附圖2-3,從AFM對比圖可以看出,制備前后表面出現明顯變化,淺色區域為凝血酶分子。光電子能譜表征測試結果見附圖4-5,經過XPS對比可以看出,(1)凝血酶分子成功涂覆在羥基磷灰石表面,且有一定厚度;(2)從高分辨XPS解譜來看,沒有新的化學鍵產生,緩釋產物是凝血酶。上述結果說明凝血酶涂層前后成分與形貌產生了明顯的變化,形成了穩定的涂層,涂層為凝血酶層;沒有新的化學鍵結合產生,說明凝血酶無其它污染物產生。
7.取出步驟5樣品在30℃空氣中干燥2小時,每組取6塊樣品,利用酶標儀在450nm波長下分別測定不同濃度標準品的吸光度,根據不同標準品濃度及對應的吸光度繪制標準曲線。在此基礎上不同時間下計算的出的平均凝血酶濃度如附圖6所示,從附圖6可知在0-60分鐘內凝血酶釋放迅速,從60-180分鐘凝血酶釋放十分緩慢但仍可維持一定的濃度。
將鍍有凝血酶的金屬基底(共6塊)分別浸泡于盛有200ml生理鹽水的燒杯中,分別于0h、1h、2h、3h、4h、5h取樣本液100ul置于標記好的EP管中,每次取樣后棄去原有生理鹽水,利用酶標儀測定不同時間下六組溶液的吸光度并計算平均值。不同時間下棄去浸泡溶液測得的吸光度應用t檢驗兩兩組間比較P值均大于0.05,差異無統計學意義,每隔1小時棄去浸泡溶液前測得的溶液的吸光度無顯著差異,我們可以認為相同時間段內藥物涂層金屬基底可穩定持續釋放凝血酶。具體結果如附圖7所示。
上述結果說明凝血酶在1小時候達到穩定緩釋值,而在持續變化的溶液中可以穩定的緩釋凝血酶。
上述試驗研究表明“凝血酶-羥基磷灰石-無氧化物層-金屬”鋼板于生理鹽水溶液中可持續穩定地釋放凝血酶,從而保證溶液中凝血酶的濃度,具有凝血酶緩釋效果,即,如此制備的凝血酶緩釋金屬基質內鏡下止血夾也具有良好的凝血酶緩釋效果。
以上所述,僅為本發明較佳的具體實施方式,但本發明的保護范圍并不局限于此,任何熟悉本技術領域的技術人員在本發明披露的技術范圍內,可輕易想到的變化或替換,都應該涵蓋在本發明的保護范圍之內。因此,本發明的保護范圍應該以權利要求書的保護范圍為準。
- 還沒有人留言評論。精彩留言會獲得點贊!