一種兼具促進骨形成和抑制骨吸收作用的二氧化鈦納米管及其制備方法與流程
本發明提供一種兼具促進骨形成和抑制骨吸收作用的二氧化鈦納米管及其制備方法。屬于生物醫學材料領域,涉及一種利用旋轉涂布層層自組裝技術在負載辛伐他汀的二氧化鈦納米管表面構建殼聚糖/明膠多層膜的方法,屬于鈦材表面功能化的方法。
背景技術:
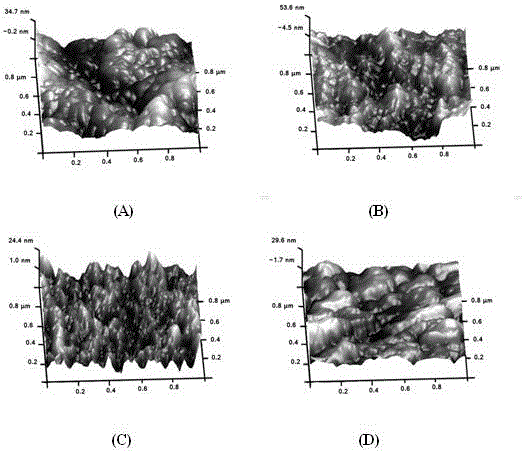
:鈦材由于具有良好的機械性能和生物相容性,而被廣泛作為骨組織植入材料應用于生物醫學領域。但在植入初期,因其存在生物惰性,缺乏誘導骨生成潛能,導致鈦基植入體與周邊自然骨組織的整合性差,植入體容易松動并引發骨溶癥。尤其對于患有骨質疏松癥的老年患者,骨移植手術是一個巨大的挑戰。Park和Oh等通過模擬自然骨的納米結構,在鈦材表面構建二氧化鈦納米管結構并證實具有良好的促成骨作用(Park,2009,Small&Oh,2009,ProceedingsoftheNationalAcademyofSciences)。二氧化鈦納米管因重復性好、簡單易行且具有獨特的納米拓撲結構,可作為負載藥物、生長因子等的載體在生物醫學工程領域得到廣泛應用。辛伐他汀作為他汀類藥物已被廣泛應用于臨床領域,可有效降低血漿膽固醇水平,治療心血管疾病。近年,研究表明辛伐他汀可促進骨形成和抑制骨吸收,成為臨床常見的骨類病癥治療藥物,并且有很大的開發潛力。目前,Jegal和Pullisaar等研究發現負載辛伐他汀的支架材料能促進成骨分化,進而提高骨整合性(Jegal,2016,MacromolecularResearch&Pullisaar,2009,Biochemical&BiophysicalResearchCommunications)。但是如何有效地控制辛伐他汀藥物釋放,避免濃度不適引起炎癥反應,仍是一大挑戰。層層自組裝技術是基于聚陽離子和聚陰離子交替沉積制備聚電解質自組裝多層膜的技術。殼聚糖和明膠因具有良好的生物相容性而分別作為多聚陽離子和多聚陰離子。隨著多層膜結構的不斷降解,所負載的藥物釋放,進而引起細胞生物學反應。技術實現要素:本發明的目的是要提供一種兼具促進骨形成和抑制骨吸收作用的二氧化鈦納米管及其制備方法,其利用二氧化鈦納米管的管狀結構裝載辛伐他汀,并在其表面構建多層膜,隨著多層膜結構的物理降解控制二氧化鈦納米管中辛伐他汀藥物釋放性能。本發明的目的是這樣實現的:利用陽極氧化法合成二氧化鈦納米管,進一步利用滴加法在二氧化鈦納米管里裝載藥物辛伐他汀,最后利用旋轉涂布層層自組裝技術在負載辛伐他汀的二氧化鈦納米管上構建殼聚糖/明膠多層膜。為達到上述目的,本發明提供如下技術方案:a、將鈦材按照常規方法進行預處理;b、利用陽極氧化法在步驟a預處理后的鈦材表面制備管徑約30-100nm的二氧化鈦納米管;c、采用直接滴加法在步驟b制得的二氧化鈦納米管上負載辛伐他汀;d、利用旋轉涂布層層自組裝技術在步驟c制得的負載辛伐他汀的二氧化鈦納米管上構建殼聚糖/明膠多層膜。進一步,所述步驟a是將鈦材剪切成(1-2)cm×(1-2)cm鈦片,依次利用丙酮、無水乙醇和雙蒸水超聲清洗10-30min,置于37-40℃烘箱干燥備用。進一步,所述步驟b是以步驟a預處理后的鈦片為陽極,鉑片為陰極,以體積分數為50%的丙三醇溶液配制的0.27mol/L氟化銨溶液為電解質,在10-30V的恒定電壓下電解1-3h,將氧化后的鈦片超聲清洗2-5min,干燥,最后放置于馬弗爐中400-600℃條件下加熱1-3h,制得管徑為30-100nm的二氧化鈦納米管。進一步,所述步驟c是以體積分數為50%的乙醇溶液配制的10-15mmol/L辛伐他汀溶液。進一步,所述步驟d是以體積分數為0.3-0.5%的醋酸溶液配制5-10mg/mL的殼聚糖,常溫攪拌并溶解;以三蒸水配制5-10mg/mL的明膠溶液,40-50℃水浴加熱使其溶解;用旋轉涂布法在負載辛伐他汀的二氧化鈦納米管表面構建殼聚糖/明膠多層膜,共6-10個循環,旋轉速度為2000-4000rpm,每層旋轉時間為20-40s。本發明的有益效果在于:本發明利用二氧化鈦納米管的管狀結構裝載辛伐他汀,并通過多層膜結構的物理降解控制辛伐他汀藥物釋放。實現藥物緩釋的目的。優點:該方法簡單易行、周期短、成本較低,具有良好的應用前景。附圖說明圖1是掃描電子顯微鏡圖像:未處理鈦材(a),管徑為70nm的二氧化鈦納米管(b),負載辛伐他汀的二氧化鈦納米管(c),負載辛伐他汀并被殼聚糖/明膠多層膜覆蓋的二氧化鈦納米管(d)。圖2是原子力顯微鏡圖像:未處理鈦材(a),管徑為70nm的二氧化鈦納米管(b),負載辛伐他汀的二氧化鈦納米管(c),負載辛伐他汀并被殼聚糖/明膠多層膜覆蓋的二氧化鈦納米管(d)。圖3是接觸角檢測:除第0層的TiO2納米管、第1層辛伐他汀外,奇數層為明膠,偶數層為殼聚糖(n=3)。圖4是辛伐他汀分別從負載辛伐他汀的二氧化鈦納米管,負載辛伐他汀并被殼聚糖/明膠多層膜覆蓋的二氧化鈦納米管中釋放的曲線。圖5是成骨細胞在經過不同處理的鈦材表面的堿性磷酸酶含量,其中*表示兩組間p<0.05,**表示兩組間p<0.01。圖6是破骨細胞在經過不同處理的鈦材表面的酸性磷酸酶含量,其中*表示兩組間p<0.05,**表示兩組間p<0.01。具體實施方式實施例1.兼具促進骨形成和抑制骨吸收作用二氧化鈦納米管的制備a、將鈦材剪切成1cm×1cm的鈦片,依次利用丙酮、無水乙醇和雙蒸水超聲清洗20min,并于37℃烘箱中烘干備用;b、以步驟a所準備的鈦片為陽極,鉑片為陰極,以體積分數為50%的丙三醇溶液配制的0.27mol/L的氟化銨溶液為電解質,在15V的恒定電壓下電解1h,將氧化后的鈦片超聲清洗2min,干燥,最后放置于馬弗爐中400℃條件下加熱2h,制得管徑為70nm的二氧化鈦納米管;c、以體積分數為50%的乙醇溶液配制10mmol/L的辛伐他汀溶液,利用滴加法在步驟b所制得的1cm×1cm鈦片表面的二氧化鈦納米管上滴加4μL辛伐他汀溶液;d、以體積分數為0.3%的醋酸溶液配制10mg/mL的殼聚糖,常溫攪拌并溶解;以三蒸水配制10mg/mL的明膠溶液,50℃水浴加熱使其溶解;用旋轉涂布法在步驟c所制得的負載辛伐他汀的二氧化鈦納米管表面構建殼聚糖/明膠多層膜,共6個循環,旋轉速度為3000rpm,每層旋轉時間為30s。實施例2.兼具促進骨形成和抑制骨吸收作用二氧化鈦納米管的制備a、將鈦材剪切成1cm×1cm的鈦片,依次利用丙酮、無水乙醇和雙蒸水超聲清洗20min,并于37℃烘箱中烘干備用;b、以步驟a所準備的鈦片為陽極,鉑片為陰極,以體積分數為50%的丙三醇溶液配制的0.27mol/L的氟化銨溶液為電解質,在20V的恒定電壓下電解1h,將氧化后的鈦片超聲清洗2min,干燥,最后放置于馬弗爐中400℃條件下加熱2h,制得管徑為70nm的二氧化鈦納米管;c、以體積分數為50%的乙醇溶液配制10mmol/L的辛伐他汀溶液,利用滴加法在步驟b所制得的1cm×1cm鈦片表面的二氧化鈦納米管上滴加4μL辛伐他汀溶液;d、以體積分數為0.3%的醋酸溶液配制10mg/mL的殼聚糖,常溫攪拌并溶解;以三蒸水配制10mg/mL的明膠溶液,50℃水浴加熱使其溶解;用旋轉涂布法在步驟c所制得的負載辛伐他汀的二氧化鈦納米管表面構建殼聚糖/明膠多層膜,共6個循環,旋轉速度為3000rpm,每層旋轉時間為30s。結果如表1所示,對其表面化學元素進行XPS分析,C元素的逐步提高,Ti元素的消失,說明已成功將負載辛伐他汀并覆蓋殼聚糖/明膠多層膜在二氧化鈦納米管表面。表1、各組樣品表面化學元素組成(按質量百分含量計算)底物C%O%N%Ti%二氧化鈦納米管16.5058.75024.75負載辛伐他汀的二氧化鈦納米管19.4856.11024.40負載辛伐他汀并被殼聚糖/明膠多層膜覆蓋的二氧化鈦納米管64.7021.9213.380由圖1結果可見,經過陽極氧化在鈦材表面形成了直徑為70nm的二氧化鈦納米管,通過直接滴加法負載辛伐他汀后,表面納米管結構仍清晰可見,表明藥物已進入納米管,最后通過旋轉涂布殼聚糖/明膠多層膜后,納米管狀結構被完全覆蓋。由圖2結果可見,負載辛伐他汀后,表面仍可觀察到山谷樣結構,這與二氧化鈦納米管結構相關。相反,多層膜覆蓋后在表面變得較平整。由圖3結果可見,二氧化鈦納米管接觸角為小于15°,說明其具有很強的親水性。當負載辛伐他汀藥物后,接觸角升高至大于40°小于50°。第二層殼聚糖沉積后,接觸角變為30-35°。從第七層開始,接觸角在30°與45°的之間產生規律性的波動,說明從第六層開始在TiO2納米管表面已經形成單層、全覆蓋的殼聚糖和明膠層。由圖4結果可見,為了證實殼聚糖/明膠多層膜可控制辛伐他汀緩慢釋放,在不同時間點收集0.5mLPBS檢測辛伐他汀活性,從未鋪膜的二氧化鈦納米管中釋放出的辛伐他汀,24h內釋放很快,在48h基本達到最高值,24h到48h間釋放速率有一定緩解,說明納米管一定的緩釋作用,但這種作用維持時間有限。經過殼聚糖/明膠多層膜修飾后,藥物釋放緩慢,直到120h達到最高。說明殼聚糖/明膠多層膜起到了控制辛伐他汀緩慢釋放的作用。實施例3.兼具促進骨形成和抑制骨吸收作用二氧化鈦納米管的制備a、將鈦材剪切成1cm×1cm的鈦片,依次利用丙酮、無水乙醇和雙蒸水超聲清洗20min,并于37℃烘箱中烘干備用;b、以步驟a所準備的鈦片為陽極,鉑片為陰極,以體積分數為50%的丙三醇溶液配制的0.27mol/L的氟化銨溶液為電解質,在30V的恒定電壓下電解1h,將氧化后的鈦片超聲清洗2min,干燥,最后放置于馬弗爐中400℃條件下加熱2h,制得管徑為70nm的二氧化鈦納米管;c、以體積分數為50%的乙醇溶液配制10mmol/L的辛伐他汀溶液,利用滴加法在步驟b所制得的1cm×1cm鈦片表面的二氧化鈦納米管上滴加4μL辛伐他汀溶液;d、以體積分數為0.3%的醋酸溶液配制10mg/mL的殼聚糖,常溫攪拌并溶解;以三蒸水配制10mg/mL的明膠溶液,50℃水浴加熱使其溶解;用旋轉涂布法在步驟c所制得的負載辛伐他汀的二氧化鈦納米管表面構建殼聚糖/明膠多層膜,共6個循環,旋轉速度為3000rpm,每層旋轉時間為30s。實驗例1.兼具促進骨形成和抑制骨吸收作用的二氧化鈦納米管對成骨細胞分化的促進能力取實施例2經過不同處理后得到的“二氧化鈦納米管”、“二氧化鈦納米管-辛伐他汀”和“二氧化鈦納米管-辛伐他汀-殼聚糖/明膠多層膜”材料以及未處理純鈦(簡稱為“鈦材”),在不同材料表面接種新生大鼠頭蓋骨的成骨細胞,接種密度為1×104/cm2,用含體積分數為10%胎牛血清的高糖DMEM培養基進行培養,每隔2天進行換液。分別培養4天和7天后,用200μL1%的TritonX-100溶液收集細胞,2500轉離心5min,利用試劑盒檢測細胞上清液中的堿性磷酸酶和蛋白質含量,最后用酶標儀分別于波長520nm和562nm處測定吸光度。結果如圖5所示,不論在第4天還是7天,與其他組相比,在負載辛伐他汀并被殼聚糖/明膠多層膜覆蓋的二氧化鈦納米管上生長的成骨細胞表達最高的堿性磷酸酶含量(p<0.05或p<0.01),說明辛伐他汀的不斷釋放促進成骨細胞早期分化。實驗例2.兼具促進骨形成和抑制骨吸收作用的二氧化鈦納米管對破骨細胞形成的抑制能力取實施例2經過不同處理后得到的“二氧化鈦納米管”、“二氧化鈦納米管-辛伐他汀”和“二氧化鈦納米管-辛伐他汀-殼聚糖/明膠多層膜”材料以及未處理純鈦(簡稱為“鈦材”),在不同材料表面接種RAW264.7細胞,接種密度為6×104/cm2,用含有10%胎牛血清,20ng/mL巨噬細胞集落刺激因子(m-CSF)及50ng/mL重組核轉錄因子kappa-B的配體(RANKL)的條件培養基進行培養。每隔2天換液。培養7天后,用200μL1%的TritonX-100溶液收集細胞,2500轉離心5min,利用試劑盒對上清液中的抗酒石酸酸性磷酸酶的活性進行檢測。最后用酶標儀于波長405nm處測定吸光度。結果如圖6所示,與未處理鈦與二氧化碳納米管組相比,在負載辛伐他汀的二氧化鈦納米管和負載辛伐他汀并被殼聚糖/明膠多層膜覆蓋的二氧化鈦納米管上生長的破骨細胞表達較低的抗酒石酸酸性磷酸酶的活性(p<0.05或p<0.01),說明辛伐他汀的不斷釋放抑制破骨細胞形成。經過上述實驗步驟,可以獲得一種藥物緩釋系統,該系統利用二氧化鈦納米管的管狀結構裝載辛伐他汀,進而在其表面構建多層膜,隨著多層膜結構的物理降解控制二氧化鈦納米管中辛伐他汀藥物釋放性能。此外,該系統能有效促進成骨分化,抑制破骨細胞形成。上述實施方案中需要注意的問題是:所有與細胞接觸的實驗用具和試劑都必須是無菌的。最后說明的是,以上實施例僅用于說明本發明的技術方案而非限制。盡管通過上述實施例已經對本發明做了較為詳細的描述,但本領域技術人員仍可以根據
發明內容和實施例部分所描述的技術內容,在形式上和細節上對其作出各種各樣的改變,而不偏離所附權利要求書所限定的本發明的精神和范圍。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1