靈仙新苷在制備治療或預防炎性腸病的藥物中的應用的制作方法
本發明屬于天然藥物技術領域,具體涉及一種靈仙新苷在制備治療或預防炎性腸病的藥物中的應用。
背景技術:
炎性腸病簡稱IBD,是一種特殊的慢性腸道炎癥性疾病,主要包括克羅恩病(CD)和潰瘍性結腸炎(UC)。臨床上,炎性腸病患者表現為反復的腹痛、腹瀉、粘液血便,甚至出現各種全身并發癥如視物模糊、關節疼痛、皮疹等。本病經治療可好轉,也可自行緩解。但多數患者反復發作,遷延不愈,其中相當部分患者因出現并發癥而需要手術治療。
靈仙新苷是一種集抗炎、鎮痛和免疫調節作用于一體的安全、高效、穩定的新型天然藥物,具有成藥性好和產業化前景廣闊的特點;并且靈仙新苷還具有顯著的調血脂、抗動脈粥樣硬化和抗心肌缺血作用,抗類風濕性關節炎作用。但是其口服生物利用度低,而且口服后在腸道黏膜分布較多,目前其抗炎性腸病的作用還未開發。
技術實現要素:
本發明的目的是提供靈仙新苷在制備治療或預防炎性腸病的藥物中的應用。
本發明的目的是通過以下方式實現的:
以靈仙新苷為藥物活性成分在制備治療或預防炎性腸病的藥物中的應用。
靈仙新苷添加藥學上可接受的輔料制備成適合臨床使用的劑型。所述的劑型為口服制劑或注射劑,優選所述的輔料為崩解劑、稀釋劑、黏合劑、潤滑劑、拋射劑、增溶劑、助溶劑、乳化劑、著色劑、填充劑、潤濕劑、滲透壓調節劑、穩定劑、助流劑、矯味劑、防腐劑、助懸劑、包衣材料、芳香劑、抗黏合劑、整合劑、滲透促進劑、等滲調節劑、pH值調節劑、緩沖劑、增塑劑、表面活性劑、發泡劑、消泡劑、增稠劑、包合劑、保濕劑、吸收劑、絮凝劑與反絮凝劑、助濾劑、阻滯劑、抗氧劑、抑菌劑。
在制備治療或預防炎性腸病的藥物時,靈仙新苷可以作為唯一活性成分或者與其他有效成分組合使用。
本發明所述的靈仙新苷可以通過市售獲得或通過以下方法制備得到:
取威靈仙藥材(東北鐵線蓮),用藥材10倍重量水加熱回流提取3次,每次2小時,合并水提液,將水提液室溫冷卻、過濾后上預先處理好的大孔樹脂D101(流速2BV/h),依次用水和20%乙醇洗脫至流出液澄清后,再用50%乙醇洗脫至流出液無色,收集50%乙醇洗脫液,濃縮,微波干燥,得威靈仙總皂苷干粉,將該總皂苷干粉加入其50倍重量無水乙醇加熱回流2小時后趁熱過濾,濾液室溫放置過夜,濾取沉淀,干燥后得粗品,粗品用20%乙醇溶解后上預先處理好的ODS柱(流速1BV/h),依次用30%,40%,90%乙醇分別洗脫至無色,收集40%乙醇洗脫液,減壓濃縮干燥后,即得淡黃色靈仙新苷,含量:>90%。
本發明通過靈仙新苷對炎癥性腸炎大鼠克羅恩病(Crohn’s disease,CD)的防治實驗,采用SD大鼠TNBS/乙醇法構建模型,評價了靈仙新苷32、16、8mg/kg抗大鼠炎癥性結腸炎的作用。結果表明,靈仙新苷具有顯著抗大鼠炎癥性腸炎克羅恩病的作用,可利用此開發出一種抗炎性腸病(包括免疫炎性腸病和其他原因引起的炎性腸病)的療效好而安全性高的一類中藥新藥。
附圖說明
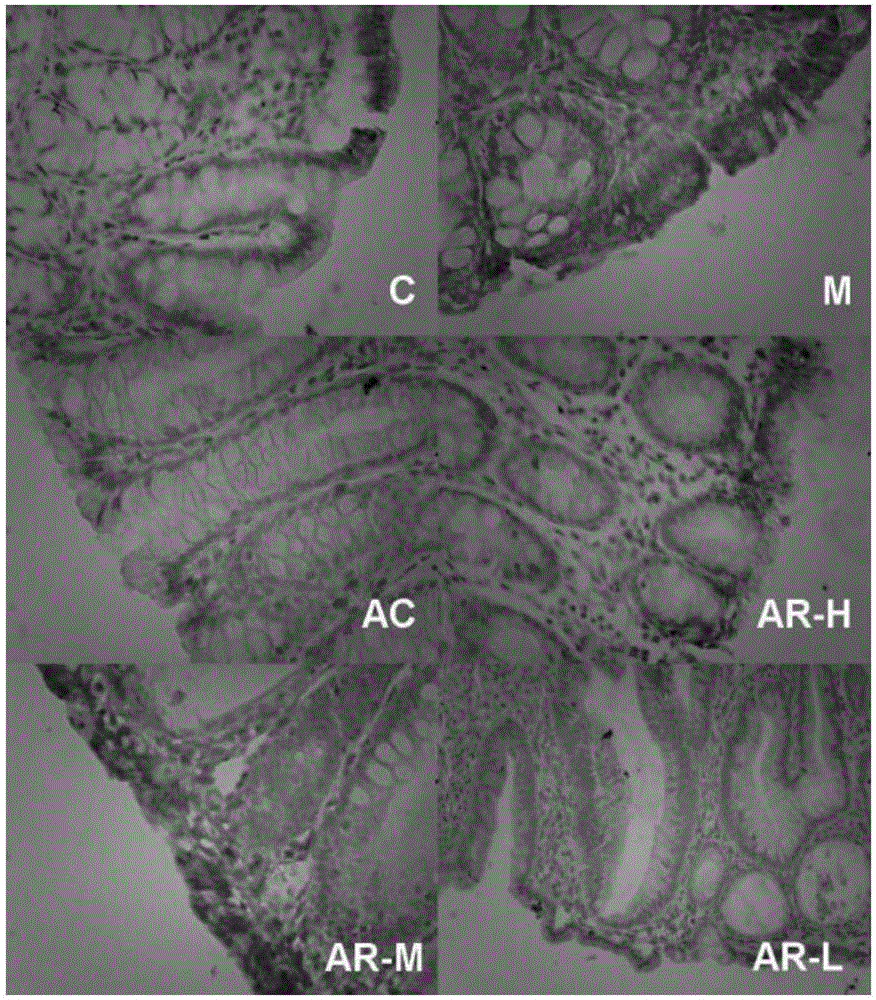
圖1為大鼠炎癥性腸病克羅恩模型組織病理學圖。
圖中,C空白對照組,M模型對照組,AC美沙拉嗪組,AR-H靈仙新苷高劑量組,AR-M靈仙新苷中劑量組,AR-L靈仙新苷低劑量組,×400
圖2為大鼠炎癥性腸病克羅恩模型腸組織TNF-α表達(免疫組化)圖。
圖中,C空白對照組,M模型對照組,AC美沙拉嗪組,AR-H靈仙新苷高劑量組,AR-M靈仙新苷中劑量組,AR-L靈仙新苷低劑量組,×400
圖3為大鼠炎癥性腸病克羅恩模型腸組織TLR4表達(免疫組化)圖。
圖中,C空白對照組,M模型對照組,AC美沙拉嗪組,AR-H靈仙新苷高劑量組,AR-M靈仙新苷中劑量組,AR-L靈仙新苷低劑量組,×400
圖4為大鼠炎癥性腸病克羅恩模型腸組織NF-κBp65表達(免疫組化)圖。
圖中,C空白對照組,M模型對照組,AC美沙拉嗪組,AR-H靈仙新苷高劑量組,AR-M靈仙新苷中劑量組,AR-L靈仙新苷低劑量組,×400
圖5為大鼠炎癥性腸病克羅恩模型腸組織TLR4、NF-κBp65表達(Western blot)圖。
圖中,C空白對照組,M模型對照組,AC美沙拉嗪組,AR-H靈仙新苷高劑量組,AR-M靈仙新苷中劑量組,AR-L靈仙新苷低劑量組。
具體實施方式
以下通過實施例對本發明進行進一步描述,但本發明并不限于實施例所述的范圍。
實施例1
通過藥效試驗證明靈仙新苷對大鼠炎癥性腸病克羅恩模型的防治作用:
1.1試驗方法:
(1)動物分組:SPF級雄性SD大鼠48只,按體重隨機均分為6組,分別設為正常對照組(Normal control group,NC組)、克羅恩病模型組(Model group,MC組)、靈仙新苷低劑量組(Low dose AR group,AR-L組,16mg·kg-1)、靈仙新苷中劑量組(Moddel dose AR group,AR-M組,32mg·kg-1)、靈仙新苷高劑量組(High dose AR group,AR-H組,64mg·kg-1)和陽性藥組(美沙拉嗪,5-Aminosalicylic acid group,AC組,500mg·kg-1)。
(2)模型建立:參照國際公認的Morris方法,采用TNBS/乙醇法構建模型,大鼠先適應性飼養1周,造模前禁食不禁水24小時,稱重,腹腔注射10%水合氯醛1ml/kg,麻醉后,倒懸位,將大鼠灌胃針自肛門緩慢插入直腸約8cm,正常對照組灌入同體積生理鹽水,其他5組大鼠灌入5%TNBS0.4ml+50%乙醇0.2ml(2:1=v:v)混合溶液用lml注射器緩慢把藥液推入腸內[2],倒懸位持續30s后,取頭低尾高位20-30度,放置觀察籠中,清醒后放回飼養籠。
(3)給藥方法:造模后24h開始灌胃,正常組與模型組給予0.9%的氯化鈉溶液2mL/只灌胃;AC組按100mg/kg灌胃;AR-H組、AR-M組、AR-L組分別給予32mg、16mg和8mg/kg.,給藥容積為0.5ml/100g,每天灌胃一次,連續給藥28d。除空白組外,其余5組每隔6d重復造模一次,共造模4次。
實驗中采用的靈仙新苷(Clematichinenoside,AR)為淡黃色粉末,含量>90%。
臨用前用蒸餾水溶解配制成所需濃度的澄清溶液。
美沙拉嗪腸溶包衣片為葵花藥業集團佳木斯鹿靈制藥有限公司產品,規格:0.25g/片,臨用前用0.5%CMC-Na研磨配制成濃度為50mg/ml的均勻混懸液。
(4)指標測定與評價:
A.標本采集及結腸黏膜組織學損傷評分
頸總動脈取血處死大鼠,游離結腸組織,沿腸系膜縱軸剖開,冰生理鹽水清洗,肉眼觀察黏膜損傷情況,并行結腸組織大體形態損傷評分,評分標準采用結腸組織大體形態損傷指數(colon marcroscopic damage index,CMDI)標準如下:
0分:結腸黏膜無損傷
1分:局部結腸黏膜充血水腫但無糜爛、潰瘍形成
2分:有潰瘍形成但無顯著炎癥發生
3分:在一個部位上有線性潰瘍形成并且有炎癥
4分:在兩個或以上的部位有潰瘍形成和/或炎癥
5分:沿結腸長軸有兩個或以上部位有潰瘍形成和炎癥,長度超過1cm
6~8分:潰瘍形成超過2cm
B.病理組織切片HE染色及觀察
固定標本:選取大鼠結腸組織病變最明顯的位置約2cm,放在10%中性甲醛中固定,這里甲醛容量取為組織標本的2-3倍即可。
切片:在10%中性甲醛中固定24h后取出大鼠組織,逐級用酒精脫水,然后用二甲苯透明、浸蠟,再石蠟包埋,做常規切片4μm,45℃水浴后撈片,在80℃烤箱烤片約40min。
染色:把切片放入二甲苯中浸泡,時間為5-10min/次,共泡3次;然后用無水乙醇浸泡,1min/次共2次,接著用95%乙醇浸泡,1-2min/次,2次,再用80%乙醇浸泡約1min,最后自來水漂洗4-5次;使用蘇木素染色(染細胞核)5-6min,然后自來水漂洗4-5次;再浸于1%鹽酸,染色5sec,用自來水沖洗返藍;用1%的伊紅染色(染細胞漿)30sec;用95%的乙醇脫水2次,1-2min/次;用無水乙醇脫水,2次,1-2min;用二甲苯脫水透明3次,2min/次;最終用中性樹膠封片、鏡檢。
C.組織學損傷指數(tissues damage index,TDI)
組織切片HE染色后,在顯微鏡下觀察潰瘍、炎性細胞浸潤等變化。并采用組織學損傷指數(tissues damage index,TDI)[3]進行評分。標準如下:
0分:沒有損傷
1分:黏膜和/或黏膜下輕度炎癥浸潤和充血水腫,黏膜輕度糜爛,伴隨有毛細血管增生,而黏膜肌層保持完整
2分:在1分的基礎上,范圍達標本的50%以上
3分:顯著地炎癥浸潤和充血水腫,有潰瘍形成并延伸到黏膜固有層,較少的炎癥細胞浸潤黏膜固有層,肌層無壞死
4分:在3分的基礎上,范圍達標本的50%及以上
5分:潰瘍廣泛形成,伴有黏膜糜爛,有數量眾多的中性粒細胞浸潤,細胞壞死及潰瘍面可達到黏膜固有肌層
6分:在5分的基礎上,范圍達標本的50%及以上
D.脾臟指數測定:
大鼠處死后取出脾臟,使用電子天平稱重,以脾臟的重量(g)與大鼠每100g體重之比作為脾臟指數。
E.ELISA法檢測結腸組織中的IL-10和TNF-α含量
在酶標板上包裹抗大鼠細胞因子(TNF-α和IL-10)的單抗;樣品和標準品里的大鼠細胞因子與單抗結合后,再加上生物素化過的抗大鼠細胞因子抗體,這樣就形成了免疫復合物連接在板上面;用辣根過氧化物酶標記的親和素會與生物素特異性結合,加入顯色劑則出現藍色,再加入終止液,顏色變黃,在450nm處測量吸光度值。因為細胞因子濃度與吸光度值成正比關系,通過繪制標準曲線,最終可以求出標本中的大鼠結腸組織中的細胞因子的濃度。
F.免疫組化法檢測腸組織TLR4、TNF-α、NF-kBp65陽性細胞數表達
采用免疫組織化學法檢測大鼠結腸組織中TLR4、TNF-α、NF-kBp65的表達。主要染色過程如下:
①.石蠟切片脫蠟水化,微波中檔抗原修復10min。自然冷卻,用PBS液(0.01mol/L
PH7.4)沖洗3次×2min。
②正常山羊血清封閉,室溫孵育10min。傾去血清,勿洗,滴加即用型一抗,37℃孵育1小時。
②PBS沖洗,2min×3次。
③滴加即用型快速免疫組化MaxVisionTM二抗,37℃或室溫孵育10-15min。
④PBS沖洗,2min×3次。
⑤滴加新鮮配制的顯色劑(DAB)3-5min,顯微鏡下觀察。
⑦自來水充分沖洗,蘇木素復染,自來水沖洗返藍。
⑧梯度酒精脫水、二甲苯透明,中性樹膠封片。
G.Western blot法檢測腸組織TLR4、NF-kBp65蛋白表達
稱取100mg腸組織置于冰板上表面皿中剪成碎片,在破碎的組織中加入1ml預冷蛋白裂解液(RIPA:PMSF=9:1),用4℃玻璃勻漿器勻漿至95%細胞被破碎并靜置于冰浴下30min,將組織勻漿4℃18000rpm離心15min,取上清腸組織蛋白轉移至新的離心管中。各樣品取5μl進行蛋白定量,其余樣本加入總體積1/5的loading buffer(5×),100℃煮沸5min后放于-20℃冰箱中保存。
使用BCA蛋白濃度測定試劑盒(BCA protein Assay Kit),按照50:1的比例將50體積BCA試劑A和BCA試劑B充分混合配制工作液;蛋白標準溶液0、0.5、1.0、2.0、4.0、6.0、8.0、10.0μg/孔加入200μl BCA工作液后再562nm下比色,記錄吸光值,測定繪制標準曲線;將待測樣品稀釋至20μl,測定吸光值,代入標準曲線得到樣品實際濃度(單位:μg/μl)。
配制十二烷基硫酸鈉-聚丙烯酸胺凝膠(SDS-PAGE),將配好的分離膠用移液槍加入電泳槽4.5ml并加水封液面。分離膠凝固后用濾紙將水吸干。加入配制的濃縮膠1.5ml。從左至右分別在電泳槽中加入Marker、NC組、MC組、AC組、AR-H組、AR-M組、AR-L組蛋白,兩側各加loading buffer壓邊。Marker上樣量2μl,其余各組按照測定的樣品蛋白含量保持上樣量一致。電泳分離時濃縮膠保持60V電壓20min左右,分離膠保持100V電壓60min左右至Marker跑開即可終止。按照海綿、3張濾紙、PAGE膠、NC膜、3張濾紙、海綿制成膜/濾紙三明治將膠上蛋白轉至硝酸纖維素膜(NC膜)上,保持100mA電流電轉2h左右。轉膜結束配制脫脂奶粉封閉液(1g奶粉+20ml TBST)對膜進行封閉,室溫下搖床封閉1h。TBST洗滌干凈封閉液封,將膜加一抗并塑封于搖床上孵育室溫過夜。取出膜TBST緩沖液洗滌三次,每次10min,搖床震蕩。二抗孵育2h,同樣TBST緩沖液洗滌三次,每次10min,搖床震蕩。加入顯色劑放入凝膠圖像分析系統顯影[5]。該實驗重復三次。
1.2試驗結果:
(1)結腸黏膜組織學損傷評分(CMDI)
結腸黏膜組織學損傷評分表明:與正常對照組比較,模型組腸壁增厚,腸管增粗,與外周組織粘連,部分大鼠可見腸梗阻表現,糜爛及潰瘍形成,具有顯著性差異(P<0.01)。與模型組比較,陽性藥組和AR各劑量組均有不同程度的改善,顯著性恢復腸管增粗與腸壁增厚,與外周組織粘連少,黏膜充血水腫減輕,糜爛及潰瘍形成不明顯(P<0.01,P<0.05)。
(2)病理組織檢查和組織學損傷指數評分(TDI)
光學顯微鏡下觀察,空白對照組大鼠結腸結構清晰,其隱窩結構完整,腺體未見破壞。模型組大鼠結腸組織中局部潰瘍形成,結腸黏膜上皮壞死脫落,并見大量炎癥細胞浸潤,黏膜及黏膜下層出現嚴重的水腫,并伴有大量炎癥細胞、中性粒細胞、淋巴細胞浸潤,黏膜下層出現嚴重的水腫,杯狀細胞被破壞且結構紊亂,其中1只表現為多量炎癥細胞浸潤到黏膜固有層,局部見粘膜糜爛。與空白組比較,模型組大鼠組織學損傷指數極顯著升高(P<0.01);陽性藥組、AR高劑量組大鼠局部見淺潰瘍形成,少量散在炎性細胞浸潤固有腺周圍,固有腺結構改善,充血水腫減輕,有增生的邊緣上皮細胞覆蓋潰瘍面,與模型組比較,陽性藥組、AR高劑量組組織學損傷指數極顯著降低(P<0.01);AR中劑量組大鼠腸組織中多量炎癥細胞浸潤到隱窩和黏膜固有層,肉芽組織纖維化改善,黏膜及黏膜下炎癥細胞浸潤減少,與模型組比較,AR中劑量組組織學損傷指數顯著降低(P<0.05)。結果見表1:
表1靈仙新苷對大鼠炎癥性腸病克羅恩模型組織學損傷指數評分(TDI)與結腸黏膜組織學損傷評分(CMDI)(n=8)
**P<0.01,與空白對照組比較,*P<0.05,與空白對照組比較;##P<0.01,與模型對照組比較,#P<0.05,與模型對照組比較;ΔΔP<0.01,與美沙拉嗪組比較,ΔP<0.05,與美沙拉嗪組比較
(3)免疫組化法檢測大鼠結腸組織TLR4、TNF-α和NF-kBp65的陽性細胞表達
TNF-α蛋白表達定位于腸上皮細胞漿內,空白對照組可見少量棕黃色染色,模型組胞漿內大量棕黃色細胞染色,與空白組比較,模型組TNF-α陽性細胞表達極顯著增強(P<0.01);與模型組比較,陽性藥組、AR高、中劑量組TNF-α陽性細胞表達極顯著降低(P<0.01),并且AR高、中、低劑量組TNF-α陽性細胞表達呈現一定劑量依賴性;與陽性藥比較,AR高劑量組TNF-α陽性細胞表達無明顯差異。
TLR4蛋白表達定位在腸上皮細胞胞漿及少部分胞膜上,空白對照組可見顏色較淺的棕黃色染色,模型組胞漿內可觀察到明顯且大量棕黃色染色,與空白組比較,陽性藥組、AR高、中劑量組TLR4陽性細胞表達極顯著降低(P<0.01),AR低劑量組TLR4陽性細胞表達顯著降低(P<0.01),并且AR高、中、低劑量組TLR4陽性細胞表達呈現一定劑量依賴性;與陽性藥比較,AR高劑量組TLR4陽性細胞表達無明顯差異。
NF-kBp65蛋白表達定位在腸上皮細胞胞漿和胞核內,空白對照組可見少量棕黃色染色,模型組可見大量棕黃色細胞染色,與空白組比較,模型組NF-kBp65陽性細胞表達極顯著增強(P<0.01);與模型組比較,陽性藥組、AR高、中劑量組NF-kBp65陽性細胞表達極顯著降低(P<0.01),并且AR高、中、低劑量組NF-kBp65陽性細胞表達呈現一定劑量依賴性;與陽性藥比較,AR高劑量組NF-kBp65陽性細胞表達無明顯差異。結果見表2:
表2靈仙新苷對大鼠炎癥性腸病克羅恩模型腸組織TNF-α,TLR4及NF-κBp65表達(免疫組化)的影響(n=8)
**P<0.01,與空白對照組比較,*P<0.05,與空白對照組比較;##P<0.01,與模型對照組比較,#P<0.05,與模型對照組比較;ΔΔP<0.01,與美沙拉嗪組比較,ΔP<0.05,與美沙拉嗪組比較
(4)靈仙新苷對大鼠脾臟指數的影響:
與空白組大鼠比較,模型組大鼠脾臟指數極顯著升高(p<0.01);與模型組比較,陽性藥組、AR高劑量組極顯著降低大鼠脾臟指(p<0.01);與模型組比較,AR中、低劑量組顯著降低大鼠脾臟指數(p<0.05);與陽性藥比較,AR高、中劑量組無顯著性差異。結果見表3:
表3靈仙新苷對大鼠炎癥性腸病克羅恩模型脾臟指數的影響(n=8)
**P<0.01,與空白對照組比較,*P<0.05,與空白對照組比較;##P<0.01,與模型對照組比較,#P<0.05,與模型對照組比較;ΔΔP<0.01,與美沙拉嗪組比較,ΔP<0.05,與美沙拉嗪組比較
(5)大鼠結腸組織細胞因子表達
與正常對照組大鼠比較,模型組大鼠結腸組織TNF-a的含量顯著增高,差異有顯著性;與模型組大鼠進行比較,5-ASA組大鼠結腸組織TNF-a的含量明顯降低;與模型組大鼠進行比較,AR高、中劑量組大鼠結腸組織TNF-a的含量明顯降低;5-ASA組與AR高劑量組大鼠結腸組織TNF-a的含量進行比較,無顯著性差異。與正常對照組大鼠比較,模型組大鼠結腸組織IL-10的含量顯著降低,差異有顯著性;與模型組大鼠進行比較,5-ASA組大鼠結腸組織IL-10的含量明顯升高;與模型組大鼠進行比較,AR高、中劑量組大鼠結腸組織IL-10的含量明顯升高;5-ASA組與AR高劑量組大鼠結腸組織IL-10的含量進行比較,無顯著性差異。AR高劑量組大鼠結腸組織IL-10的含量顯著高于AR低劑量組大鼠結腸組織IL-10含量。結果見表4:
表4靈仙新苷對大鼠炎癥性腸病克羅恩模型腸組織IL-10及TNF-α含量的影響(n=8)
**P<0.01,與空白對照組比較,*P<0.05,與空白對照組比較;##P<0.01,與模型對照組比較,#P<0.05,與模型對照組比較;ΔΔP<0.01,與美沙拉嗪組比較,ΔP<0.05,與美沙拉嗪組比較
(6)Western blot檢測腸組織TLR4、NF-κBp65蛋白表達
與空白對照組比較,模型組極顯著增加細胞核中NF-κBp65亞基蛋白的表達(P<0.01);與模型組比較,陽性藥組、AR高劑量組極顯著抑制細胞核中NF-κBp65亞基蛋白表達(P<0.01),與模型組比較,AR中劑量組顯著抑制細胞核中NF-κBp65亞基蛋白表達(P<0.05),AR各劑量組均可不同程度地抑制細胞核中NF-κBp65亞基蛋白表達并呈現一定劑量相關性。結果見表5:
表5靈仙新苷對大鼠炎癥性腸病克羅恩模型腸組織TLR4、NF-κBp65蛋白表達(Western blot)的影響(n=8)
**P<0.01,與空白對照組比較,*P<0.05,與空白對照組比較;##P<0.01,與模型對照組比較,#P<0.05,與模型對照組比較;ΔΔP<0.01,與美沙拉嗪組比較,ΔP<0.05,與美沙拉嗪組比較
上述研究結果表明,靈仙新苷具有顯著抗大鼠炎癥性腸炎克羅恩病的作用。
上述靈仙新苷是通過以下方法制備得到:取威靈仙藥材(東北鐵線蓮),用藥材10倍重量水加熱回流提取3次,每次2小時,合并水提液,將水提液室溫冷卻、過濾后上預先處理好的大孔樹脂D101(流速2BV/h),依次用水和20%乙醇洗脫至流出液澄清后,再用50%乙醇洗脫至流出液無色,收集50%乙醇洗脫液,濃縮,微波干燥,得威靈仙總皂苷干粉,將該總皂苷干粉加入其50倍重量無水乙醇加熱回流2小時后趁熱過濾,濾液室溫放置過夜,濾取沉淀,干燥后得粗品,粗品用20%乙醇溶解后上預先處理好的ODS柱(流速1BV/h),依次用30%,40%,90%乙醇分別洗脫至無色,收集40%乙醇洗脫液,減壓濃縮干燥后,得淡黃色靈仙新苷,含量:>90%。
- 還沒有人留言評論。精彩留言會獲得點贊!