一種錯時釋放雙緩釋涂層多功能小口徑人工血管及其制備方法與流程
本發明涉及一種醫用人工血管及其制備方法,具體的說是一種錯時釋放雙緩釋涂層多功能小口徑人工血管及其制備方法。
背景技術:
據統計中國有超過3000萬周圍血管閉塞疾病(pad)患者和100多萬終末期腎病患者,其中終末期腎病患者每年還以12萬遞增。為了挽救pad患者肢體和維系終末期腎病患者“生命通路”,血管的重建或動靜脈通路的建立是最重要的治療方式,而其中很大一部分患者由于自體血管條件的限制需要用到小口徑人工血管(sdvps,直徑≤6cm)。但目前的sdvps因植入后內壁缺乏內皮細胞覆蓋和吻合口內膜過度增生,缺乏長期通暢性和良好生物相容性,膝下人工血管旁路術后4年的通暢率僅僅54%。盡管sdvps有著這些明顯不足,但至今仍然沒有一種“理想的”血管代用品有望在不久將來取代目前的sdvps。組織工程人工血管是一個非常有前景的領域,但是它的基礎和應用研究還處于早期。因此對sdvps改良促進移植后血管內壁快速內皮化同時抑制內膜增生,從而改進其長期通暢性已迫在眉睫。目前人工血管的改良主要包括兩個方面:材料工程學改進和藥物蛋白等緩釋涂層。
自半個多世紀前voorhees首次使用維尼綸人工血管以來,dacron、ptfe、polyurethanes(pu)等材料人工血管及它們的改良產品廣泛應用于臨床。近年來silicone(pdms)、poly(ether)urethane(petu)等材料的人工血管也進入動物實驗或者臨床實驗。但是sdvps效果都不甚理想,為了進一步提高其長期通暢性,研究發現通過材料改變人工血管表面性狀可抑制血栓形成和內膜增生,比如碳、聚丙烯硫化物-聚乙二醇(peg)和1,8-辛二醇檸檬酸聚合物(pog)等涂層的eptfe血管等都顯示一定的抑制血栓形成和內膜增生效果。本申請發明人曾使用pdms涂層針織pet血管,并使用pva修飾其內表面,該人工血管消除了pet血管通常用牛血清預凝可能帶來的風險,顯示較好的抗血栓形成和抑制內膜增生的作用,同時具有良好的生物相容性、順應性、滲透性、縫合性和耐穿刺性。將該人工血管植入羊頸動脈旁路模型中發現內膜增生較商用的牛血清預凝的pet血管明顯減少。
藥物緩釋涂層是改進人工血管長期通暢性的另一個重要途徑。目前常用于涂層緩釋的藥物有paclitaxel(ptx)、sirolimus、everolimus、zotarolimus等。ptx和sirolimus等緩釋的支架已經成功使用于冠狀動脈和周圍動脈成形術中,并顯示減少再狹窄的發生;baek等將ptx涂層于人工血管管腔內表面,將該血管用于豬動靜脈瘺模型,與非涂層的人工血管對比,發現實驗組血管均保持通暢內膜增生明顯被抑制,而對照組血管僅一根血管保持通暢而且內膜增生明顯。本申請發明人曾使用ptx緩釋pdms涂層pva修飾來改良針織pet血管,將該血管植入羊頸動脈,研究證實與商用的牛血清預凝的pet血管對比,術后6周內膜增生明顯減少,證實ptx-pdms在抑制內膜增生中的作用(參考文獻leebk,kimyh,parkdw,etal.acuteandlong-termangiographicoutcomesofsidebranchstenosisafterrandomizedtreatmentofzotarolimus-,sirolimus-,andpaclitaxel-elutingstentforcoronaryarterystenosis.jkoreanmedsci.2012;27(12):1499-1506.)。
但是不管是血管材料改進和涂層應用,還是藥物緩釋都還面臨著許多問題,除了內膜增生以外,血管內壁再內皮化仍困擾著人工血管研究人員。研究發現人工血管植入人體數年后,血管內壁內皮化仍局限在距吻合口1-2cm內,甚至ptx或sirolimus等涂層在抑制內膜增生的同時也抑制內皮細胞層形成或者導致內皮細胞功能異常,從而導致高血栓形成風險。為了提高人工血管內壁內皮化,有研究將內皮細胞或者內皮祖細胞種植于dacron或者eptfe血管內表面,術后發現人工血管內壁內皮化可達到40%-92%;另有研究將抗cd34抗體或抗內皮細胞鈣粘蛋白抗體涂層于eptfe血管內表面或金屬裸支架上去捕獲循環血中的內皮祖細胞,植入后血管內壁內皮化明顯增加;也有研究將血管內皮生長因子(vegf)或者vegf基因固化于人工血管內表面,通過vegf在植入血管局部促進內皮細胞遷徙、增殖和成熟,從而促進血管內壁內皮化。比如lahtinen等將vegf-165dna質粒涂層注射在移植的eptfe血管周圍,研究發現vegf-165dna質粒能在局部轉染并促進人工血管內壁早期內皮化,提高通暢性。這些研究均在不同程度上解決了人工血管內壁內皮化的問題,但在血管內皮化的同時,內皮細胞種植技術的細胞培養耗費大量時間和費用、專用實驗室配備和細胞的免疫原性,抗cd34抗體和vegf固化等面臨的內皮細胞增殖的難以控制、緩釋技術的不完善和后期吻合口內膜增生等問題,尤其是后者尚待解決。
是否能找到一種方法既能抑制內膜增生又能促進人工血管內壁內皮化呢;最近有研究在嘗試進行多成分緩釋涂層,并且嘗試使多個生物活性物質差異釋放從而產生協同的生物學作用。有研究構建抗cd34抗體、vegf和堿性成纖維生長因子(bfgf)多涂層的支架,讓涂層各成分之間產生協同作用,促進內皮祖細胞捕獲、增殖和成熟;hongzhang等設計將不同緩釋系統涂層在人工血管的內外表面分別緩釋vegf和pdgf,促使vegf和pdgf在血管內外表面先后釋放,早期vegf的釋放促進血管內壁內皮化,隨后pdgf釋放促進vsmc增殖和細胞外基質的合成,從而支持內皮細胞防止其凋亡和加強血管壁結構。為達到即促進血管內皮化又抑制后期的內膜增生目的,假如能設計一個錯時釋放的雙緩釋涂層,早期促進血管內壁快速內皮化,隨后持續抑制吻合口內膜增生,可能成為一個可行的方案。
vegf基因轉染表達的vegf蛋白是目前已知最強的內皮細胞有絲分裂原,它通過刺激內皮祖細胞遷移和成熟促進血管生成和再內皮化,還可以促進損傷的內皮細胞迅速修復。vegf緩釋涂層的人工血管或支架在動物模型中已多次被證實促進內皮細胞再生從而加快內壁的再內皮化。ptx是常用的抑制內膜增生的免疫抑制劑,在藥物緩釋支架、ptx涂層人工血管研究中都證實其具有強烈的抑制內膜增生作用,該作用主要通過抑制平滑肌細胞的增殖、粘附和遷移來實現。
高分子納米材料聚乳酸-羥基乙酸共聚物(plga)是經過美國fda批準應用于臨床的一種具有生物可降解和生物相容性高分子聚合物。本申請發明人前期采用乳化蒸發法制備封裝雷帕霉素的plga納米微粒(rapa-plga-nps,雷帕霉素(rapa)聚乳酸-羥基乙酸共聚物(plga)納米微粒(rapa-plga-nps)),顯示高封裝率和載藥效率,浸涂靜脈后明顯抑制大鼠頸靜脈-頸動脈移植后內膜增生。聚乳酸-羥基乙酸共聚物(plga)納米微粒(plga-nps)作為一種非病毒基因載體,因其持續的可控表達、高安全性和生物相容性,以及防止體內dna降解和促進質粒dna內吞而使目的基因易轉染等特性,被廣泛研究和應用于基因治療。有研究報道將基因封裝的plganps固化于支架內表面能在支架相連的動脈組織內高效轉染和表達。另外bechler等將封裝dna(ppkcδ)質粒的納米材料涂層在球囊導管表面,通過該球囊導管在鼠損傷動脈位置持續擴張20分鐘,3天后發現擴張局部血管組織內ppkcδ表達明顯增加,14天與對照組相比內膜增生減少60%,證實封裝基因的plganps在局部進行基因轉染和表達的有效性。
技術實現要素:
本發明所要解決的技術問題是,克服現有技術的缺點,提供一種錯時釋放雙緩釋涂層多功能小口徑人工血管及其制備方法,達到植入早期vegf基因轉染表達促進血管內壁快速內皮化,后期ptx持續緩釋抑制隨后的內膜增生的目的,確保多功能人工血管在促進內皮細胞遷移、增殖和成熟與抑制中膜血管平滑肌細胞增殖之間產生協同作用,從而保證植入后良好的血管內壁內皮化和長期的通暢性,可促進小口徑人工血管長期通暢性的明顯改善。
本發明解決以上技術問題的技術方案是:
一種錯時釋放雙緩釋涂層多功能小口徑人工血管,包括人工血管,在人工血管的內外表面均噴涂有雙層涂層,雙層涂層的內涂層為ptx緩釋pdms涂層ptx-pdms,雙層涂層的外涂層為生物降解的封裝vegf基因的聚乳酸-羥基乙酸共聚物納米微粒緩釋涂層plga-nps。
錯時釋放雙緩釋涂層多功能小口徑人工血管的制備方法,包括以下步驟:
㈠將人工血管伸展至使用長度,將11gpdms溶于88g乙酸乙酯中形成配置溶液,然后將人工血管置入含有配置溶液的自動涂噴裝置內,以80轉/分鐘不斷旋轉,5min后取出血管,在60℃下干燥,并重復這個過程3次;
㈡將ptx溶于pdms溶脹劑中,pdms溶脹劑為乙酸乙酯溶液,將步驟㈠涂有pdms涂層的人工血管浸入甲醇溶液中5分鐘激活,然后用去離子水清洗干凈,再浸入含有ptx的pdms溶脹劑中30min,取出血管后常溫晾干,等離子消毒備用;
㈢取30ml二氯甲烷和丙酮混合溶液,二氯甲烷和丙酮的體積比為9∶1,在西林瓶中溶解plga至質量百分濃度5%作為油相,取vegf質粒1ml作為水相,混合水相和油相,磁力攪拌,探頭超聲乳化4分鐘,加入質量百分濃度2%的pva溶液反復超聲乳化,室溫下旋轉蒸發3h,揮發有機溶劑,形成封裝vegf質粒的plga-nps,并用γ-射線照射滅菌,4℃保存備用;
㈣取制備好的封裝vegf基因的plga納米微粒,將之置入乙醇溶液中形成納米微粒懸浮液,使用自動噴涂裝置將配置好的所述納米微粒懸浮液均勻地噴涂在步驟㈡涂有ptx緩釋pdms涂層ptx-pdms的人工血管內外表面,4℃晾干后,重復2次噴涂過程,制備的人工血管采用等離子消毒,4℃下保存備用。
本發明所用的自動噴涂裝置為現有設備,型號:sonoflux2000f,美國思諾泰企業sono-tek公司生產。
本發明對血管涂層的生物活性物質和涂層緩釋技術進行調整、改進與創新,采用不同緩釋系統,將ptx-pdms作為血管內涂層,生物降解的封裝vegf基因的plga-nps作為外涂層,確保雙緩釋之間的錯時釋放,形成早期vegf基因釋放和轉染,促進內皮細胞遷移、增殖和成熟,隨后ptx長時間的緩釋抑制吻合口內膜過度增殖,形成錯時釋放的雙緩釋涂層技術,在促進內皮細胞粘附、增殖和成熟與抑制內膜過度增生上產生協同作用。這樣由內層ptx-pdms涂層和外層封裝vegf基因的plga-nps緩釋涂層組成的小口徑的pet血管,以達到植入早期vegf基因轉染表達促進血管內壁快速內皮化,后期ptx持續緩釋抑制隨后的內膜增生的目的,確保多功能人工血管在促進內皮細胞遷移、增殖和成熟與抑制中膜血管平滑肌細胞增殖之間產生協同作用,從而保證植入后良好的血管內壁內皮化和長期的通暢性,可促進小口徑人工血管長期通暢性的明顯改善。
本發明進一步限定的技術方案是:
前述的錯時釋放雙緩釋涂層多功能小口徑人工血管,其中ptx緩釋pdms涂層ptx-pdms上打有穿過人工血管管壁的納米微孔,plga-nps所述納米微孔形成后噴涂在ptx-pdms上。
前述的錯時釋放雙緩釋涂層多功能小口徑人工血管,其中納米穿孔間隔均勻且有序排列。
前述的錯時釋放雙緩釋涂層多功能小口徑人工血管,其中ptx緩釋pdms涂層ptx-pdms包括均勻涂于人工血管表面的pdms和浸入pdms基質中的ptx,pdms的噴涂量為每平方厘米15-20mg。
前述的錯時釋放雙緩釋涂層多功能小口徑人工血管的制備方法,其中步驟㈣中,為了增加人工血管表面涂層量,在噴涂所述納米微粒懸浮液之前用激光在步驟㈡制備好的ptx-pdms人工血管表面打穿過人工血管管壁的納米微孔。
前述的錯時釋放雙緩釋涂層多功能小口徑人工血管的制備方法,其中vegf質粒為vegf-165基因質粒,vegf質粒濃度為1mg/ml。
前述的錯時釋放雙緩釋涂層多功能小口徑人工血管的制備方法,其中人工血管涂層前后分別精確稱量,確保每平方厘米pdms涂層為15-20mg。
本發明的有益效果是:⑴本發明構建生物降解的plga-nps和ptx-pdms兩種不同緩釋系統,通過緩釋系統錯時釋放生物活性物質來改良人工血管,從而讓多個生物活性物質發揮協同作用,避免了單個生物活性物質釋放系統的局限性,或多生物活性物質釋放系統同時釋放所帶了的效應之間抵消或者干擾。⑵本發明將vegf(vegf-165)基因和ptx同時用于改良小口徑人工血管,通過不同緩釋系統的錯時釋放,早期vegf基因轉染表達促進血管內壁內皮化,后期ptx持續緩釋抑制隨后的吻合口內膜過度增生,從而促進人工血管內壁快速內皮化防止血栓形成,同時抑制后期吻合口過度增生狹窄,改善小口徑人工的長期通暢性。
申請人通過研究發明,本發明的sdvps縱向和周向穩定性未受明顯影響,但是剛性隨著pdms涂層量的增加而增大,當pdms20mg/cm2時彈性最好;滲透性檢測發現在pdms>15mg/cm2時滲漏明顯抑制,30mg/cm2時基本消失;pdms15-20mg/cm2時,順應性與傳統的sdvps無明顯差異;因此,將pdms的噴涂量設定為每平方厘米15-20mg。體外模擬循環下的釋放試驗證實,vegf基因在循環30分鐘后循環液中檢測到,30小時后到達最大值,隨后逐漸減少一周低量維持,而ptx在循環12h后開始檢測到,48h后到達高峰(2-3μg/h),隨后逐漸下降,10天后循環液中維持在8-9μg/l,顯示二者之間良好的錯時釋放特征。將本發明的sdvps吻合在剛取出的動脈上置于模擬循環中,24h后ptx在吻合口處的濃度>30μg/l/mm2,距吻合口5mm遠處降至14.2μg/l/mm2,1cm遠處未發現明顯的ptx濃集。將本發明的sdvps植入羊頸動脈建立旁路模型,術后6周取材觀察sdvps內膜增生情況,結果發現本發明的sdvps較商用的pet血管內膜增生明顯減少(569.0±235.7μmvs1843.9±653.8μm,p<0.05)。
附圖說明
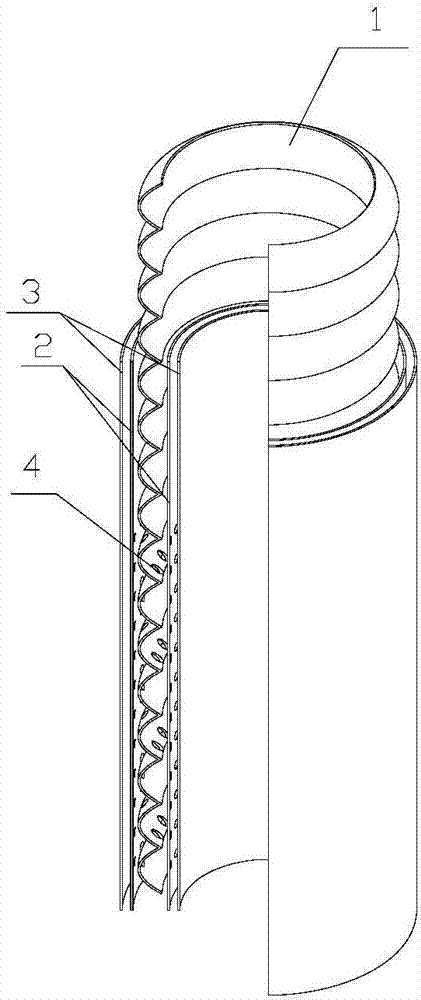
圖1為本發明的立體結構示意圖。
圖2是本發明的結構示意圖。
圖3是圖2的c-c剖面圖。
圖4是圖2的d點局部放大圖。
具體實施方式
實施例1
本實施例是一種錯時釋放雙緩釋涂層多功能小口徑人工血管,結構如圖1所示,包括人工血管1,在人工血管1的內外表面均噴涂有雙層涂層,雙層涂層均有兩層涂層組成,內涂層為噴涂在人工血管1內外表面的ptx緩釋pdms涂層ptx-pdms2,雙層涂層的外涂層為噴涂在ptx緩釋pdms涂層ptx-pdms2上的生物降解的封裝vegf基因的聚乳酸-羥基乙酸共聚物納米微粒緩釋涂層plga-nps3。為了增加納米微粒涂層plga-nps3的效率,增加人工血管表面涂層量,在ptx緩釋pdms涂層ptx-pdms2上打有穿過人工血管管壁的納米微孔4,納米微孔4可以間隔均勻且有序排列。ptx緩釋pdms涂層ptx-pdms包括均勻涂于人工血管表面的pdms和浸入pdms基質中的ptx,所述pdms的噴涂量為每平方厘米15-20mg。
本實施例使用未預凝的6mmpet人工血管(microntm,法國intervascular公司),利用自動化的涂層裝置將pdms均勻涂于pet血管表面,達到每平方厘米15-20mgpdms,然后通過濕法共價/離子結合方法將ptx浸入pet血管涂層的pdms基質中。vegf-165基因質粒和gfp基因質粒分別從sinobiologicalinc公司(北京)和clontech公司(paloalto,ca,usa)購買,采用雙乳液溶劑揮發法制備封裝vegf-165基因質粒的plganps。將制備好的封裝vegf-165基因質粒的plganps通過自動醫用噴涂裝置均勻噴涂于ptx-pdmspet血管的內外表面構建vegf-165基因和ptx雙緩釋的多功能人工血管(vegf/ptx-pdmspet血管)。
本實施例錯時釋放雙緩釋涂層多功能小口徑人工血管的制備方法包括以下步驟:
首先將人工血管伸展至廠家指定的使用長度,將11gpdms溶于88g乙酸乙酯中配置成溶液,然后將人工血管置入含有配置溶液的自動涂層裝置內,以80轉/分鐘不斷旋轉,5min后取出血管,在60℃下干燥,重復這個過程3次。pet血管涂層前后分別精確稱量,確保每平方厘米pdms涂層在15-20mg,并使用測厚儀測量涂層后pet血管厚度。
將ptx溶于配置的pdms溶脹劑中,制備的pdms涂層的pet血管浸入甲醇溶液中5分鐘激活,然后用去離子水清洗干凈,再浸入配置的含有ptx的pdms溶脹劑中30min,取出血管后常溫晾干,等離子消毒備用。
采用雙乳化溶劑揮發法制備封裝基因的plganps,采用乳酸單體和羥基乙酸單體比例為50∶50的plga。vegf-165基因質粒和gfp基因質粒從生物公司購買。具體步驟如下:取30ml二氯甲烷和丙酮(二氯甲烷/丙酮=9∶1)混合溶液,在西林瓶中溶解plga至濃度為5%作為油相,取vegf-165gene質粒(1mg/ml)1ml作為內水相,混合水相和油相,磁力攪拌,探頭超聲乳化(250w)4分鐘,加入2%pva溶液反復超聲乳化,室溫下旋轉蒸發3h,揮發去有機溶劑,形成封裝vegf-165gene質粒的plganps。封裝gfpgene、封裝羅丹明-b的plga的納米微粒和封裝空白質粒的nps用同樣的方法制備。制備nps用γ-射線照射滅菌,4℃保存備用。
取制備好的封裝vegf-165基因的plga納米微粒,將之置入乙醇溶液中形成納米微粒懸浮液,為了增加人工血管表面nps涂層量,用激光在制備好的ptx-pdmspet血管表面打上納米微孔,使用自動噴涂裝置將配置好的nps懸液均勻地噴涂在人工血管內外表面,4℃晾干后,重復2次噴涂過程,噴涂前和噴涂晾干后精確稱量人工血管重量,計算噴涂封裝vegfgene的plganps量。制備的血管等離子消毒,4℃下保存備用。
本實施例的vegf/ptx-pdmspet血管物理性能、體外活性物質釋放動力學和基因轉染檢測具體如下:
物理性能檢測:使用英斯特朗拉伸試驗機(instron,4502)檢測構建的人工血管的縱向和周向穩定(縱向和周向拉伸爆破時的應力)及彈性。使用6-0prolene縫線在在1/10圓周處間斷縫合10針,邊距約3mm(至少打7個結以防滑脫),兩端固定在英斯特朗拉伸試驗機上后,作牽拉實驗,計算機自動控制應力,記錄吻合口斷裂時的應力讀數,測定吻合固持強度。將血管沿縱軸剪開固定,用2-0直針穿刺血管測定穿刺阻力。取8cm長構建血管,遠近端結扎,并經近端插入連通管接測壓計和加壓注入裝置,然后300mmhg/s注入pbs液,記錄管壁破裂開始滲水時的壓力讀數,測量滲透性。每組實驗測10個樣本,取平均值,并與未涂層的pet血管及商用的預凝pet血管做比較。結構顯示圖層不影響材料的穩定性,其縱向和徑向應力與傳統材料相媲美,而且隨著pdms涂層含量的增減其穩定性尤其是徑向穩定性增加明顯,當涂層量超過20mgpdms/c㎡時,其彈性模量超過其它聚酯材料。
體外活性物質釋放動力學檢測:使用體外模擬循環裝置(8mm直徑封閉回路的硅膠管,渦輪泵提供循環動力),將8cm長構建的pet血管固定于循環中段,循環中充滿含5%白蛋白pbs溶液,維持120mmhg壓力持續循環,流量維持在500ml/min,持續循環30天,每天取樣,取樣時,將循環內pbs溶液全部取出,測定其中基因和ptx濃度,然后循環內充滿新的含5%白蛋白pbs溶液,繼續持續循環,等待下一個取樣,做基因和ptx釋放曲線。同時用封裝羅丹明-b的plga納米微粒噴涂的ptx-pdmspet血管固定于循環中段,方法同前,每10天取出血管用激光掃描共聚焦顯微鏡可視下觀察血管中羅丹明-b殘留情況。結果顯示,開始循環三十分鐘后,vegf基因在循環液(白蛋白5%))中檢測到,30小時后到達最大值,隨后逐漸減少一周低量維持,而ptx在循環12小時后循環液中檢測到(白蛋白5%),48小時后達到最大值。根據介質循環量,我們計算一個釋放速率是每小時2-3μg。隨后,觀察到濃度的降低。10天后,在介質中的ptx濃度穩定在8-9μg/l.,顯示二者之間良好的錯時釋放特征。
體外基因轉染實驗:取24孔細胞培養板中20孔,分為5組,分別取vegf/ptx-pdmspet血管、vegfpdmspet血管、ptx-pdmspet血管、blank/ptx-pdmspet血管,各剪取5mm×5mm大小血管壁。第一組4孔孔底鋪上vegf/ptx-pdmspet血管壁;第二組4孔孔底鋪上vegfpdmspet血管壁;第三組4孔孔底鋪上ptx-pdmspet血管壁;第四組4孔孔底鋪上blank/ptx-pdmspet血管壁;第五組4孔孔底不鋪人工血管,作為空白對照組。人臍靜脈內皮細胞系ecv304細胞(實驗室保存)復蘇后接種于培養皿中,置5%co2,37℃,飽和濕度培養箱內培養。取對數生長期的ecv304細胞,用胰酶消化7分鐘后,制成1×105/ml的細胞懸液,將該細胞懸液按500μl/孔種植到上述準備好的培養孔中,置5%co2,37℃,飽和濕度培養箱內培養。按照同樣的方法種植另外三個相同的細胞培養板。分別于種植后24h和48h取其中的2個培養板,進行下列檢測:細胞染色固定,顯微鏡下計數;elsa法檢測各組vegf蛋白表達;mtt法檢測ecv304細胞活力。結果顯示含有vegf基因組內細胞生長旺盛,呈集落樣或直線樣生長,細胞倍增時間3-3.5天左右,較其它組明顯加快,該組別中vegf蛋白表達明顯增高,隨培養時間延長,其表達量逐漸升高,在第4天達到高峰,后逐漸降低。
除上述實施例外,本發明還可以有其他實施方式。凡采用等同替換或等效變換形成的技術方案,均落在本發明要求的保護范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!