H因子增強抗體及其用途的制作方法
本發明涉及免疫學和醫學領域。特別地,本發明涉及h因子特異性抗體(factorhspecificantibody)及其用途。
背景技術:
補體系統是先天免疫的重要元素,其有助于保護諸如哺乳動物的許多生物體抵抗入侵的病原體。補體系統由超過30種主要在肝臟中合成的不同成分組成。補體系統的激活通過三種不同途徑發生,經典途徑(classicalpathway)、凝集素途徑(lectinpathway)和旁路途徑(alternativepathway)。三種途徑在形成c3轉化酶時收斂(converge),其對于每種途徑是不同的,但具有相似的活性。
在經典補體途徑中,由c1q、c1r和c1s組成的補體成分(c)1復合物的激活在結合至抗體-抗原復合物時發生。c1復合物切割c4和c2,導致由c4bc2a組成的c3轉化酶的形成。c3轉化酶將c3切割成活性組分c3a和c3b。在凝集素途徑中,甘露糖結合凝集素結合至病原體表面上的甘露糖殘基,其激活能夠切割c4和c2的絲氨酸蛋白酶masp-1和masp-2。如在經典途徑中,這導致c4bc2ac3轉化酶的形成。該c3轉化酶可以結合c3b以形成c5轉化酶。與經典和凝集素途徑相反,旁路途徑由于血漿中c3到c3(h2o)的自發水解而具有低水平的連續活性。該c3b樣c3(h2o)可通過結合因子b(fb)形成液相c3轉化酶,其進而被因子d激活成bb。類似地,當c3b結合至表面時,它可結合fb以形成c3bb。該復合物被d因子切割為c3bbb,它是可被備解素(properdin)(p因子)穩定至c3bbbp的旁路途徑的c3轉化酶。該c3轉化酶能夠將c3切割成c3a和c3b。除了該過程,旁路途徑充當經典和凝集素激活途徑的擴增環(amplificationloop),因為在這些途徑中產生的c3b可充當旁路途徑的起始點。由此,擴增環導致經典和凝集素途徑的增強。在三種激活途徑之一中形成的c3轉化酶可結合c3b以形成c5轉化酶。所有三種補體途徑的c5轉化酶將c5激活為c5a和c5b,其啟動補體系統的末端途徑(terminalpathway)。c5b結合c6、c7、c8和c9以形成膜攻擊復合物(mac),其形成跨膜通道并引起細胞溶解。
在病原體的膜中形成孔之后,補體通過使用c3b分子的調理作用(opsonisation)和產生促炎肽諸如c3a和c5a(其吸引并激活免疫細胞到感染部位)幫助清除病原體或變異的自身細胞(alteredself-cell)。由于補體的強促炎性質,宿主細胞被多種膜和可溶性補體調節蛋白良好地保護。
旁路途徑促成80-90%的總補體活性。因此,該途徑的調節至關重要。通常,如果通過c3和c3b的自發水解形成的c3(h2o)不被病原體結合,則被h因子(fh)、i因子(fi)和宿主細胞表面分子快速失活,從而抑制c3轉化酶的形成。cd55(也稱為衰變加速因子或daf)在宿主細胞表面結合c3b。fi將c3b切割成無活性形式,但依賴于在細胞表面上表達(cd46,mcp)或在血漿(fh)中循環的輔因子。fh是血漿糖蛋白,其對于控制在溶液中和在細胞表面上的補體的旁路途徑是重要的。fh在與fb相同的位置結合c3b,從而防止c3轉化酶的形成。fh還具有衰變加速活性,即一旦它們被形成,它就促進旁路途徑c3轉化酶的解離。fh是否結合c3b由存在于細胞表面上的碳水化合物決定。存在于宿主細胞表面上的唾液酸、糖胺聚糖和肝素促進fh與c3b的結合,而c3b與病原體表面上表達的分子的結合導致fb的結合。因此,fh在宿主細胞上而不是在致病細胞(pathogeniccell)的表面上發揮其補體抑制活性,因為結合fh的細胞表面分子在宿主細胞上表達,但通常不在致病細胞上表達。
fh缺陷或由于突變所致的宿主表面識別受損與補體介導的組織損傷和疾病有關。在正常止血期間控制補體激活之后,fh還在限制病變細胞和組織的補體介導的損傷中起重要作用。已經描述了fh基因中的多種突變,其可能導致fh蛋白的功能喪失。fh的c-端區域是疾病突變的熱點。這是fh與宿主細胞結合的關鍵區域。該區域中大多數疾病相關的突變干擾fh結合。大多數具有突變的fh基因的患者具有雜合突變(heterozygousmutation),意味著約一半的循環fh具有正常功能。然而,這顯然不足以在其中補體被激活的某些條件下保護自身表面。fh缺陷可能導致腎臟疾病,例膜性增生性腎小球腎炎(mpgn)和非典型溶血尿毒綜合征(ahus)。最近,已經描述了fh突變和年齡相關性黃斑病(amd)之間的關系。
目前,對于諸如ahus中的fh缺陷的標準治療是血漿補充或血漿置換療法。使用這種療法補充缺陷型補體調控因子。此外,血漿置換療法清除了針對補體因子的突變補體因子和/或自身抗體。然而,血漿療法也有一些限制。沒有前瞻性臨床研究顯示血漿置換療法在治療ahus中是安全或有效的,并且血漿療法的療效可能依賴潛在的突變。一些患者對新鮮冷凍血漿形成過敏反應,這可能需要停止任何形式的血漿療法。此外,由于給予血漿源性活性致病性補體成分,血漿置換可能使ahus的臨床表現惡化。
最近,在多個國家(其中有美國和歐洲國家)中,治療性單克隆抗體艾庫組單抗(eculizumab)已被批準用于治療ahus和陣發性睡眠性血紅蛋白尿癥(pnh)。艾庫組單抗(eculizumab)是針對c5特異性的人源化小鼠單克隆抗體,其防止c5裂解為c5a和c5b。因此,它防止末端途徑的激活并減少免疫細胞的流入。然而,艾庫組單抗(eculizumab)的使用與不期望的副作用相關。因為它阻斷c5(其是引發末端途徑的關鍵組分),用艾庫組單抗(eculizumab)治療的患者變得易于被莢膜細菌(例如,腦膜炎奈瑟氏球菌(neisseriameningitidis))感染,其清除非常依賴于mac形成。因此,在接受用艾庫組單抗(eculizumab)治療之前,要求患者接受針對腦膜炎球菌(meningococcus)的疫苗接種。此外,由于艾庫組單抗(eculizumab)作用于c3的下游,維持c3沉積,這在涉及不期望的或過度的補體激活的多種病癥中是有害的。此外,艾庫組單抗(eculizumab)治療涉及到高成本,并且抗體的可得性有限。
結合ccp18的小鼠單克隆抗體由cheng等人(clinicalchemistry,2005)進行描述。據描述,稱為x52.1的該抗體增加fh與c3b和c3d的結合,其被認為是由fh的二聚引起的。由x52.1誘導的fh與c3b和c3d的結合增加導致補體介導的細胞裂解增加,包括rbc和多種類型的癌細胞,如由corey等人(jbiolchem.2000)所證實的。這表明抗體x52.1抑制fh的補體抑制活性。事實上,corey等人表明抗體可以通過增強補體介導的癌細胞裂解用于治療癌癥。
鑒于上述,因此仍需要改善與不期望的或過度的補體激活相關的病癥的療法。
技術實現要素:
本發明的一個目的是提供針對與補體系統的旁路途徑的不希望的或過度激活相關的疾病的治療策略,其克服了這種疾病的當前治療策略的缺點。本發明的另一個目的是提供可用于治療這類疾病的抗體,所述抗體具有比當前可用的抗體改善的性質。本發明的抗體及其片段對fh是特異性的,并且增強fh的功能,從而特異性抑制旁路補體途徑的激活。
本發明提供了特異性結合至h因子(fh)的補體調控蛋白結構域(complementcontrolproteindomain)17(ccp17)和/或ccp18并且增強fh活性的分離的,合成的或重組的抗體或其片段。
本發明人首次開發并分離了能夠特異性結合fh的抗體,其能夠增強fh的功能。本發明的增強抗fh抗體是旁路補體途徑的激活的有效抑制劑。不希望受理論束縛,認為該增強作用不依賴抗體對fh分子的多聚化。如實例中所證實的,抗fh增強抗體抑制或甚至完全阻斷用健康人供體血清孵育的紅細胞的裂解。在正常條件下,用健康人供體血清孵育綿羊紅細胞(srbc)不導致srbc的裂解,因為它們受在srbc表面上與唾液酸結合的血清中的h因子保護。當用阻斷fh功能的單克隆抗體孵育正常人血清時,觀察到srbc的裂解。這可通過血清fh對細胞表面的保護不足來解釋。由抗fh阻斷抗體誘導的這種裂解被本發明的-fh增強抗體抑制或甚至阻斷。實例進一步顯示本發明的增強抗fh抗體抑制酵母聚糖和脂多糖(lps)上的旁路途徑介導的c3沉積。進一步發現,增強抗fh抗體恢復來自3位無關的ahus患者的血清中fh的保護功能。如實例中進一步證明的,當用本發明的增強抗fh抗體預孵育血清時,在ahus患者血清的存在下,孵育的紅細胞的裂解被完全消除。
實例進一步證明,不僅完整的抗fh抗體增強fh的功能。對于這種抗體的fab’和f(ab’)2片段,觀察到相同的效果。由于fab’不能交聯fh分子,因此抗體和抗體片段的增強作用不能是這種交聯的結果。然而,實例確實證明抗fh抗體及其片段能夠抑制c3沉積,表明測試的片段能夠增加fh與c3b、ic3b和c3d的結合。不受理論的束縛,因此認為增強抗fh抗體與fh的結合導致fh的構象變化,其導致細胞表面上的fh與c3b、ic3b和c3d的結合增加。
根據本發明的增強抗fh抗體和片段高度優于諸如艾庫組單抗(eculizumab)的抗c5抗體,用于抑制補體系統的旁路途徑的不期望的或過度的激活。主要優點是本發明的抗體和片段的補體抑制作用在激活的c3而不是c5的水平上干擾補體激活,并且該干擾通過增強天然存在的抑制劑而發生。因此,僅當c3被激活時才發生對c3的干擾。相反,對于一般的c3抑制劑,所有循環c3都被阻斷,這可能導致一般的c3缺陷。盡管c3(例如,作為艾庫組單抗(eculizumab)的靶標的c5)參與補體系統的所有三種途徑,但fh特異性抑制旁路途徑的擴增環,其中將c3切割成c3b,并且其隨后在細胞表面與fb結合,并且c3轉化酶的形成促進另外的c3分子切割成c3b。本發明的抗體和片段干擾c3水平的補體激活的事實的主要優點是避免了c3b在表面上的累積和c3a的釋放。相反,如果補體激活在c5水平被諸如艾庫組單抗(eculizumab)抑制,則c3b的積累和c3a的釋放不受抑制。c3b用作調理素(opsonin),且c3a是過敏毒素(anaphylatoxin)。因此,優選防止c3b和c3a形成的積累,因為這些過程導致免疫細胞的吸引和靶標的調理吞噬作用(opsonophagocytosis)。這意味著例如接受艾庫組單抗(eculizumab)的pnh患者仍然需要輸血,因為c3b的積累導致紅細胞的調理作用,其隨后在肝和脾中被清除。此外,用抗c5抗體的治療導致c3b和c3a形成在細胞上的積累,否則其將被mac裂解。抗c5抗體的一個重要缺點是患者對于感染變得脆弱,因為抗體也干擾由病原體誘導的補體激活。通過靶向保護宿主細胞的補體系統的調控因子,避免這種情況。
如本文所用的,術語“抗體”是指包含至少一種與輕鏈可變區(vl)配對的重鏈可變區(vh)的免疫球蛋白,其對靶表位是特異性的。該術語涵蓋多克隆和單克隆抗體。它是指特異性結合fh的ccp17和/或ccp18,優選地ccp18,包括全長免疫球蛋白的任何形式的抗體。根據本發明的抗體或其片段包含至少一個抗原結合位點。如本文所用的,術語“抗原結合位點”是指包含至少一個cdr序列,優選地至少兩個cdr序列,更優選地至少三個cdr序列的抗體或其片段的位點。例如,抗原結合位點包含輕鏈cdr1-3或重鏈cdr1-3。特別優選的抗原結合位點包括輕鏈cdr1-3和重鏈cdr1-3。“抗體片段”在本文中被定義為具有至少一種在種類上而不一定是數量上的與所述抗體的共有性質的部分。片段能夠特異性結合與所述抗體相同的抗原,即fh的ccp17和/或ccp18,盡管不必具有相同的程度。抗體的片段包含所述抗體的至少一個cdr序列。所述片段優選包含抗體的重鏈cdr1、cdr2和cdr3序列,以及所述抗體的輕鏈cdr1、cdr2和cdr3序列。抗體片段的非限制性實例是單結構域抗體、單鏈抗體、納米抗體(nanobody)、單抗體(unibody)、單鏈可變片段(scfv)、fab片段、fab’片段、f(ab’)2片段和f(ab)2片段。抗體的優選片段包含至少重鏈可變結構域(vh)和/或輕鏈可變結構域(vl)。更優選的片段包含至少fab片段。如實例中所證實的,本發明的增強性抗fh抗體的fab’片段保留增強fh功能的能力。特別優選的片段是根據本發明的抗體的fab片段、fab’片段、f(ab’)2片段和f(ab)2片段。
如技術人員所熟知的,抗體含有兩條重鏈和兩條輕鏈。抗體的重鏈是構成免疫球蛋白分子的兩種類型鏈中的較大的。重鏈包含恒定結構域和可變結構域,該可變結構域參與抗原結合。抗體的輕鏈是構成免疫球蛋白分子的兩種類型鏈中的較小的。輕鏈包含恒定結構域和可變結構域。輕鏈的可變結構域通常但不總是與參與抗原結合的重鏈的可變結構域一起。互補決定區(cdr)是存在于重鏈可變結構域和輕鏈可變結構域中的高可變區(hypervariableregion)。在全長抗體的情況下,重鏈的cdr1-3和連接的輕鏈的cdr1-3一起形成抗原結合位點。
氨基酸序列或核酸序列的一致性百分比,或術語“%序列一致性”在本文中被定義為在比對兩個序列之后,與參考氨基酸序列或核酸序列中殘基一致的氨基酸序列或核酸序列的全長的殘基的百分比,并且如果必要,引入間隙(gap)以實現最大百分比一致性。用于比對的方法和計算機程序是本領域公知的,例如“比對2(align2)”。
根據本發明的抗體和片段特異性結合fh的ccp17和/或ccp18。優選的抗體和片段至少結合fh的ccp18。fh是在血漿中循環的155千道爾頓(kda)可溶性糖蛋白。fh含有20個補體調控蛋白(ccp)結構域,編號為1-20,起始于fh的n端。ccp結構域也被稱為短共有重復序列(shortconsensusrepeat)(scr)或sushi結構域。ccp1-4是參與調節的結構域,且ccp19-20參與結合c3b,并且ccp6、7、8、19和20結合在細胞表面表達的gag和唾液酸。結合ccp19和/或ccp20的抗體抑制fh的活性。不受理論的束縛,人們認為結合位于結合結構域ccp19和ccp20附近的結構域的抗體(即ccp17和ccp18)增強fh的活性。實際上,如在實例中所證明的,結合ccp18的抗體增強fh的功能。如本文所用的,術語“特異性”和“特異性結合”或“能夠特異性結合”是指抗體與它的表位之間的非共價相互作用。這表明抗體或片段優先結合所述表位而不是其他表位或其它抗原。因此,盡管抗體或片段可非特異性地結合至其他表位或抗原,但所述抗體或片段對它的表位的結合親和力顯著高于所述抗體或片段對任何其他表位或抗原的結合親和力。
根據本發明的抗體和片段能夠增強fh的活性,優選地人fh的活性。術語“增強fh活性”是指如果根據本發明的抗體或片段結合至fh,則fh的活性增加。盡管特異性結合fh的抗體是已知的,但這些抗體主要用于fh的檢測,例如在免疫測定中。此外,已經描述了阻斷或抑制它的功能的fh特異性抗體。本發明人首次開發了fh特異性抗體,其在結合fh時增強它的功能。令人驚訝地發現,本發明的增強抗fh抗體的活性增加fh的補體抑制活性。可在體外或體內增強所述fh活性。優選地,由本發明的抗體和片段增強的fh的活性是優選地對個體中的旁路補體激活的抑制。如本文所用的,術語“旁路補體激活”是指通過旁路途徑激活補體系統,即涉及至少旁路途徑的c3轉化酶的形成(即c3bbb/c3bbbp),或涉及增加該c3轉化酶的形成。旁路補體激活可進一步包括通過旁路途徑c3轉化酶將c3切割成c3a和c3b,旁路途徑c5轉化酶的形成(即c3bbbc3b/c3bbbc3b)和/或c5的切割,以及隨后c6、c7、c8和c9的結合以形成mac。旁路補體激活可進一步包括旁路途徑擴增環的增加。所述旁路補體激活優選地在個體中,優選地在個體的體液中,優選地在血液、間質液或腦脊液中,更優選地在血液中被抑制。如本文所用的,“個體”是包括補體系統作為它的免疫系統的一部分的人或動物。優選地,所述個體是哺乳動物,更優選地是人。
如本文所用的,“旁路補體激活的抑制”包括引起其抑制或者是其抑制的結果的旁路補體系統的成分、因子或活性的量或活性的任何改變。旁路補體激活的抑制例如包括溶血活性的抑制、在所述個體的細胞上的補體成分3(c3)沉積的抑制、fh與c3b、ic3b和/或c3d的結合的增加、旁路補體途徑c3轉化酶c3bbb/c3bbbp的形成的抑制、b因子與c3b的結合的抑制和/或c3b和b因子之間的相互作用的抑制、通過旁路途徑c3轉化酶將c3切割成c3a和c3b的抑制、fh與宿主細胞且特別是與宿主細胞上表達的唾液酸、糖胺聚糖和/或肝素的結合的增加、旁路補體途徑的擴增環的抑制和旁路補體途徑c5轉化酶c3bbbc3bp/c3bbbc3bp的形成的抑制、通過旁路途徑c5轉化酶將c5切割成c5a和c5b的抑制、fh的衰減加速活性的增加,即一旦它們形成就促進旁路途徑c3轉化酶的解離,和/或導致c3b降解的fi輔因子活性的增加。通過由本發明的抗fh抗體和片段增強的fh抑制旁路補體激活優選包括溶血活性的抑制、所述個體的細胞上的c3沉積的抑制和/或fh與c3b、ic3b和/或c3d的結合的增加。
如本文所用的,“抑制”優選是指所指示的活性降低至少約25%,更優選地至少約50%,更優選地至少約75%,更優選地至少約80%,更優選地至少約85%,更優選地至少約90%,最優選地至少約95%。因此,“旁路補體激活的抑制”優選是指旁路補體途徑的活性降低至少約25%,更優選地至少約50%、75%、80%、85%、90%或95%。類似地,“溶血活性的抑制”優選是指溶血活性降低至少約25%,更優選地至少約50%、75%、80%、85%、90%或95%。
如本文所用的,“增加”優選是指所指示的活性增加至少約25%,更優選地至少約50%,更優選地至少約75%,更優選地至少約80%,更優選地至少約85%,更優選地至少約90%,最優選地至少約95%。因此,“fh與c3b的結合的增加”優選是指fh與c3b的結合增加至少約25%,更優選地至少約50%、75%、80%、85%、90%或95%。類似地,“fh與宿主細胞的結合的增加”優選是指fh與宿主細胞的結合增加至少約25%,更優選地至少約50%、75%、80%、85%、90%或95%。
如本文所用的,“溶血活性”是指紅細胞破裂,和細胞內容物隨后釋放到例如,由補體系統的激活誘導的循環中,優選地作為在細胞表面處形成mac的結果。例如,如本文在實例中描述的通過使用sanchez-corral等人(2004)和wouters等人(2008)描述的溶血測定(可選地具有一些修改)來測量溶血活性。在該測定中,例如在37℃用諸如人血清的血清將諸如綿羊紅細胞(srbc)的紅細胞孵育1.25小時,同時振蕩。具有低水平的fh或功能障礙的fh的血清導致srbc的裂解。可通過加入含有20mm的edta的佛羅拿(veronal)緩沖液,隨后在預冷的離心機(例如,7℃)中離心2.5分鐘停止裂解。通過測量在412nm處測量的上清液的吸光度來測定紅細胞裂解的百分比。血清可例如來自健康人個體或來自患有與不期望的或過度的旁路途徑補體激活相關的病癥(例如,ahus)的人個體。可通過在抗體或片段的存在下用血清孵育紅細胞來測定抗體或片段抑制溶血活性的能力。
例如,使用如本文在實例中描述的c3沉積測定法測量c3沉積的抑制。該測定包括用酵母聚糖或lps涂覆微量滴定板(microtiterplate)。隨后,在存在或不存在抗體或片段的情況下,用例如來自健康個體或來自患有與如上所述的不期望的或過度的旁路補體激活相關的病癥的個體的血清孵育板。可用抗c3抗體檢測酵母聚糖或lps上的c3沉積。
例如,使用如本文在實例中描述的elisa測量fh與c3b的結合的增加。該測定包括用c3b涂覆微量滴定elisa板,并用例如來自健康個體或患有與如上所述的不期望的或過度的旁路補體激活相關的病癥的個體的血清孵育板。可用諸如過氧化物酶標記的多克隆抗fh的抗fh抗體檢測結合的fh。在用涂覆的c3b孵育之前,在抗體或片段的存在下,可通過預孵育血清來測定抗體或片段增強fh與c3b結合的能力。作為另一個實例,可使用表面等離子體共振(spr)測定fh與c3b的結合。spr是在無標記環境中實時測量生物分子相互作用的技術。例如,在存在或不存在(不同濃度的)本發明的抗體或片段的情況下,將諸如c3b的相互作用物之一固定至傳感器表面,并將諸如fh的另一個在溶液中游離,并通過表面。
根據本發明的抗體或其片段優選是單克隆抗體或片段。單克隆抗體是由單一分子種類組成的抗體。可有利地重組產生單克隆抗體,使得獲得的抗體的量顯著高于抗血清中存在的多克隆抗體的情況。然而,多克隆抗體和片段也包括在本發明中。根據本發明的抗體或片段優選是嵌合的或人源化抗體。因此,優選地,所述抗體或片段包含至少人輕鏈和重鏈恒定區。更優選地,所述抗體或片段還包含重鏈和輕鏈可變區中的人構架區(humanframeworkregion)。進一步優選的是人抗體或片段,其完全由人序列組成。使用嵌合的、人源化或人抗體優于使用非人抗體,因為使用非人抗體或片段用于治療人類疾病受許多因素限制。人體可將非人抗體識別為外來的,這將導致針對非人抗體或片段的免疫應答,導致不利的副作用和/或抗體或片段從循環中的快速清除。當將嵌合的、人源化或人抗體給予人時,副作用的機會減少。此外,由于與非人抗體相比時清除率降低,因此當使用嵌合、人源化或人抗體時,通常實現在循環中更長的半衰期。
可通過本領域已知的各種方法制備對特定抗原特異性的抗體,例如根據本發明的fh。例如,人fh可用作誘發抗體的免疫原。作為另一個實例,人fh的ccp17和/或ccp18結構域可用作免疫原。這種方法的一個實例是通過在實例中描述的免疫和雜交瘤產生。例如,可通過免疫諸如balb/c小鼠的小鼠,用人h因子腹膜內注射,可選地在佐劑(例如montanide)的存在下,例如以四周的間隔,產生fh的小鼠單克隆抗體。在第四次免疫后數天,可用例如,骨髓瘤細胞系sp2/0融合脾細胞。可通過elisa測試雜交瘤的上清液中h因子特異性抗體的存在。例如,用moab(例如,大鼠抗小鼠κmoabrm19)涂覆微量滴定板以捕獲小鼠igg抗體。通過生物素化h因子測定抗體的特異性。提供fh特異性抗體的方法的另一個實例是通過篩選表達編碼免疫球蛋白鏈的重組核酸序列的噬菌體展示文庫。用于抗體噬菌體展示的方法已在本領域中使用并廣泛描述。可使用用于免疫的相同抗原(例如,人fh或人fh的ccp17和/或ccp18結構域)進行用于抗體的文庫的篩選。
一旦獲得fh特異性的抗體或片段(特別是fh的ccp17和/或ccp18),就可通過本領域技術人員已知的多種方法測試其所需的生物活性,即它們增強fh的活性的能力。如上文描述的,增強fh的活性優選包括溶血活性的抑制、細胞上c3沉積的抑制和/或fh與c3b的結合的增加。測試這些活性的功能測定在上文描述并在實例中詳細描述。
根據本發明的特別優選的抗體是抗fh.07抗體,其制備和鑒定在實例中描述。表1提供了抗體抗fh.07的可變重鏈和輕鏈序列以及單獨cdr序列的概述。甚至更優選的是包含抗體抗fh.07的重鏈cdr序列和輕鏈cdr序列或抗體fh.07的重鏈可變區和輕鏈可變區的單克隆嵌合或人源化抗體或其片段。如本文所用的,術語“抗fh.07”包括具有至少如表1所示的重鏈和輕鏈cdr1、cdr2和cdr3區的所有抗體和片段,例如分離的和/或純化的抗體或重組產生的抗體。根據本發明的另一優選抗體或片段是與抗體抗fh.07競爭結合fh,特別是競爭結合fh的ccp18的抗體或片段。因此,還提供了特異性結合h因子(fh)的ccp17和/或ccp18,優選地ccp18的抗體或其片段,其增強fh活性,并與抗體抗fh.07競爭結合fh。可使用本領域熟知的方法測定競爭,例如通過使用biacoret3000儀器(gehealthcare,littlechalfont,uk)的表面等離子體共振,由此將fh固定在傳感器芯片上,并將潛在的競爭抗體流過固定的fh。基于表1的重鏈和輕鏈cdr序列,能夠產生包含至少一個如表1所示的cdr序列的抗體或其片段,其對fh的cc18是特異性的。
因此,本發明進一步提供了分離的、合成的或重組的抗體或其片段,包含:
-seqidno:5的重鏈cdr1序列,和/或
-seqidno:6的重鏈cdr2序列,和/或
-seqidno:7的重鏈cdr3序列,和/或
-seqidno:1的輕鏈cdr1序列,和/或
-seqidno:2的輕鏈cdr2序列,和/或
-seqidno:3的輕鏈cdr3序列。所述抗體優選特異性結合fh的補體ccp17和/或ccp18,更優選地結合ccp18,并增強fh活性。更優選地,根據本發明的抗體或片段包含表1的所有三種重鏈cdr和所有三種輕鏈cdr。在一個實施例中,根據本發明的抗體或片段包含表1所示的重鏈可變區序列和/或輕鏈可變區序列。因此,還提供了具有seqidno:8的重鏈序列和/或具有seqidno:4的輕鏈序列的根據本發明的抗體或片段。
可選地,優化所述cdr中至少一個的序列,從而產生變體抗體,例如以提高結合親和力、fh增強能力或體內或儲存穩定性。此外,可選地,優化本發明的抗體或片段的至少一個框架區中的至少一個序列,例如以改善抗體或片段的結合效力或穩定性或在其給藥于人類之后減少非人類序列的副作用。這例如通過誘變程序進行。技術人員能夠產生包含至少一個改變的cdr或框架序列的抗體變體。例如,通過突變編碼這種構架序列的核酸分子優化cdr和/或構架序列。例如,應用保守氨基酸取代。保守氨基酸取代的實例包括諸如異亮氨酸、纈氨酸、亮氨酸或蛋氨酸的一個疏水殘基取代另一個疏水殘基,以及一個極性殘基取代另一個極性殘基,例如精氨酸取代賴氨酸、谷氨酸取代天冬氨酸,或谷氨酰胺取代天冬酰胺。為了選擇改良的抗體或片段,優選測試所得變體抗體的結合親和力、fh增強能力和/或穩定性。優選地,人生殖系序列用于根據本發明的抗體或片段中的框架區。人生殖系序列的使用使所述抗體的免疫原性的風險最小化,因為這些序列不太可能包含對衍生框架區的個體而言是獨特的體細胞改變,并且當應用于另一個人個體時可引起免疫原性應答。通常,cdr序列的最多達三個氨基酸殘基可能變化,同時保留相同的特異性。因此,根據本發明的抗體或片段優選含有重鏈和輕鏈cdr1、cdr2和cdr3序列,其中與表1的重鏈和輕鏈cdr1、cdr2和cdr3序列相比,每個cdr的至多3個,優選地至多2個,更優選地至多1個氨基酸發生改變。
因此,本發明進一步提供了分離的、合成的或重組的抗體或其片段,其包含:
-包含與seqidno:5的序列至少80%一致的序列的重鏈cdr1序列,和/或
-包含與seqidno:6的序列至少80%一致的序列的重鏈cdr2序列,和/或
-包含與seqidno:7的序列至少80%一致的序列的重鏈cdr3序列,和/或
-包含與seqidno:1的序列至少80%一致的序列的輕鏈cdr1序列,和/或
-包含與seqidno:2的序列至少80%一致的序列的輕鏈cdr2序列,和/或
-包含與seqidno:3的序列至少80%一致的序列的輕鏈cdr3序列。所述抗體優選特異性結合fh的補體ccp17和/或ccp18,更優選地結合ccp18,并增強fh活性。優選地,所述抗體或片段包含與這些序列至少85%,更優選地至少86%,更優選地至少87%,更優選地至少88%,更優選地至少89%,更優選地至少90%,更優選地至少91%,更優選地至少92%,更優選地至少93%,更優選地至少94%,更優選地至少95%,更優選地至少96%,更優選地至少97%,更優選地至少98%,更優選地至少99%一致的重鏈cdr1、cdr2和/或cdr3序列和/或輕鏈cdr1、cdr2和/或cdr3序列。
還提供根據本發明的抗體或片段,其包含或具有含有與seqidno:8的序列具有至少80%的序列一致性的序列的重鏈序列和/或包含或具有含有與seqidno:4的序列具有至少80%的序列一致性的序列的輕鏈序列,或者與這些重鏈或輕鏈可變區序列中的任何一個具有至少85%,更優選地至少86%,更優選地至少87%,更優選地至少88%,更優選地至少89%,更優選地至少90%,更優選地至少91%,更優選地至少92%,更優選地至少93%,更優選地至少94%,更優選地至少95%,更優選地至少96%,更優選地至少97%,更優選地至少98%,更優選地至少99%的一致性的序列。
本發明還提供了包含編碼根據本發明的抗體或其片段的核酸序列的分離的、合成的或重組的核酸分子。優選的核酸分子編碼至少如表1所示的重鏈cdr1、cdr2和cdr3以及輕鏈cdr1、cdr2和cdr3。優選地,根據本發明的核酸分子具有至少30個核苷酸,更優選地至少50個核苷酸,更優選地至少75個核苷酸的長度。優選地,根據本發明的核酸分子編碼單克隆嵌合或人源化抗體或其片段,其包含如表1所示的抗體抗fh.07的重鏈cdr序列和輕鏈cdr序列或抗體抗fh.07的重鏈可變區和輕鏈可變區。編碼抗體抗fh.07的重鏈和輕鏈cdr的核酸序列在表1描述。然而,包含不同于在表1中描述的cdr核酸序列的核酸序列但包含編碼在表1中描述的所述重鏈或輕鏈cdr序列的氨基酸序列的核酸密碼子的編碼根據本發明的抗體的重鏈或輕鏈cdr的核酸分子也包括在本發明中。因此,提供了分離的、合成的或重組的核酸分子,其包含編碼至少seqidno:1、2、3、5、6和7的序列的核酸序列。還提供了分離的、合成的或重組的核酸分子,其包含編碼至少seqidno4和8的序列的核酸序列。編碼重鏈和/或輕鏈cdr的核酸分子或通過例如保守氨基酸取代修飾的抗體也包括在本發明中,只要編碼的cdr氨基酸序列與表1所示的cdr序列具有至少80%,優選地至少85%,更優選地至少90%,更優選地至少95%的序列一致性。
根據本發明的核酸分子或核酸序列優選包含核苷酸鏈,更優選地dna和/或rna。然而,本發明的核酸分子或核酸序列可包含其他種類的核酸結構,例如dna/rna螺旋、肽核酸(pna)、鎖核酸(lockednucleicacid)(lna)和/或核酶。這種其他的核酸結構被稱為核酸序列的功能等同物,并且包括在本發明中。術語“核酸序列的功能等同物”還包括包含表現出與天然核苷酸相同功能的非天然核苷酸、修飾核苷酸和/或非核苷酸結構單元的鏈。
本發明還提供了分離的、合成的或重組的核酸分子,其包括:
-包含與seqidno:13的序列至少80%一致的序列的重鏈cdr1序列,和/或
-包含與seqidno:14的序列至少80%一致的序列的重鏈cdr2序列,和/或
-包含與seqidno:15的序列至少80%一致的序列的重鏈cdr3序列,和/或
-包含與seqidno:9的序列至少80%一致的序列的輕鏈cdr1序列,和/或
-包含與seqidno:10的序列至少80%一致的序列的輕鏈cdr2序列,和/或
-包含與seqidno:11的序列至少80%一致的序列的輕鏈cdr3序列。根據本發明的核酸分子優選包含具有與所述cdr序列至少85%,更優選地至少90%,更優選地至少95%,更優選地至少96%,更優選地至少97%,更優選地至少98%,更優選地至少99%的序列一致性的序列。優選地,所述核酸分子包含重鏈序列,所述重鏈序列包含與seqidno:16的序列具有至少80%的序列一致性的序列和/或包含輕鏈序列,所述輕鏈序列包含與seqidno:12的序列具有至少80%的序列一致性的序列,更優選地與seqidno:12和/或seqidno:16具有至少85%,更優選地至少90%,更優選地至少95%,更優選地至少96%,更優選地至少97%,更優選地至少98%,更優選地至少99%的序列一致性。
本發明還提供了包含根據本發明的核酸分子的載體(vector)。優選的載體是質粒。“質粒(plasmid)”在本文被定義為環狀,優選地雙鏈dna分子。制備包含根據本發明的核酸分子的載體的方法是本領域熟知的。適于產生本發明載體的載體的非限制性實例是逆轉錄病毒和慢病毒載體。根據本發明的載體可以用于多種應用。根據本發明的載體優選用于根據本發明的核酸分子在細胞中的體外表達,優選用于產生根據本發明的抗體或片段。此外,包含根據本發明的核酸分子的根據本發明的載體可以用于治療。將這種載體給予需要其的個體,優選人類,導致根據本發明的抗體或片段的體內表達。
還提供了包含根據本發明的核酸分子或載體的重組細胞。優選地,將這種核酸分子或載體引入所述細胞中,使得細胞的核酸翻譯機器將產生編碼的抗體或片段。根據本發明的核酸分子或載體優選在所謂的生產者細胞(producercell)中表達,例如像中國倉鼠卵巢(cho)、nso(小鼠骨髓瘤)或293(t)細胞系的細胞,其中的一些適合于商業抗體生產。這種生產者細胞的增殖導致能夠產生根據本發明的抗體或片段的生產者細胞系。優選地,所述生產者細胞系適于產生用于人的抗體。因此,所述生產者細胞系優選不含諸如病原微生物的病原體。
本發明還提供了用于產生根據本發明的抗體或片段的方法,包括向細胞提供根據本發明的核酸分子或載體,并且允許所述細胞翻譯由所述核酸分子或載體所包含的核酸序列,由此產生根據本發明的所述抗體或片段。根據本發明的方法優選地進一步包括收獲、純化和/或分離所述抗體或片段。還提供了使用用于產生根據本發明的抗體或片段的方法獲得的抗體或片段。
根據本發明的抗體或片段可有利地用于治療應用。因此,提供了包含根據本發明的抗體或片段以及藥學上可接受的運載體(carrier)、稀釋劑和/或賦形劑的藥物組合物。還提供了包含根據本發明的核酸分子或載體以及至少一種藥學上可接受的運載體、稀釋劑和/或賦形劑的藥物組合物。合適的運載體的非限制性實例是例如鑰孔血藍蛋白(klh)、血清白蛋白(例如,bsa或rsa)和卵白蛋白。優選的運載體是溶液,例如水溶液,例如鹽水或油基(oil-based)溶液。可摻入片劑、膠囊劑等的賦形劑的非限制性實例是諸如黃蓍膠,阿拉伯膠、玉米淀粉或明膠的粘結劑,諸如微晶纖維素的賦形劑,諸如玉米淀粉、預膠化淀粉和海藻酸的崩解劑,諸如硬脂酸鎂的潤滑劑,諸如蔗糖、乳糖或糖精的甜味劑,以及諸如薄荷、冬青油或櫻桃油的調味劑。當劑型單位形式是膠囊劑時,除了一種或多種上述賦形劑之外,它優選還含有諸如脂肪油的液體運載體。各種其他材料可以包衣形式存在或改變劑量單位的物理形式。例如,可用蟲膠和/或糖或兩者包衣片劑。根據本發明的藥物組合物優選適于人類使用。
可以多種不同的方式給予本文所述的藥物組合物。實例包括通過口服、鼻內、直腸、局部、腹膜內、靜脈內、肌內、皮下(subcutaneous)、真皮下(subdermal)、透皮、鞘內和顱內方法給予包含根據本發明的抗體和含有藥學上可接受的運載體的藥物組合物。對于口服給藥,可以固體劑型形式(例如,膠囊劑、片劑和粉末劑)或以液體劑型形式(例如,酏劑、糖漿劑和混懸劑)給予活性成分。可根據常規藥學實踐,通過將本發明的抗體或片段溶解或懸浮在諸如水或天然存在的油(例如,芝麻油、椰子油、花生油、棉籽油等)或合成脂肪載體(例如,油酸乙酯)的注射用載體中配制用于注射的無菌組合物。還可以摻入緩沖劑、防腐劑和/或抗氧化劑。
本發明還提供了用于治療的根據本發明的抗體或片段。還提供了用于治療的根據本發明的核酸分子。所述治療可以是治療性或預防性的。根據本發明的抗體或片段特別適合于治療、減輕或預防與旁路途徑補體激活相關的病癥。因此,提供了根據本發明的抗體或片段,用于治療、減輕或預防與旁路途徑補體激活相關的病癥。還提供了根據本發明的核酸分子,用于治療、減輕或預防與旁路途徑補體激活相關的病癥。如本文所用的,“與旁路補體激活相關的病癥”在本文被定義為其中不期望的和/或過量的旁路途徑補體激活導致細胞、組織或細胞外基質損傷的病癥。可能被不期望的和/或過度的旁路途徑激活損傷的細胞是與血液接觸的任何細胞,例如紅細胞、上皮細胞,特別是肝和/或腎上皮細胞、血小板、白細胞、內皮細胞。所述病癥優選是與受損的fh功能或fh缺陷相關的病癥。更優選地,所述病癥是與受損的fh功能或fh缺陷相關但不具有fh缺失相關的病癥。由于本發明的抗體和片段增強fh的功能,因此抗體和片段特別適于阻斷或降低受損的fh功能或fh缺陷的影響。然而,如在實例中所證實的,本發明的增強抗fh抗體不僅抑制用具有受損的旁路途徑激活的患者的血清孵育的紅細胞的裂解,而且抑制用其中fh被人為阻斷的健康個體的血清孵育的紅細胞的裂解。因此,抗體和片段還可以用于阻斷或減少由除了受損的fh功能或fh缺陷之外的因素引起的不期望的和/或過度的旁路途徑補體激活。可被治療的這類病癥的非限制性實例是非典型溶血尿毒綜合征(ahus)、陣發性睡眠性血紅蛋白尿癥(pnh)、年齡相關性黃斑變性(amd)、膜性增生性腎小球腎炎(mpgn)。
非典型溶血尿毒綜合征(atypicalhemolyticuremicsyndrome)(ahus)也稱為補體介導的hus,其特征在于溶血性貧血、血小板減少、全身性血栓性微血管病(tma)和腎衰竭。ahus的發病通常在兒童期,并且該疾病的發作與例如感染、懷孕、其他疾病、手術或創傷相關。超過60%的ahus患者死亡或發展終末期腎臟疾病(esrd)(盡管血漿置換或血漿補充)。已在患有ahus的患者中鑒定出補體系統的成分或因子的多種突變。fh、fifb,膜輔因子蛋白(mcp)、血栓調節蛋白(thbd)或c3中的突變包括約50%的患有ahus的患者中的已知突變,其中fh的突變是最常見的(約20-30%的ahus患者)。大多數患者對于突變是雜合的,然而這導致病理性fh缺陷。此外,在約10%的患者中,ahus由針對fh的自身抗體誘發,也導致功能性fh減少。目前,ahus的標準治療是血漿補充或血漿置換療法。此外,艾庫組單抗(eculizumab)用于治療患有ahus的患者。腎移植與高復發風險相關,其依賴于基于ahus的突變。由于復發的風險增加,因此在具有fh、fb、fi、c3或thbd突變的兒童中,移植是禁忌的。根據本發明的優選包含至少fab片段的抗體或片段特別適于治療、減輕或預防由fh的突變或抗fh自身抗體的存在誘發的ahus。然而,由于本發明的抗體和片段在不存在受損的fh功能或fh缺陷的情況下也增強fh的活性,因此可有利地用本發明的抗體或片段治療、減輕或預防任何形式的補體依賴性ahus。
陣發性睡眠性血紅蛋白尿癥(paroxysmalnocturnalhemoglobinuria)(pnh)由全能造血干細胞的x染色體中的基因突變引起。突變導致磷脂酰肌醇聚糖a類蛋白質的缺陷,其對于糖基磷脂酰肌醇膜錨定蛋白(gpi-ap)的合成至關重要。補體系統cd55的抑制劑是這種蛋白質的一個實例,其在宿主細胞表面結合c3b,從而防止c3轉化酶的形成。因此,這些蛋白質的缺陷導致不期望的或過度的補體激活。pnh的主要結果之一是紅細胞經歷補體系統的過度活性所致的裂解。最近,在多個國家中,艾庫組單抗(eculizumab)已被批準用于pnh的治療。其他療法包括輸血、紅細胞刺激劑治療、用皮質類固醇和合成代謝類固醇治療。由于本發明的抗體和片段優選地也獨立于fh或fh功能的水平而增強fh的活性,從而抑制補體系統的旁路途徑的激活,因此抗體和片段可有利地用于pnh患者。此外,由于本發明的抗體和片段在c3沉積的水平上起作用,這與在激活途徑的更下游起作用的艾庫組單抗(eculizumab)相對,因此肝臟中的細胞消耗由于較少的細胞被c3b調理(opsonize)而減少。
年齡相關性黃斑變性(age-relatedmaculardegeneration)(amd)是對視網膜的損傷,影響老年個體的侵襲通常導致黃斑、視野中心的視力喪失。最近,fh的突變和snp(單核苷酸多態性)已影響約35%的amd患者。snp位于fh的ccp7中,并且被證明影響fh與肝素的結合,從而損害fh結合宿主細胞表面以及細胞外基質的能力。根據本發明的優選包含至少fab片段的抗體或片段特別適于治療、減輕或預防特征在于fh功能降低且優選地特征在于編碼fh的基因的snp的amd。
膜性增生性腎小球腎炎(membranoproliferativeglomerulonephritis)(mpgn)是主要發生在兒童和年輕成年人中的慢性腎炎的罕見原因。它由于腎小球系膜和內皮細胞的增殖以及腎小球系膜基質的擴張、由于內皮下免疫沉積物和/或膜內致密沉積物所致的外周毛細血管壁增厚,以及腎小球系膜插入至毛細血管壁引起腎小球損傷。mpgn通常與完全不存在fh相關。可用本發明的抗體和/或片段治療的mpgn優選與受損的fh功能或fh缺陷相關,但不具有fh缺失。因此,本發明提供了根據本發明的的抗體或片段或核酸分子的用途,用于治療、減輕或預防與旁路途徑補體激活相關的病癥,其中所述病癥選自由以下各項組成的組:非典型溶血尿毒綜合征(ahus)、陣發性睡眠性血紅蛋白尿癥(pnh)、年齡相關性黃斑變性(amd)、膜性增生性腎小球腎炎(mpgn)。還提供了根據本發明的抗體或片段、核酸分子或載體在制備用于治療、減輕或預防與旁路途徑補體激活相關的病癥的藥物中的用途。所述病癥優選選自由以下各項組成的組:非典型溶血尿毒綜合征(ahus)、陣發性睡眠性血紅蛋白尿癥(pnh)、年齡相關性黃斑變性(amd)、膜性增生性腎小球腎炎(mpgn)。根據本發明可用作藥物或預防藥的優選抗體是包含如表1所示的重鏈和輕鏈cdr1、cdr2和cdr3的抗體或其片段,優選地fab、fab’或f(ab)2或f(ab’)2片段。所述抗體或片段優選是單克隆人源化或嵌合抗體或片段。
本發明還提供了一種用于抑制旁路補體激活的方法,包括向個體給予根據本發明的抗體或片段,或根據本發明的核酸分子或載體。
本發明還提供了用于治療、減輕或預防與旁路途徑補體激活相關的病癥的方法,包括向需要其的個體給予治療有效量的根據本發明的抗體或片段。還提供了用于治療、減輕或預防與旁路途徑補體激活相關的病癥的方法,包括向需要其的個體給予治療有效量的根據本發明的核酸分子或載體。還提供了用于治療、減輕或預防與旁路途徑補體激活相關的病癥的方法,包括向需要其的個體給予治療有效量的根據本發明的藥物組合物。所述病癥優選選自由以下各項組成的組:非典型溶血尿毒綜合征(ahus)、陣發性睡眠性血紅蛋白尿癥(pnh)、年齡相關性黃斑變性(amd)、膜性增生性腎小球腎炎(mpgn)。如本文所用的,“個體”是具有補體系統作為它的免疫系統的一部分的人或動物,優選是哺乳動物。在特別優選的實施例中,個體是人。用于本發明方法的優選抗體是包含如表1所示的重鏈和輕鏈cdr1、cdr2和cdr3的抗體或其片段,優選地fab、fab’、f(ab)2或f(ab’)2片段。所述抗體或片段優選是單克隆人源化或嵌合抗體或片段。
可給予包含本發明的抗體、片段、核酸分子的組合物用于預防性和/或治療性治療。在治療應用中,以足以抵抗疾病的癥狀和/或其并發癥的量將根據本發明的抗體、片段、核酸分子或組合物給予已經患有疾病和/或已經顯示疾病癥狀的個體,優選是人。在預防性應用中,在個體表現出病癥的癥狀之前將根據本發明的抗體、片段、核酸分子或組合物給予個體以預防這些癥狀或其并發癥的發展。例如,可用根據本發明的抗體、片段、核酸分子或組合物預防性治療攜帶可能或將會引起與旁路補體激活相關的病癥的基因突變的個體。抗體、片段或核酸分子通常以治療量存在于根據本發明的藥物組合物中,所述治療量是足以治療病癥,特別是與補體系統的旁路途徑的不期望的或過度激活相關的病癥相關的癥狀的量。
為了清楚和簡潔描述的目的,在本文可將特征描述為本發明的相同或單獨的方面或實施例的一部分。本領域技術人員將理解,本發明的范圍可包括具有在本文描述為相同或單獨的實施例的一部分的特征的全部或一些的組合的實施例。
在以下非限制性實例中更詳細地說明本發明。
表1.抗體抗fh.07的氨基酸和核苷酸序列(根據imgt編號系統的cdr編號(lefranc1997,lefranc1999和lefranc等人,2003)
附圖說明
圖1:單克隆抗體抗fh.07的表位的表征。抗fh.07針對ccp18,如通過結合至重組fhccp結構域15-18、15-19和18-20所指示的。
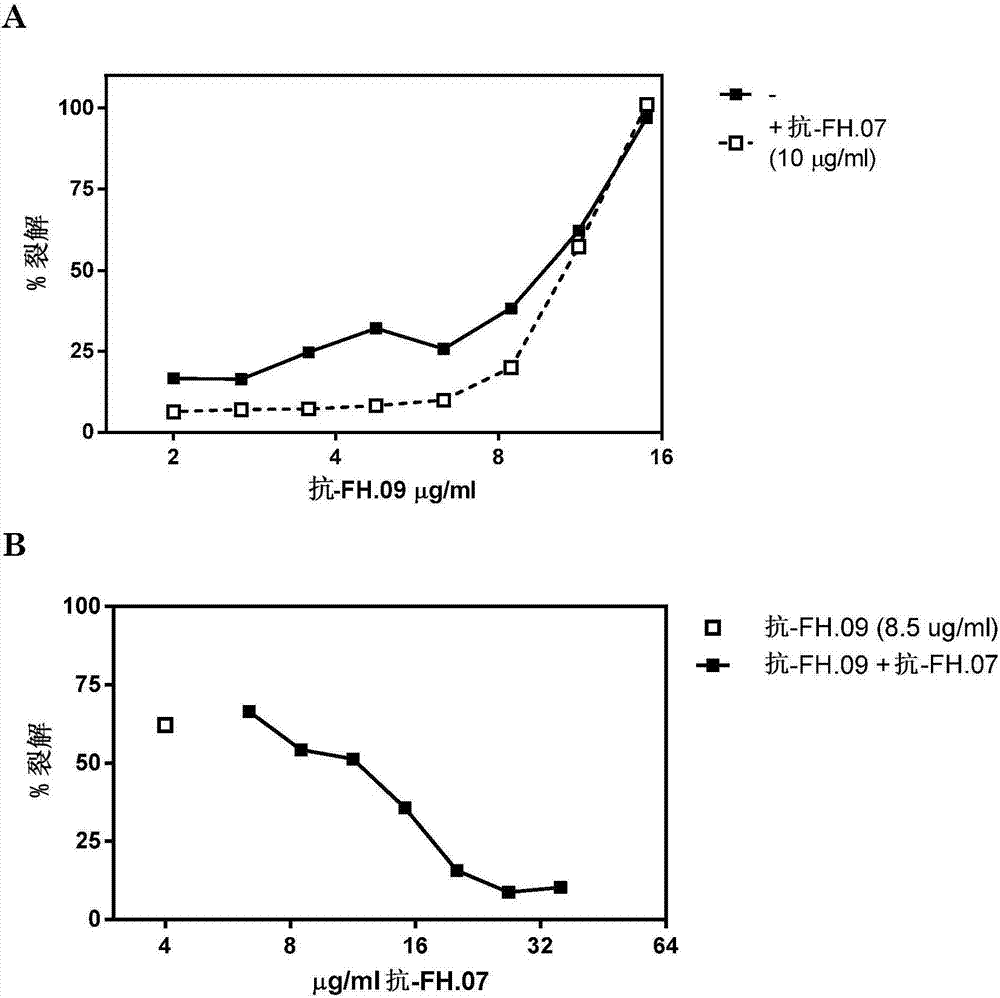
圖2:抗fh.07抑制由健康供體血清中的moab抗fh.09(阻斷針對ccp6的moab)誘導的srbc裂解。a.滴定抗fh.09以誘導srbc裂解,通過固定量的抗fh.07(500nm)抑制。b.誘導次優裂解的抗fh.09(8.5μg/ml)的固定量,通過增加抗fh.07的量抑制。
圖3:a,b.如通過酵母聚糖和lps涂層上的c3沉積測量的,抗fh.07及其f(ab’)2和fab’片段抑制旁路途徑激活。a.酵母聚糖上的血清滴定,固定量的抗fh.07(完整的,f(ab’)2,fab’,500nm)。b.lps上固定的血清稀釋,抗fh.07的滴定(完整的,f(ab’)2,fab’)。c.在橋接elisa中測定的fh的交聯。fab’不能交聯fh。
圖4:由于ahus患者血清中功能性fh不足,srbc裂解可被抗fh.07(完整的,f(ab’)2或者fab’片段)抑制。b,c.在mgegta+100μg/ml完整的抗體、f(ab’)2或fab’片段中的10%(v/v)血清。
圖5:a.如通過elisa測量的,抗fh.07增加fh與c3b的結合。b,c,d.fh與(b)c3b、(c)ic3b和(d)c3d相互作用的spr分析的傳感圖(sensogram)。添加抗fh.07fab’片段使所測量的ru在所有表面上增加至少2倍,反映增加的fh結合。
具體實施方式
實例
材料和方法
試劑
從comptech.(tyler,texas,美國)獲得人純化的h因子。從sanquin(businessunitreagents,sanquin,amsterdam,荷蘭)獲得大鼠抗小鼠κ(rm19)。從sanquin獲得高性能elisa緩沖液(hpe)。從sanquin獲得多克隆兔抗人-h因子,從quidel獲得多克隆山羊抗人fh。
重組fhccp(ccp1-4、ccp1-7、ccp6-8、ccp8-15、ccp12-13、ccp15-18、ccp15-19、ccp18-20或ccp19-10)是drchristophschmidt的友情贈予并且如在前面(schmidt等人,2008)描述的進行制備。如下所述制備fh的小鼠單克隆抗體。抗fh.07(鼠類igg1)針對ccp18,抗fh.09(鼠類igg1)針對ccp6。抗il-6.8用作不相關的同種型對照,并從sanquin獲得。moab抗c3.19與分子的c3d片段上的表位反應,并且之前已經描述過(wolbink等人,1993)。
免疫和雜交瘤產生
通過用在montanide中的25μg人h因子作為佐劑以4周的間隔腹膜內免疫balb/c小鼠產生h因子的小鼠單克隆抗體。第四次加強免疫后三天,將脾細胞與骨髓瘤細胞系sp2/0融合。通過elisa測試雜交瘤的上清液中h因子特異性抗體的存在。簡言之,用大鼠抗小鼠κmoab(rm19)涂覆微量滴定板以捕獲小鼠igg抗體。通過生物素化h因子測定抗體的特異性。用鏈霉親和素-hrp和tmb顯影測定。
表位作圖moab
使用由多個ccp組成的重組人fh片段測試fh特異性moab的反應性。為此,將50微升的100μg/ml抗fhmoab與0.5ml的2mg/ml的rm-19偶聯的sepharose(25μg的moab每1mg的cnbr-sepharose)混合。用125i標記fh片段,并向每個樣品中加入100μl(20000c/30秒),隨后孵育o/n。在具有0.1%(w/v)吐溫-20和0.1%(w/v)bsa(ptb)的pbs中進行測定。用含有0.1%(w/v)吐溫-20的pbs將樣品洗滌5次并計數30秒。測量sepharose結合放射性并與總輸入(設置為100%)比較。
單克隆抗體的f(ab’)2和fab’片段的產生
為了制備抗fhmoab的f(ab’)2片段,在37℃下用胃蛋白酶(20μg/ml)(sigmap-6887)將5.2mg的每種抗體在5.2ml的0.1m檸檬酸/檸檬酸三鈉緩沖液(ph3.7)中孵育16小時。接下來,加入3m氯化鈉和1mtris,并將ph調節至8.9。使用protasepharose柱除去剩余的完整抗體和/或fc片段。為了制備單價fab’片段,通過用10mm的二硫赤蘚糖醇孵育60分鐘還原f(ab’)2片段。隨后,用20mm的碘乙酰胺封閉游離巰基。將片段針對pbs透析,并在sds-page上檢查切割效率。
srbc溶血測定
使用先前由sanchez-corral等人(2004)和wouters等人(2008)描述的溶血測定(具有一些調整)測量h因子功能性。在補充有5.8%(w/v)蔗糖(vbs)的佛羅拿(veronal)緩沖液(3mm的巴比妥、1.8mm的巴比妥鈉、145的nacl,ph7.4(vb))中將綿羊紅細胞(srbc)稀釋至2.1×108個細胞/ml的終濃度。在添加或不添加適當濃度的所指示的抗fhmoab的情況下,在含有0.05%(w/v)的明膠、10mm的mgcl2、20mm的egta(vbg-ap)的佛羅拿緩沖液中將正常的集合的人血清或ahus患者血清稀釋至20%(v/v)。
通過將50μl的血清樣品與50μl的srbc懸浮液混合以達到10%(v/v)血清的終濃度(在5mm的mgcl2、10mm的egta中含有1.05×108個細胞/ml),隨后在37℃下孵育1.25小時,同時在200rpm下振蕩進行測定。通過加入100μl含有20mm的edta的冰冷vb,隨后在預冷的離心機(7℃)中以1800rpm離心2.5分鐘來終止裂解。在synergy2酶標儀(biotek)上在412nm下測量上清液的吸光度。每個樣品的裂解表示為與100%裂解對照(在含有0.6%(w/v)皂苷的h2o中孵育的srbc)相比的百分比。作為陰性對照,用在補充有10mm的edta的vb中稀釋的血清孵育srbc以防止補體激活。
在酵母聚糖和lps上的c3沉積
用酵母聚糖(100μg/ml,在nuncpolysorp96孔微量滴定板上在室溫下在pbs涂覆的o/n中)或傷寒沙門氏菌(salmonellatyphosa)lps(sigmal-6386,40μg/ml,在nuncpolysorp96孔微量滴定板上在室溫下在pbs涂覆的o/n中)涂覆微量滴定板。在用pbs/吐溫洗滌后,在存在或不存在指定濃度的抗fhmoab或抗體片段的情況下,在含有0.05%(w/v)的明膠、5mm的mgcl2、10mm的egta和0.1%(w/v)的吐溫20的佛羅拿緩沖液中孵育人健康供體血清。用生物素化moab抗c3.19(在hpe中,0.55μg/ml),隨后在hpe中用0.01%(v/v)與聚-hrp結合的鏈霉親和素孵育來檢測c3沉積。
與c3b結合的h因子
在微量滴定elisa板上o/n涂覆c3b(40μg/ml,在碳酸鹽-碳酸氫鹽緩沖液中,ph9.6)。在c3b涂覆板上孵育之前,在室溫下用抗fhmoab(100μg/ml)將健康供體血清(在pbs/bsa/泊洛沙姆/edta中1:8稀釋)預孵育2.5小時。用過氧化物酶標記的多克隆山羊抗fh檢測結合的fh。用tmb顯色elisa(1μg/ml)。
fh與c3b、ic3b和c3d的相互作用的spr分析
使用biacoret3000儀器(gehealthcare,littlechalfont,英國)通過表面等離子體共振測定在抗fhmoab的存在下fh與c3b、ic3b或c3d的結合。使用標準胺偶聯將純化的c3b、ic3b或c3d(補體技術(complementtechnology))固定在cm5biacore傳感器芯片(gehealthcare)的三個流動池之一上。剩余的流動池用作參考表面,并通過進行偶聯反應而不添加任何蛋白質來制備。在分別與c3b、ic3b和c3d偶聯后,獲得4400個響應單位(responseunit)(ru)、4180個ru和1470個ru的響應(response)。在25℃下使用10μl/min的流速并且在具有0.05%(w/v)吐溫20(hbs-p)的10mm的hepes-緩沖的150mm的鹽水(ph7.4)中進行spr實驗。進行0.5μm的fh的重復注射,接觸時間為210秒,以獲得每個表面上的fh的參考結合信號。在每次樣品注射后,允許240秒的解離時間,使用hbs-p作為運行緩沖液,隨后1mnacl的單次30秒注射以再生表面。
為了確定抗fh.07的作用而不干擾通過moab的可能的交聯,使用如上所述產生的fab’片段。將fab’片段與0.5μm的純化的fh以2:1的摩爾比混合,并且在不加入fh的情況下也注入每種fab’片段,以確定fab’片段與表面的任何相互作用。
結果
單克隆抗體
我們獲得了21種抗人fh的單克隆抗體。按照識別的順序編號moab。所有抗體能夠捕獲可溶性人fh,表明高親和力。一些moab通過阻斷與i因子的相互作用來抑制輔因子活性,并且如通過與正常人血清孵育時增強的srbc裂解所表明的,其它moab抑制fh與細胞表面的結合。在實例中使用后面抑制性moab(抗fh.09)之一以誘導在與正常人血清孵育時的srbc的體外裂解。抗fh.03不抑制fh,并且在實例中用作對照抗體。除了抑制moab之外,我們識別了一種增強fh的功能的moab(抗fh.07)。
通過使用重組fh片段繪制moab的結合位點圖
為了繪制抗fh.07的結合位點圖,我們測試了該moab對一組放射性標記的重組ccp結構域或純化的人fh的反應性。在放射免疫測定中測試moab的結合并與輸入(100%)關聯。如圖1所示,抗fh.07結合重組片段ccp15-18、ccp15-19和ccp18-20,表明抗fh.07對fh分子的ccp18是特異性的。
抗fh.07抑制通過阻斷抗fhmoab誘導的srbc裂解
為了研究抗fh.07對h因子的功能的影響,我們首先通過阻斷針對fh的抗體誘導srbc的裂解(抗fh.09)。在正常條件下,用健康人供體血清孵育srbc不會導致srbc的裂解,因為這些細胞受在srbc表面上與唾液酸結合的血清中的h因子保護。在用增加量的阻斷moab抗fh.09孵育正常人血清時,觀察到srbc的劑量依賴性裂解(圖2a)。這可以通過血清fh對細胞表面的保護不足來解釋。當加入固定量的抗fh.07時,抑制srbc裂解。這表明抗fh.07抵消抗fh.09的作用(圖2a)。
在另外的實驗中,將固定量的抗fh.09加入到健康供體血清以誘導srbc的次優裂解(約60%)。通過添加增加量的抗fh.07,這種裂解可被完全阻斷(圖2b),再次表明這些單克隆抗體的相反作用。
抗fh.07抑制酵母聚糖和lps上的旁路途徑介導的c3沉積
為了研究抗fh.07是否對通過fh的旁路途徑抑制具有影響并且排除對srbc或對這些細胞的裂解的直接影響,進行了在作為旁路途徑激活劑的酵母聚糖或lps上的c3沉積測定。在mgegta佛羅拿緩沖液中進行實驗以排除ca2+依賴性的經典或凝集素途徑激活。
在酵母聚糖或lps涂覆的板上孵育增加的血清濃度導致劑量依賴性c3沉積。通過向血清滴定中加入固定量的抗fh.07(500nm),抑制c3沉積(圖3a),由向右移動的曲線表示。當向血清中加入相同量的抗fh.03(一種非抑制性抗fhmoab)時,沒有觀察到這種變化。這表明通過加入抗fh.07加強了fh對旁路途徑激活的抑制功能。此外,通過在lps涂覆的板上添加增加量的抗fh.07達到固定的血清濃度(1:10),可完全阻斷c3沉積(圖3b)。
抗fh.07的fab’片段具有與完整moab相同的效果
當用抗fh.07孵育時觀察到fh抑制功能增加的一種可能機制是通過經抗體的交聯使fh多聚化,從而增加fh對表面的親合力。為了測試這種可能性,我們產生抗fh.07的單價fab’片段。如果fh的交聯是觀察到的fh功能增加的原因,則預期單價fab’片段不顯示增強效應。使用橋接elisa(bridgingelisa),我們首先檢查所產生的fab’片段是否確實是完全單價的并且不能交聯fh分子。為此,用fh涂覆elisa板,并使用生物素化fh進行檢測。如圖3c所示,產生的fab’片段不能在液相中的涂層和fh上交聯fh,而f(ab’)2片段和完整的igg能夠交聯fh。然后,在c3沉積測定中在酵母聚糖和lps涂覆的板上測試抗fh.07、f(ab’)2和fab’片段。令我們驚訝的是,我們觀察到fab’片段對fh功能的相同的增強效應。在酵母聚糖和lps上,抗fh.07fab’片段導致與完整的igg抗體相同的c3沉積減少(圖3a和3b)。因此,我們得出結論,抗fh.07的影響不是通過單克隆抗體的fh分子交聯所致。此外,這是由我們在我們的小組中沒有觀察到任何其他20種單克隆抗體的任何增強效應的事實強調的。
抗fh.07恢復ahus患者血清中的fh保護功能
用增加量的具有ccp20的已知突變的ahus患者的血清孵育srbc導致由于細胞對補體激活的保護不足所致的細胞裂解(圖4a)。然而,該患者血清中接近一半的fh是功能性的,因為該患者(與大多數ahus患者一樣)具有雜合突變。基于先前的結果,我們假設用抗fh.07預孵育ahus患者血清將導致fh功能的增強,導致srbc的保護恢復。實際上,當我們用抗fh.07孵育ahus患者血清時,觀察到的srbc的裂解被完全消除(圖14a和4b),而對照抗體顯示無作用。在三個無關的ahus患者中獲得該結果,所有這些患者在fh的scr20中都攜帶獨特的雜合突變(圖4b)。與如上所述的在酵母聚糖和lps上的c3沉積實驗一致,抗fh.07的f(ab’)2和fab’片段也可抑制該患者血清中補體介導的srbc裂解(圖4c)。
在抗fh.07的存在下,h因子與c3b的結合增加
由于抗fh.07的fab’片段對fh功能發揮與完整的igg相同的增強作用,因此通過單克隆抗體的fh分子的多聚化不能作為增強的解釋。我們假設很可能通過抗fh.07與ccp18結合,fh的構象以增加與表面結合的方式變化。h因子具有位于整個分子不同位點的c3b和糖胺聚糖二者的結合位點。由于我們觀察到在酵母聚糖和lps上的c3沉積的fh增強作用,因此我們首先研究了抗fh.07對fh與c3b結合的影響。為此,用c3b涂覆elisa板,并用hrp標記的多克隆抗fh檢測來自正常人血清的結合fh。如圖5所示,抗fh.07顯著增加fh與c3b的結合,而其他抗fhmoab(不相關的moab或不具有增強效應的其他fh特異性抗體)沒有影響。
此外,進行spr實驗以研究在不存在和存在下抗fh.07fab’片段的情況下,fh與c3b、ic3b和c3d的相互作用。簡言之,用c3b、ic3b或c3d涂覆cm5biacore傳感器芯片的三個流動池,并在不存在或存在抗fhmoab的情況下,在biacoret3000系統上測定fh與這些表面的相互作用。
在正常條件下,fh顯示與c3b的相互作用和與ic3b和c3d的相對較少的相互作用。加入抗fh.09的fab’片段或同種型對照(抗il-6.8)不影響fh與c3b、ic3b或c3d的結合。然而,添加抗fh.07的fab’片段極大地增加了對c3b涂覆的表面的響應(圖5b)。抗fh.07本身不顯示與c3b的任何相互作用,表明測量的增加的響應是由fh與每個表面的結合增加引起的。甚至結合ic3b和c3d(其對于天然fh通常較低),在加入抗fh.07后也增加(分別為圖5c和5d)。在所有表面上的測量的相互作用增加至少2倍,由此不能僅通過抗fhmoabfab’片段的結合后,預期fh的質量增加33%來解釋。
參考文獻
chengzz,coreymj,
coreymj,kindersrj,podujecm,brucecl,rowleyh,brownlg,hassgm,vessellarl.mechanisticstudiesoftheeffectsofanti-factorhantibodiesoncomplement-mediatedlysis.jbiolchem.2000;275(17):12917-25.
lefrancmp,“uniquedatabasenumberingsystemforimmunogeneticanalysis”immunologytoday,18,509(1997).pmid:9386342.
lefrancmp,″theimgtuniquenumberingforimmunoglobulins,tcellreceptorsandig-likedomains″,theimmunologist.1999;7,132-136.
lefrancmp,pommiéc,ruizm,giudicelliv,foulquiere,truongl,thouvenin-contetv,andlefrancg,“imgtuniquenumberingforimmunoglobulinandtcellreceptorvariabledomainsandigsuperfamilyv-likedomains”dev.comp.immunol.,27,55-77(2003).pmid12477501.
sanchez-corralp,gonzalez-rubioc,rodriguezdecordobas,lopez-trascasam.functionalanalysisinserumfromatypicalhemolyticuremicsyndromepatientsrevealsimpairedprotectionofhostcellsassociatedwithmutationsinfactorh.molimmunol,2004may;41(1):81-4.
schmidt.cq,herbert.ap,kavanaghd,gandyc,fentoncj,blaumbs,lyonm,uhrind,barlowpn.anewmapofglycosaminoglycanandc3bbindingsitesonfactorh.jimmunol,2008aug15;181(4):2610-9.
woutersd,brouwermc,dahamr,hackce.studiesonthehaemolyticactivityofcirculatingc1q-c3/c4complexes.molimmunol,2008apr;45(7):1893-9.epub2007dec3.
wolbinkgj,bollenj,baarsjw,tenbergerj,swaakaj,paardekooperj,hackce.applicationofamonoclonalantibodyagainstaneoepitopeonactivatedc4inanelisaforthequantificationofcomplementactivationviatheclassicalpathwayjimmunolmethods,1993jul6;163(1):67-76.
- 還沒有人留言評論。精彩留言會獲得點贊!