一種口腔鱗癌細胞株、其制備方法及應用與流程
本發明屬于生命醫學領域,具體涉及一種口腔鱗癌細胞株、其制備方法及相關應用。
背景技術:
口腔癌作為頭頸部惡性腫瘤的重要組成部分,其發生率逐年上升。口腔癌中,90%以上為口腔鱗狀細胞癌(oral squamous cell carcinoma,OSCC)。口腔鱗癌是指發生在口腔正常黏膜上皮的鱗狀細胞癌,又稱口腔黏膜細胞癌。吸煙、酗酒和刺激性飲食被認為是口腔鱗癌的主要危險因素。由于口腔位于頭頸部正中,同時又是呼吸系統和消化系統的共同起始端,該部位的惡性腫瘤往往直接影響患者的吞咽、咀嚼、呼吸、說話、美觀等重要功能。局部病灶的擴大切除術并結合預防性頸淋巴結清掃術是目前手術治療的主要方法,但這會造成患者術后呼吸、吞咽、咀嚼以及言語等相關功能完整性的破壞和減退,嚴重降低了患者術后的生活質量,且患者術后5年生存率僅50%-60%,且在淋巴結轉移的患者中則更低。近年來隨著口腔鱗癌傳統治療手段的不斷改進及腫瘤免疫治療的研究,采用化療藥物及免疫方法治療口腔鱗癌成為可能。
腫瘤細胞系在腫瘤的分子發生機制、生物標記物的尋找以及化療及靶向治療藥物開發等研究中,具有舉足輕重的作用。盡管人源性腫瘤組織來源的腫瘤細胞系,具有與人類腫瘤相似的遺傳背景和生物學特性,但是由于物種間差異存在免疫排斥,該類細胞系在正常免疫動物成瘤均不佳,在免疫缺陷動物體內的成瘤又忽略了免疫系統在腫瘤發生及發展中的作用。
人口腔癌細胞株目前存在多種,為了更好的研究口腔癌發生、發展及預后,往往使用小鼠作為動物疾病模型,研究體內環境及驗證相關的分子機制。動物疾病模型作為研究疾病的重要工具,雖然在種屬上存在某些缺陷和不足,但仍能很好的反應該疾病的發生和發展。因此,小鼠口腔癌細胞系是研究口腔癌變機理、腫瘤轉移、腫瘤放療和化療敏感性分子基礎等生物學問題的重要材料,建立和鑒定小鼠口腔癌細胞株具有重要科學意義。
在研究口腔癌發生發展機制時,往往需要用腫瘤細胞建立動物模型從體內進行驗證:裸鼠成瘤及肺轉移實驗。然而,這都忽略了免疫系統對腫瘤發生及轉移的影響;在運用這類細胞系和裸鼠動物模型篩選或研發新的治療癌癥的藥物時,忽視了免疫系統對抗癌藥物效果的影響,也忽視了抗癌藥物對免疫系統功能的影響。因此,建立一株小鼠來源的、能在正常免疫力小鼠體內成瘤的口腔癌細胞株,更能真實的反映腫瘤發生發展,對于研究口腔癌發生、發展、治療藥物及治療效果具有重要的臨床意義。
技術實現要素:
為了克服上述現有技術的不足,本發明提供了一種口腔鱗癌細胞株、其制備方法及應用。
本發明第一方面提供了一種口腔鱗癌細胞株——MAL基因敲除鼠舌鱗癌細胞系Mca-T-MAL-/-,其特征在于,該菌株已于2016年6月15日保藏于中國典型培養物保藏中心,地址:中國武漢市武漢大學,其保藏號為CCTCCNO:C2016117。所述的口腔鱗癌細胞株為采用含4-硝基喹啉-1氧化物飲水誘導小鼠,至其口腔舌部黏膜發生腫瘤,得到口腔鱗癌組織。
本發明第二方面提供了一種上述的口腔鱗癌細胞株的制備方法,其特征在于,包括以下步驟:
步驟一:采用含4-硝基喹啉-1氧化物飲水誘導小鼠,得到口腔鱗癌組織;
步驟二:將所述的口腔鱗癌組織進行原代培養,得到原代細胞;所培養的原代細胞為多邊形上皮細胞,具有典型的腫瘤細胞生物學特性,它能在體外連續長期傳代,在體外培養一年,傳至100多代,細胞仍生長增殖活躍;后采用有限稀釋法篩選出單克隆細胞,經體外傳代至50代仍生長活躍,且增殖時間,克隆形成能力,遷移能力和腫瘤細胞相關分子表達結果,提示該細胞株具有腫瘤細胞生物學特性。
步驟三:將所述的原代細胞進行純化并連續培養,并篩選細胞株,得到所述的口腔鱗癌細胞株。
所述的小鼠為MAL基因敲除C57BL/6J小鼠。
所述的步驟二中的原代培養為在所述的口腔鱗癌組織中加入胰酶,孵育后,進行貼壁培養而得到的。
所述的步驟三中,采用有限元稀釋法篩選細胞株。
所述細胞株為在原代細胞中經過單克隆法篩選出的細胞株,其在倒置光學相差顯微鏡下觀察,可見細胞呈多角形或者橢圓形,成團接觸生長,核大,胞漿豐富,細胞間連接緊密,與平皿之間貼附生長。HE染色見細胞核圓形、橢圓形或腎形,染色較淡,常位于中央,核仁明顯,常為3-4個。
所述細胞株的蛋白表達特征為:蛋白印跡實驗證實與EMT密切相關的蛋白,篩選細胞株的E-cadherin和Ki67均較原代未篩選細胞高表達,免疫組化結果同蛋白印跡結果相似,在篩選細胞株中,角蛋白CK染色強陽性,大部分細胞E-cadherin表達陽性,且免疫組織化學染色顯示其與人口腔癌細胞有著相似的蛋白譜表達。
細胞在裸鼠皮下可成瘤,裸鼠尾靜脈注射肺轉移實驗也證實該細胞株可產生肺轉移。
將裸鼠皮下所成瘤體組織修剪成極小組織塊(1-2毫米直徑)后,移植至正常免疫C57BL/6J小鼠皮下,可見瘤體生長形成腫瘤。
本發明第三方面提供了上述的口腔鱗癌細胞株在臨床化療藥物動物體內治療效果評價中的應用。
本發明第四方面提供了上述的口腔鱗癌細胞株在研發抗癌藥物中的應用。
本發明第五方面提供了口腔鱗癌細胞株在研究MAL基因功能中的應用。
本發明提供的口腔鱗癌細胞株具有典型的腫瘤細胞生物學特性,可作為研究口腔癌發生、發展及口腔癌肺轉移的細胞及動物疾病模型。可用于在細胞水平上研究口腔癌的發生、發展和轉移的機理;可作為臨床化療藥物的治療效果評價及研制和/或篩選治療口腔鱗癌藥物的工具。更有價值的是,該細胞株成瘤后瘤體組織可在正常免疫力小鼠皮下成瘤,可為研究免疫與腫瘤發生學及轉移、腫瘤的免疫治療藥物篩選和抗瘤效果驗證等生物醫學問題提供重要工具。
附圖說明:
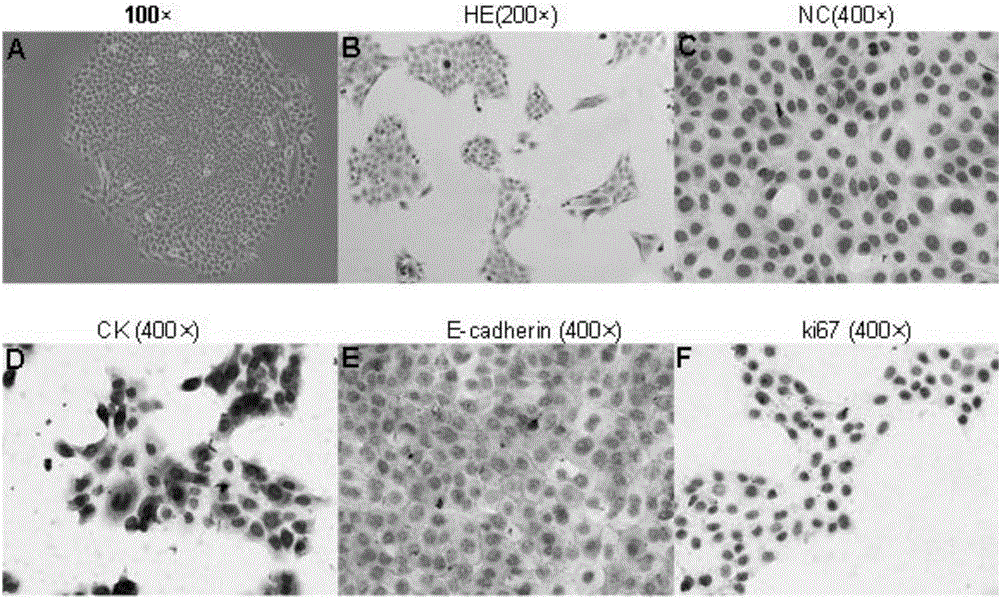
圖1為小鼠口腔鱗癌細胞株的鏡下觀及染色圖。
圖2為小鼠口腔鱗癌組織病理圖。
圖3為裸鼠皮下成瘤瘤體切片染色圖。
圖4為裸鼠肺組織轉移瘤體切片染色圖。
圖5為正常免疫小鼠皮下瘤體切片染色圖。
圖6為小鼠的腫瘤切片染色圖。
具體實施方式
下面結合具體的實施例對本發明作進一步地說明,以更好地理解本發明。
經4-硝基喹啉-1氧化物(4-nitroquinoline-1-oxide,4NQO)飲水誘導的MAL基因敲除鼠20周后,小鼠口腔舌部黏膜可見一菜花狀腫物,切取部分腫瘤組織經原代培養后建立的口腔癌細胞株,命名為MAL基因敲除小鼠舌鱗癌細胞株(MAL-/-mouse tongue cancer cell line,Mca-T-MAL-/-),保藏號為CCTCC NO:C2016117。
實施例一
該小鼠口腔癌口腔癌的細胞株,按照以下方法制備所得:
步驟一:小鼠口腔癌組織塊的獲取:用常規小鼠口腔癌誘導劑4NQO(80微克/毫升)飲水誘導MAL基因敲除小鼠20周后,編號為167#的雌性小鼠舌背部黏膜發現一菜花狀病灶,病理診斷為口腔鱗癌,見圖2,用消毒后的手術器械快速切除舌尖腫物,并以消毒小剪刀迅速解離腫瘤標本,用含1%青-鏈霉素雙抗的高糖DMEM溶液浸泡移至生物安全柜,含雙抗的消毒PBS緩沖液反復清洗組織去除粘液和紅細胞等雜質后得到剩余的組織;
步驟二:組織塊法結合胰酶消化法原代培養腫瘤細胞:將步驟一得到的剩余的組織粗切成小組織塊,用PBS緩沖液清洗,讓組織片沉淀,去除上清液,用無菌解剖刀和剪子把剩余組織再細切,用PBS清洗組織碎片數次,離心,去除上清后加1ml胰酶,在37℃孵育消化30分鐘后,離心,去胰酶,加入1ml含20%胎牛血清的高糖DMEM培養基,重懸收集的腫瘤組織塊,進行貼壁培養,過夜后加入2ml培養基,每3天換液,可得到原代腫瘤細胞;
步驟三:對步驟二得到的存活細胞進行純化,含10%胎牛血清的高糖DMEM培養基進行腫瘤細胞培養,每3天傳代一次,連續培養并傳代超過100代,細胞生長增殖仍活躍;
步驟四:有限元稀釋法篩選口腔癌細胞株:采用有限元稀釋法對步驟三中細胞篩選腫瘤細胞株,將步驟三中細胞制備成10個/ml細胞懸液后,接種至96孔板,每孔100μl進行單細胞培養,每3天換液,并成功獲取腫瘤細胞的單克隆株,該單克隆株傳代至50代,仍活躍生長,即得細胞株Mca-T-MAL-/-。
Mca-T-MAL-/-是一株C57小鼠口腔癌細胞系,來源于一只MAL基因敲除的雌性小鼠的舌部黏膜菜花狀病灶,病理診斷確定為口腔鱗癌,見圖2。
實施例二
本發明所述小鼠口腔癌細胞株Mca-T-MAL-/-的檢測鑒定
1、形態觀察
主要觀察細胞的一般形態,如大體形態、核漿比例、染色質和核仁大小、多少等,以及細胞骨架微絲微管的排列狀態等。
1.1倒置光學顯微鏡觀察
主要在正常生長狀態下觀察細胞的一般形態,如大體形態、核漿比例、粘附特性等。
倒置光學相差顯微鏡下觀察本發明所述小鼠口腔癌細胞株Mca-T-MAL-/-,可見細胞呈多角形或者橢圓形,成團接觸生長,核大,胞漿豐富,細胞間連接緊密,與平皿之間貼附生長。HE染色見細胞核圓形、橢圓形或腎形,染色較淡,常位于中央,核仁明顯,常為3-4個。見圖1。
1.2免疫組化檢測細胞標記蛋白
采用免疫組化染色,免疫組化染色試劑盒購自上海基因科技生物技術開發有限公司。所用的抗體為:Ki67、CK和E-cadherin。
具體步驟為:
步驟一:待檢測細胞株消化后制備成適宜濃度細胞懸液后,接種于消毒爬片上,過夜后,用PBS緩沖液沖洗2次,每次3-5分鐘,冷4%多聚甲醛固定15分鐘,浸泡于PBS中備用;
步驟二:取所需玻片加50μl3%過氧化氫阻斷內源性過氧化物酶,室溫下孵育15分鐘;PBS沖洗三次,每次3分鐘;
步驟三:除去PBS液,每張切片加50μl正常非免疫動物血清,室溫下孵育15分鐘;
步驟四:除去血清,每張切片加50μl的一抗,4度孵育過夜;
步驟五:PBS沖洗三次,每次3-5分鐘;除去PBS液,每張切片加50μlHRP生物素標記的二抗,室溫下孵育30分鐘;PBS沖洗三次,每次3分鐘;
步驟六:除去PBS液,每張切片加80μl新鮮配制的DAB顯色液,顯微鏡下觀察顯色,并適時中止顯色;
步驟七:自來水沖洗,蘇木素復染,PBS或自來水沖洗返藍;
步驟八:經過梯度酒精脫水干燥,二甲苯透明,中性樹膠封固。
步驟九:本發明所述小鼠口腔癌細胞株Mca-T-MAL-/-的免疫組織化學染色顯示,其與人來源的口腔癌組織有著相似的蛋白表達,證實與EMT密切相關,見圖1。
2、細胞生長增殖
檢測細胞生長曲線、倍增時間、平板克隆和細胞周期/凋亡。
2.1CCK-8法測定細胞生長增殖
步驟一:制備2×104個/ml靶細胞細胞懸液,取96孔板,每孔中加100μl細胞懸液,分1、3、5和7天四個時間點,每個時間點5個復孔,在37℃細胞培養箱中孵育過夜后,讓細胞貼壁;空白對照孔,每孔加100μl細胞培養基,不加細胞;
步驟二:分別于培養后1、3、5和7天各孔中加入10μlCCK-8,37度孵育2小時,于450nm波長下檢測OD值,從而檢測細胞增殖,結果見圖3。
2.2細胞計數法繪制細胞生長曲線
步驟一:制備2×104個/ml靶細胞細胞懸液,接種于24孔板,每孔中加1ml細胞懸液,在37℃細胞培養箱中孵育過夜后,讓細胞貼壁;分1、2、3、4、5、6和7天時間點,每組4個復孔;
步驟二:分別于培養后1、2、3、4、5、6和7天PBS清洗細胞2次,加入胰酶0.5ml消化細胞后,進行細胞計數,計算出細胞總數后,繪制出細胞生長曲線;
步驟三:本發明所述細胞株的體外倍增時間為27.95h,見圖3。
2.3平板克隆
步驟一:制備1×104個/ml靶細胞細胞懸液,接種100μl細胞懸液于含10ml培養基的10cm皿中,在37℃細胞培養箱中孵育2周,每3天換液;
步驟二:于培養2周后,用PBS清洗細胞2次,加入5ml4%多聚甲醛固定15min后,PBS清洗細胞2次;
步驟三:加入5ml1%結晶紫染色15min,流水清洗涼干后拍照,進行克隆計數,計算出克隆總數,并統計結果,見圖3;
2.4檢測細胞凋亡
細胞凋亡水平分析采用FITC/Annexin V凋亡試劑盒(BD Biosciences,USA),細胞通過Annexin V(Propidium Iodide,PI)和碘化丙啶雙染后,使用LSRⅡ型流式細胞儀檢測其凋亡水平,步驟如下:
步驟一:制備5×105個/ml靶細胞細胞懸液,按每孔接種5×105個于6孔板中,在37℃細胞培養箱中孵育過夜后,換無血清無雙抗培養基饑餓24小時,使細胞同步化,再換為血清培養基培養24小時;
步驟二:胰酶消化收集懸浮和貼壁生長細胞,預冷PBS洗2遍,1500rpm離心5min;
步驟三:棄上清,100μl的1×binding buffer重懸細胞;加入5μl Annexin V混勻后室溫孵育15分鐘;
步驟四:加入3μlPI混勻后室溫孵育5min后,加入300μl 1×binding buffer混勻,冰上避光放置30min;
步驟五:BD流式細胞儀檢測分析,發現本發明細胞株的基礎凋亡水平在6.03%左右,見圖3。
2.5檢測細胞周期
步驟一:制備5×105個/ml靶細胞細胞懸液,按每孔接種5×105個于6孔板中,在37℃細胞培養箱中孵育過夜后,換無血清無雙抗培養基饑餓24小時,使細胞同步化,再換為血清培養基培養24小時;
步驟二:胰酶消化收集細胞,預冷PBS洗2遍后用75%酒精重懸細胞,-20度固定過夜;
步驟三:將細胞1500rpm離心5min后棄乙醇,PBS洗3遍后,500μlPI/RNase Staining Buffer重懸細胞,冰上避光孵育30min;
步驟四:BD流式細胞儀檢測分析,周期結果見圖3。
實施例三
本發明所述小鼠口腔癌細胞株Mca-T-MAL-/-體內動物模型的建立
實驗選取6周BALB/C裸鼠,雌雄各半,所有動物實驗均按照上海交通大學醫學院批準的動物實驗操作準則進行。
1、裸鼠皮下成瘤
步驟一:實驗細胞分兩組,分別為本發明的細胞株Mca-T-MAL-/-和未篩選的原代小鼠口腔癌細胞;
步驟二:細胞消化計數后,用無血清無抗生素的DMEM洗2遍,用無血清無雙抗DMEM將細胞稀釋成1×107個/ml的細胞懸液,冰上保存;
步驟三:每只裸鼠選取兩個注射點,于左右大腿外側皮下注射100μl細胞懸液,左側注射本發明細胞株,右側注射未篩選的細胞株,防止懸液溢出;
步驟四:定期測量體重,并觀察瘤體大小,測量瘤體的最大徑和最小徑,腫瘤體積=最大徑×最小徑×最小徑/2;每周測量一次,至第8周腫瘤達到一定程度時終止實驗,并以腫瘤體積為縱坐標,時間為橫坐標,繪制腫瘤生長曲線;
步驟五:收集標本,中性福爾馬林固定后石蠟包埋切片,行HE染色確定腫瘤性質,見圖4。細胞體積大,核大,核仁明顯,細胞形態與細胞株相似。
2、裸鼠肺轉移實驗
步驟一:實驗細胞為本發明的細胞株;細胞消化計數后,用無血清無抗生素的DMEM洗2遍,用無血清無雙抗DMEM將細胞稀釋成5×107個/ml的細胞懸液,冰上保存備用;
步驟二:用胰島素注射器吸取混勻的細胞懸液,于裸鼠尾靜脈進行注射,每只緩慢注射200μl,注射完成后密切觀察動物狀態;
步驟三:注射后每天觀察小鼠狀態,每周稱重一次,至第15周時,動物精神萎靡且皮膚潮紅時,即可考慮終止實驗;
步驟四:收集標本,解剖分離肺組織,并觀察肺形態改變、拍照記錄,見圖5,石蠟包埋后切片,HE染色確定腫瘤性質;細胞體積大,核大,核仁明顯,細胞形態與細胞株相似。
3、免疫力正常小鼠皮下成瘤實驗
步驟一:C57小鼠麻醉后腹部移植部位備皮,將本實施例中1裸鼠皮下成瘤的瘤體組織作為對象;將腫瘤組織用消毒器械剪成大小約1mm*1mm*1mm組織,用無血清無抗生素的PBS洗2遍,冰上保存備用;
步驟二:用刀片在小鼠腹部中間切一大小約3-5mm的橫形切口,并鈍性分離皮下組織,將瘤體組織移植至小鼠皮下,使瘤體組織距離切口大于1cm,完成后緊密縫合傷口并密切觀察動物狀態;
步驟三:定期測量體重,并觀察瘤體大小,測量瘤體的最大徑和最小徑,腫瘤體積=最大徑×最小徑×最小徑/2;每周測量一次,至第6周腫瘤達一定程度時終止實驗,并以腫瘤體積為縱坐標,時間為橫坐標,繪制腫瘤生長曲線;
步驟四:收集標本,中性福爾馬林固定后石蠟包埋切片,行HE染色確定腫瘤性質,見圖6;染色形態如圖所示,細胞體積大,核大,核仁明顯,細胞形態與細胞株相似。
以上對本發明的具體實施例進行了詳細描述,但其只是作為范例,本發明并不限制于以上描述的具體實施例。對于本領域技術人員而言,任何對本發明進行的等同修改和替代也都在本發明的范疇之中。因此,在不脫離本發明的精神和范圍下所作的均等變換和修改,都應涵蓋在本發明的范圍內。
- 還沒有人留言評論。精彩留言會獲得點贊!