一種標準分子量片段混合物的制備方法及由其制備的標準分子量片段混合物與流程
本發明涉及DNA分型
技術領域:
,尤其涉及一種標準分子量片段混合物的制備方法及由其制備的標準分子量片段混合物。
背景技術:
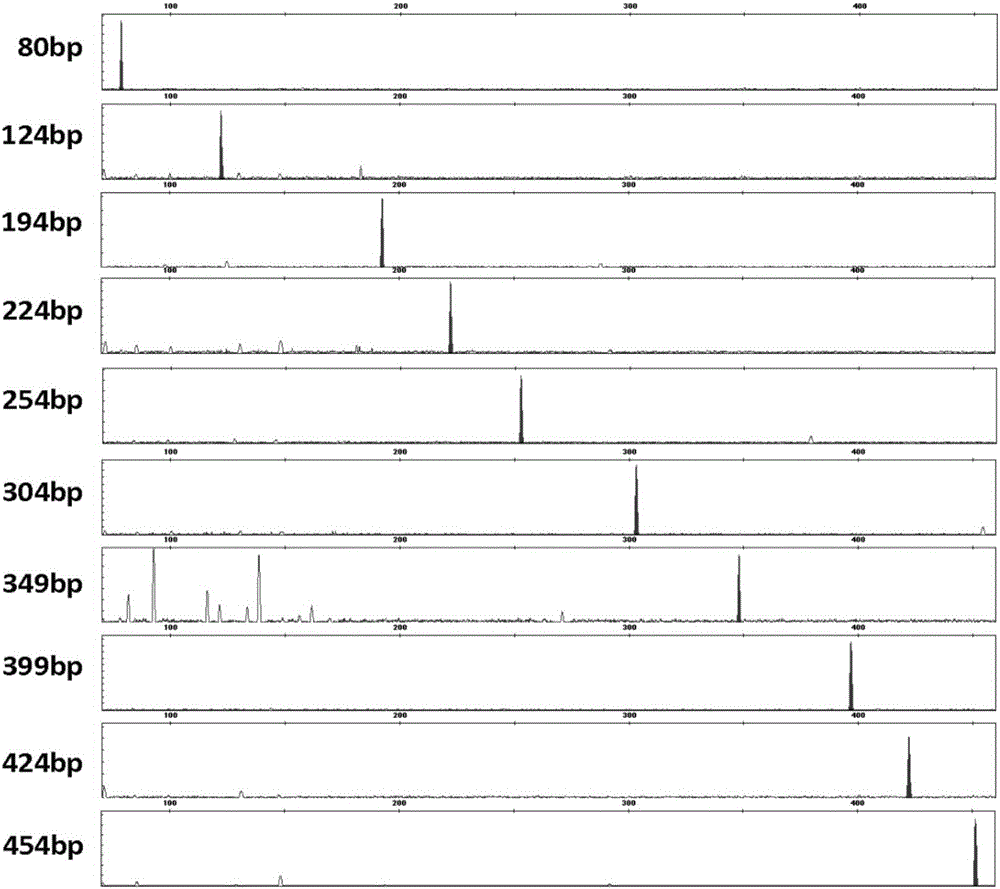
:法醫DNA分型技術自問世以來,在法醫學領域引起革命性的變革,極大地提高了執法部門根據現場證據搜集罪犯的能力。DNA遺傳標記具有不隨年齡、營養狀況或環境變化而改變等特點,利用毛細管電泳檢測DNA遺傳標記,進而確定DNA分型的方法被廣泛應用。在毛細管電泳實驗中,標準分子量片段混合物作為內標物,定量加入到待測樣品DNA中,即可根據內標物的分子量推定待分型DNA的片段大小。標準分子量片段混合物是一組帶有熒光標記的、已知分子量大小的、較純的DNA片段混合物。與傳統DNA分子量標準物(Marker)相比,首先,內標作為內對照,其本身帶有熒光標記,與待測樣品在同一毛細管中檢測,校對計算結果更加準確。其次,遺傳分析儀所用的電泳介質是毛細管電泳的流膠,分辨率可精確到1個bp,較瓊脂糖凝膠分辨率(幾十個bp)提高了幾十倍,因此其精確度也更高。利用單一DNA片段的PCR擴增雖然方法簡單,但是利用同一對引物對同一片段進行反復的PCR擴增,有時重復性差,各種PCR產物在混合時相互稀釋,有時候需要濃縮才能夠達到較好的濃度標準,需要較高的人力和資金投入。多重PCR產物的擴增的方法,即利用一對或幾對引物在同一反應管內對一個或多個模板進行擴增,獲得一組PCR產物,但是由于多重引物的相互影響,PCR效率低,重復性差,很難實現內標的大量生產。如何提供一種具有制備簡單、成本低、易于保存、實用性強、檢測靈敏、定量快速等優點的標準分子量片段混合物成為有待解決的問題。技術實現要素:本發明提供一種標準分子量片段混合物的制備方法,通過將標準分子量片段分兩步進行制備,制備過程簡單,并能顯著降低制備成本。本發明還提供了一種標準分子量片段混合物,由所述方法制備,具有易于保存、實用性強、檢測方便的特點。本發明還提供了一種試劑盒,包括所述的標準分子量片段混合物,所述試劑盒能有效的檢測DNA分子大小。本發明提供的一種標準分子量片段混合物的制備方法,其中,所述標準分子量片段混合物包括1個80bp大小的SEQIDNo.1所示片段和其余9個片段,所述9個片段的大小分別為124bp、194bp、224bp、254bp、304bp、349bp、399bp、424bp和454bp,其中,所述9個片段分兩部分進行制備,首先以pMD18-T質粒載體作為模板,利用針對以上9個片段的擴增引物對所述模板分別進行PCR擴增獲得9個片段的擴增序列,將所述擴增序列酶切后獲得9個目標片段,然后將各目標片段分別插入質粒載體獲得9個重組質粒,并將各重組質粒分別轉入宿主細胞進行增殖,之后回收各重組質粒并酶切獲得所述9個片段的第一部分,所述擴增引物為SEQIDNo.2至SEQIDNo.19所示的核苷酸序列,然后將各片段的第一部分分別與作為第二部分的帶熒光接頭連接獲得所述9個片段。在本發明的方案中,所述SEQIDNo.1可以通過人工合成獲得。SEQIDNo.1的序列為:GAGCATGTCGTGACGTCAGAATTCTCACGCTCGTCGTTTGGTATGGCTTCATTCAGCTCCGGTTCCCAACGATCAAGGCG。本發明提供的9對擴增引物及其相對應的標準分子量片段如下表1所示,PCRF代表正向引物,PCRR代表反向引物;在本發明的一個具體實施方式中,所述第一部分與所述第二部分通過粘性末端連接。在本發明的另一個具體實施方式中,插入目標片段的質粒載體為pMD18-T質粒載體,所述酶切為EcolRΙ和SalΙ雙酶酶切。在本發明的方案中,所述酶切包括對所述擴增序列的酶切,對重組質粒的酶切等。在本發明的另一個具體實施方式中,作為第二部分的帶熒光接頭由兩條互補的DNA序列構成,所述DNA序列為SEQIDNo.20和SEQIDNo.21所示的序列,所述帶熒光接頭的不互補端為EcolRΙ粘性末端,所述帶熒光接頭的另一端的一條DNA鏈末端帶有熒光標記物。例如,所述帶熒光接頭可以為:片段大小序列SEQIDNO.修飾19bpGAGCATGTCGTGACGTCAGSEQIDNo.205’熒光標記物23bpCTCGTACAGCACTGCAGTCTTAASEQIDNo.21無進一步的,所述熒光標記物位于SEQIDNo.20的5’端,所述熒光標記物為ROX。進一步的,所述宿主細胞為JM109大腸桿菌細胞。更進一步的,所述第二部分與各片段的第一部分的連接條件為:第二部分與各片段的第一部分的摩爾比為3:1,連接溫度為37℃,連接時間為30min,然后升溫至95℃,5min終止連接反應。更進一步的,將pMD18-T載體1963bp處至2391bp的序列作為模板來使用所述擴增引物進行擴增。申請人研究發現使用這段序列GC比例適中,無特殊二級結構,有利于穩定的獲得上述片段。本發明提供的一種標準分子量片段混合物,所述標準分子量片段混合物所述方法獲得。本發明還提供了一種試劑盒,含有所述的標準分子量片段混合物。本發明提供的方案具有以下突出的優點:1)本發明提供一種標準分子量片段混合物的制備方法,解決了利用單一DNA片段的PCR擴增雖然方法簡單,但是利用同一對引物對同一片段進行反復的PCR擴增,有時重復性差,各種PCR產物在混合時相互稀釋,有時候需要濃縮才能夠達到較好的濃度標準,需要較高的人力和資金投入的難題。2)同時也解決了多重PCR產物的擴增的方法,即利用一對或幾對引物在同一反應管內對一個或多個模板進行擴增,獲得一組PCR產物,但是由于多重引物的相互影響,PCR效率低,重復性差,很難實現內標的大量生產的問題。3)本發明方案將標準分子量片段分兩步進行制備,利用將所述第一部分插入質粒載體,并在宿主體內大量擴增帶有所述第一部分的重組質粒,一批次實驗制備的質粒量遠遠大于作為僅通過PCR擴增可獲得的量,僅需要人工合成較短的第二部分,使用時通過酶切重組質粒獲得大量所述第一部分與所述第二部分連接即可,后期不需要DNA聚合酶和PCR緩沖液,并且需要的設備簡單,極大地降低了制備成本。重組質粒的易保存性和穩定性,也使得標準分子量片段穩定且易重復,確保了制備的標準分子量片段不僅僅在長度上穩定,同時在堿基序列層面上也相對穩定,保證了其作為毛細管電泳時做標準分子量片段標定目標DNA分子長度的準確性。附圖說明圖1顯示了本發明的標準分子量片段混合物的毛細管電泳檢測結果;圖2顯示了9947A標準DNA以本申請制備的標準分子量片段混合物作為參照物的毛細管電泳分型結果;圖3顯示了9948標準DNA以本申請制備的標準分子量片段混合物作為參照物的毛細管電泳分型結果。具體實施方式實施例1標準分子量片段混合物的制備本實施例中使用的pMD18-T質粒載體購自Takara公司,產品目錄號6011;EcolRΙ和SalΙ酶購自Takara公司,產品目錄號分別為:EcolRΙ為1040S,SalΙ為1080S;緩沖液以及其他反應試劑也可商購獲得。本實施例中的標準分子量片段混合物包括1個80bp大小的SEQIDNo.1所示片段和其余9個片段,所述9個片段的大小分別為124bp、194bp、224bp、254bp、304bp、349bp、399bp、424bp和454bp,其中,80bp大小的SEQIDNo.1所示片段通過上海生工公司合成;所述9個片段分兩部分進行制備,首先以pMD18-T質粒載體作為模板,利用針對以上9個片段的擴增引物對所述模板分別進行PCR擴增獲得9個片段的擴增序列,將所述擴增序列酶切后獲得9個目標片段,然后將各目標片段分別插入質粒載體獲得9個重組質粒,并將各重組質粒分別轉入宿主細胞進行增殖,之后回收各重組質粒并酶切獲得所述9個片段的第一部分,所述擴增引物為SEQIDNo.2至SEQIDNo.19所示的核苷酸序列,然后將各片段的第一部分分別與作為第二部分的帶熒光接頭連接獲得所述9個片段。進一步的,插入目標片段的質粒載體為pMD18-T質粒載體,所述酶切為EcolRΙ和SalΙ雙酶酶切;所述引物序列SEQIDNo.2至SEQIDNo.19通過上海生工公司合成。使用的帶熒光接頭如下,其序列通過上海生工公司合成:9個片段的具體制備過程如下:1.利用所述擴增引物分別進行PCR獲得9個片段的擴增序列(1)50ulPCR擴增體系為:(2)PCR擴增程序:擴增結束后,配置1%瓊脂糖凝膠,每排留有14個孔,其中一個作為標記孔,其他加入PCR反應后的產物。進行電泳,吸取2μL上樣緩沖液,1μLPCR產物,電壓140V,45分鐘,觀察電泳結果,獲得9個片段的擴增序列。2.將獲得的擴增序列用EcolRΙ和SalΙ雙酶切后分別插入pMD18-T質粒載體形成重組質粒:1)對擴增序列進行雙酶切,20ul酶切體系如下:擴增序列SalIEcoRI10×H緩沖液16.4ul0.8ul0.8ul2ul酶切條件:37℃,3h;然后在95℃,10min終止酶切;獲得9個目標片段。2)對pMD18-T質粒載體進行雙酶切,100ul酶切體系如下:酶切條件:37℃,過夜;然后95℃,10min終止酶切;獲得經雙酶切的載體產物。3)將各目標片段分別和經雙酶切的載體產物進行連接,10ul連接體系如下:連接試劑盒使用從Takara公司商購獲得的DNA連接試劑盒,產品目錄號:6023。連接條件:16℃,1h;獲得插入有目標片段的9個重組質粒。3.然后將各重組質粒分別轉入宿主細胞進行擴增:1)取1管-80℃保存的感受態JM109大腸桿菌細胞(Takara公司,產品目錄號:9052),置冰上融化;2)加入上述重組質粒,輕輕旋轉離心管以混勻內容物,冰浴30min;3)將離心管置于42℃熱擊60-90秒,然后迅速置冰浴2-3分鐘,該過程不要搖動離心管;4)向每個離心管中加入500ul液體LB培養基(不含抗生素),混勻后置于37℃搖床振蕩培養45分鐘(150轉/分鐘);目的是使質粒上相關的抗性標記基因表達,使菌體復蘇;5)將離心管內容物混勻,吸取100ul已轉化的感受態細胞加到含相應抗生素的LB固體瓊脂培養基上(含50ug/ml氨芐青霉素),用無菌的彎頭玻棒輕輕將細胞均勻涂開。將平板置于室溫直至液體被吸收,倒置平板,37℃培養12-16小時,至藍、白斑區分明顯為止。6)在超凈臺內,將單個的白色菌斑挑入LB液體培養基中,一個菌落一支管,180~200轉/分鐘過夜(12~16個小時,以菌體渾濁為佳)。4.利用質粒回收試劑盒回收各重組質粒,并用EcolRΙ和SalΙ雙酶酶切來獲得所述9個片段的第一部分:其中,質粒回收試劑盒為購自天根生化科技(北京)有限公司的質粒小提試劑盒,產品目錄號:DP103。1)用1.5ml離心管收集上述6)中1-5ml菌液,12,000rpm離心1min,棄上清。2)加入250μlP1/RNaseA混合液,漩渦劇烈振蕩直至菌體完全重新懸浮,室溫靜置1-2min。3)加入250μlP2,輕柔地反復顛倒混勻5-6次。室溫放置1-2min,使菌體充分裂解,直至形成澄清的裂解溶液。4)加入350μlP3,立即輕柔地反復顛倒混勻5-6次。此時會出現白色絮狀沉淀。5)12,000rpm室溫離心10min,收集上清。6)將上清置于DNA純化柱中,靜置1-2min。7)12,000rpm離心1min,棄濾液。8)加入500μl溶液PD,12,000rpm離心1min,棄濾液。9)加入500μl溶液PW,12,000rpm離心1min,棄濾液。10)加入500μl溶液PW,12,000rpm離心1min,棄濾液。11)12,000rpm離心3min,以徹底去除純化柱中殘留的液體。12)將DNA純化柱置于新的離心管中。向純化柱中央處,懸空滴加50-100μl水,室溫放置2min。13)12,000rpm離心1min,管底為高純度重組質粒DNA,即回收的重組質粒DNA,可置于-20℃保存。14)對回收的重組質粒DNA進行酶切,100ul雙酶酶切體系如下:酶切條件:37℃恒溫培養箱中過夜進行酶切,然后升溫至95℃,10min終止酶切,獲得各片段的第一部分。5.將各片段的第一部分分別與作為第二部分的帶熒光接頭連接獲得所述9個片段:使用的連接酶同上。連接反應中第二部分與第一部分摩爾比為3:1,可以根據第二部分和第一部分的實際濃度對其添加量進行適當調整以實現上述的摩爾比,這對本領域技術人員來說是可以實現的。連接條件為:37℃,30min;然后升溫至95℃,5min終止連接反應,獲得所述9個片段。6.將制備的9個片段與所述SEQIDNo.1混合后即獲得本發明的標準分子量片段混合物,利用ABI3130XL型遺傳分析儀(AppliedBiosystems公司)進行毛細管電泳檢測,可見出峰位置正確,片段大小與預期結果一致,峰型良好,峰高基本一致,見圖1。可以看出,本申請提供的方法能通過簡單的步驟,以較低的成本,獲得所述標準分子量片段混合物。實施例2利用本申請制備的標準分子量片段混合物對已知DNA樣本進行分型。以9947A、9948標準DNA為模板,用DNATyper15試劑盒擴增反應體系進行擴增,以本申請制備的標準分子量片段混合物作為參照物,經ABI3130XL遺傳分析儀進行毛細管電泳檢測,得出9947A、9948的分型結果,見圖2和圖3。可以看出,相比于兩個標準DNA的已知分型,使用本申請制備的標準分子量片段混合物作為參照物,獲得的分型完整,結果準確,說明使用本申請制備的標準分子量片段混合物能夠用于分析毛細管電泳DNA片段大小。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1