一種雷公藤原生質體的分離及瞬時轉化方法與流程
本發明屬于植物組織培養領域,具體涉及一種雷公藤原生質體的分離及瞬時轉化方法,特別涉及一種雷公藤原生質體的分離純化方法和外源基因瞬時轉化的方法。
背景技術:
中藥雷公藤為根類藥材,來源于衛矛科植物雷公藤(Tripterygium wilfordii Hook.f.)的根或根的木質部,具有清熱解毒、祛風通絡、舒筋活血、消腫止痛、殺蟲止血等功效。雷公藤的主要活性物質為生物堿類、二萜類、三萜類、倍半萜類及糖類。具有抗炎、抗腫瘤、免疫抑制等作用,在現代臨床治療中主要應用于類風濕、抗腫瘤、腎小球疾病、系統性紅斑狼瘡等疾病。近年來,雷公藤的研究引起了國內外生物醫學和農學等領域專家的廣泛關注,但是對于雷公藤原生質體和瞬時轉化的研究尚屬空白,在一定程度上限制了雷公藤的功能基因及合成生物學等方面的深入研究。
原生質體是指沒有細胞壁包被的“裸露”植物細胞,最外層由一層質膜包圍,內含細胞質(包括基質、細胞器和后含物等)和細胞核,具有細胞全能性,可以再生細胞壁,進行連續分裂。原生質體的應用前景非常廣泛,可以用于植物的遺傳轉化研究、細胞融合研究、遺傳育種研究以及細胞膜研究等領域。
技術實現要素:
本發明的第一個目的是提供一種雷公藤原生質體的分離方法。
本發明提供的雷公藤原生質體的分離方法包括如下步驟:
1)用酶解液酶解雷公藤愈傷組織懸浮細胞,得到酶解后的雷公藤懸浮細胞;
2)收集所述酶解后的雷公藤懸浮細胞中的沉淀,即得到雷公藤原生質體;
所述酶解液包括纖維素酶、果膠酶和離析酶。
上述方法中,
所述纖維素酶、所述果膠酶和所述離析酶的質量比為4:1:1。其中,1個酶活力單位是指在特定條件(25℃,其它為最適條件)下,在1分鐘內能轉化1微摩爾底物的酶量,或是轉化底物中1微摩爾的有關基團的酶量。
上述方法中,
所述酶解液還包括甘露醇。
上述方法中,
所述甘露醇在所述酶解液中的濃度為0.3-0.7mol/L。
上述方法中,
所述酶解液由甘露醇、BSA、MES、CaCl2·2H2O、纖維素酶、果膠酶、離析酶和水組成;
所述甘露醇在所述酶解液中的濃度為0.6mol/L;
所述BSA在所述酶解液中的質量分數為0.6%;
所述MES在所述酶解液中的質量分數為0.1%;
所述CaCl2·2H2O在所述酶解液中的濃度為0.05mol/L;
所述纖維素酶在所述酶解液中的質量分數為2.0%;
所述果膠酶在所述酶解液中的質量分數為0.5%;
所述離析酶在所述酶解液中的質量分數為0.5%。
上述方法中,
所述收集為離心,所述離心的條件為(17-104)×g離心5min,所述離心的條件具體為67×g離心5min。
上述方法中,
所述酶解的時間為10h。
上述方法中,
所述雷公藤愈傷組織懸浮細胞來源于雷公藤愈傷組織。
上述方法中,
所述1)和所述2)之間還包括過濾的步驟;所述過濾為用滅菌的300目不銹鋼細胞篩過濾。
本發明的第二個目的是提供由上述方法分離得到的原生質體。
本發明的第三個目的是提供上述原生質體的新用途。
本發明提供了上述原生質體在外源基因表達中的應用。
本發明的第四個目的是提供一種外源基因表達的方法。
本發明提供的外源基因表達的方法包括如下步驟:將外源基因轉化上述原生質體中,實現外源基因的表達。
上述方法中,所述外源基因為gfp基因。
本發明的第五個目的是提供上述酶解液。
上述酶解液在原生質體分離中的應用也屬于本發明的保護范圍。
本發明提供了一種雷公藤原生質體的分離方法。本發明的雷公藤原生質體的分離方法的最佳分離條件是:酶解液配比為2.0%纖維素酶+0.5%果膠酶+0.5%離析酶;甘露醇濃度0.6mol/L,酶解時間10h,67×g轉速離心5min。通過實驗證明:用本發明的方法提取得到的原生質體經過純化后,原生質體產量為4.24×105/g FW,活力為94.5%。本發明還通過PEG4000介導轉化的方法成功將外源質粒轉化到本發明提取的原生質體中并順利表達,成功的建立了雷公藤懸浮細胞原生質體瞬時轉化體系。本發明為深入開展雷公藤的功能基因組學研究奠定了基礎,同時也為雷公藤進行基因編輯、亞細胞定位、基因過表達和干擾等研究提供了物質基礎。
附圖說明
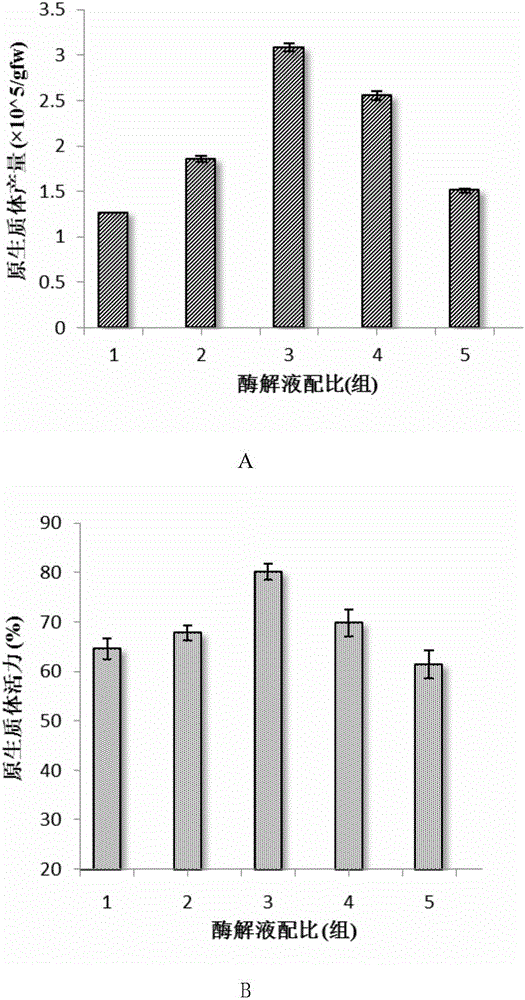
圖1為酶解液配比對原生質體產量和活力的影響。圖1A為酶解液配比對原生質體產量的影響;圖1B為酶解液配比對原生質體活力的影響。
圖2為酶解時間對原生質體產量和活力的影響。圖2A為酶解時間對原生質體產量的影響;圖2B為酶解時間對原生質體活力的影響。
圖3為甘露醇濃度對原生質體產量和活力的影響。圖3A為甘露醇濃度對原生質體產量的影響;圖3B為甘露醇濃度對原生質體活力的影響。
圖4為處理轉速對原生質體產量和活力的影響。圖4A為處理轉速對原生質體產量的影響;圖4B為處理轉速對原生質體活力的影響。
圖5為原生質體形態。圖5A為可見光下純化后的原生質體形態;圖5B為臺盼藍染色后無活力的原生質體形態。
圖6為激光共聚焦掃描顯微鏡明場下的原生質體及GFP圖片。圖6A為激光共聚焦掃描顯微鏡明場下的原生質體;圖6B為激光共聚焦掃描顯微鏡488nm激發光下原生質體的GFP熒光圖片;圖6C為激光共聚焦掃描顯微鏡488nm激發光下原生質體葉綠體自發熒光圖片;圖6D為激光共聚焦掃描顯微鏡下原生質體GFP熒光與自發熒光疊加圖片。
具體實施方式
下述實施例中所使用的實驗方法如無特殊說明,均為常規方法。
下述實施例中所用的材料、試劑等,如無特殊說明,均可從商業途徑得到。
下述實施例中的定量試驗,均設置三次重復實驗,結果取平均值。
下述實施例中所用儀器包括:離心機(SIGMA)、激光共聚焦掃描顯微鏡(VisiTech)、超凈工作臺、顯微鏡、恒溫培養振蕩器,循環水式多用真空泵、電子天平、高溫高壓滅菌鍋。
下述實施例中的W5溶液為0.125mol/L CaCl2、0.154mol/L NaCl、5mmol/L KCl、2mmol/L MES,KOH調至pH5.6,高溫高壓滅菌。
下述實施例中的MMG溶液為15mmol/L MgCl2、0.1%MES、0.4mol/L甘露醇,KOH調至pH5.6,高溫高壓滅菌。
下述實施例中的PEG溶液為40%PEG4000、0.2mol/L甘露醇、0.1mol/L CaCl2(現配現用,最多可于4℃保存五天)。
下述實施例中的WI溶液為0.5mol/L甘露醇、4mmol/L MES、20mmol/L KCl,KOH調至pH5.6,高溫高壓滅菌。
下述實施例中的試劑的購買處和產品目錄號如下:纖維素酶(R-10,YAKULT,150703-02),果膠酶(Y-23,YAKULT),離析酶(R-10,YAKULT),甘露醇(D-Mannitol,Solarbio,1126F034),牛血清白蛋白(BSA,Roche),嗎啉乙磺酸(MES,賽克林,C10035338),二水合氯化鈣(CaCl2·2H2O,國藥集團化學試劑有限公司,20130130),聚乙二醇(PEG4000,Solarbio,1226B034),氯化鈉(NaCl,北京現代東方精細化學品有限公司,20140301),氯化鉀(KCl,國藥集團化學試劑有限公司,20120925),磷酸鹽緩沖液(PBS,gibco,1760235),臺盼藍染液(北京鼎國昌盛生物技術有限責任公司,5BR00130)。
實施例1、一種雷公藤懸浮細胞原生質體的分離純化方法及其活性檢測
一、雷公藤懸浮細胞的制備
雷公藤懸浮細胞來源于愈傷組織,具有大量的細胞間隙,細胞壁易被酶解,具有生長速度快、次生代謝物積累迅速等優點,是制備原生質體的理想材料。具體制備方法如下:
1、愈傷組織的獲得
將雷公藤幼嫩枝條滅菌處理,扦插培育出無菌苗,再取無菌苗的新生葉,切成0.5cm×0.5cm左右小塊,接種在含0.5mg/L 2,4-D(北京鼎國昌盛生物技術有限公司,DH101-1)的MS瓊脂培養基(Caisson Labs,MSP22-50LT)上,25℃,暗培養誘導形成愈傷組織。
2、愈傷組織的繼代培養
選取白色有光澤、質地疏松、長勢良好的愈傷組織于0.5mg/L 2,4-D+0.1mg/L KT(北京鼎國昌盛生物技術有限公司,DH135-2)+0.5mg/L IBA(北京鼎國昌盛生物技術有限公司,II172)的MS瓊脂培養基上繼代培養,25℃,暗培養。繼代培養3代以上,選取生長良好、質地疏松、生長情況一致或相似的愈傷組織,用鑷子夾成小塊,壓碎,以每瓶1.0g的愈傷組織量轉接入含100mL 0.5mg/L 2,4-D+0.1mg/L KT+0.5mg/L IBA的MS液體培養液的250mL三角瓶中,放于搖床上,25℃,黑暗,120rpm懸浮培養,20天繼代一次,獲得雷公藤懸浮細胞。
二、原生質體的分離及其活性檢測
選取繼代培養10-12天的雷公藤懸浮細胞作為原生質體提取材料。采取不同的酶解液配比、甘露醇濃度、酶解時間及處理轉速分離雷公藤原生質體并檢測原生質體產量和活力,選出最優處理條件參數。具體步驟如下:
1、酶解液配比對原生質體產量和活力的影響
(1)酶解液的配制:將甘露醇、BSA、MES、CaCl2·2H2O、纖維素酶、果膠酶、離析酶和超純水混勻,溶質及其濃度為:0.5mol/L甘露醇、0.6%(質量分數)BSA、0.1%(質量分數)MES、0.05mol/L CaCl2·2H2O,KOH調至pH5.6,得到酶解液,根據酶解液中的纖維素酶、果膠酶、離析酶質量分數的不同,將酶解液分為如下5組:
1組:1.5%(質量分數)纖維素酶+0.3%(質量分數)果膠酶+0.5%(質量分數)離析酶;
2組:2.0%(質量分數)纖維素酶+0.3%(質量分數)果膠酶+0.5%(質量分數)離析酶;
3組:2.0%(質量分數)纖維素酶+0.5%(質量分數)果膠酶+0.5%離析酶(質量分數);
4組:2.0%纖維素酶(質量分數)+0.7%果膠酶(質量分數)+0.5%離析酶(質量分數);
5組:2.5%纖維素酶(質量分數)+0.3%果膠酶(質量分數)+0.5%離析酶(質量分數);
將上述5組不同的酶解液分別在55℃水浴鍋中活化10min,0.22μm微孔濾膜過濾除菌,待下一步試驗使用。
(2)原生質體的分離
取0.5g雷公藤懸浮細胞,吸干培養基,盡量壓碎,按照10mL/g的量分別加入步驟(1)中5組酶解液中酶解,25℃,50rpm黑暗振搖酶解12h;用滴管抽吸懸浮細胞混懸液數次,以促進原生質體的釋放;用滅過菌的300目不銹鋼細胞篩過濾,得到濾液;濾液在67×g條件下離心5分鐘,棄上清,收集原生質體。
(3)原生質體的純化
向步驟(2)中分離得到的原生質體中加入5ml W5溶液,重懸清洗原生質體,離心5分鐘,棄上清,再分別用5ml、2ml的W5溶液各洗滌一次。棄去上清液,加入1ml MMG溶液重懸,即可獲得純化的原生質體。
(4)原生質體的產量和活力檢測
原生質體的產量的檢測方法為:用MMG溶液將步驟(3)獲得的純化的原生質體稀釋5倍,將稀釋的原生質體懸浮液滴在血球計數板上。待原生質體將計數室充滿,在顯微鏡下觀察并計數(四個大格中的原生質體數目)。每個樣品重復計數三次。
每克雷公藤懸浮細胞原生質體產量(個/g FW)計算公式:{原生質體總個數/(4×材料質量)}×稀釋倍數×104。
原生質體的活力的檢測方法(采用臺盼藍染色法):用MMG溶液將步驟(3)獲得的純化的原生質體稀釋5倍,將配好的臺盼藍染液(北京鼎國昌盛生物技術有限責任公司,5BR00130),按體積比1:10加入到稀釋后的原生質體懸浮液中染色,選取4個有代表性的視野進行統計。原生質體活力的計算方法為:未被臺盼藍染色的原生質體占該視野下原生質體總數的百分比。
將得到的原生質體進行產量和活力檢測,結果如圖1A和圖1B。比較1、2、5組,三組的纖維素酶濃度依次增加,其中第二組的原生質體產量和活力最高,分別可以達到1.86×105/g FW和67.8%。纖維素酶濃度過低不能充分解離細胞壁,而纖維素濃度過高則會使細胞膜破裂,影響原生質體活性,故纖維素的最佳濃度為2.0%;比較2、3、4組,三組的果膠酶濃度依次增加,結果顯示第四組產量和活力最高,分別可以達到3.08×105/g FW和80.15%,與其他組存在顯著性差異,故果膠酶的最佳濃度為0.5%。綜上,雷公藤懸浮細胞原生質體分離的最佳酶液配比為2.0%纖維素酶+0.5%果膠酶+0.5%離析酶。
2、酶解時間比對原生質體產量和活力的影響
(1)酶解液的配制:將甘露醇、BSA、MES、CaCl2·2H2O、纖維素酶、果膠酶、離析酶和超純水混勻,溶質及其濃度分別為:0.5mol/L甘露醇、0.6%(質量分數)BSA、0.1%(質量分數)MES、0.05mol/L CaCl2·2H2O、2.0%(質量分數)纖維素酶、0.5%(質量分數)果膠酶、0.5%(質量分數)離析酶,KOH調至pH5.6,得到酶解液。將上述酶解液在55℃水浴鍋中活化10min,0.22μm微孔濾膜過濾除菌,待下一步試驗使用。
(2)原生質體的分離
取0.5g雷公藤懸浮細胞,吸干培養基,盡量壓碎,按照10mL/g的量分別加入步驟(1)中的酶解液中酶解,25℃,50rpm黑暗振搖分別酶解6h、8h、10h、12h、14h和16h;用滴管抽吸懸浮細胞混懸液數次,以促進原生質體的釋放;用滅過菌的300目不銹鋼細胞篩過濾,得到濾液;濾液在67×g條件下離心5分鐘,棄上清,分別收集原生質體。
(3)原生質體的純化
分別向步驟(2)中分離得到的原生質體中加入5ml W5溶液,重懸清洗原生質體,離心5分鐘,棄上清,再分別用5ml、2ml的W5溶液各洗滌一次。棄去上清液,加入1ml MMG溶液重懸,即可獲得純化的原生質體。
(4)原生質體的產量和活力檢測
檢測方法同步驟1中的(4)。
將得到的原生質體進行產量和活力檢測,結果見圖2A和圖2B。從圖中可以看出:隨酶解時間的增加,原生質體的產量隨之提高,但原生質體的活力在10h時最高,達82.2%。酶解時間過短不能使原生質體完全分離出來,提取效率低,而酶解時間過長,細胞壓力過大,容易破碎,鏡下檢測死細胞和碎片增多,活細胞所占比例小,不利于后續實驗的開展。因此,10h為雷公藤能懸浮細胞原生質體的最佳酶解時間。
3、甘露醇濃度比對原生質體產量和活力的影響
(1)酶解液的配制:將甘露醇、BSA、MES、CaCl2·2H2O、纖維素酶、果膠酶、離析酶和超純水混勻,溶質及其濃度分別為:0.6%(質量分數)BSA、0.1%(質量分數)MES、0.05mol/L CaCl2·2H2O、2.0%(質量分數)纖維素酶、0.5%(質量分數)果膠酶、0.5%(質量分數)離析酶,KOH調至pH5.6,得到酶解液,根據酶解液中甘露醇濃度的不同分為如下5組:
1組:0.3mol/L甘露醇;
2組:0.4mol/L甘露醇;
3組:0.5mol/L甘露醇;
4組:0.5mol/L甘露醇;
5組:0.7mol/L甘露醇;
將上述酶解液分別在55℃水浴鍋中活化10min,0.22μm微孔濾膜過濾除菌,待下一步試驗使用。
(2)原生質體的分離
取0.5g雷公藤懸浮細胞,吸干培養基,盡量壓碎,按照10mL/g的量分別加入步驟(1)中5組酶解液中酶解,25℃,50rpm黑暗振搖酶解12h;用滴管抽吸懸浮細胞混懸液數次,以促進原生質體的釋放;用滅過菌的300目不銹鋼細胞篩過濾,得到濾液;濾液在67×g條件下離心5分鐘,棄上清,收集原生質體。
(3)原生質體的純化
向步驟(2)中分離得到的原生質體中加入5ml W5溶液,重懸清洗原生質體,離心5分鐘,棄上清,再分別用5ml、2ml的W5溶液各洗滌一次。棄去上清液,加入1ml MMG溶液重懸,即可獲得純化的原生質體。
(4)原生質體的產量和活力檢測
檢測方法同步驟1中的(4)。
將得到的原生質體進行產量和活力檢測,結果見3A和圖3B。由圖可見,當甘露醇濃度為0.5mol/L時原生質體產量最高,而此時活力卻不是最高的,當甘露醇濃度為0.6mol/L時雖然產量比0.5mol/L稍低,但此時原生質體活力最高。溶液滲透壓低于原生質體的滲透壓會導致細胞脹破死亡;當甘露醇濃度過高時原生質體失水皺縮,且不利于原生質體的釋放。雖然0.5mol/L與0.6mol/L兩個處理組中存活的原生質體總數相近,但由于具存活的原生質體才能進行瞬時轉化,相較而言,甘露醇濃度為0.6mol/L是更有利于下一步實驗的開展。所以,分離原生質體的最佳甘露醇濃度為0.6mol/L。
4、處理轉速對原生質體產量和活力的影響
(1)酶解液的配制:將甘露醇、BSA、MES、CaCl2·2H2O、纖維素酶、果膠酶、離析酶和超純水混勻,溶質及其濃度分別為:0.5mol/L甘露醇、0.6%(質量分數)BSA、0.1%(質量分數)MES、0.05mol/L CaCl2·2H2O、2.0%(質量分數)纖維素酶、0.5%(質量分數)果膠酶、0.5%(質量分數)離析酶,KOH調至pH5.6,得到酶解液。將上述酶解液在55℃水浴鍋中活化10min,0.22μm微孔濾膜過濾除菌,待下一步試驗使用。
(2)原生質體的分離
取0.5g雷公藤懸浮細胞,吸干培養基,盡量壓碎,按照10mL/g的量分別加入步驟(1)中的酶解液中酶解,25℃,50rpm黑暗振搖酶解12h;用滴管抽吸懸浮細胞混懸液數次,以促進原生質體的釋放;用滅過菌的300目不銹鋼細胞篩過濾,得到濾液;將濾液在不同處理轉速:17×g、37×g、67×g、104×g條件下離心5分鐘,棄上清,分別收集原生質體。
(3)原生質體的純化
分別向步驟(2)中分離得到的原生質體中加入5ml W5溶液,重懸清洗原生質體,離心5分鐘,棄上清,再分別用5ml、2ml的W5溶液各洗滌一次。棄去上清液,加入1ml MMG溶液重懸,即可獲得純化的原生質體。
(4)原生質體的產量和活力檢測
檢測方法同步驟1中的(4)。
將得到的原生質體進行產量和活力檢測,結果見圖4A和圖4B。比較四組數據,當轉速為67×g時產量可以達到2.17×105g/FW;活力最高可達78.4%,產量和活力均為最高水平。當轉速過低時不利于原生質體的沉降,碎片和原生質體不能得到有效分離;當轉速過高時,會對原生質體造成機械損傷,同樣不利于原生質體的分離純化。綜上,分離純化原生質體的最佳轉速為67×g。
三、原生質體分離純化方法的有效性驗證
1、酶解液的配制:將甘露醇、BSA、MES、CaCl2·2H2O、纖維素酶、果膠酶、離析酶和超純水混勻,溶質及其濃度分別為:0.6mol/L甘露醇、0.6%(質量分數)BSA、0.1%(質量分數)MES、0.05mol/L CaCl2·2H2O、2.0%(質量分數)纖維素酶、0.5%(質量分數)果膠酶、0.5%(質量分數)離析酶,KOH調至pH5.6,得到酶解液。將上述酶解液在55℃水浴鍋中活化10min,0.22μm微孔濾膜過濾除菌,待下一步試驗使用。
2、原生質體的分離
取0.5g雷公藤懸浮細胞,吸干培養基,盡量壓碎,按照10mL/g的量加入步驟1中的酶解液中酶解,25℃,50rpm黑暗振搖酶解10h;用滴管抽吸懸浮細胞混懸液數次,以促進原生質體的釋放;用滅過菌的300目不銹鋼細胞篩過濾,得到濾液;濾液在67×g條件下離心5分鐘,棄上清,收集原生質體。
3、原生質體的純化
向步驟2中分離得到的原生質體中加入5ml W5溶液,重懸清洗原生質體,離心5分鐘,棄上清,再分別用5ml、2ml的W5溶液各洗滌一次。棄去上清液,加入1ml MMG溶液重懸,即可獲得純化的原生質體。
4、原生質體的產量和活力檢測
檢測方法同步驟二的1中的(4)。
獲得的原生質體產量高達4.24×105/g FW,活力可達94.5%,原生質體形態及臺盼藍染色后的原生質體形態見圖5A和圖5B。
實施例2、雷公藤懸浮細胞原生質體在外源基因瞬時轉化表達中的應用
利用PEG介導轉化法對雷公藤懸浮細胞原生質體的瞬時轉化進行了研究,具體步驟如下:
1、將實施例一的步驟三中獲得的純化的原生質體的濃度調到約為5×105個/mL,得到原生質體溶液;
2、將200μl的原生質體溶液、20μg的E3025質粒(E3025質粒自帶GFP編碼序列,E3025質粒的核苷酸序列如序列1所示)和220μL PEG溶液輕敲混勻,得到轉化混合物,在黑暗條件下誘導轉化混合物20min,得到轉化混合液;
3、室溫下用880μL W5溶液稀釋轉化混合液,然后輕柔顛倒搖動離心管使之混合完好以終止轉化反應。67×g離心2min,收集沉淀,去上清;
4、用W5溶液重復清洗步驟3收集的沉淀一次,收集沉淀,去上清;
5、用1mL WI溶液輕柔重懸步驟4收集的沉淀于多孔組織培養皿中,25℃黑暗靜置培養。
6、18h后取出,67×g離心2min,去掉部分上清,對其進行濃縮,取適量制片,激光共聚焦掃描顯微鏡下觀察GFP表達情況。
結果如圖6A、圖6B、圖6C和圖6D。由于原生質體來源于黑暗培養的雷公藤懸浮細胞,因此其細胞中不含葉綠素,激光共聚焦掃描顯微鏡488nm激發光下只能觀察到GFP綠色熒光,證明編碼GFP的E3025質粒成功轉化到原生質體中,并順利表達,雷公藤懸浮細胞原生質體瞬時轉化體系成功建立。
序列表
<110>首都醫科大學
<120>一種雷公藤原生質體的分離及瞬時轉化方法
<160>1
<210>1
<211>4612bp
<212>DNA
<213>人工序列
<220>
<223>
<400>1
tcgcgcgttt cggtgatgac ggtgaaaacc tctgacacat gcagctcccg gagacggtca 60
cagcttgtct gtaagcggat gccgggagca gacaagcccg tcagggcgcg tcagcgggtg 120
ttggcgggtg tcggggctgg cttaactatg cggcatcaga gcagattgta ctgagagtgc 180
accatatgcg gtgtgaaata ccgcacagat gcgtaaggag aaaataccgc atcaggcgcc 240
attcgccatt caggctgcgc aactgttggg aagggcgatc ggtgcgggcc tcttcgctat 300
tacgccagct ggcgaaaggg ggatgtgctg caaggcgatt aagttgggta acgccagggt 360
tttcccagtc acgacgttgt aaaacgacgg ccagtgccac ccataatacc cataatagct 420
gtttgccaac cggtcaacat gtggagcacg acacacttgt ctactccaaa aatatcaaag 480
atacagtctc agaagaccaa agggcaattg agacttttca acaaagggta atatccggaa 540
acctcctcgg attccattgc ccagctatct gtcactttat tgtgaagata gtggaaaagg 600
aaggtggctc ctacaaatgc catcattgcg ataaaggaaa ggccatcgtt gaagatgcct 660
ctgccgacag tggtcccaaa gatggacccc cacccacgag gagcatcgtg gaaaaagaag 720
acgttccaac cacgtcttca aagcaagtgg attgatgtga taacatggtg gagcacgaca 780
cacttgtcta ctccaaaaat atcaaagata cagtctcaga agaccaaagg gcaattgaga 840
cttttcaaca aagggtaata tccggaaacc tcctcggatt ccattgccca gctatctgtc 900
actttattgt gaagatagtg gaaaaggaag gtggctccta caaatgccat cattgcgata 960
aaggaaaggc catcgttgaa gatgcctctg ccgacagtgg tcccaaagat ggacccccac 1020
ccacgaggag catcgtggaa aaagaagacg ttccaaccac gtcttcaaag caagtggatt 1080
gatgtgatat ctccactgac gtaagggatg acgcacaatc ccactatcct tcgcaagacc 1140
cttcctctat ataaggaagt tcatttcatt tggagaggac gtcgagagtt ctcaacacaa 1200
catatacaaa acaaacgaat ctcaagcaat caagcattct acttctattg cagcaattta 1260
aatcatttct tttaaagcaa aagcaatttt ctgaaaattt tcaccattta cgaacgatag 1320
ccatggtccg gactcagatc tcgagctcaa gcttcgaatt ctgcagtcga cggtaccgcg 1380
ggcccgggat ggtagatctg actagtaaag gagaagaact tttcactgga gttgtcccaa 1440
ttcttgttga attagatggt gatgttaatg ggcacaaatt ttctgtcagt ggagagggtg 1500
aaggtgatgc aacatacgga aaacttaccc ttaaatttat ttgcactact ggaaaactac 1560
ctgttccgtg gccaacactt gtcactactt tctcttatgg tgttcaatgc ttttcaagat 1620
acccagatca tatgaagcgg cacgacttct tcaagagcgc catgcctgag ggatacgtgc 1680
aggagaggac catcttcttc aaggacgacg ggaactacaa gacacgtgct gaagtcaagt 1740
ttgagggaga caccctcgtc aacaggatcg agcttaaggg aatcgatttc aaggaggacg 1800
gaaacatcct cggccacaag ttggaataca actacaactc ccacaacgta tacatcatgg 1860
ccgacaagca aaagaacggc atcaaagcca acttcaagac ccgccacaac atcgaagacg 1920
gcggcgtgca actcgctgat cattatcaac aaaatactcc aattggcgat ggccctgtcc 1980
ttttaccaga caaccattac ctgtccacac aatctgccct ttcgaaagat cccaacgaaa 2040
agagagacca catggtcctt cttgagtttg taacagctgc tgggattaca catggcatgg 2100
atgaactata caaagctagc cactaatcta gagtccgcaa aaatcaccag tctctctcta 2160
caaatctatc tctctctatt tttctccaga ataatgtgtg agtagttccc agataaggga 2220
attagggttc ttatagggtt tcgctcatgt gttgagcata taagaaaccc ttagtatgta 2280
tttgtatttg taaaatactt ctatcaataa aatttctaat tcctaaaacc aaaatccagt 2340
gacgcggccg cacccataat acccataata gctgtttgcc agtaatcatg gtcatagctg 2400
tttcctgtgt gaaattgtta tccgctcaca attccacaca acatacgagc cggaagcata 2460
aagtgtaaag cctggggtgc ctaatgagtg agctaactca cattaattgc gttgcgctca 2520
ctgcccgctt tccagtcggg aaacctgtcg tgccagctgc attaatgaat cggccaacgc 2580
gcggggagag gcggtttgcg tattgggcgc tcttccgctt cctcgctcac tgactcgctg 2640
cgctcggtcg ttcggctgcg gcgagcggta tcagctcact caaaggcggt aatacggtta 2700
tccacagaat caggggataa cgcaggaaag aacatgtgag caaaaggcca gcaaaaggcc 2760
aggaaccgta aaaaggccgc gttgctggcg tttttccata ggctccgccc ccctgacgag 2820
catcacaaaa atcgacgctc aagtcagagg tggcgaaacc cgacaggact ataaagatac 2880
caggcgtttc cccctggaag ctccctcgtg cgctctcctg ttccgaccct gccgcttacc 2940
ggatacctgt ccgcctttct cccttcggga agcgtggcgc tttctcaatg ctcacgctgt 3000
aggtatctca gttcggtgta ggtcgttcgc tccaagctgg gctgtgtgca cgaacccccc 3060
gttcagcccg accgctgcgc cttatccggt aactatcgtc ttgagtccaa cccggtaaga 3120
cacgacttat cgccactggc agcagccact ggtaacagga ttagcagagc gaggtatgta 3180
ggcggtgcta cagagttctt gaagtggtgg cctaactacg gctacactag aaggacagta 3240
tttggtatct gcgctctgct gaagccagtt accttcggaa aaagagttgg tagctcttga 3300
tccggcaaac aaaccaccgc tggtagcggt ggtttttttg tttgcaagca gcagattacg 3360
cgcagaaaaa aaggatctca agaagatcct ttgatctttt ctacggggtc tgacgctcag 3420
tggaacgaaa actcacgtta agggattttg gtcatgagat tatcaaaaag gatcttcacc 3480
tagatccttt taaattaaaa atgaagtttt aaatcaatct aaagtatata tgagtaaact 3540
tggtctgaca gttaccaatg cttaatcagt gaggcaccta tctcagcgat ctgtctattt 3600
cgttcatcca tagttgcctg actccccgtc gtgtagataa ctacgatacg ggagggctta 3660
ccatctggcc ccagtgctgc aatgataccg cgagacccac gctcaccggc tccagattta 3720
tcagcaataa accagccagc cggaagggcc gagcgcagaa gtggtcctgc aactttatcc 3780
gcctccatcc agtctattaa ttgttgccgg gaagctagag taagtagttc gccagttaat 3840
agtttgcgca acgttgttgc cattgctaca ggcatcgtgg tgtcacgctc gtcgtttggt 3900
atggcttcat tcagctccgg ttcccaacga tcaaggcgag ttacatgatc ccccatgttg 3960
tgcaaaaaag cggttagctc cttcggtcct ccgatcgttg tcagaagtaa gttggccgca 4020
gtgttatcac tcatggttat ggcagcactg cataattctc ttactgtcat gccatccgta 4080
agatgctttt ctgtgactgg tgagtactca accaagtcat tctgagaata gtgtatgcgg 4140
cgaccgagtt gctcttgccc ggcgtcaata cgggataata ccgcgccaca tagcagaact 4200
ttaaaagtgc tcatcattgg aaaacgttct tcggggcgaa aactctcaag gatcttaccg 4260
ctgttgagat ccagttcgat gtaacccact cgtgcaccca actgatcttc agcatctttt 4320
actttcacca gcgtttctgg gtgagcaaaa acaggaaggc aaaatgccgc aaaaaaggga 4380
ataagggcga cacggaaatg ttgaatactc atactcttcc tttttcaata ttattgaagc 4440
atttatcagg gttattgtct catgagcgga tacatatttg aatgtattta gaaaaataaa 4500
caaatagggg ttccgcgcac atttccccga aaagtgccac ctgacgtcta agaaaccatt 4560
attatcatga cattaaccta taaaaatagg cgtatcacga ggccctttcg tc 4612
- 還沒有人留言評論。精彩留言會獲得點贊!