一種采用畢赤酵母制備白藜蘆醇二聚體的方法與流程
本發明涉及基因工程和微生物發酵技術領域,特別涉及一種采用畢赤酵母制備白藜蘆醇二聚體提取物的方法。
背景技術:
白藜蘆醇二聚體(viniferins)是白藜蘆醇被4-羥基芪過氧化物酶(4-trihydroxy-trans-stilbene)氧化所形成的;是植物在惡劣環境中或遭到病原體侵染時所分泌的植物抗毒素;比白藜蘆醇具有更強的抗氧化性能,能夠有效清除和抑制自由基的產生,同時還能抑制脂質過氧化和DNA損失;可改善血小板的活性達到舒緩過敏癥狀和抗炎的作用。
白藜蘆醇二聚體存在于葡萄葉表皮、漿果果皮和葡萄籽中,含量極低。雖然采取如紫外線照射、真菌感染、機械損傷等方法會刺激白藜蘆醇二聚體的合成,但效果不佳。當前對白藜蘆醇二聚體的制備方法主要是化學全合成法,有研究應用1,1-二苯基-2-三硝基苯肼(DPPH)處理白藜蘆醇,合成白藜蘆醇二聚體,產量為15%,缺點是合成產率低,應用大量強刺激性、有毒的DPPH,危險性高、環境負荷重;有研究應用FeCl3處理白藜蘆醇,得到白藜蘆醇二聚體,產量為2.7%,缺點是重金屬富集,難以直接應用;有研究應用白藜蘆醇化學氧化聚合產生白藜蘆醇二聚體,缺點是工藝復雜,副產物多,且反應方向不可控。
目前國內外尚未有應用畢赤酵母制備白藜蘆醇二聚體的方法,也未有應用畢赤酵母表達4-羥基芪過氧化物酶蛋白的相關報道。
技術實現要素:
本發明的目的在于提供一種采用畢赤酵母制備白藜蘆醇二聚體的方法,以解決當前白藜蘆醇二聚體產量低、工藝復雜、反應方向不可控、環境負荷重的問題。
為解決上述技術問題,本發明采用以下技術方案:一種采用畢赤酵母制備白藜蘆醇二聚體的方法,其特征在于包括如下步驟:
1)含4-羥基芪過氧化物酶基因的pPU19質粒載體的構建:分別應用限制性內切酶EcoP1和EcoP15酶切4-羥基芪過氧化物酶基因片段和pPU19質粒,得到酶切后的4-羥基芪過氧化物酶基因片段4TTS(+)和pPU19質粒基因片段pPU19(+);采用T4連接酶將上述酶切產物進行連接,得到重組質粒pPU19-4TTS,然后通過PCR技術擴增以pPU19質粒DNA為PCR擴增模板的4-羥基芪過氧化物酶基因,得PCR擴增后的重組質粒表達載體pPU19-4TTS;所述4-羥基芪過氧化物酶基因片段4TTS(+)的基因序列為:
GAAGAGCTGTCGACAGTCGCATGCCAGCTAAATTAAGAAAACCTTCACTTGCTTCAAGTAAAGCATGTCGATCCTTCAACGAATTCTATATCACTTGGATGGAAAACTAAGTGTTCAGTATTTCACAGGTGACAAACCAGACAAGAAGCGTACATTCATTTGACCGAAGAAGCTTGAGGAGCACCCAAACATGGTGCTTATATGGCTCCATCTCTTAACACGCCAAGAGATCAC;
2)通過熱激法將PCR擴增后的重組質粒表達載體pPU19-4TTS轉入保藏編號為638632的Komagataella pastoris DSMZ 70382畢赤酵母菌株中,獲得表達4-羥基芪過氧化物酶的畢赤酵母,命名為Pichia pastoris\pPU19\4TTS,其核苷酸序列:
TCGCTGGTAATCCCGGCTTTTGCTGCTTACAAGCTTTACGGATTATTTCTAGGAGGTAGNCAATTATTGGGTGGTCGCAGCAGTTTCAAAGAGGAGGAGCCAGCTTCTGGGTCAAAAGAAAAGGGACAGAGCAAGAGACAACAGAAACTAGAAAAGAGAGGACAAAAGGTGAGATACAGATAGAATCTTTGCGAGTGAACCAAGGTAGCTGAAAAACATAACTTGCAAGGATGCTATTGGACAATTTTAGGTGATAAACTCGATTGCTATCACTGGGCTCTGCCACATGGAAGCTTTAGTGAGAAGAGCTGTCGACAGTCGCATGCCAGCTAAATTAAGAAAACCTTCACTTGCTTCAAGTAAAGCATGTCGATCCTTCAACGAATTCTATATCACTTGGATGGAAAACTAAGTGTTCAGTATTTCACAGGTGACAAACCAGACAAGAAGCGTACATTCATTTGACCGAAGAAGCTTGAGGAGCACCCAAACATGGTGCTTATATGGCTCCATCTCTTAACACGCCAAGAGATCACAGCTCTTGCGCACTATTCGAGTCGTTTACTTTTTTTTTGGTTTTTGCTAGGCCTTCCATTACTTCTTTACTTCGTTAGTGACAAGTGACTTAAGGCCAATGTATTCTTGAATCAAAAGAAGGCTGTGTCAATTCCTAAGCCCTACTAGCTCTACTTTCGGAGTGACCTACCGATAAGTTCGCATACGCGAATCTGGACCATTTTTATAATACCAAGTAGAAATTCAATAGCCATCTAGCTGTTTCTACATGATGACAGCCCATAACCATAAAGAAAACTGCAAACGATTGCTGAGCTTGTAGAGCGTCCAGTAAGTAGCGCAATCTCCAGTGAGCAACGTAATATCATATTTTCTTCTCTCTCTTTCATTCTCCTCCGAGAATTACAGAAGCATCATAGTAGTGTACCCACCAATGGTTGTGAGCGACTGCGCGATTCCATGGATGCTACTGAAACCAATGAATGAAACTTGTCAAGTTTCCTCGCTTCCTTTTACATAACGGATCTTTTAACTTAGAAACAGTTTAGTAAAAGAAATTCATCAATACAATGGACGGAGGTAAGTCAGCTCTTTCAGCAAGGGAGCATGGAATCAGATTGGCAACGACTTCTGCGATTCTTATTCTTCCGATTGATTCAACAGTAGATTTGCGAGTGGTTGGCCAAACACACAGTTTCGATGCGATCTCCGTTTGATTTGTATGAATACGCAGTCATCTCATTGGTGGAGCATTTTATACGGATTGATTGAGTGGAAGCATGGTACTGAGAGTATCTACATGTGCATTTCTGTTGGTTGTCCTCGGTTGAGTTTTCGTATCTGTTTGTCCCCCCAATTTTGTCCACTCCTTTTGGCAATCTGCCGAATCCAAGCTCATAATACTAACTCCCATTTTAGAAGACGTTGCAGCAGTAAGTACCCTTACATGTAATCCATGAAAGCAAATGTGGCGCAGTCAATCGAAGTCACTGTCTGATTGATTCTTCCCTCAGTGGCGGT;
3)對步驟(2)得到的Pichia pastoris\pPU19\4TTS菌株通過劃線和繼代培養,經初篩、復篩,進行液培發酵,選取代謝產物含量高或是活性高的菌液劃線于固體篩選培養基上,分離純化,得到復篩菌種;
4)制備含白藜蘆醇二聚體的發酵產物:配置含有15-20g/L的白藜蘆醇的LB發酵培養基,從平板上挑取Pichia pastoris\pPU19\4TTS單菌落于LB培養基的搖瓶中,發酵,得到含白藜蘆醇二聚體的發酵產物;
5)白藜蘆醇二聚體的分離:將步驟(4)所述含白藜蘆醇二聚體的發酵產物液體經樹脂純化,得固型物即為白藜蘆醇二聚體提取物。
進一步地,步驟(3)中液培發酵的條件為:發酵溫度37℃,振蕩速度160r/min,pH為7,發酵時間24h。
步驟(4)中搖瓶發酵的條件為:溫度為31-35℃,振蕩速度180-220r/min,起始pH控制在6-8,發酵時間控制在32-40h。
步驟(5)中白藜蘆醇二聚體的分離方法具體為:將步驟4)所述含白藜蘆醇二聚體的發酵產物液體經H103型大孔樹脂富集純化,柱內徑4mm,高度1m,裝柱體積為2L,上樣液的質量濃度為0.7-0.8mg/mL,上樣流速為2-4BV/h,先用3-5倍柱體積的蒸餾水洗滌,然后用8BV 75%的乙醇水溶液洗脫,回收乙醇水溶液洗出液,使用旋轉蒸發儀去除乙醇,得固型物即為白藜蘆醇二聚體提取物。
本發明保藏號為638632的Komagataella pastoris DSMZ 70382畢赤酵母菌株保藏于NCBI(美國國立生物技術信息中心)。4-羥基芪過氧化物酶購于上海信裕生物科技有限公司;pPU19質粒購于澳大利亞pCambia公司;限制性內切酶EcoP1和EcoP15酶購于上海斯泰爾生物科技有限公司;T4連接酶購于Thermo Fisher Scientific;液培發酵設備購于南京潤澤生物工程設備有限公司,型號RZY-XGX;固體篩選培養基購于上海哈靈生物科技有限公司;LB培養基購于Sigma Aldrich;白藜蘆醇購買于帝斯曼(中國)有限公司;H103型大孔樹脂購于天津浩聚樹脂;旋轉蒸發儀為德國艾卡RV10型旋轉蒸發儀。
本發明首次在畢赤酵母表達系統中分泌表達了4-羥基芪過氧化物酶,成功將影響白藜蘆醇二聚體生成的4-羥基芪過氧化物酶導入Komagataella pastoris DSMZ 70382畢赤酵母,獲得能夠表達4-羥基芪過氧化物酶的重組畢赤酵母。
本發明首次應用畢赤酵母,通過基因工程法將能夠產生白藜蘆醇二聚體的關鍵性4-羥基芪過氧化物酶基因導入畢赤酵母,篩選獲得一種高通量表達4-羥基芪過氧化物酶畢赤酵母菌種。選擇畢赤酵母是因為畢赤酵母基因表達系統為真核表達系統,且具有調控機理嚴格的醇氧化酶AOX基因啟動子;表達水平高,即可在胞內表達,又可以進行分泌型表達;且發酵工藝成熟,易工業化生產;培養成本低,產物容易分離;外援蛋白基因遺傳穩定,不易丟失。微生物發酵法制備白藜蘆醇二聚體,選用的方法綠色環保、不受氣候影響、成本低、產物可控,且適宜工業化生產。
經本發明方法分離得到的白藜蘆醇二聚體純度為45-60%,其中白藜蘆醇轉化白藜蘆醇二聚體的轉化率為35%-45%。遠遠高于當前文獻報道值,且操作工藝簡單,選用的方法綠色環保、不受氣候影響、成本低、產物可控,且適宜工業化生產。
附圖說明
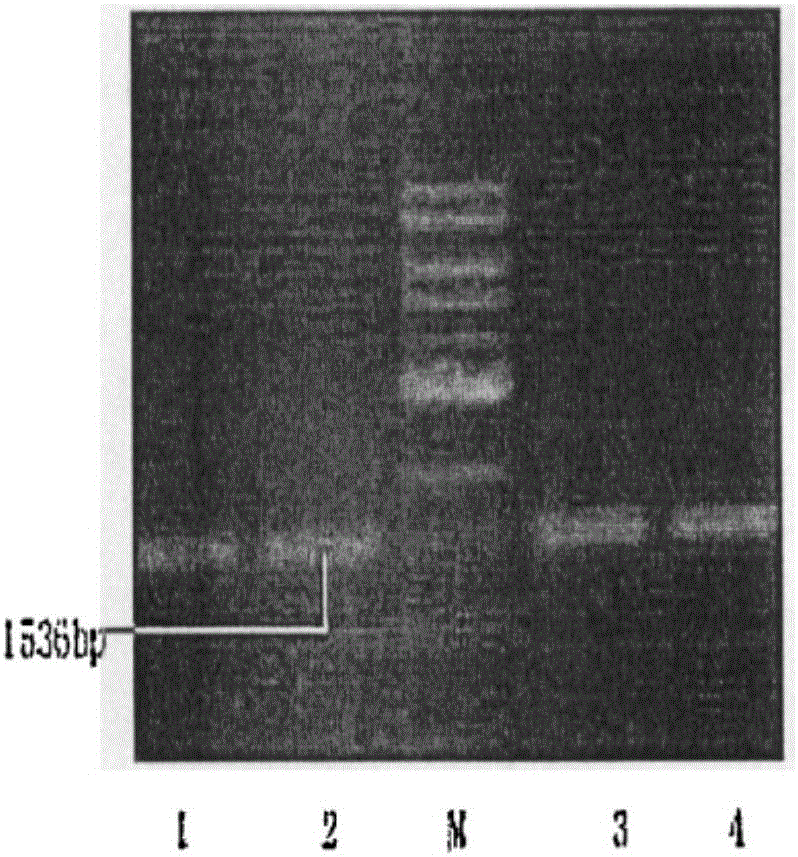
圖1為表達4-羥基芪過氧化物酶基因的畢赤酵母的瓊脂糖電泳檢測結果圖。
圖2為表達4-羥基芪過氧化物酶基因的畢赤酵母的核苷酸序列。
具體實施例
以下結合實施例1~5對本發明公開的技術方案作進一步的說明:
實施例1:
采用畢赤酵母制備白藜蘆醇二聚體提取物的方法,包括以下步驟:
1)在滅菌的離心管內加入1g 4-羥基芪過氧化物酶基因、2g pPU19質粒基因、0.3mL限制性酶緩沖液、10U限制性內切酶EcoP1和10U EcoP15和100mL純水,在30℃下進行溫浴10min,經旋渦震蕩10s,在12000r/min的轉速下,離心2min,過濾,得到含酶切后的4-羥基芪過氧化物酶基因片段4TTS(+)和pPU19質粒基因片段pPU19(+)的混合液。其中4-羥基芪過氧化物酶基因片段4TTS(+)的基因序列為:
GAAGAGCTGTCGACAGTCGCATGCCAGCTAAATTAAGAAAACCTTCACTTGCTTCAAGTAAAGCATGTCGATCCTTCAACGAATTCTATATCACTTGGATGGAAAACTAAGTGTTCAGTATTTCACAGGTGACAAACCAGACAAGAAGCGTACATTCATTTGACCGAAGAAGCTTGAGGAGCACCCAAACATGGTGCTTATATGGCTCCATCTCTTAACACGCCAAGAGATCAC。
2)在滅菌的離心管內,加入5μL的步驟1)得到的含4-羥基芪過氧化物酶基因片段4TTS(+)和pPU19質粒基因片段pPU19(+)的混合液、0.5μL的T4連接酶、1μL連接酶緩沖液、5μL的ddH2O,然后經漩渦振蕩1min,在12000r/min的轉速下,離心15s后,置于16℃水中保溫過夜,即得含4-羥基芪過氧化物酶基因的pPU19質粒載體,可置于4℃的冰箱中備用。
3)通過PCR技術對重組后的質粒載體進行擴增,于95℃預變性5min,1個循環;94℃變性40s,57℃復性40s,35個循環;72℃延伸2min,72℃最后延伸10min,即得到擴增后的含4-羥基芪過氧化物酶基因的pPU19質粒載體;
4)將重組表達載體pPU19-4TTS用熱激法轉入Komagataella pastoris DSMZ 70382畢赤酵母感受態細胞內,通過瓊脂糖電泳檢測結果如圖1所示,核苷酸序列如圖2,在DNA分子量標準的306bp處檢測出4-羥基芪過氧化物酶基因,酶切產物的目的條帶為234bp,符合酶切4-羥基芪過氧化物酶基因的堿基數,證明重組Komagataella pastoris DSMZ 70382畢赤酵母成功表達4-羥基芪過氧化物酶基因,將其命名為Pichia pastoris\pPU19\4TTS;
5)從平板上挑取Pichia pastoris\pPU19\4TTS單菌落于裝有LB培養基的搖瓶中,培養基成分為蛋白胨1g/L、酵母膏1.5g/L、蔗糖6g/L、MgSO4 0.3g/L、CaCl2 0.2g/L、K2HPO40.2g/L、白藜蘆醇15g/L,控制溫度為31℃,振蕩速度180r/min,起始pH控制在6,發酵時間控制在32h,得到含白藜蘆醇二聚體的發酵產物;
6)將白藜蘆醇二聚體的發酵產物液體經H103型大孔樹脂富集純化,柱內徑4mm,高度1m,裝柱體積為2L,上樣液的質量濃度為0.7mg/mL,上樣流速為2BV/h,先用3倍柱體積的蒸餾水洗滌,然后用8BV 75%的乙醇水溶液洗脫,回收乙醇水溶液。使用旋轉蒸發儀祛除乙醇,所得固形物即為白藜蘆醇二聚體提取物,經HPLC測試,其純度為45%,其中白藜蘆醇轉化白藜蘆醇二聚體的轉化率為35%。
實施例2:
采用畢赤酵母制備白藜蘆醇二聚體提取物的方法,包括以下步驟:
1)在滅菌的離心管內加入1g 4-羥基芪過氧化物酶基因、2g pPU19質粒基因、0.3mL限制性酶緩沖液、10U限制性內切酶EcoP1和10U EcoP15和100mL純水,在32℃下進行溫浴13min,經旋渦震蕩12s,在12000r/min的轉速下,離心2min,過濾,得到含酶切后的4-羥基芪過氧化物酶基因片段4TTS(+)和pPU19質粒基因片段pPU19(+)的混合液。其中4-羥基芪過氧化物酶基因片段4TTS(+)的基因序列為:
GAAGAGCTGTCGACAGTCGCATGCCAGCTAAATTAAGAAAACCTTCACTTGCTTCAAGTAAAGCATGTCGATCCTTCAACGAATTCTATATCACTTGGATGGAAAACTAAGTGTTCAGTATTTCACAGGTGACAAACCAGACAAGAAGCGTACATTCATTTGACCGAAGAAGCTTGAGGAGCACCCAAACATGGTGCTTATATGGCTCCATCTCTTAACACGCCAAGAGATCAC。
2)在滅菌的離心管內,加入5μL的步驟1)得到的含4-羥基芪過氧化物酶基因片段4TTS(+)和pPU19質粒基因片段pPU19(+)的混合液、0.5μL的T4連接酶、1μL連接酶緩沖液、5μL的ddH2O,然后經漩渦振蕩1.3min,在12000r/min的轉速下,離心12s后,置于16℃水中保溫過夜,即得含4-羥基芪過氧化物酶基因的pPU19質粒載體,可置于4℃的冰箱中備用。
3)通過PCR技術對重組后的質粒載體進行擴增,于95℃預變性5min,1個循環;94℃變性40s,57℃復性40s,35個循環;72℃延伸2min,72℃最后延伸10min,即得到擴增后的含4-羥基芪過氧化物酶基因的pPU19質粒載體;
4)將重組表達載體pPU19-4TTS用熱激法轉入Komagataella pastoris DSMZ 70382畢赤酵母感受態細胞內,獲得表達4-羥基芪過氧化物酶基因的Komagataella pastoris DSMZ 70382畢赤酵母,命名為Pichia pastoris\pPU19\4TTS;
5)從平板上挑取Pichia pastoris\pPU19\4TTS單菌落于裝有LB培養基的搖瓶中,培養基成分為蛋白胨2g/L、酵母膏1.5g/L、蔗糖6.5g/L、MgSO4 0.4g/L、CaCl2 0.25g/L、K2HPO4 0.3g/L、白藜蘆醇16g/L,控制溫度為32℃,振蕩速度190r/min,起始pH控制在6.5,發酵時間控制在33h,得到含白藜蘆醇二聚體的發酵產物;
6)將白藜蘆醇二聚體的發酵產物液體經H103型大孔樹脂富集純化,柱內徑4mm,高度1m,裝柱體積為2L,上樣液的質量濃度為0.75mg/mL,上樣流速為2.5BV/h,先用3倍柱體積的蒸餾水洗滌,然后用8BV 75%的乙醇水溶液洗脫,回收乙醇水溶液。使用旋轉蒸發儀祛除乙醇,所得固形物即為白藜蘆醇二聚體提取物,經HPLC測試,其純度為50%,其中白藜蘆醇轉化白藜蘆醇二聚體的轉化率為38%。
實施例3:
采用畢赤酵母制備白藜蘆醇二聚體提取物的方法,包括以下步驟:
1)在滅菌的離心管內加入1g 4-羥基芪過氧化物酶基因、2g pPU19質粒基因、0.3mL限制性酶緩沖液、10U限制性內切酶EcoP1和10U EcoP15和100mL純水,在33℃下進行溫浴15min,經旋渦震蕩14s,在13000r/min的轉速下,離心3min,過濾,得到含酶切后的4-羥基芪過氧化物酶基因片段4TTS(+)和pPU19質粒基因片段pPU19(+)的混合液。其中4-羥基芪過氧化物酶基因片段4TTS(+)的基因序列為:
GAAGAGCTGTCGACAGTCGCATGCCAGCTAAATTAAGAAAACCTTCACTTGCTTCAAGTAAAGCATGTCGATCCTTCAACGAATTCTATATCACTTGGATGGAAAACTAAGTGTTCAGTATTTCACAGGTGACAAACCAGACAAGAAGCGTACATTCATTTGACCGAAGAAGCTTGAGGAGCACCCAAACATGGTGCTTATATGGCTCCATCTCTTAACACGCCAAGAGATCAC。
2)在滅菌的離心管內,加入5μL的步驟1)得到的含4-羥基芪過氧化物酶基因片段4TTS(+)和pPU19質粒基因片段pPU19(+)的混合液、0.5μL的T4連接酶、1μL連接酶緩沖液、5μL的ddH2O,然后經漩渦振蕩2min,在12000r/min的轉速下,離心16s后,置于16℃水中保溫過夜,即得含4-羥基芪過氧化物酶基因的pPU19質粒載體,可置于4℃的冰箱中備用。
3)通過PCR技術對重組后的質粒載體進行擴增,于95℃預變性5min,1個循環;94℃變性40s,57℃復性40s,35個循環;72℃延伸2min,72℃最后延伸10min,即得到擴增后的含4-羥基芪過氧化物酶基因的pPU19質粒載體;
4)將重組表達載體pPU19-4TTS用熱激法轉入Komagataella pastoris DSMZ 70382畢赤酵母感受態細胞內,獲得表達4-羥基芪過氧化物酶基因的Komagataella pastoris DSMZ 70382畢赤酵母菌,命名為Pichia pastoris\pPU19\4TTS;
5)從平板上挑取Pichia pastoris\pPU19\4TTS單菌落于裝有LB培養基的搖瓶中,培養基成分為蛋白胨2.5g/L、酵母膏2g/L、蔗糖7g/L、MgSO4 0.35g/L、CaCl2 0.25g/L、K2HPO4 0.25g/L、白藜蘆醇15g/L,控制溫度為33℃,振蕩速度195r/min,起始pH控制在6.5,發酵時間控制在34h,得到含白藜蘆醇二聚體的發酵產物;
6)將白藜蘆醇二聚體的發酵產物液體經H103型大孔樹脂富集純化,柱內徑4mm,高度1m,裝柱體積為2L,上樣液的質量濃度為0.78mg/mL,上樣流速為3.0BV/h,先用4倍柱體積的蒸餾水洗滌,然后用8BV 75%的乙醇水溶液洗脫,回收乙醇水溶液。使用旋轉蒸發儀祛除乙醇,所得固形物即為白藜蘆醇二聚體提取物,經HPLC測試,其純度為48%,其中白藜蘆醇轉化白藜蘆醇二聚體的轉化率為40%。
實施例4:
采用畢赤酵母制備白藜蘆醇二聚體提取物的方法,包括以下步驟:
1)在滅菌的離心管內加入1g 4-羥基芪過氧化物酶基因、2g pPU19質粒基因、0.3mL限制性酶緩沖液、10U限制性內切酶EcoP1和10U EcoP15和100mL純水,在33℃下進行溫浴15min,經旋渦震蕩20s,在14000r/min的轉速下,離心3min,過濾,得到含酶切后的4-羥基芪過氧化物酶基因片段4TTS(+)和pPU19質粒基因片段pPU19(+)的混合液。其中4-羥基芪過氧化物酶基因片段4TTS(+)的基因序列為:
GAAGAGCTGTCGACAGTCGCATGCCAGCTAAATTAAGAAAACCTTCACTTGCTTCAAGTAAAGCATGTCGATCCTTCAACGAATTCTATATCACTTGGATGGAAAACTAAGTGTTCAGTATTTCACAGGTGACAAACCAGACAAGAAGCGTACATTCATTTGACCGAAGAAGCTTGAGGAGCACCCAAACATGGTGCTTATATGGCTCCATCTCTTAACACGCCAAGAGATCAC。
2)在滅菌的離心管內,加入5μL的步驟1)得到的含4-羥基芪過氧化物酶基因片段4TTS(+)和pPU19質粒基因片段pPU19(+)的混合液、0.5μL的T4連接酶、1μL連接酶緩沖液、5μL的ddH2O,然后經漩渦振蕩1.6min,在12000r/min的轉速下,離心14s后,置于16℃水中保溫過夜,即得含4-羥基芪過氧化物酶基因的pPU19質粒載體,可置于4℃的冰箱中備用。
3)通過PCR技術對重組后的質粒載體進行擴增,于95℃預變性5min,1個循環;94℃變性40s,57℃復性40s,35個循環;72℃延伸2min,72℃最后延伸10min,即得到擴增后的含4-羥基芪過氧化物酶基因的pPU19質粒載體;
4)將重組表達載體pPU19-4TTS用熱激法轉入Komagataella pastoris DSMZ 70382畢赤酵母感受態細胞內,獲得表達4-羥基芪過氧化物酶基因的Komagataella pastoris DSMZ 70382畢赤酵母菌,命名為Pichia pastoris\pPU19\4TTS;
5)從平板上挑取Pichia pastoris\pPU19\4TTS單菌落于裝有LB培養基的搖瓶中,培養基成分為蛋白胨3g/L、酵母膏2g/L、蔗糖8g/L、MgSO4 0.3g/L、CaCl2 0.3g/L、K2HPO40.3g/L、白藜蘆醇18g/L,控制溫度為33℃,振蕩速度200r/min,起始pH控制在7.5,發酵時間控制在36h,得到含白藜蘆醇二聚體的發酵產物;
6)將白藜蘆醇二聚體的發酵產物液體經H103型大孔樹脂富集純化,柱內徑4mm,高度1m,裝柱體積為2L,上樣液的質量濃度為0.80mg/mL,上樣流速為3BV/h,先用4倍柱體積的蒸餾水洗滌,然后用8BV 75%的乙醇水溶液洗脫,回收乙醇水溶液。使用旋轉蒸發儀祛除乙醇,所得固形物即為白藜蘆醇二聚體提取物,經HPLC測試,其純度為60%,其中白藜蘆醇轉化白藜蘆醇二聚體的轉化率為45%。
實施例5:
采用畢赤酵母制備白藜蘆醇二聚體提取物的方法,包括以下步驟:
1)在滅菌的離心管內加入1g 4-羥基芪過氧化物酶基因、2g pPU19質粒基因、0.3mL限制性酶緩沖液、10U限制性內切酶EcoP1和10U EcoP15和100mL純水,在35℃下進行溫浴20min,經旋渦震蕩25s,在15000r/min的轉速下,離心4min,過濾得到含酶切后的4-羥基芪過氧化物酶基因片段4TTS(+)和pPU19質粒基因片段pPU19(+)的混合液。其中4-羥基芪過氧化物酶基因片段4TTS(+)的基因序列為:
GAAGAGCTGTCGACAGTCGCATGCCAGCTAAATTAAGAAAACCTTCACTTGCTTCAAGTAAAGCATGTCGATCCTTCAACGAATTCTATATCACTTGGATGGAAAACTAAGTGTTCAGTATTTCACAGGTGACAAACCAGACAAGAAGCGTACATTCATTTGACCGAAGAAGCTTGAGGAGCACCCAAACATGGTGCTTATATGGCTCCATCTCTTAACACGCCAAGAGATCAC。
2)在滅菌的離心管內,加入5μL的步驟1)得到的含4-羥基芪過氧化物酶基因片段4TTS(+)和pPU19質粒基因片段pPU19(+)的混合液、0.5μL的T4連接酶、1μL連接酶緩沖液、5μL的ddH2O,然后經漩渦振蕩1.6min,在12000r/min的轉速下,離心13s后,置于16℃水中保溫過夜,即得含4-羥基芪過氧化物酶基因的pPU19質粒載體,可置于4℃的冰箱中備用。
3)通過PCR技術對重組后的質粒載體進行擴增,于95℃預變性5min,1個循環;94℃變性40s,57℃復性40s,35個循環;72℃延伸2min,72℃最后延伸10min,即得到擴增后的含4-羥基芪過氧化物酶基因的pPU19質粒載體;
4)將重組表達載體pPU19-4TTS用熱激法轉入Komagataella pastoris DSMZ 70382畢赤酵母感受態細胞內,獲得表達4-羥基芪過氧化物酶基因的Komagataella pastoris DSMZ 70382畢赤酵母菌,命名為Pichia pastoris\pPU19\4TTS;
5)從平板上挑取Pichia pastoris\pPU19\4TTS單菌落于裝有LB培養基的搖瓶中,培養基成分為蛋白胨5g/L、酵母膏4g/L、蔗糖12g/L、MgSO4 0.5g/L、CaCl2 0.4g/L、K2HPO40.6g/L、白藜蘆醇20g/L,控制溫度為35℃,振蕩速度220r/min,起始pH控制在8,發酵時間控制在40h,得到含白藜蘆醇二聚體的發酵產物;
6)將白藜蘆醇二聚體的發酵產物液體經H103型大孔樹脂富集純化,柱內徑4mm,高度1m,裝柱體積為2L,上樣液的質量濃度為0.80mg/mL,上樣流速為4.0BV/h,先用5倍柱體積的蒸餾水洗滌,然后用8BV 75%的乙醇水溶液洗脫,回收乙醇水溶液。使用旋轉蒸發儀祛除乙醇,所得固形物即為白藜蘆醇二聚體提取物,經HPLC測試,其純度為50%,其中白藜蘆醇轉化白藜蘆醇二聚體的轉化率為42%。
SEQUENCE LISTING
<110> 珀萊雅化妝品股份有限公司
<120> 一種采用畢赤酵母制備白藜蘆醇二聚體的方法
<130>
<160> 2
<170> PatentIn version 3.3
<210> 1
<211> 234
<212> DNA
<213> 4-羥基芪過氧化物酶基因片段4TTS(+)
<400> 1
gaagagctgt cgacagtcgc atgccagcta aattaagaaa accttcactt gcttcaagta 60
aagcatgtcg atccttcaac gaattctata tcacttggat ggaaaactaa gtgttcagta 120
tttcacaggt gacaaaccag acaagaagcg tacattcatt tgaccgaaga agcttgagga 180
gcacccaaac atggtgctta tatggctcca tctcttaaca cgccaagaga tcac 234
<210> 2
<211> 1536
<212> DNA
<213> 表達4-羥基芪過氧化物酶的畢赤酵母
<220>
<221> misc_feature
<222> (60)..(60)
<223> n is a, c, g, or t
<400> 2
tcgctggtaa tcccggcttt tgctgcttac aagctttacg gattatttct aggaggtagn 60
caattattgg gtggtcgcag cagtttcaaa gaggaggagc cagcttctgg gtcaaaagaa 120
aagggacaga gcaagagaca acagaaacta gaaaagagag gacaaaaggt gagatacaga 180
tagaatcttt gcgagtgaac caaggtagct gaaaaacata acttgcaagg atgctattgg 240
acaattttag gtgataaact cgattgctat cactgggctc tgccacatgg aagctttagt 300
gagaagagct gtcgacagtc gcatgccagc taaattaaga aaaccttcac ttgcttcaag 360
taaagcatgt cgatccttca acgaattcta tatcacttgg atggaaaact aagtgttcag 420
tatttcacag gtgacaaacc agacaagaag cgtacattca tttgaccgaa gaagcttgag 480
gagcacccaa acatggtgct tatatggctc catctcttaa cacgccaaga gatcacagct 540
cttgcgcact attcgagtcg tttacttttt ttttggtttt tgctaggcct tccattactt 600
ctttacttcg ttagtgacaa gtgacttaag gccaatgtat tcttgaatca aaagaaggct 660
gtgtcaattc ctaagcccta ctagctctac tttcggagtg acctaccgat aagttcgcat 720
acgcgaatct ggaccatttt tataatacca agtagaaatt caatagccat ctagctgttt 780
ctacatgatg acagcccata accataaaga aaactgcaaa cgattgctga gcttgtagag 840
cgtccagtaa gtagcgcaat ctccagtgag caacgtaata tcatattttc ttctctctct 900
ttcattctcc tccgagaatt acagaagcat catagtagtg tacccaccaa tggttgtgag 960
cgactgcgcg attccatgga tgctactgaa accaatgaat gaaacttgtc aagtttcctc 1020
gcttcctttt acataacgga tcttttaact tagaaacagt ttagtaaaag aaattcatca 1080
atacaatgga cggaggtaag tcagctcttt cagcaaggga gcatggaatc agattggcaa 1140
cgacttctgc gattcttatt cttccgattg attcaacagt agatttgcga gtggttggcc 1200
aaacacacag tttcgatgcg atctccgttt gatttgtatg aatacgcagt catctcattg 1260
gtggagcatt ttatacggat tgattgagtg gaagcatggt actgagagta tctacatgtg 1320
catttctgtt ggttgtcctc ggttgagttt tcgtatctgt ttgtcccccc aattttgtcc 1380
actccttttg gcaatctgcc gaatccaagc tcataatact aactcccatt ttagaagacg 1440
ttgcagcagt aagtaccctt acatgtaatc catgaaagca aatgtggcgc agtcaatcga 1500
agtcactgtc tgattgattc ttccctcagt ggcggt 1536
- 還沒有人留言評論。精彩留言會獲得點贊!