基于香豆素類的接力響應型熒光分子探針及其制備方法和用途與流程
本發明涉及一種基于香豆素類的接力響應型熒光分子探針及其制備方法和
用途,屬于化學熒光傳感材料技術領域。
背景技術:
鐵作為生命體中重要的微量元素之一,在生命體生長發育過程中,具有舉足輕重的作用。其參與血紅蛋白、肌紅蛋白、細胞色素,細胞色素氧化酶等的合成并能激活琥珀脫氫酸、黃嘌呤氧化酶等的活性。
鐵還參與造血功能,影響蛋白質及去氧核糖核酸的合成及造血維生素代謝,缺鐵時肝臟內合成去氧核糖核酸將收到抑制,肝臟發育減慢,肝細胞及其它細胞內的線粒體和微粒體發生異常,細胞色素c,含量減少,導致蛋白質的合成及能量運用減少,進而發生貧血及發育不良。相反盲目的攝入過量的鐵也會對健康造成威脅,相關研究表明,腦鐵異常沉淀會參與中樞神經系統變性疾病的病理過程,引起或加重神經功能改變,引起阿爾茲海默病,帕金森病等中樞神經退行性變疾病。
在生態環境中,水體系統中鐵離子含量過高會影響水體顏色并會散發惡臭,嚴重危害水生生物的正常生長發育,而且隨著生態系統的遷移和富集作用,經生物鏈最終還會進入人體危害人體健康。而磷酸根離子在生物系統中無處不在,是一個重要的核苷酸新陳代謝的產物,在生物系統的能量轉換和儲存中扮演著至關重要的角色,它在細胞信號轉導、膜完整性、骨礦化、肌肉功能以及其他重要生物過程中起著至關重要的作用,其與鐵離子都是生物不可或缺的離子之一。傳統的檢測技術通常有電感耦合等離子體法、原子吸收法、離子色譜法、紫外可見分光光度法和電化學法等,但這些技術通常需要大型的儀器,并且對樣品的要求較高,檢測前需要進行嚴格的預處理,具有操作復雜,耗時,成本高,抗干擾性差等缺點,很難實現快速有效的檢測目的。基于此,構建一種快速、便捷、有效的能用于水體及生物體中鐵離子及磷酸根離子檢測的方法是非常必要的。
近年來,熒光傳感信號檢測技術已經引起了研究人員的關注,其在檢測分析生物分子,陰陽離子等方面的研究已有大量報道。由于該技術具有靈敏度高、選擇性好、響應速度快、操作方便、成本低等一系列的優點。其已經被廣泛的應用于生物醫學、環境科學和分子生物學等眾多領域。熒光傳感材料一般由熒光信號報告單元和底物接收單元兩個主要基本要素構成。待測目標離子/分子與探針受體單元通過各種作用力(如分子間氫鍵,靜電作用,共價鍵等)相互作用,引起信號報告單元熒光信號的改變,進而實現對目標物的光學傳感檢測。
接力識別是熒光探針分子功能強化的一個新方向。所謂接力識別是指探針分子在一定條件下對某一離子進行選擇性識別后,利用原位生成的中間產物(新的中間體或者是配合物)與新的離子物種間的特殊作用直接在原測試條件下繼續進行新的離子識別。顯然,接力識別型熒光探針能夠使得兩種離子的識別操作可在同一測試條件下連續進行,具有操作簡單的顯著優點,并能降低探針合成的工作量,有利于節能減排。由于金屬離子和陰離子電荷互補,某些“熒光探針-金屬離子”絡合物又可以作為間接識別陰離子的熒光探針,并具有實時響應的優點,所以設計合成對特定金屬離子和陰離子具有接力識別功能的熒光探針備受關注,并已經成為當前接力識別熒光探針研究的主要方向。
眾所周知,香豆素類化合物是易合成的苯并吡喃酮結構,其具有相對光穩定性,低毒性,易修飾和較長的激發波長。香豆素及其衍生物具有很大的斯托克斯位移,一定可調性的光物理參數和優良的量子產率,進而有效地防止了激發和發射光譜之間的重疊。其還具有良好的水溶性,低細胞毒性和良好的細胞兼容性,即其結構單元可以穿過細胞膜,為其進行活細胞試驗提供了可能。香豆素母體結構的各個位置相對活潑,易于被修飾,因此多有報道以香豆素為熒光團,在母體不同位置c-4、c-6、c-7、c-8上修飾不同類型的基團,從而得到性能好、應用廣泛的探針材料,并很好的用于陰陽離子和生物分子的識別檢測。
技術實現要素:
本發明旨在克服傳統檢測技術的限制,目的在于提供一種新型的基于香豆素類的接力響應型熒光分子探針及其制備方法和用途,本發明涉及的熒光分子探針能夠很好的實現對fe3+和po43-的接力識別。檢測條件溫和能成功地應用于生物細胞中fe3+和po43-的有效識別成像,具有成本低,合成簡單,響應快速和檢測靈敏度高等特點。
本發明采取的技術方案如下:
本發明提供一種新型的基于香豆素類的接力響應型熒光分子探針,所述材料是由4-甲基傘型酮作為熒光基團,首先采用氯乙酰氯取代4-甲基傘型酮上c-7位上的羥基氫形成中間化合物r,隨后將該化合物r與2-氨甲基吡啶同樣通過取代反應進行結合制得熒光分子探針材料。
本發明還提供一種新型的基于香豆素類的接力響應型熒光分子探針的制備方法,包括如下步驟:
步驟1、化合物r(7-氯乙酰氧基-4-甲基-香豆素)的制備:
參考文獻poshiyaa.synthesisstudiesofbacterialdna-gyraseinhibitors[j].ijpt,2011,3(3):3048-3059.進行制備。
將一定量的4-甲基傘型酮和三乙胺溶解在無水二氯甲烷,置于圓底燒瓶中,在冰浴鍋中將混合物降至0℃,將氯乙酰氯逐滴加入上述溶液中,然后在n2保護下攪拌。反應結束后,加入100ml蒸餾水,然后用ch2cl2萃取三次。合并有機層,用無水na2so4干燥,過濾并減壓蒸餾除去溶劑,得到白色固體產物,粗產物在乙醇中重結晶純化得到化合物r。
步驟2、熒光分子探針xds的制備:
將2-氨甲基吡啶、nahco3、k2co3和ki置于圓底燒瓶中,稱取化合物r溶于無水乙腈中,將其在室溫下邊攪拌邊逐滴加入到上述混合物中,在n2保護下,冷凝回流反應;反應結束后將混合物冷卻至室溫,過濾,減壓蒸餾除去溶劑,得到固體產物,在乙醇中重結晶純化,得到白色化合物xds,即為本發明所述的基于香豆素類的接力響應型熒光分子探針。
上述步驟1中,4-甲基傘型酮,三乙胺,氯乙酰氯和無水二氯甲烷的用量分別為0.5~1.6g(3-9mmol):0.1~0.5ml:0.24~0.72ml(3~9mmol):25~50ml,反應時間為6~12h。
上述步驟2中,nahco3,k2co3,ki,化合物r和2-氨甲基吡啶的加入量分別為0.34~3.5g(4~20mmol):0.55~2.8g(4~20mmol):0.64~3.4g(4~20mmol):1.0~2.5g(4~10mmol):0.45~2.2g(4~20mmol);回流溫度為70~80℃;反應時間為6~12h。
本發明另一目的是將上述合成的熒光探針用于水體和生物體細胞中fe3+離子和po43-離子的接力檢測。
本發明的技術效果為:
(1)本發明提供了一種新型的基于香豆素類的接力響應型熒光分子探針的制備方法及用途。該探針由于結構中香豆素熒光基團的存在,熒光分子探針本身具有強的藍色熒光發射。并且探針結構穩定,本身具有很好的水溶性,該探針可以實現完全水溶,無需借助于其他有機溶劑,在應用過程中不會造成二次污染。相比于需要借助有機溶劑的熒光分子探針具有更好的應用前景。
(2)本發明中熒光分子探針是采用氯乙酰氯經兩步簡單的反應將4-甲基傘型酮和2-氨甲基吡啶進行結合,原料相對廉價,合成條件溫和易于控制,后處理簡單。
(3)fe3+存在是會形成“分子探針—fe3+”絡合物,改變了探針分子結構的電荷分布,本身的藍色熒光發生猝滅,在進一步加入po43-離子后,由于金屬離子和陰離子電荷互補作用使得探針的熒光恢復,實現了在同一個體系中對fe3+和po43-離子的接力識別檢測,效果顯著。相比傳統的檢測技術,采用本發明制備的熒光分子探針對fe3+和po43-進行檢測,選擇性和靈敏度高,其他常見的金屬離子和陰離子的干擾小,無需大型儀器,可以在100%水溶液中進行檢測,檢測條件溫和,響應時間快,識別信號可視化。
(4)本發明中熒分子探針能夠用于生物體細胞中fe3+離子和po43-離子熒光成像檢測分析。
附圖說明
圖1為實施例3所制備的基于香豆素類的接力響應型熒光分子探針的合成過程示意圖。
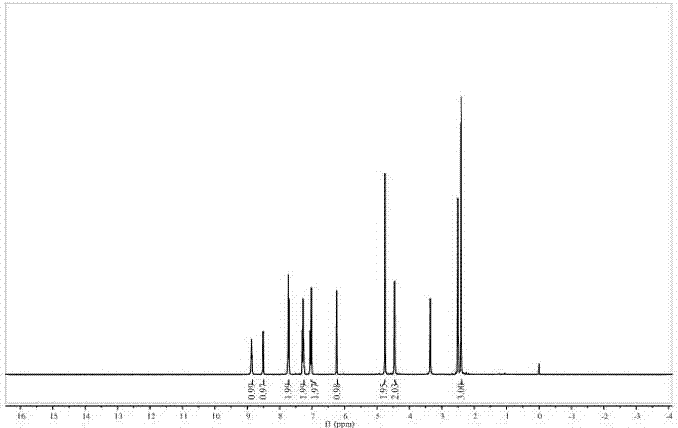
圖2為實施例3所制備熒光分子探針的1hnmr,其中溶劑為dmso-d6。
圖3為實施例3所制備熒光分子探針的13cnmr圖,其中溶劑為dmso-d6。
圖4為實施例3所制備熒光分子探針的ms圖。
圖5為實施例3所制備熒光分子探針的熒光發射光譜。
圖6為實施例3所制備熒光分子探針在不同金屬離子存在時的熒光光譜圖;圖中的xds表示的是本發明制備的熒光分子探針材料。
圖7為實施例3所制備熒光分子探針在不同濃度fe3+存在時的熒光光譜圖,插圖為體系熒光減弱程度(i0-i)與fe3+濃度之間的線性關系,其中i0為熒光分子探針自身的在380nm處的熒光發射強度,i表示加入fe3+后對應的熒光發射強度。
圖8為實施例3所制備熒光分子探針在加入fe3+前后一段時間內的光學穩定性。
圖9為實施例3所制備的熒光分子探針與fe3+結合后加入不同陰離子的熒光光譜圖。
圖10為實施例3所制備熒光分子探針與fe3+結合后,在不同濃度po43-加入時的熒光光譜圖,插圖為體系熒光增強程度(i-i0)與po43-濃度之間的線性關系,其中i0為熒光分子探針與fe3+結合后在380nm處的熒光發射強度,i表示加入po43-后對應的熒光發射強度。
圖11為實施例3所制備熒光分子探針用于水體中多次重復接力識別fe3+和po43-圖。
圖12為實施例3所制備熒光分子探針用于生物體活細胞中fe3+和po43-的成像圖;圖中a為加入熒光分子探針培養后的細胞在明場下的成像,b為加入熒光分子探針培養后的細胞在熒光場下的成像,c為加入20μmfe3+后細胞在熒光場下的成像,d為再次加入20μmpo43-后細胞在熒光場下的成像。
具體實施方式:
為使本發明實施例的目的、技術方案和優點更加清楚,下面將結合附圖說明對本發明實施例中的技術方案進行清楚、完整地描述,顯然,所描述的實施例是本發明一部分實施例,而不是全部的實施例,基于本發明中的實施例,本領域普通技術人員在沒有做出創造性勞動的前提下所獲得的所有其他實施例,都屬于本發明保護的范圍。
實施例1:
步驟1、化合物r的制備:將0.5g(3mmol)4-甲基傘型酮和0.1ml三乙胺溶解在25ml無水二氯甲烷置于圓底燒瓶中,在冰浴鍋中將混合物降至0℃,將0.24ml(3mmol)氯乙酰氯逐滴加入上述溶液中,然后在n2保護下攪拌反應6h。反應結束后,加入100ml蒸餾水,然后用ch2cl2萃取三次。合并有機層用無水na2so4干燥,過濾并減壓蒸餾除去溶劑,得到白色固體產物。粗產物在乙醇中重結晶純化得到0.47g化合物r,產率為63%.
步驟2、熒光分子探針xds的制備:將0.45g(4mmol)2-氨甲基吡啶,0.34g(4mmol)nahco3,0.55g(4mmol)k2co3和0.64g(4mmol)ki置于圓底燒瓶中,稱取1.006g(4mmol)化合物r溶于無水乙腈中,將其在室溫下邊攪拌邊逐滴加入到上述混合物中,在n2保護下,70℃條件下冷凝回流反應6h。反應結束后將混合物冷卻至室溫,過濾,減壓蒸餾除去溶劑,得到固體產物,在乙醇中重結晶純化,得到0.66g白色化合物xds,產率為50.6%
實施例2:
步驟1、化合物r的制備:將1g(6mmol)4-甲基傘型酮和0.3ml三乙胺溶解在35ml無水二氯甲烷置于圓底燒瓶中,在冰浴鍋中將混合物降至0℃,將0.48g(6mmol)氯乙酰氯逐滴加入上述溶液中,然后在n2保護下攪拌反應9h。反應結束后,加入100ml蒸餾水,然后用ch2cl2萃取三次。合并有機層用無水na2so4干燥,過濾并減壓蒸餾除去溶劑,得到白色固體產物。粗產物在乙醇中重結晶純化得到0.87g化合物r,產率為70%.
步驟2、熒光分子探針xds的制備:將1.35g(12mmol)2-氨甲基吡啶,1.02g(12mmol)nahco3,1.65g(12mmol)k2co3和1.86g(12mmol)ki置于圓底燒瓶中,稱取3.018g(12mmol)化合物r溶于無水乙腈中,將其在室溫下邊攪拌邊逐滴加入到上述混合物中,在n2保護下,75℃條件下冷凝回流反應9h。反應結束后將混合物冷卻至室溫,過濾,減壓蒸餾除去溶劑,得到固體產物,在乙醇中重結晶純化,得到2.05g白色化合物xds,產率為52.4%
實施例3:
步驟1、化合物r的制備:將1.6g(9mmol)4-甲基傘型酮和0.5ml三乙胺溶解在50ml無水二氯甲烷置于圓底燒瓶中,在冰浴鍋中將混合物降至0℃,將0.72ml(9mmol)氯乙酰氯逐滴加入上述溶液中,然后在n2保護下攪拌反應12h。反應結束后,加入100ml蒸餾水,然后用ch2cl2萃取三次。合并有機層用無水na2so4干燥,過濾并減壓蒸餾除去溶劑,得到白色固體產物。粗產物在乙醇中重結晶純化得到1.27g化合物r,產率為68%。
步驟2、熒光分子探針xds的制備:將2.2g(20mmol)2-氨甲基吡啶,3.5g(20mmol)nahco3,2.8g(20mmol)2.5gk2co3(20mmol)和3.4g(20mmol)ki置于圓底燒瓶中,稱取1.006g(20mmol)化合物r溶于無水乙腈中,將其在室溫下邊攪拌邊逐滴加入到上述混合物中,在n2保護下,80℃條件下冷凝回流反應12h。反應結束后將混合物冷卻至室溫,過濾,減壓蒸餾除去溶劑,得到固體產物,在乙醇中重結晶純化,得到3.84g白色化合物xds,產率為60%。
如圖1所示是基于香豆素類的接力響應型熒光分子的合成過程示意圖。
如圖2和圖3所示分別為所制備熒光分子探針的1hnmr和13cnmr圖。1hnmr(400mhz,dmso-d6)δ8.87(t,j=5.7hz,1h),8.51(d,j=4.5hz,1
h),7.74(dd,j=12.8,5.1hz,2h),7.31–7.24(m,2h),7.07–7.00(m,2h),6.24(s,1h),4.75(s,2h),4.46(d,j=5.9hz,2h),2.41(s,3h).
13cnmr(101mhz,dmso-d6)δ167.82,161.15,160.54,158.62,154.99,153.85,149.29,137.12,126.98,122.61,121.48,114.10,113.04,111.91,102.22,67.66,44.30,18.61.
通過核磁譜圖可以確定制備合成的熒光分子探針與圖1中預期的結構是一致的。
如圖4所示為本發明所制備的熒光分子探針(c18h16n2o4,mn=324)的質譜圖,其中,325.60為[m+h]對應的分子量,進一步證實了該熒光傳感材料的結構。
圖5為熒光分子探針(10μm)在水溶液中的的熒光發射光譜。激發波長為320nm,熒光狹縫寬度均為5。從圖中可以看出該熒光分子探針在380nm處有強的熒光發射峰。
實施例4:本發明制備的熒光分子探針對fe3+檢測的特異性驗證
將實施例3中制備的熒光分子探針用去離子水配制1mm的儲備液置于-4oc冰箱中備用;在檢測前用hepes緩沖溶液(0.05m,ph=7.4)稀釋到10μm作為待用探針溶液。濃度為10mm的金屬離子(al3+,cr3+,fe3+,ca2+,cd2+,co2+,cu2+,fe2+,mg2+,mn2+,sr2+,zn2+,pb2+,hg2+,ni2+,cs+,k+,li+和na+)儲備液同樣用去離子水配制待用。移取10μm待用探針溶液,分別加20當量不同種金屬離子溶液,采用熒光光譜儀分別對各自的熒光光譜進行測定,其中激發波長為320nm。
熒光傳感材料自身具有強的藍色熒光,在380nm處有熒光發射,當加入10當量不同金屬離子后的熒光光譜如圖6所示,從圖中可以看出,熒光分子探針對fe3+表現出獨特的選擇性,當fe3+存在時,在紫外燈照射下可呈現出肉眼可見的熒光淬滅現象。熒光光譜中380nm處的熒光發射在很大程度上被減弱,然而,其他金屬離子的存在并沒有引起熒光分子探針熒光的改變。這個結果充分的說明本發明制備的熒光分子探針對fe3+具有選擇性識別性能。
實施例5:本發明制備的熒光分子探針對fe3+檢測的靈敏性驗證
移取實施例4中的10μm的待用探針溶液,對fe3+進行熒光滴定實驗,即分別加入0~10當量的fe3+進行熒光光譜測定并討論熒光強度變化與加入fe3+量之間的關系。本實施例中用到的金屬離子濃度分別為:0.05×10-5m、0.1×10-5m、0.2×10-5m、0.3×10-5m、0.4×10-5m、0.5×10-5m、0.6×10-5m、0.7×10-5m、0.8×10-5m、0.9×10-5m、1.0×10-5m、1.1×10-5m、1.2×10-5m、1.3×10-5m、1.4×10-5m、2.0×10-5m、4.0×10-5m、6.0×10-5m、8.0×10-5m、10.0×10-5m。
熒光滴定實驗的熒光發射光譜如圖7所示,從圖中可以看出,熒光分子探針體系在380nm處熒光發射強度隨著fe3+加入量的增加而逐漸減弱。
圖7中的插圖為相應的熒光減弱程度(i0-i)與金屬離子的濃度之間的線性關系,當fe3+濃度在0-10μm范圍內時呈現兩者呈現出良好的線性關系,相關系數為0.996,線性方程的斜率(slope)分別為3.66×107,根據方程lod=3σ/slope(20次空白樣的標準偏差σ=1.568)計算得最低檢出限lod可低達1.285×10-7m。結果表明該熒光分子探針在該范圍內的fe3+可進行定量檢測并具有高的靈敏性。實施例6:本發明制備的熒光分子探針光學性質的穩定性及與金屬fe3+結合后穩定性的驗證
移取實施例4中的10μm的待用探針溶液,將其放置在紫外燈下照射60min,每隔10min檢測一次熒光強度。隨后加入10當量的fe3+,并在接下來的90min內,每隔10min檢測一次體系的熒光強度。
在加入fe3+前后不同時間段的熒光強度如圖8所示,探針在fe3+加入之前熒光強度在60min內基本保持穩定不變,這表明本發明制備的熒光分子探針自身具有很好的光學穩定性。加入fe3+之后的熒光強度迅速大幅度減弱,并在90min內依舊保持穩定,這也表明本發明制備的熒光分子探針對fe3+具有快速識別性能,并能形成穩定的探針-金屬絡合物。
實施例7:本發明制備的熒光分子探針與fe3+結合后接力識別檢測磷酸根離子(po43-)驗證
移取實施例4中的10μm的待用探針溶液,加入10當量金屬fe3+,混合均勻作為檢測溶液待用。配制一系列濃度為10mm的f-,cl-,br-,i-,so42-,scn-,clo4-,po43-,co32-,no3-,no2-,aco–和cn-離子溶液,將10當量的這一系列陰離子溶液分別加入到上述探針-fe3+混合待用溶液中并對體系的熒光光譜進行檢測。
熒光光譜如圖9所示,不難看出在加入不同陰離子之后,只有po43-的加入可以使380nm處的熒光發射強度恢復,熒光從無色恢復到探針原有的藍色,然而其他陰離子的加入并不會對探針-fe3+混合溶液體系的熒光造成影響。這充分的說明探針-fe3+混合溶液可以作為新的探針體系接力識別po43-。
實施例8:本發明制備的熒光分子探針與fe3+結合后對po43-離子接力識別的靈敏性驗證
移取實施例7中的探針-fe3+混合待用溶液,對po43-進行熒光滴定實驗,即分別加入0~10當量的po43-進行熒光光譜測定并討論熒光強度變化與加入po43-量之間的關系。本實施例中用到的po43-濃度分別為:0.1×10-5m、0.2×10-5m、0.3×10-5m、0.4×10-5m、0.5×10-5m、0.6×10-5m、0.7×10-5m、0.8×10-5m、0.9×10-5m、1.0×10-5m、2.0×10-5m、3.0×10-5m、4.0×10-5m、5.0×10-5m、6.0×10-5m、7.0×10-5m、8.0×10-5m、9.0×10-5m、10.0×10-5m。
熒光滴定實驗的熒光發射光譜如圖10所示,從圖中可以看出,熒光分子探針體系在380nm處熒光發射強度隨著po43-加入量的增加而逐漸增強,插圖為在380nm處的熒光強度與加入的po43-含量的線性關系圖,從中可以看出在po43-濃度為0-1μm范圍內,熒光強度與po43-濃度呈現出很好的線性關系。
圖10中插圖為相應的熒光增強程度(i-i0)與po43-的濃度之間的關系,當po43-的濃度在0-10μm范圍內兩者呈現良好的線性關系,線性方程的斜率(slope)分別為4.94×107,根據方程lod=3σ/slope(20次空白樣的標準偏差σ=2.47)計算得最低檢出限lod可低達1.49×10-7m。結果表明該熒光分子探針在該范圍內可對po43-進行定量檢測并具有高的靈敏性。
實施例9:熒光分子探針用于水體中接力識別fe3+和po43-多次重復驗證
采集長江水進行fe3+和po43-的加標實驗,分別配制成濃度為10mm的fe3+溶液和po43-溶液待用。移取實施例4中的配制的10μm的熒光分子探針溶液,交替的加入10當量的fe3+溶液和10當量的po43-溶液,反復進行4次,并檢測每個階段的熒光光譜,記錄在380nm處的熒光強度。
熒光分子探針用于水體中fe3+和po43-多次重復接力識別的結果如圖11所示,從結果可以看出,該熒光分子探針溶液中反復多次加入fe3+和po43-依然能通過熒光發射強度的變化達到水體中兩種離子識別檢測的目的。這也充分的說明本發明制備的熒光分子探針可以用于真實水體中目標離子的檢測并且具有多次重復利用性。
實施例10:本發明制備的熒光分子探針對細胞中fe3+和po43-的成像分析
將ramos細胞(人b淋巴瘤細胞,購買于sigma)在rpmi-1640培養液中培養24h,加入20μm的實施例3制備的熒光分子探針繼續培養30min,用緩沖溶液洗滌三次來移除殘余的熒光分子探針;之后加入fe3+(20μm)溶液繼續培養30min;洗滌后在倒置熒光顯微鏡下觀察加入fe3+培養前后的細胞熒光成像情況。隨后在fe3+培養過的細胞中加入po43-(20μm)溶液再次培養30min,洗滌在倒置熒光顯微鏡觀察細胞熒光成像。
熒光分子探針對生物細胞中fe3+和po43-的熒光成像結果如圖12所示,圖12-a和圖12-b分別為加入熒光分子探針培養后的細胞在明場和熒光場下的成像,圖12-a細胞的完整性可以間接表明本發明制備的熒光分子探針具有較低的生理毒性,不會對生物細胞造成破壞,圖12-b表明用熒光分子探針培養后的細胞具有藍色熒光,這也說明探針分子成功地進入細胞內部;圖12-c為加入fe3+后細胞在熒光場下的成像,fe3+的存在導致細胞中熒光發生淬滅。圖12-d為再次加入po43-培養后細胞的成像,從圖中可以發現,由于細胞中po43-的存在,細胞內部重新呈現出強的藍色熒光發射。這一結果充分證明了該熒光分子探針由于檢測條件的溫和性同樣也可以用于生物體內fe3+和po43-的檢測分析。
- 還沒有人留言評論。精彩留言會獲得點贊!