一種用于土壤宏蛋白組學研究的樣品制備處理方法與流程
本發明涉及到以蛋白組學分析為目的的全蛋白提取和處理方法,尤其是一種用于土
壤宏蛋白組學研究的樣品制備處理方法。
背景技術:
隨著土壤宏基因組學的日益成熟和發展,作為后基因組時代重要技術平臺的土壤宏蛋白質組學越來越受到關注。土壤蛋白質在碳氮磷的生物地球化學循環以及有機物的積累方面發揮重要作用,與土壤質量與可持續發展息息相關。蛋白質組本質上指的是在大規模水平上研究蛋白質的特征,包括蛋白質的表達水平、翻譯后的修飾、蛋白與蛋白相互作用等。宏蛋白質組學是研究整個生態系統內所有微生物來源的蛋白質種類和豐度變化的技術手段。
在過去的10年中,宏蛋白質組學極大地加深了我們對于微生物群落以及它們所處的地球化學環境的理解。蛋白質組學的研究提供了不同微生物類群在凋落物分解過程中所起到的作用,對于胞外酶的研究可以揭示微生物量的限制因素、酶與凋落物分解的關系、酶活性與相關蛋白豐度的關系、酶的微生物起源以及落葉層生物與生物地球化學作用之間的關系。微生物蛋白與其生境的時間分布可以為微生物的多樣性與其在生物地球化學作用過程中所扮演的角色的研究提供幫助。宏蛋白質組學將從一個新的水平上提供微生物演替和特定種群分布活動的信息,并且這些信息都能從表達的蛋白上得到解析。土壤微生物生物量巨大、種類繁多、不易分離培養,宏基因組學與蛋白質組學結合為解決這一難題提供了契機,特別是宏蛋白質組學可以深入地研究種群的多樣性,可以直接觀察蛋白質在環境樣本中的變化,能夠提供細胞的功能信息,可以細致地分析群落的結構與功能。宏蛋白質組學可以通過分析微生物酶的來源功能和活動來解決不同種類蛋白的混合表達問題,從而克服尋找酶信息與相關生態系統過程聯系的困難。土壤宏蛋白質組學的研究是解析土壤宏基因功能的重要手段之一,對于碳氮磷的生物地球化學循環以及土壤有機質積累的研究具有重大價值,可將蛋白信息與相關的生態系統過程聯系起來。
目前土壤宏蛋白組學研究面臨的主要問題之一就是,蛋白組的提取難度大。主要有以下原因:1.土壤的基質非常復雜,對蛋白提取造成了干擾;2.蛋白質種類繁多,物理性質差異較大,目前使用的方法難以實現對所有蛋白質的高效提取;3.土壤蛋白豐度差異大,有些蛋白含量非常少,現有方法常常會漏提低豐度蛋白質;4.目前的處理方法總體而言過程都比較繁瑣,期間容易造成污染和不確定因素;5.隨著所需分析樣本數量的增加,處理方法的通量也顯得尤為重要。
技術實現要素:
本發明的目的在于提供一種操作簡單、穩定性強、回收率高、提取全面而且通量高的土壤宏蛋白組學研究樣品的制備處理方法。
為實現上述目的,本發明提供一種用于土壤宏蛋白組學研究的樣品制備處理方法,其特征在于:其經過下列工藝步驟:
(1)樣品預處理:將土壤樣品放入冷凍干燥機,干燥至衡重,低溫破碎,過100目篩子,稱取200-400mg過篩后土壤樣品,優選的取300mg土壤樣品,按質量比1:10加入裂解緩沖液;;使其混勻,隨后水浴加熱處理,渦旋,得到第一懸混液;
(2)震蕩破碎:按照每0.5ml裂解緩沖液/2顆鋼珠的比例將鋼珠加入到步驟(1)中得到的第一懸混液,0~4℃下利用研磨機震蕩破碎得到破碎后的第一懸混液;
(3)超聲提取:將步驟(2)中得到的破碎后的第一懸混液在冰上進行超聲,進一步破碎,促使蛋白質充分溶出;離心,收集第一上清液;
(4)冷丙酮沉淀:向步驟(3)中得到的第一上清液加入3-6倍體積的-20℃預冷的丙酮,優選的,加入4倍體積的-20℃預冷的丙酮;在-20℃下靜置5小時,高速離心,棄掉溶液,用-20℃的丙酮洗2次,加入50μl裂解緩沖液溶解蛋白質得到蛋白溶液;
(5)蛋白質酶解:精密稱取步驟(4)所得含50μg蛋白質的蛋白溶液,加入單一蛋白酶或者蛋白酶組合,其中加入的蛋白質和每種蛋白酶質量比為20-50:1,優選的,按質量比25:1加入蛋白酶;于37℃孵育過夜得到多肽溶液;
(6)肽段的提取和純化:對于步驟(5)所得多肽溶液,按照每10μg蛋白質對應3-4μl分離劑1的比例,優選的加入17μl分離劑1渦旋5分鐘,然后按照每10μg蛋白質對應50-70μl分離劑2的比例,優選的加入300μl分離劑2,渦旋混勻,離心,靜置10分鐘,在不擾動沉淀和中間相的情況下,將約90%的含肽段的下層相轉移到新的離心管中;再按照每10μg蛋白質對應50-70μl分離劑3的比例,優選的加入300μl分離劑3,渦旋混勻后,離心,取下層;合并兩次所得肽段溶液;
(7)利用固相萃取離心柱對步驟(6)兩次所得肽段溶液進行脫鹽處理,收集洗出液;經離心濃縮干燥后,用復溶液充分渦旋重新溶解肽段樣品,直接上機分析。
進一步,所述步驟(1)中的土壤為包括普通土壤、淤泥、沉積物在內的各種土壤樣品。
進一步,所述步驟(1)中的低溫破碎為液氮研磨破碎或其他可保持破碎過程中樣品溫度在零度以下的破碎裝置;
任選的,所述步驟(1)中的稱取過篩后的土壤樣品的質量為200-400mg。
任選的,所述步驟(1)和(4)中的裂解緩沖液的配方為:70mm溴化四乙銨、0.5%二乙基二硫代氨基甲酸鈉、10mm三(2-羧乙基)膦、30mm二氯乙酰胺、0.5%十二烷基硫酸鈉,1m尿素,ph值調至8.0-8.2;
任選的,所述步驟(1)中所述的水浴的溫度為80-95攝氏度,時間為30分鐘-2小時。
進一步,所述步驟(2)中所使用的鋼珠直徑為1-3mm,使用前經過清洗和400℃高溫烘烤去除可能附著的污染物。
進一步,所述步驟(3)中所述的超聲破碎時控制超聲破碎儀功率80~100w,超聲30s,關閉30s,超聲破碎時間為5~10min。
進一步,所述步驟(3)、(6)、(7)中離心和步驟(4)中高速離心的條件為溫度4℃,轉速14000rpm,離心15min。
進一步,所述步驟(5)中單一蛋白酶是指胰蛋白酶、糜蛋白酶、木瓜蛋白酶、lysc、argc、aspn或gluc;蛋白酶組合指的是胰蛋白酶、糜蛋白酶、木瓜蛋白酶、lysc、argc、aspn和gluc中的至少兩種酶的組合。
進一步,所述步驟(6)中分離劑1為二甲亞砜,其加入量與蛋白質的比例為:3-4μl:10μg;優選3.5μl:10μg;
任選的,分離劑2為乙酸乙酯、環己烷和甲酸按照體積比5:1:0.01混合制備得到的混合液;其加入量與蛋白質的比例為:50-70μl:10μg;優選60μl:10μg;
任選的,分離劑3配方為:乙酸乙酯和環己烷按照體積比6:1的比例混合制備得到的混合液,其加入量與蛋白質的比例為:50-70μl:10μg;優選60μl:10μg。
進一步,所述步驟(7)中固相萃取離心柱為microspinc18silicacolumn;
任選的,脫鹽處理為:先用乙腈溶液潤濕萃取柱,棄掉,重復一次;用0.2體積%甲酸平衡萃取柱,重復一次;將步驟(6)兩次所得肽段溶液注入萃取柱;用0.1體積%甲酸的2體積%乙腈洗萃取柱,重復一次;用75%乙腈-0.1%甲酸洗脫萃取柱,洗二次,收集合并兩次洗出液;
進一步,所述步驟(7)中復溶液配方為:含有2%體積的甲醇溶液,其中含有0.8%體積的甲酸。
所述步驟(5)中蛋白質濃度測定方法為bicinchoninicacid(bca)方法。
本發明所述固相萃取離心柱為microspinc18silicacolumn(nestgroup公司)。
本發明所述的丙酮、二甲亞砜、乙酸乙酯、三氟乙酸、甲酸、甲醇、乙腈均為質譜純或色譜純級別試劑。
本發明所提供的用于土壤宏蛋白組學研究樣品的制備處理方法,其是將土壤樣品凍干粉碎后,加入裂解緩沖液后進行水浴,震蕩破碎,超聲,丙酮沉淀,重新定溶后得到蛋白提取液;對蛋白提取液進行濃度測量,取適量蛋白質,加入蛋白酶進行酶解,隨后依次加入分離劑1、分離劑2、分離劑3,對提取液中蛋白組進行純化,隨后進行除鹽處理,用復溶液重新溶解肽段樣品。該工藝可從土壤樣品中獲得種類全面、濃度及純度均較高的宏蛋白質組學樣品。本發明采用新的裂解緩沖液配方和分離劑配方及對應的流程,結合高溫裂解和低溫超聲破碎的方法,能夠從土壤中獲得種類全面、濃度及純度高的蛋白質組學樣品。本發明所制備的最終產物可以直接進行液相色譜串聯質譜分析。本發明工藝合理,操作可靠易行,制備科學,最大限度地提取蛋白質,簡化了操作步驟,對大量開展大規模的土壤宏蛋白質組學研究具有重大意義。
附圖說明
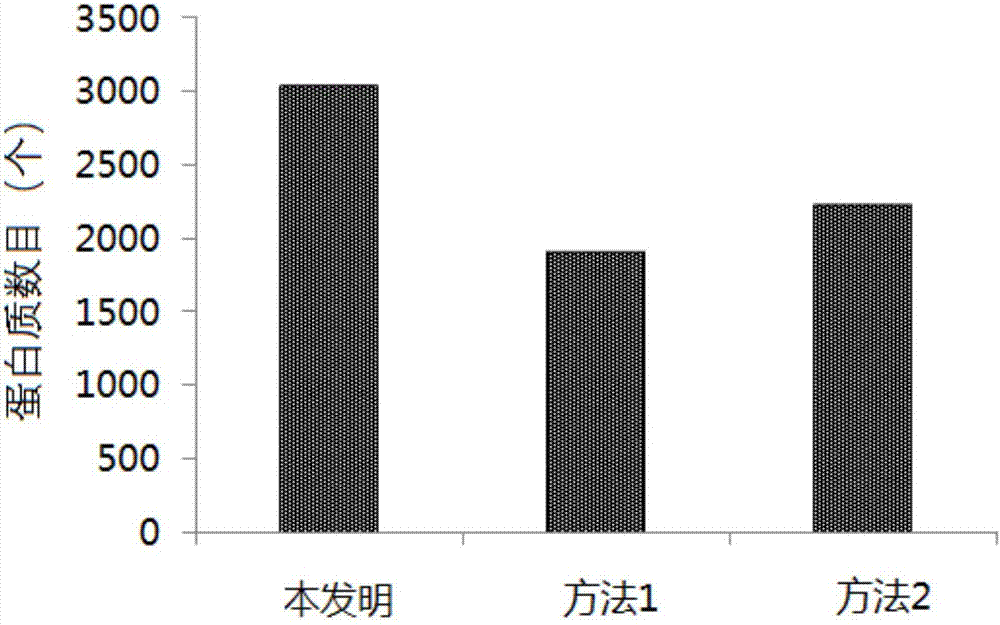
圖1是實施例1中采用不同前處理方法從土壤中提取的蛋白質數量比較圖。
圖2是實施例2中采用不同前處理方法從沉積物樣品中提取的蛋白質數量比較圖。
圖3是實施例3中采用不同前處理方法從淤泥樣品中提取的蛋白質數量比較圖。
具體實施方式
下面詳細描述本發明的實施例,所述實施例的示例在附圖中示出,其中自始至終相同或類似的標號表示相同或類似的元件或具有相同或類似功能的元件。下面通過參考附圖描述的實施例是示例性的,旨在用于解釋本發明,而不能理解為對本發明的限制。本發明的描述中,“第一”、“第二”、“第三”等為指代或描述方便,不能理解為有順序關系或者有相對重要性指示,除非另有說明,“多個”、“多組”、“多重”的含義是兩個(組或重)或兩個(組或重)以上。實施例中未注明具體技術或條件者,按照本領域內的文獻所描述的技術或條件或者按照產品說明書進行。所用試劑或儀器未注明生產廠商者,均為可以通過市購獲得的常規產品。
實施例1:一種用于普通土壤樣品中宏蛋白質組學研究樣品的制備處理方法
(1)樣品預處理:將土壤樣品放入冷凍干燥機,干燥至衡重,液氮環境下磨碎。精密稱取200mg土壤粉末至離心管內,加入2ml裂解液,使用移液槍吹打,使其混勻,隨后95℃水浴30min,渦旋5min。其中,裂解液的配方為:70mm溴化四乙銨(tetraethyl-ammoniumbromide,teab)、0.5%二乙基二硫代氨基甲酸鈉(sdc)、10mm三(2-羧乙基)膦(tris(2-carboxyethyl)phosphine,tcep)、30mm二氯乙酰胺(2-chloroacetamide)、0.5%十二烷基硫酸鈉(sds),1m尿素(urea),ph值調至8.0。
(2)震蕩破碎:將6顆經過清洗和400℃烘烤后直徑為3mm的鋼珠加入步驟(1)中得到的懸混液中,低溫下震蕩破碎,震蕩頻率為90hz,時間為60s;
(3)超聲提取:將步驟(2)中得到的溶液樣品在冰上進行超聲,進一步破碎,促使蛋白質充分溶出,超聲功率為100w,超聲30s,關閉30s,超聲破碎時間為5min。然后采用低溫離心機控制溫度4℃,控制轉速15000g,離心5min,收集上清液;
(4)冷丙酮沉淀:向步驟(3)得到的上清液中,加入3倍體積的冷丙酮,在-20℃下靜置5小時,高速離心,溫度4℃,控制轉速15000g,離心10min,棄掉溶液,用-20℃丙酮洗2次,然后加入50μl裂解緩沖液重新溶解蛋白質。
(5)蛋白質酶解:利用bca法,對步驟(4)中得到的全蛋白溶液進行蛋白質濃度的測定,取50μg蛋白質,加入胰蛋白酶和lysc酶,蛋白質和胰蛋白酶和lysc酶質量比25:1:1;37℃下孵育12小時,得到蛋白質酶解多肽溶液;
(6)肽段的提取和純化:對于步驟(5)所得多肽溶液,加入15μl分離劑3(二甲亞砜),渦旋5分鐘,然后加入250μl分離劑2(乙酸乙酯、環己烷和甲酸,體積比5:1:0.01),渦旋混勻,溫度10℃,控制轉速1000rpm,離心5min,然后靜置10分鐘,在不擾動任何沉淀和中間相的情況下,將約90%的下層相(含肽段)轉移到新的離心管中。再加入250μl分離劑3(乙酸乙酯和環己烷,體積比6:1),渦旋混勻后,采用低溫離心機控制溫度10℃,控制轉速1000rpm,離心5min,取下層,合并兩次所得肽段溶液。
(7)肽段溶液的脫鹽:利用microspinc18silicacolumn(nestgroup公司)對肽段樣品進行脫鹽,除鹽流程為:先用100μl乙腈潤濕萃取柱,棄掉,重復一次;用100μl0.1%甲酸平衡萃取柱,重復一次;將酶解樣品注入萃取柱;用100μl0.1%甲酸的2%乙腈洗萃取柱,重復一次;用100μl75%乙腈(0.1%甲酸)洗脫萃取柱,洗二次,收集合并兩次洗出液。
(8)回收液經離心濃縮干燥后,用50μl的復溶液(2%甲醇溶液,其中含有0.8%甲酸)充分渦旋溶解,直接上機分析。
對比例1:(方法1)
(1)將土壤樣品放入冷凍干燥機,干燥至衡重,液氮環境下磨碎。精密稱取100mg樣品粉末至離心管內,加入1ml蛋白提取液(50mmtris,0.1%sds,10mmhepes,ph=8.1),冰上超聲3min,靜置30min,然后離心15min(4℃,15000g),收集上清液。
(2)向(1)中的上清液中加入1ml含20mm二硫蘇糖醇(dtt)的20%tca/丙酮(w/v)溶液,-20℃下靜置過夜;
(3)離心30min(4℃,15000g),棄去上清,收集沉淀;
(4)將步驟(4)中沉淀溶解于50μl蛋白質溶解液(6murea,2mthiourea,20mmdtt,30mmtris/hcl,0.1%sds,ph=8.3),充分溶解后,低溫離心機控制溫度4℃,控制轉速15000g,離心30min,取上清
(5)利用bradford法,對步驟(5)中得到的全蛋白溶液進行蛋白質濃度的測定,取100μg蛋白質,加入胰蛋白酶,蛋白質和胰蛋白酶質量比50:1,37℃下孵育16小時,得到蛋白質酶解多肽溶液;
(6)利用omixc18tip對肽段樣品進行脫鹽,除鹽流程為:先用100μl乙腈潤濕萃取柱,重復一次;用100μl乙腈/0.1%甲酸(1:1,v/v)平衡萃取柱,重復一次;用100μl0.1%甲酸平衡萃取柱,重復三次;將酶解樣品吸附到萃取柱上;依次用200μl、800μl、200μl0.1%甲酸的2%乙腈清洗萃取柱;將吸附的肽段釋放至120μl甲醇/0.1%甲酸(1:1,v/v)溶液中,直接上機分析。
對比例2:(方法2)
(1)將土壤樣品放入冷凍干燥機,干燥至衡重,液氮環境下磨碎。精密稱取100mg樣品粉末至離心管內,加入1ml蛋白提取液(0.3m磷酸,ph=8.1),冰上超聲3min,靜置過夜,然后采用低溫離心機控制溫度4℃,控制轉速15000g,離心15min,收集上清液。
(2)向(1)中的上清液中加入1ml60%硫酸銨水溶液,靜置3小時,低溫離心(4℃,15000g)30min,棄去上清,收集沉淀;
(3)向步驟(3)中沉淀中加入100μl8m尿素,充分溶解后;
(4)利用bca法,對步驟(4)中得到的全蛋白溶液進行蛋白質濃度的測定;
(5)從步驟(4)所得溶液中精密量取含100μg蛋白質的溶液,轉移至新離心管中,加入10mmdtt(終濃度),37℃變性1小時,然后再加入50mmiaa(終濃度),鋁箔紙完全包裹離心管以避免光照,室溫反應0.5小時;
(6)將millipore10kd超濾膜加入50μl8m尿素潤洗,14,000g離心10分鐘,將步驟(5)的蛋白樣品轉移至超濾管,14,000xg離心20分鐘;
(7)向步驟(6)中超濾管中加入200μl8m尿素,14,000xg離心30分鐘,重復2次;再加入200μl50mm碳酸氫銨,14,000xg離心30分鐘,重復3-4次;
(8)直接將2μg胰蛋白酶加到步驟(7)的超濾管中,用封口膜密封超濾管,置于37℃烘箱中孵育過夜;
(9)更換新的超濾收集管,將步驟(8)中的超濾管14,000xg離心30-40分鐘,收集穿透液;再補充80μl50mm碳酸氫銨,14,000xg離心30-40分鐘,合并兩次穿透液。
(10)步驟(9)的穿透液經離心濃縮干燥后,用50μl的甲醇充分溶解,直接上機分析。
將三種方法制備的樣品在相同條件的液相色譜/質譜系統下檢測,并經過maxquant進行數據分析,得到的蛋白鑒定數目見圖1。從圖1可以看出,采用本發明的方法進行蛋白質組學檢測前處理,能夠在土壤中檢出更多種類的蛋白質。
本實施例所提供的普通土壤宏蛋白質組學研究樣品的制備處理方法,其工藝合理,操作可靠,制備科學,應用范圍廣泛,在保證蛋白質提取效率和純度的情況下最大限度地簡化了操作步驟,最終所得樣品可以直接利用液相色譜串聯質譜的方法進行檢測分析。
實施例2:一種用于沉積物樣品中宏蛋白質組學研究樣品的制備處理方法
(1)樣品預處理:將沉積物樣品(sediment,為任何可以由流體流動所移動的微粒,并最終成為在水或其他液體底下的一層固體微粒)放入冷凍干燥機,干燥至衡重,液氮環境下磨碎。精密稱取300mg土壤粉末至離心管內,加入3ml裂解液,使用移液槍吹打,使其混勻,隨后90℃水浴1小時,渦旋5min。裂解液的配方為:70mm溴化四乙銨(tetraethyl-ammoniumbromide,teab)、0.5%二乙基二硫代氨基甲酸鈉(sdc)、10mm三(2-羧乙基)膦(tris(2-carboxyethyl)phosphine,tcep)、30mm二氯乙酰胺(2-chloroacetamide)、0.5%十二烷基硫酸鈉(sds),1m尿素(urea),ph值調至8.2。
(2)震蕩破碎:將6顆經過清洗和400℃烘烤后直徑為3mm的鋼珠加入步驟(1)中得到的懸混液中,低溫下震蕩破碎,震蕩頻率為90hz,時間為60s;
(3)超聲提取:將步驟(2)中得到的溶液樣品在冰上進行超聲,進一步破碎,促使蛋白質充分溶出,超聲功率為90w,超聲30s,關閉30s,超聲破碎時間為8min。然后采用低溫離心機控制溫度4℃,控制轉速15000g,離心5min,收集上清液;
(4)冷丙酮沉淀:向上清液中加入4倍體積的冷丙酮,在-20℃下靜置5小時,高速離心,溫度4℃,控制轉速15000g,離心10min,棄掉溶液,用-20℃丙酮洗2次,然后加入50μl裂解緩沖液重新溶解蛋白質。
(5)蛋白質酶解:利用bca法,對步驟(4)中得到的全蛋白溶液進行蛋白質濃度的測定,取50μg蛋白質的蛋白質溶液,隨后加入胰蛋白酶、木瓜蛋白酶和lysc一起進行酶解,蛋白質和胰蛋白酶,木瓜蛋白酶和lysc的質量比20:1:1:1,得到蛋白質酶解多肽溶液;
(6)肽段的提取和純化:對于步驟(5)所得多肽溶液,加入17μl分離劑3(二甲亞砜),渦旋5分鐘,然后加入300μl分離劑2(乙酸乙酯、環己烷和甲酸,體積比5:1:0.01),渦旋混勻,溫度10℃,控制轉速1000rpm,離心5min,然后靜置10分鐘,在不擾動任何沉淀和中間相的情況下,將約90%的下層相(含肽段)轉移到新的離心管中。再加入300μl分離劑3(乙酸乙酯和環己烷,體積比6:1),渦旋混勻后,采用低溫離心機控制溫度10℃,控制轉速1000rpm,離心5min,取下層,合并兩次所得肽段溶液。
(7)肽段溶液的脫鹽:利用microspinc18silicacolumn(nestgroup公司)對肽段樣品進行脫鹽,除鹽流程為:先用100μl乙腈潤濕萃取柱,棄掉,重復一次;用100μl0.1%甲酸平衡萃取柱,重復一次;將酶解樣品注入萃取柱;用100μl0.1%甲酸的2%乙腈洗萃取柱,重復一次;用100μl75%乙腈(0.1%甲酸)洗脫萃取柱,洗二次,收集合并兩次洗出液。
(8)回收液經離心濃縮干燥后,用50μl的復溶液(2%甲醇溶液,其中含有0.8%甲酸)充分渦旋溶解,直接上機分析。
對比例1:(方法1)
(1)將沉積物樣品放入冷凍干燥機,干燥至衡重,液氮環境下磨碎。精密稱取100mg樣品粉末至離心管內,加入1ml蛋白提取液(50mmtris,0.1%sds,10mmhepes,ph=8.1),冰上超聲3min,靜置30min,然后離心15min(4℃,15000g),收集上清液。
(2)向(1)中的上清液中加入1ml含20mmdtt的20%tca/丙酮(w/v)溶液,-20℃下靜置過夜;
(3)離心30min(4℃,15000g),棄去上清,收集沉淀;
(4)將步驟(4)中沉淀溶解于50μl蛋白質溶解液(6murea,2mthiourea,20mmdtt,30mmtris/hcl,0.1%sds,ph=8.3),充分溶解后,低溫離心機控制溫度4℃,控制轉速15000g,離心30min,取上清
(5)利用bradford法,對步驟(5)中得到的全蛋白溶液進行蛋白質濃度的測定,取100μg蛋白質,加入胰蛋白酶,蛋白質和胰蛋白酶質量比50:1,37℃下孵育16小時,得到蛋白質酶解多肽溶液;
(6)利用omixc18tip對肽段樣品進行脫鹽,除鹽流程為:先用100μl乙腈潤濕萃取柱,重復一次;用100μl乙腈/0.1%甲酸(1:1,v/v)平衡萃取柱,重復一次;用100μl0.1%甲酸平衡萃取柱,重復三次;將酶解樣品吸附到萃取柱上;依次用200μl、800μl、200μl0.1%甲酸的2%乙腈清洗萃取柱;將吸附的肽段釋放至120μl甲醇/0.1%甲酸(1:1,v/v)溶液中,直接上機分析。
對比例2:(方法2)
(1)將沉積物樣品放入冷凍干燥機,干燥至衡重,液氮環境下磨碎。精密稱取100mg樣品粉末至離心管內,加入1ml蛋白提取液(0.3m磷酸,ph=8.1),冰上超聲3min,靜置過夜,然后采用低溫離心機控制溫度4℃,控制轉速15000g,離心15min,收集上清液。
(2)向(1)中的上清液中加入1ml60%硫酸銨水溶液,靜置3小時,低溫離心(4℃,15000g)30min,棄去上清,收集沉淀;
(3)向步驟(3)中沉淀中加入100μl8m尿素,充分溶解后;
(4)利用bca法,對步驟(4)中得到的全蛋白溶液進行蛋白質濃度的測定;
(5)從步驟(4)所得溶液中精密量取含100μg蛋白質的溶液,轉移至新離心管中,加入10mmdtt(終濃度),37℃變性1小時,然后再加入50mmiaa(終濃度),鋁箔紙完全包裹離心管以避免光照,室溫反應0.5小時;
(6)將millipore10kd超濾膜加入50μl8m尿素潤洗,14,000g離心10分鐘,將步驟(5)的蛋白樣品轉移至超濾管,14,000xg離心20分鐘;
(7)向步驟(6)中超濾管中加入200μl8m尿素,14,000xg離心30分鐘,重復2次;再加入200μl50mm碳酸氫銨,14,000xg離心30分鐘,重復3-4次;
(8)直接將2μg胰蛋白酶加到步驟(7)的超濾管中,用封口膜密封超濾管,置于37℃烘箱中孵育過夜;
(9)更換新的超濾收集管,將步驟(8)中的超濾管14,000xg離心30-40分鐘,收集穿透液;再補充80μl50mm碳酸氫銨,14,000xg離心30-40分鐘,合并兩次穿透液。
(10)步驟(9)的穿透液經離心濃縮干燥后,用50μl的甲醇充分溶解,直接上機分析。
將三種方法制備的樣品在相同條件的液相色譜/質譜系統下檢測,并經過maxquant進行數據分析,得到的蛋白鑒定數目見圖2。從圖2可以看出,利用本發明方法能夠在沉積物樣品中檢出更多種類的蛋白質。
本實施例所提供的沉積物宏蛋白質組學研究樣品的制備處理方法,其工藝合理,操作可靠,制備科學,應用范圍廣泛,在保證蛋白質提取效率和純度的情況下最大限度地簡化了操作步驟,最終所得樣品可以直接利用液相色譜串聯質譜的方法進行檢測分析。
實施例3:一種用于淤泥樣品中宏蛋白質組學研究樣品的制備處理方法
(1)樣品預處理:將淤泥樣品放入冷凍干燥機,干燥至衡重,液氮環境下磨碎。精密稱取400mg淤泥粉末至離心管內,加入4ml裂解液,使用移液槍吹打,使其混勻,隨后80℃水浴2小時,渦旋5min。其中,裂解液的配方為:70mm溴化四乙銨(tetraethyl-ammoniumbromide,teab)、0.5%二乙基二硫代氨基甲酸鈉(sdc)、10mm三(2-羧乙基)膦(tris(2-carboxyethyl)phosphine,tcep)、30mm二氯乙酰胺(2-chloroacetamide)、0.5%十二烷基硫酸鈉(sds),1m尿素(urea),ph值調至8.0。
(2)震蕩破碎:將8顆經過清洗和400℃烘烤后直徑為3mm的鋼珠加入步驟(1)中得到的懸混液中,低溫下震蕩破碎,震蕩頻率為90hz,時間為60s;
(3)超聲提取:將步驟(2)中得到的溶液樣品在冰上進行超聲,進一步破碎,促使蛋白質充分溶出,超聲功率為80w,超聲30s,關閉30s,超聲破碎時間為10min。然后采用低溫離心機控制溫度4℃,控制轉速15000g,離心5min,收集上清液;
(4)冷丙酮沉淀:向步驟(3)得到的上清液中加入6倍體積的冷丙酮,在-20℃下靜置5小時,高速離心,溫度4℃,控制轉速15000g,離心10min,棄掉溶液,用-20℃丙酮洗2次,然后加入50μl裂解緩沖液重新溶解蛋白質。
(5)蛋白質酶解:利用bca法,對步驟(4)中得到的全蛋白溶液進行蛋白質濃度的測定,取50μg蛋白質,加入胰蛋白酶,蛋白質和蛋白酶比25:1;37℃下孵育12小時,得到蛋白質酶解多肽溶液;
(6)肽段的提取和純化:對于步驟(5)所得多肽溶液,加入20μl分離劑3(二甲亞砜),渦旋5分鐘,然后加入350μl分離劑2(乙酸乙酯、環己烷和甲酸,體積比5:1:0.01),渦旋混勻,溫度10℃,控制轉速1000rpm,離心5min,然后靜置10分鐘,在不擾動任何沉淀和中間相的情況下,將約90%的下層相(含肽段)轉移到新的離心管中。再加入350μl分離劑3(乙酸乙酯和環己烷,體積比6:1),渦旋混勻后,采用低溫離心機控制溫度10℃,控制轉速1000rpm,離心5min,取下層,合并兩次所得肽段溶液。
(7)肽段溶液的脫鹽:利用microspinc18silicacolumn(nestgroup公司)對肽段樣品進行脫鹽,除鹽流程為:先用100μl乙腈潤濕萃取柱,棄掉,重復一次;用100μl0.1%甲酸平衡萃取柱,重復一次;將酶解樣品注入萃取柱;用100μl0.1%甲酸的2%乙腈洗萃取柱,重復一次;用100μl75%乙腈(0.1%甲酸)洗脫萃取柱,洗二次,收集合并兩次洗出液。
(8)回收液經離心濃縮干燥后,用50μl的復溶液(2%甲醇溶液,其中含有0.8%甲酸)充分渦旋溶解,直接上機分析。
對比例1:(方法1)
(1)將淤泥樣品放入冷凍干燥機,干燥至衡重,液氮環境下磨碎。精密稱取100mg樣品粉末至離心管內,加入1ml蛋白提取液(50mmtris,0.1%sds,10mmhepes,ph=8.1),冰上超聲3min,靜置30min,然后離心15min(4℃,15000g),收集上清液。
(2)向(1)中的上清液中加入1ml含20mmdtt的20%tca/丙酮(w/v)溶液,-20℃下靜置過夜;
(3)離心30min(4℃,15000g),棄去上清,收集沉淀;
(4)將步驟(4)中沉淀溶解于50μl蛋白質溶解液(6murea,2mthiourea,20mmdtt,30mmtris/hcl,0.1%sds,ph=8.3),充分溶解后,低溫離心機控制溫度4℃,控制轉速15000g,離心30min,取上清
(5)利用bradford法,對步驟(5)中得到的全蛋白溶液進行蛋白質濃度的測定,取100μg蛋白質,加入胰蛋白酶,蛋白質和胰蛋白酶質量比50:1,37℃下孵育16小時,得到蛋白質酶解多肽溶液;
(6)利用omixc18tip對肽段樣品進行脫鹽,除鹽流程為:先用100μl乙腈潤濕萃取柱,重復一次;用100μl乙腈/0.1%甲酸(1:1,v/v)平衡萃取柱,重復一次;用100μl0.1%甲酸平衡萃取柱,重復三次;將酶解樣品吸附到萃取柱上;依次用200μl、800μl、200μl0.1%甲酸的2%乙腈清洗萃取柱;將吸附的肽段釋放至120μl甲醇/0.1%甲酸(1:1,v/v)溶液中,直接上機分析。
對比例2:(方法2)
(1)將淤泥樣品放入冷凍干燥機,干燥至衡重,液氮環境下磨碎。精密稱取100mg樣品粉末至離心管內,加入1ml蛋白提取液(0.3m磷酸,ph=8.1),冰上超聲3min,靜置過夜,然后采用低溫離心機控制溫度4℃,控制轉速15000g,離心15min,收集上清液。
(2)向(1)中的上清液中加入1ml60%硫酸銨水溶液,靜置3小時,低溫離心(4℃,15000g)30min,棄去上清,收集沉淀;
(3)向步驟(3)中沉淀中加入100μl8m尿素,充分溶解后;
(4)利用bca法,對步驟(4)中得到的全蛋白溶液進行蛋白質濃度的測定;
(5)從步驟(4)所得溶液中精密量取含100μg蛋白質的溶液,轉移至新離心管中,加入10mmdtt(終濃度),37℃變性1小時,然后再加入50mmiaa(終濃度),鋁箔紙完全包裹離心管以避免光照,室溫反應0.5小時;
(6)將millipore10kd超濾膜加入50μl8m尿素潤洗,14,000g離心10分鐘,將步驟(5)的蛋白樣品轉移至超濾管,14,000xg離心20分鐘;
(7)向步驟(6)中超濾管中加入200μl8m尿素,14,000xg離心30分鐘,重復2次;再加入200μl50mm碳酸氫銨,14,000xg離心30分鐘,重復3-4次;
(8)直接將2μg胰蛋白酶加到步驟(7)的超濾管中,用封口膜密封超濾管,置于37℃烘箱中孵育過夜;
(9)更換新的超濾收集管,將步驟(8)中的超濾管14,000xg離心30-40分鐘,收集穿透液;再補充80μl50mm碳酸氫銨,14,000xg離心30-40分鐘,合并兩次穿透液。
(10)步驟(9)的穿透液經離心濃縮干燥后,用50μl的甲醇充分溶解,直接上機分析。
將三種方法制備的樣品在相同條件的液相色譜/質譜系統下檢測,并經過maxquant進行數據分析,得到的蛋白鑒定數目見圖3。從圖3可以看出,利用本發明方法能夠在沉積物樣品中檢出更多種類的蛋白質。
本實施例所提供的淤泥宏蛋白質組學研究樣品的制備處理方法,其工藝合理,操作可靠,制備科學,應用范圍廣泛,在保證蛋白質提取效率和純度的情況下最大限度地簡化了操作步驟,最終所得樣品可以直接利用液相色譜串聯質譜的方法進行檢測分析。
盡管上面已經示出和描述了本發明的實施例,可以理解的是,上述實施例是示例性的,不能理解為對本發明的限制,本領域的普通技術人員在不脫離本發明的原理和宗旨的情況下在本發明的范圍內可以對上述實施例進行變化、修改、替換和變型。
- 還沒有人留言評論。精彩留言會獲得點贊!