基于多模態MRI數據的腦瘤術后空間域分割方法與流程
本發明屬于圖像處理與生物醫學結合的技術領域,尤其是一種基于多模態MRI數據的腦瘤術后空間域分割方法。
背景技術:
腦腫瘤(腦瘤)嚴重威脅人類健康。磁共振圖像(MRI)分割是腦瘤手術放射治療計劃制定、長期縱向研究的一個重要前提。本方法基于多模態MRI數據的腦瘤術后分割,具有重要意義。腦腫瘤是指生長在顱腔內的癌性物質,包括腦實質發生病變引起的原發性腫瘤,也有由身體其他部位轉移侵入顱內的繼發性腫瘤。在人群中發病率很高,已經成為危害人民生命健康的重要腫瘤之一。而且不論其性質是良性還是惡性,一旦在顱內占據一定空間,勢必壓迫腦組織,造成顱內壓升高、中樞神經損害,危及患者的生命。全球每年發生原發性腦瘤的人數約為250,000人,2013年最新的腫瘤流行病學調查研究結果表明,腦腫瘤發病率占全身腫瘤發病率的1.4%,而死亡比例超過2.4%。2011年中國腫瘤登記地區腦瘤新發病例數為87 220例,發病率為6.47/10萬,年因腦瘤死亡病例數為50777例。
世界衛生組織根據腦腫瘤的惡性程度將其分成四級:I級為良性,II級為低度惡性,II和IV為高度惡性。I級和II級的腦瘤有著比較好的預后,手術的緊迫性沒有高度惡性的腫瘤高,有時僅作觀察隨訪即可。具有高度惡性的膠質母細胞瘤,可以發生時即為膠質母細胞瘤,也可從良性的星形細胞瘤惡變而來。目前在臨床工作中,手術加術后放療已成為腦瘤的常規治療模式,已被公認是一種有效治療手段。
針對磁共振成像(MRI)進行腦腫瘤區域分割是腦瘤手術放射治療計劃制定、長期縱向研究的一個重要前提。在各種醫學影像學技術中,磁共振成像(MRI)對軟組織有著很強的分辨力,所以據此界定腫瘤邊界更為準確。MRI圖像腦腫瘤分割在診斷、病理分析、治療以及科學研究等方面具有重要意義。臨床上一般由有經驗的醫生根據解剖知識,利用計算機輔助軟件手工勾畫分割腫瘤區域。但是,人工分割的主觀性很強,不同的醫生對同一病人的磁共振圖像會有不同的判斷結果,同一個醫生在不同的時期對同一病人的圖像判斷結果也存在差異,而且醫學圖像成像過程中很容易因為噪聲、場偏移效應、組織運動和局部體積效應的影響,造成圖像本身存在模糊、灰度不均勻等現象。因此人工分割速度慢、實時性差、可重復性差,難以勝任大量圖像數據的分割處理工作。為了減輕醫生們的工作強度,同時提高分割的正確率,特別是降低病變部位的漏過率,在腦瘤圖像的分割的過程中采用計算機軟件輔助操作。一般情況下磁共振圖像中的腦腫瘤有如下特性:大小和位置各異;在不同模態的MRI上的外觀各異;密度可能和正常組織相交疊;可能有占空效應(新組織擠走了正常組織)或滲透效應(改變現有組織的特性);內部結構的復雜性,存在血管或出現鈣化等;周圍可能伴隨著水腫等。這些對分割方法的選擇提出了更高的要求。
自動分析腦腫瘤的圖像對提高診斷率、治療計劃的制定、病人的隨訪有著潛在的巨大價值。發展腦腫瘤的自動分割技術是一個非常大的挑戰,為了面對這個挑戰,已經提出了很多方法。對腦腫瘤的分割配準的研究最早可以追溯到20余年前,近些年各種方法大量地被提出。世界上頂級的醫學圖像會議Medical Image Computing and Computer Assisted Interventions(MICCAI)2012年、2013、2014、2015連續四年進行腦腫瘤分割的挑戰比賽。使用FLAIR(T2-weighted MRI with fluid-attenuated inversion recovery)、T1(T1-weighting)、T2(T2-weighted)、T1c(T1-weighting with contrast-enhanced)、PD(Proton Density)等模態的方法占了大多數。對于分割腦腫瘤中不同子類(壞死Necrosis、水腫Edema、增強腫瘤Enhancing tumor、非增強腫瘤Non-enhancing tumor)來說,單一模態的MRI是不夠的。MRI的不同模態圖像能提供不同的紋理邊界信息,由于個體差異,不同病人同一模態所表現的信息也大不相同。不同模態的MRI提供了不同腫瘤區域的信息:T1用來查看健康組織的結構信息,T1c用來查看壞死(necrosis)和活躍的腫瘤(enhancing tumor)部分,T2用來查看水腫(edema)的部分,FLAIR是一種特殊的模態用來幫助分離水腫和腦脊液(CSF)。
基于像素的MRI腦腫瘤分割方法一直以來是研究的一大熱點。研究內容主要針對特征提取、特征選擇和分類器設計,好的特征提取能使得分類器的工作變得簡單。特征提取按方法主要分為統計方法、模型方法和信號處理方法,其各有優勢和不足。統計方法簡單,易于實現,對小圖像具有一定的優勢,但其對全局信息的利用不足,與人類視覺模型脫節;模型方法能夠兼顧紋理局部的隨機性和整體上的規律性,具有很大的靈活性,不足是模型系數難以求解,參數調節不方便;信號處理方法善于捕捉紋理的細節信息,能同時在空間和頻域上表現紋理特征,然而小波往往忽視高頻信息,不善于提取非規則紋理特征。由上可見,沒有一種特征提取方法適合所有腦腫瘤的MRI圖像分割。Haar小波變換作為一種簡單有效的信號處理方法,是基于像素的腦腫瘤分割中的首選特征提取方法,此外利用對稱性模板(將正常人群的四個模態MRI做成圖譜經高斯平滑后,彈性變形分別配準到腦腫瘤病人相應的四個模態上形成不對稱特征。將病人的圖像和不對稱特征做差值,形成腦腫瘤病人的不對稱特征圖像。)也是一種很好的全局上下文敏感的特征提取方法。
然而,現有技術大都針對手術前腫瘤進行分割,很少有對手術后、腫瘤復發的圖像進行分割;缺乏對多個來源的分割結果進行相互參考的研究;此外,還缺乏對樣本點結構信息的合理利用。很多方法雖然能根據術前訓練圖像數據將缺血部分與增強部分區別開來且不需要實現配準,但實際上基于術后殘留的腫瘤部分與手術前相同的假設,沒有考慮實際空洞的形成對邊上組織的影響。
技術實現要素:
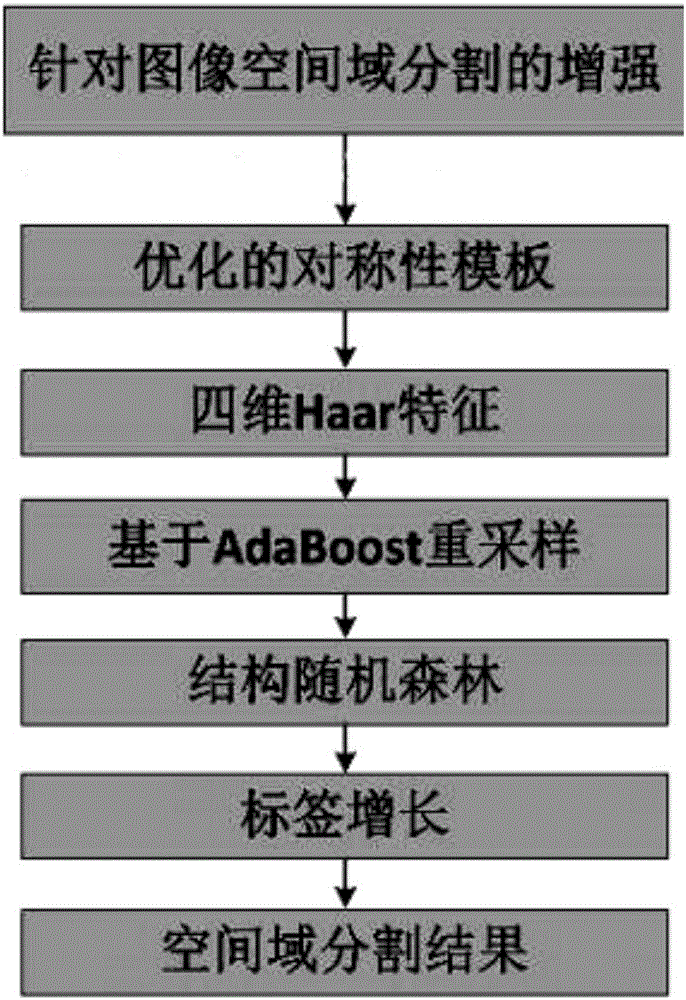
為了克服現有技術的不足,本發明提供了一種基于多模態MRI數據的腦瘤術后空間域分割方法,該分割方法基于AdaBoost重采樣的結構隨機森林算法提高了采樣的效率;建立人腦不同組織的對稱性模板,并利用四維Haar特征更能保證圖像的全局和局部特征,利用優化的相似性準則進行區域增長,從而提高局部區域的準確性。
為了實現上述目的,本發明采用的技術方案是:一種基于多模態MRI數據的腦瘤術后空間域分割方法,其特征在于,包括以下步驟:(1)獲得手術后的腦瘤MRI數據,對數據進行預處理,(2)將步驟(1)的數據映射到空間域上進行分割處理,所述空間域分割處理包括以下步驟:①構建正常人腦不同組織對稱性模板,②提取Haar結構特征,③將結構隨機森林方法結合AdaBoost框架,以圖像中的像素點為樣本,結構隨機森林方法輸入時以塊為單位輸入標簽,經步驟③獲得初步的概率結果后,④利用相似性區域增長算法增長標簽,獲得空間域分割結果。
進一步的,所述相似性區域增長算法如下所示,同時
其中,g是體素的相似性度量值,l是標簽,t為迭代點,x是體素的特征(如亮度),
兩個體素間的不同如下所示,
其中,β是一個調整參數;ρ(xi,xj)表示xi,xj兩點之間特征的歐式距離;
mean(ρ(xi,Ni))是xi和其每一個鄰接結點特征的歐式距離的平均,μ是經驗值。
采用上述方案,本發明針對腦瘤圖像分割中存在的腫瘤邊緣不清、采樣不完全造成分割結果偏小的情形,提出基于AdaBoost重采樣的結構隨機森林算法提高了采樣的效率;建立人腦不同組織的對稱性模板,并利用四維Haar特征更能保證圖像的全局和局部特征,利用優化的相似性準則進行區域增長,從而提高局部區域的準確性。
下面結合附圖對本發明作進一步描述。
附圖說明
附圖1為本發明具體實施例技術路線圖。
具體實施方式
本發明的具體實施例如圖1所示是基于多模態MRI數據的腦瘤術后空間域分割方法,其包括以下步驟:(1)獲得腦瘤手術后的腦瘤MRI數據,對數據進行預處理,(2)將步驟(1)的數據映射到空間域上進行分割處理,空間域分割處理包括以下步驟:①構建正常人腦不同組織對稱性模板,②提取Haar結構特征,③將結構隨機森林方法結合AdaBoost框架,以圖像中的像素點為樣本,結構隨機森林方法輸入時以塊為單位輸入標簽,經步驟③獲得初步的概率結果后,④利用相似性區域增長算法增長標簽,獲得空間域分割結果。
分割時按照以下步驟進行操作:首先分割出整個腫瘤區域,分割時按照步驟(1)-(2)操作;然后從整個腫瘤區域中再分割出壞死(Necrosis)、增強腫瘤(Enhancing tumor)、非增強腫瘤(Non-enhancing tumor)的合成區域,將水腫(Edema)區排除,分割時按照步驟(1)-(2)操作;再從合成區域中分割增強腫瘤(Enhancing tumor)區,分割時按照步驟(1)-(2)操作;合成區域分割出增強腫瘤(Enhancing tumor)區后,再繼續分割出壞死(Necrosis)區,剩下區域獲得非增強腫瘤(Non-enhancing tumor)區,分割時按照步驟(1)-(2)操作。
我們將空間域的分割算法轉換為像素的分類算法。分割問題看作是一個分類問題:在訓練集上獲得一個有關體素類別的推斷h,然后對測試集上的每一個體素進行分類,即有h(x(i):(i)→y(i)。
AdaBoost算法的優勢在于可以用各種方法構建子分類器,AdaBoost算法提供的是框架,而且提高精度的同時,無過擬合現象;但AdaBoost算法較難處理數據不均衡問題,而且,AdaBoost算法訓練所需樣本量大,訓練時間長。因此,作為最終的決策分類器AdaBoost算法在醫學圖像方面的應用不多,尤其是腦部MRI腫瘤分割方面。為了解決上述問題,我們將結構隨機森林方法應用到AdaBoost框架中去。由于我們是將分割問題看做是分類問題,以圖像中的像素點作為樣本,這樣的話所需樣本量和不均衡數據的問題就得到了解決。結構隨機森林輸入時以塊為單位來輸入標簽,這塊標簽在一定程度上就帶有了這塊內的上下文信息,隨機森林的結點分離函數也考慮了結構信息,與傳統的隨機森林相比,對圖像的結構把握得更好。
在利用結構隨機森林獲得初步的概率結果后,由于某些數據點并沒有被計算概率,將利用如下公式對所獲得的空間進行元胞自動機增長,其中的參數由已做好標簽的數據訓練獲得。
同時
這里g是體素的相似性度量值,l是標簽,t為迭代點,x是體素的特征(如亮度)。考慮到我們是以結構隨機森林對腫瘤整體的分割結果自動作為種子,為了增長算法不至于在necrosis部分和enhancing tumor交界處發生阻滯,我們用如下準則來進行表示兩個體素間的不同。
這里,β是一個調整參數,由訓練獲得;ρ(xi,xj)表示xi,xj兩點之間特征的歐式距離,由于我們采用了對稱性模板,所以這里的兩點的特征已經是原始四個模態的MRI與對稱性模板共同產生。這里
mean(ρ(xi,Ni))是xi和其每一個鄰接結點特征的歐式距離的平均,μ是經驗值,可以通過訓練得到。
本發明在空間域上,為精確進行腦腫瘤的分割,以圖像像素為樣本進行大量采樣提取特征,結構隨機森林輸入時以塊為單位來輸入標簽,這塊標簽在一定程度上帶有了這塊內的上下文信息,隨機森林的結點分離函數也考慮了結構信息,與傳統的隨機森林相比,對圖像的結構把握得更好;本發明采用正常人腦不同組織對稱性模板,基于AdaBoost框架使用結構隨機森林,提高采樣的效率;并采用相似度算法在已有初步分割結果的基礎上,進行區域增長。
本發明不局限于上述具體實施方式,本領域一般技術人員根據本發明公開的內容,可以采用其他多種具體實施方式實施本發明的,或者凡是采用本發明的設計結構和思路,做簡單變化或更改的,都落入本發明的保護范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!