單倍體玉米轉化的制作方法
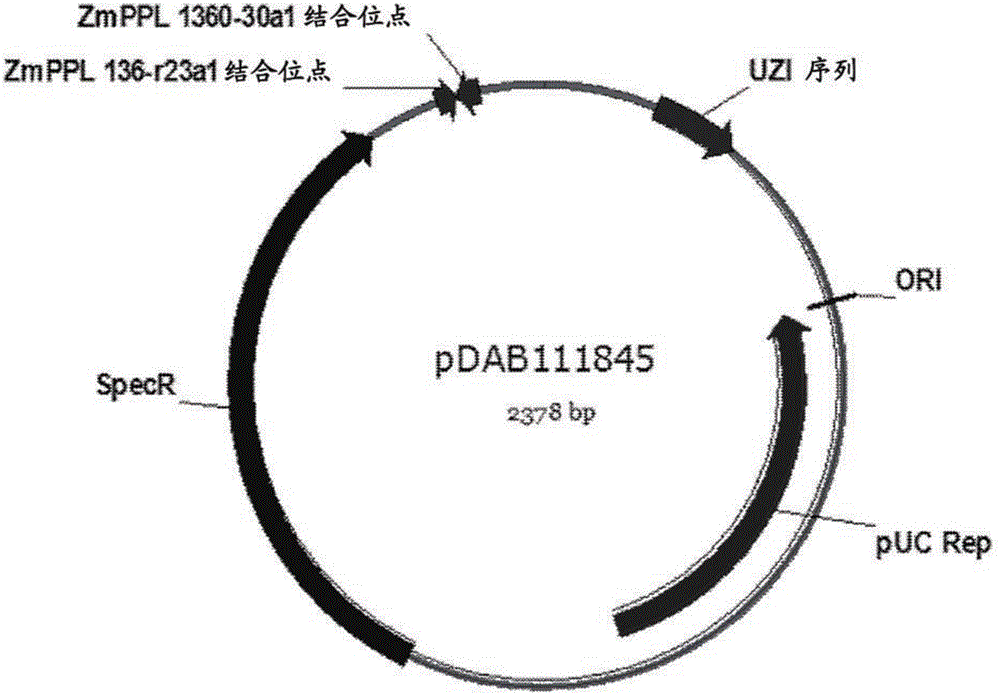
本公開一般地涉及植物、植物組織和細胞系、再生植物、和用于在其中引入和/或重排核酸的方法。提供了用于在玉米雄性來源的單倍體細胞中轉化(包括位點特異性插入)外源DNA和基因編輯的方法。發明背景轉基因玉米生產通常涉及通過土壤桿菌(Agrobacterium)共培養或微粒轟擊將轉基因遞送到二倍體體細胞組織,如未成熟合子胚的盾片區中。這些規程通常導致整合的轉基因在原代轉化體(T0)中“半合”并在T1植物世代中分離。將轉基因轉移到其它遺傳背景中需要通過回交實現漸滲。因而,此類將轉基因遞送到二倍體體細胞組織或細胞的基因組中并將轉基因轉移到其它遺傳背景中的方法有可能是費力、資源密集且耗時的。使用編碼位點特異性核酸酶的多核苷酸將轉基因位點特異性地遞送到二倍體植物基因組中的一個或多個預定位置(基因組編輯)可能造成另外一系列挑戰,這是因為二倍體基因組具有兩組相應的同源染色體,這些被編碼的位點特異性核酸酶通過切割一對同源染色體中的一條或兩條來修飾靶位點。由于切割位點的修復不完全造成的突變并不罕見。此外,由于基因組修復過程是基于模板的,修復過程可以使用外來的供體多核苷酸,也可以使用相應同源染色體上的等位序列作為模板。因此,在二倍體細胞中,相應的同源染色體上的等位序列可能與外來的供體多核苷酸競爭。當這一過程基于相應的同源染色體(而不是供體多核苷酸)而意外地修復了被切割的染色體時,會由此降低靶向轉基因整合的效率。已經描述了幾種植物轉化方法,其導致轉基因隨機整合到玉米的單倍體基因組中。這些方法包括通過聚乙二醇處理單倍體原生質體(Sukhapindaetal.,1993,PlantCellReports,13:63-68;Jardinaudetal.,1995),小孢子來源的胚樣結構的微粒轟擊(Protoplasma,187:138-143)和母本來源的胚的土壤桿菌共培養(美國專利號7,572,635)的轉基因的隨機整合。然而,仍然沒有人探索過玉米的單倍體基因組中的選定位置的穩定的位點特異性(靶向)修飾。因此,對玉米中的單倍體基因組進行穩定和靶向修飾的方法是為人期望的。此外,單倍體細胞中僅有一套染色體,即,對于每個給定基因沒有相應的等位序列,外來的供體多核苷酸作為模板容易為同源指導修復所獲得,而沒有相應同源染色體被當作修復模板的干擾,并且容易揭示突變。許多突變(例如敲除)的表型是隱性的,使得它們在二倍體組織中觀察不到,但可以在單倍體中觀察到。因此,在雄性來源的單倍體細胞系內借助位點特異性核酸酶進行轉化和誘變,隨后切割單倍體基因組DNA,并任選地在雄性來源的單倍體細胞系(例如小孢子來源的植物組織培養物的單倍體基因組)內靶向整合供體多核苷酸或靶向修飾特定序列(例如突變),對用于上述過程的組合物和方法仍然存在需要。因而,本公開提供了用于在雄性來源的單倍體細胞系(例如小孢子來源的植物組織培養物的單倍體基因組)內轉化和遞送位點特異性核酸酶的新組合物和方法。應用小孢子來源的植物組織培養物轉化方法可以提高植物基因組內位點特異性核酸酶整合的效率,從而減少篩選大量轉化事件的需要,進一步可降低完成這些類型的實驗的相關成本和人員時間。例如,小孢子來源的植物的單倍體基因組的轉化部署可以用于將供體DNA整合在特定基因組位點內,并且獲得純合植物,而不需要耗費金錢和人力篩選數萬個植物事件。此外,使用雄性單倍體細胞系進行位點特異性核酸酶介導的定向誘變可以為隱性突變的高效鑒定和分離創造條件。發明概述本公開部分基于意外發現了一種通過玉米單倍體組織或細胞中的位點特異性誘變或供體轉基因整合來穩定且靶向性地修飾單倍體基因組的方法。公開的基因組修飾方法可以與染色體加倍的方法一起使用,使位點特異性突變或轉基因在完全固定的遺傳背景中即時(instantaneously)變得純合。此外,本文公開的在單倍體組織或細胞中穩定地修飾基因組的方法可以比其它二倍體組織中的方法更高效。在二倍體組織中,在第一條染色體上的每個基因組序列在第二條染色體上具有相應的等位序列,等位序列在同源性指導的修復作用(homology-directedrepair)中充當模板,同源性指導的修復作用已經進化為可修復第一條染色體中插入的任何突變或轉基因。相比之下,單倍體組織或細胞缺失相應的第二條染色體,即它們缺少通過同源性指導的修復作用所用來去除新引入的突變或轉基因的修復模板。在一些情況下,外來的供體多核苷酸可以是同源性指導的修復作用最容易得到的模板,這樣,有助于確保期望的靶向修飾穩定整合到單倍體基因組中。此外,公開的方法還可用于揭示具有隱性表型的穩定基因組修飾突變,例如敲除和基因失活。在二倍體組織中,隱性表型不明顯,而在單倍體組織中,可以觀察到導致隱性表型的此類靶向基因組修飾。在一個方面中,本公開涉及用于修飾玉米基因組的方法,所述方法包括:提供玉米小孢子來源的、包含單倍體組織基因組的轉化感受態單倍體組織;將編碼位點特異性核酸酶的多核苷酸遞送至所述轉化感受態單倍體組織;并且確認所述單倍體組織基因組被編碼的位點特異性核酸酶所修飾。在一些實施方案中,轉化感受態單倍體組織是胚或愈傷組織。在公開的方法中,借助植物轉化方法將編碼所述位點特異性核酸酶多核苷酸的多核苷酸遞送至轉化感受態單倍體組織。在某些實施方案中,所述植物轉化方法包括下組的任何方法:微粒轟擊轉化法,土壤桿菌轉化法,磷酸鈣轉化法,聚凝胺(polybrene)轉化法,電穿孔轉化法,超聲轉化法,脂質體轉化法,顯微注射轉化法,裸DNA轉化法,質粒載體轉化法,病毒載體轉化法,碳化硅介導的轉化法,氣溶膠射束轉化法(aerosolbeamingtransformationmethod)、和PEG轉化法。在任何公開的方法中,位點特異性核酸酶多核苷酸編碼選擇的核酸酶,包括鋅指核酸酶,TALEN核酸酶,大范圍核酸酶和CRISPR核酸酶。在一些實施方案中,位點特異性核酸酶優先切割單倍體玉米基因組的基因組DNA靶區域。在具體實施方案中,切割基因組DNA的兩條鏈。在另一個實施方案中,切割基因組DNA的單鏈。在另外的實施方案中,任何前述方法可以進一步包括遞送供體多核苷酸,并將供體多核苷酸穩定整合在修飾的單倍體組織基因組中。在一些實施方案中,每個供體多核苷酸包含至少一個與單倍體組織基因組的基因組DNA靶區域至少85%相同的域。在另外的實施方案中,供體多核苷酸包含與單倍體組織基因組的基因組DNA靶區域中的兩個不同序列至少85%相同的兩個域。在本文中公開的任何用于修飾單倍體玉米基因組的方法的另外的實施方案中,小孢子來源的轉化感受態組織來自具有良種性能特征的玉米。例如,小孢子來源的轉化感受態組織可以來自良種玉米系與具有高小孢子培養反應的不同玉米系雜交而得來的雜種玉米。另外,在任何公開的方法中,單倍體組織基因組被修飾的確認包括進行基于PCR的測定法,Southern印跡測定法,Northern印跡測定法,蛋白質表達測定法,Western印跡測定法,ELISA測定法、或下一代測序測定法。來源于任何公開的方法的玉米小孢子的轉化感受態單倍體組織可以如下獲得:從玉米收獲含有小孢子的雄穗;在約4-12℃的溫度溫育所述雄穗;從所述雄穗分離含有小孢子的花藥;在花藥培養基中培養花藥以生成小孢子來源的胚;并且在愈傷組織培養基中培養所述小孢子來源的胚,從而生成小孢子來源的轉化感受態單倍體組織。在另一個實施方案中,可以用染色體加倍劑進一步處理包含經修飾的單倍體組織基因組的單倍體組織,從而生成包含經修飾的雙單倍體玉米基因組的雙單倍體玉米組織。可以將雙單倍體玉米組織培養或再生成包含經修飾的雙單倍體玉米基因組的雙單倍體玉米植物。此外,此類雙單倍體玉米植物對于單倍體組織的基因組修飾是純合的。在又一個方面中,本公開涉及用于靶向整合供體的方法,所述方法包括:提供包含單倍體組織基因組的玉米小孢子來源的轉化感受態單倍體組織;將一個或多個供體多核苷酸和一個或多個編碼位點特異性核酸酶的多核苷酸遞送至所述轉化感受態單倍體組織;以及確認一個或多個供體多核苷酸整合到單倍體組織基因組中且單倍體組織基因組由此被修飾。在一些實施方案中,轉化感受態單倍體組織是胚或愈傷組織。在這些方法中,將一個或多個供體多核苷酸和一個或多個編碼位點特異性核酸酶的多核苷酸遞送至轉化感受態單倍體組織可以通過植物轉化方法來實現。在一些實施方案中,所述植物轉化方法包括微粒轟擊轉化法,土壤桿菌轉化法,磷酸鈣轉化法,聚凝胺(polybrene)轉化法,電穿孔轉化法,超聲轉化法,脂質體轉化法,顯微注射轉化法,裸DNA轉化法,質粒載體轉化法,病毒載體轉化法,碳化硅介導的轉化法,氣溶膠射束轉化法和PEG轉化法。在另外的實施方案中,位點特異性核酸酶多核苷酸編碼選自下組的核酸酶:鋅指核酸酶,TALEN核酸酶,大范圍核酸酶和CRISPR核酸酶。在一些實施方案中,一個或多個多核苷酸編碼優選切割單倍體組織基因組的基因組DNA靶區域的位點特異性核酸酶。在另外的實施方案中,本文中公開的任何方法進一步包括一個或多個供體多核苷酸在單倍體組織基因組內的穩定整合。例如,一個或多個供體多核苷酸可以經由同源性指導的修復作用或通過非同源末端連接修復作用而整合在靶區域內。在本文中公開的任何用于修飾單倍體玉米基因組的方法中,小孢子來源的轉化感受態組織來自具有良種性能特征的玉米。例如,小孢子來源的轉化感受態組織來自雜種玉米,所述雜種玉米是良種玉米系與具有高小孢子培養反應的不同玉米系雜交而得來的。在本文中公開的用于修飾單倍體玉米基因組的任何方法中,單倍體組織基因組包括確認對單倍體組織基因組的整合包括進行基于PCR的測定法,Southern印跡測定法,Northern印跡測定法,蛋白質表達測定法,ELISA測定法或下一代測序測定法。在任何公開的實施方案中,進入單倍體組織基因組中的一個或多個供體多核苷酸可以賦予農藝學性狀(例如,編碼基因,當基因表達時提供具有農藝學性狀的玉米)。例如,農藝性狀可以選自殺蟲抗性性狀,除草劑耐性性狀,氮利用效率性狀,水利用效率性狀,營養質量性狀,DNA結合性狀和選擇標志物性狀。在任何公開的實施方案中,供體多核苷酸可以在玉米植物中穩定表達。此外,任何公開的將供體多核苷酸整合到單倍體組織基因組中的方法可以進一步包括用染色體加倍劑處理單倍體組織以產生包含加倍的單倍體組織,該加倍的單倍體組織包含整合的供體多核苷酸,并且該整合的供體多核苷酸是純合的。在另一個方面中,本公開涉及包含供體多核苷酸的植物。在一個實施方案中,植物包含單倍體基因組。在另一個實施方案中,所述植物包含雙單倍體基因組。此類植物可以從組織再生,所述組織包含本文中公開的任何方法的修飾的單倍體組織基因組或修飾的雙單倍體組織基因組。在另一方面,本公開涉及用于在玉米的單倍體基因組內引入突變的方法,所述方法包括:提供包含單倍體組織基因組的玉米小孢子來源的轉化感受態單倍體組織;將編碼位點特異性核酸酶的多核苷酸遞送至所述轉化感受態單倍體組織;并且確認單倍體玉米基因組包含由編碼的位點特異性核酸酶多核苷酸引入的突變。轉化感受態單倍體組織可以是胚或愈傷組織。可以經由植物轉化方法將一個或多個編碼位點特異性核酸酶的多核苷酸遞送至轉化感受態單倍體組織。植物轉化方法可以選自微粒轟擊轉化法,土壤桿菌轉化法,磷酸鈣轉化法,聚凝胺轉化法,電穿孔轉化法,超聲轉化法,脂質體轉化法,顯微注射轉化法,裸DNA轉化法,質粒載體轉化法,病毒載體轉化法,碳化硅介導的轉化法,氣溶膠射束轉化法和PEG轉化法。在任何公開的方法中,位點特異性核酸酶多核苷酸編碼核酸酶,包括鋅指核酸酶、TALEN核酸酶、大范圍核酸酶和CRISPR核酸酶。編碼的位點特異性核酸酶多核苷酸可以是優先在單倍體玉米基因組的靶區域處切割基因組DNA的多核苷酸。在任何公開的方法中,小孢子來源的轉化感受態組織可以來自具有良種性能特征的玉米。例如,小孢子來源的轉化感受態組織是來自雜種玉米,雜種玉米是良種玉米品系與具有高小孢子培養反應的不同玉米系雜交而得來的。在任何公開的方法中,確認單倍體玉米基因組被修飾包括進行基于PCR的測定法,Southern印跡測定法,Northern印跡測定法,蛋白質表達測定法,Western印跡測定法,ELISA測定法和下一代測序測定法。根據公開的方法引入的突變可以下調內源基因的表達。在一些實施方案中,內源基因的下調導致改變的代謝途徑。此外,由此將供體多核苷酸整合到單倍體組織基因組中的任何公開的方法可以進一步包括用染色體加倍劑處理單倍體組織以生成加倍單倍體組織,所述加倍單倍體組織包含整合供體多核苷酸,并且該整合供體多核苷酸是純合的。在一個方面中,本公開涉及包含引入的突變的植物。在一些實施方案中,所述植物包含單倍體組織基因組。在其它實施方案中,植物包含雙單倍體組織基因組。此類植物可以從根據本文中公開的任何方法生成的經修飾的單倍體組織或雙單倍體組織再生。在一個方面中,本公開涉及用于將一個或多個編碼位點特異性核酸酶的多核苷酸引入雄性來源的單倍體細胞系中的方法。在一些實施方案中,所述方法包括:提供轉化感受態的雄性來源的單倍體細胞系;將一個或多個編碼位點特異性核酸酶的多核苷酸遞送至該轉化感受態的雄性來源的單倍體細胞系;并確認該一個或多個編碼位點特異性核酸酶的多核苷酸修飾該雄性來源的單倍體細胞系的基因組。在一個實施方案中,雄性來源的單倍體細胞系是單倍體小孢子細胞系。在另一個實施方案中,將單倍體小孢子細胞系繁殖成胚或愈傷組織。在另一個實施方案中,該方法包括通過植物轉化方法將一個或多個編碼位點特異性核酸酶的多核苷酸遞送至雄性來源的單倍體細胞系。多核苷酸可以通過植物轉化方法,如例如生物射彈轉化法、土壤桿菌轉化法、磷酸鈣轉化法、聚凝胺轉化法、電穿孔轉化法、超聲轉化法、脂質體轉化法、顯微注射轉化法、裸DNA轉化法、質粒載體轉化法、病毒載體轉化法、碳化硅介導的轉化法、氣溶膠射束轉化法和PEG轉化法遞送。每個位點特異性核酸酶多核苷酸可以編碼選自鋅指核酸酶、TALEN核酸酶、大范圍核酸酶、和CRISPR核酸酶的核酸酶。在另一個實施方案中,所述方法包括遞送一個或多個編碼優先修飾基因組的基因組DNA靶區域的位點特異性核酸酶的多核苷酸。在具體實施方案中,基因組DNA靶區域的兩條鏈的單鏈被切割。在其它實施方案中,基因組DNA靶區域的單鏈被切割。在任何公開的包括遞送一個或多個供體多核苷酸的方法中,可以在修飾的基因組中整合穩定一個或多個供體多核苷酸。在某些實施方案中,每個供體多核苷酸包含至少一個與基因組的基因組DNA靶區域至少85%相同的域。在進一步的實施方案中,每個供體多核苷酸包含與基因組的基因組DNA靶區域中的兩個不同序列至少85%相同的兩個域。供體多核苷酸可以經由同源性指導的修復作用或通過非同源末端連接修復作用整合在基因組DNA靶區域內。在另一個實施方案中,通過基于PCR的測定法,Southern印跡測定法,Northern印跡測定法,蛋白質表達測定法,Western印跡測定法,ELISA測定法或下一代測序測定法確認編碼位點特異性核酸酶的多核苷酸修飾所述基因組。在另一個實施方案中,確認將一個或多個供體多核苷酸整合到基因組DNA靶區域中包括進行基于PCR的測定法,Southern印跡測定法,Northern印跡測定法,蛋白質表達測定法,Western印跡測定法,ELISA測定法和下一代測序測定法。在更進一步的實施方案中,任何公開的方法可以進一步包括獲得包含經修飾的雄性來源的單倍體細胞系的基因組的單倍體組織;用染色體加倍劑處理所述單倍體組織;生成包含經修飾的雙單倍體基因組的雙單倍體組織;并且將雙單倍體組織培養成包含經修飾的雙單倍體基因組的雙單倍體植物。在另一個實施方案中,雄性來源的單倍體細胞系獲自玉米植物。在任何公開的實施方案中,所述修飾的雙單倍體基因組是基因組切割的結果。附圖說明圖1提供了pDAB111879的質粒圖。該質粒圖是用于靶向基因組修飾的ZFN構建體的質粒圖。圖2提供了pDAB111845的質粒圖。該質粒圖是用于在單倍體原生質體中靶向整合的供體構建體的質粒圖。圖3提供了pDAB118783的質粒圖。該質粒圖是用于在單倍體愈傷組織細胞的特定基因組基因座內靶向aad-1整合的供體構建體的質粒圖。圖4提供了序列比對的圖示,顯示在PPL1切割位點處的插入和缺失,證明在轟擊單倍體愈傷組織后的靶向誘變。在比對中提供了例示缺失和插入的序列SEQIDNO:33至SEQIDNO:45。將這些改變的序列與SEQIDNO:32比較,SEQIDNO:32是鋅指核酸酶意圖結合并切割的基因組DNA靶序列。圖5提供了在秋水仙堿處理后來自二倍化愈傷組織的核的直方圖,證明有效的染色體加倍。發明詳述本公開提供了用于在源自玉米小孢子的轉化感受態單倍體組織中修飾玉米基因組的方法。該方法包括將一個或多個編碼位點特異性核酸酶的多核苷酸遞送至轉化感受態單倍體組織,并確認該一個或多個編碼的位點特異性核酸酶修飾單倍體玉米基因組。所述雄性來源的細胞系可以作為小孢子來源的植物組織培養物維持。小孢子來源的植物組織培養生成僅含有一套染色體的單倍體組織培養物。所述雄性來源的單倍體細胞系從雄性組織如小孢子和花粉或孢子體組織(例如親本單倍體胚)生成,并且可以作為胚或愈傷組織,懸浮液或原生質體培養物維持。在玉米中,雄核發育和單倍體植物生成的報道可追溯到20世紀70年代(Kuetal.,1978,Proc.Symp.PlantTissueCult.35-42),然而,雄性胚的低生成頻率以及與植物再生和染色體加倍相關的困難使得花藥或小孢子來源的植物培養物在應用育種中無法廣泛使用。這些基本問題中的許多已經隨著高反應性種質(Petolinoetal.,1988,Theor.Appl.Genet.76:157-159)和體外染色體加倍技術(Wanetal.,1991,Theor.Appl.Genet.77:889-892)的開發而得以克服,盡管在玉米中,這種技術已經在很大程度上已被棄之不用。本公開還提供了用于將供體多核苷酸靶向整合到來源于玉米小孢子的轉化感受態單倍體組織中的單倍體玉米基因組中的方法。該方法包括將一個或多個供體多核苷酸和一個或多個編碼位點特異性核酸酶的多核苷酸遞送至轉化感受態單倍體組織;并確認一個或多個供體多核苷酸整合到玉米的單倍體基因組中。本公開進一步提供了在來源于玉米小孢子的轉化感受態單倍體組織中的單倍體玉米基因組內引入突變的方法;將編碼一種或多種位點特異性核酸酶的多核苷酸遞送至所述轉化感受態單倍體組織;以及確認所述一個或多個編碼的位點特異性核酸酶修飾單倍體玉米基因組,其中通過切割突變單倍體玉米基因組,如基因組DNA內的插入或缺失的存在指示。在另一方面,本公開提供了用于修飾轉化感受態雄性來源的單倍體細胞系的基因組的方法。該方法包括將編碼位點特異性核酸酶的一個或多個多核苷酸遞送至轉化感受態雄性來源的單倍體細胞系,并確認編碼的位點特異性核酸酶修飾所述雄性來源的單倍體細胞系的基因組,其中雄性來源的單倍體細胞系的基因組通過切割而被修飾。定義除非另有定義,本文中使用的所有技術和科學術語的含義與本公開相關領域的普通技術人員的通常理解相同。在沖突的情況下,應當以包括定義的本申請為準。除非上下文另有要求,單數術語應當包括多個,并且復數術語應當包括單數。本文中提及的所有出版物,專利和其它參考文獻通過提及整體并入本文用于所有目的,如同每個單獨的出版物或專利申請具體并且單獨地指出通過提及并入一樣,除非僅指出通過提及并入專利或專利公開文本的特定部分。為了進一步闡明本公開,提供以下術語,縮寫和定義。如本文所使用的,術語“包含”、“包括”、“具有”、或“含有”或其任何其它變型意圖是非排他性的或開放式的。例如,包括列出的多個要素的組合物,混合物,工藝,方法,制品或裝置不一定僅限于那些要素,而是可以包括未明確列出的或這些組合物,混合物,工藝,方法,制品或裝置內在具有的其它元素。此外,除非明確相反指出,“或”是指包括性的或而不是排他性的或。例如,條件A或B由以下任何一個滿足:A是真(或存在)和B是假(或不存在),A是假(或不存在)和B是真(或存在),并且A和B兩者都是真(或存在)。此外,在本公開的實施方案的元件或組件之前的不定冠詞“一個”和“一種”意圖關于實例的數量(即,元件或組件的出現)是非限制性的。因此,“一個”或“一種”應當被理解為包括一個或至少一個,并且元素或組件的單數詞語形式也包括復數,除非該數量明顯意味著是單數。如本文中所使用,術語“發明”或“本發明”是非限制性術語,并且不旨在表示特定發明的任何單個實施方案,而是涵蓋如本申請中公開的所有可能的實施方案。如本文中所用,術語“植物”包括全植物和植物的任何后代,細胞,組織或部分。術語“植物部分”包括植物的任何部分,包括例如但不限于:種子(包括成熟種子和未成熟種子);植物插枝;植物細胞;植物細胞培養;植物器官(例如花粉,胚,花,果實,芽,葉,根,莖和外植體)。植物組織或植物器官可以是組織成結構或功能單元的種子,原生質體,愈傷組織或任何其它組的植物細胞。植物細胞或組織培養物可以能夠再生具有獲得細胞或組織的植物的生理和形態特征的植物,以及再生具有與植物基本相同的基因型的植物。相反,某些植物細胞不能再生生成植物。植物細胞或組織培養物中的可再生細胞可以是胚,原生質體,分生細胞,愈傷組織,花粉,葉,花藥,根,根尖,絲,花,谷粒(kernel),穗,穗軸,殼或莖。植物部分包括可收獲部分和可用于繁殖后代植物的部分。可用于繁殖的植物部分包括例如但不限于:種子;果實;插枝(cutting);幼苗;塊莖;和根莖。植物的可收獲部分可以是植物的任何有用部分,包括例如但不限于:花;花粉;幼苗;塊莖;葉;莖;果實;種子;和根。植物細胞是植物的結構和生理單位,包括沒有細胞壁的原生質體細胞和具有細胞壁的植物細胞。植物細胞可以是分離的單細胞或細胞聚集體(例如,脆弱的愈傷組織和培養的細胞)的形式,并且可以是高等組織單元(例如植物組織,植物器官,和植物)的一部分。因此,植物細胞可以是原生質體,生成配子的細胞或可以再生成全植物的細胞或細胞集合。因而,在本文的實施方案中,種子——其包含多個植物細胞并能夠再生成全植物——視為“植物細胞”。如本文中使用,術語“分離的”是指生物組分(包括核酸或蛋白質)已經與該生物組分天然存在的生物體的細胞中的其它生物組分(即,其它染色體和染色體外DNA和RNA,和蛋白質)分開、與上述其他生物組分分別制備。如本文中使用的,術語“純化的”就核酸分子而言,不需要是絕對純的(比如均質的制劑);而是表明序列相對于其天然細胞環境更純(與天然水平相比,該水平應該大至少2-5倍,例如就濃度或基因表達水平而言)。要求保護的DNA分子直接從總DNA或從總RNA獲得。另外,cDNA克隆不是天然存在的,而是優選通過對部分純化的天然存在的物質(信使RNA)進行人為操作而獲得。從mRNA構建cDNA文庫涉及創建文庫。通過對攜帶cDNA文庫的細胞克進行隆選擇,可以從文庫中生成單個cDNA克隆。因此,包括從mRNA構建cDNA文庫和選擇不同cDNA克隆的方法生成天然信使的約106倍的純化。同樣,可以將啟動子或基因DNA序列克隆到質粒中。此類克隆不是天然存在的,而是優選通過操作部分純化的天然存在的物質如基因組DNA文庫獲得。因此,在這些技術中有利于純化至少一個數量級,優選兩個或三個數量級,更優選四個或五個數量級。類似地,“合成”代表已經發生組分DNA序列的化學或功能變化的指示。已經“被合成”的核酸分子和蛋白質包括通過PCR擴增或通過重組方法生成的核酸分子和蛋白質,其中純化的多核苷酸通過摻入質粒或載體內而被進一步修飾。術語“合成的”還包括通過重組DNA方法在宿主細胞(例如植物細胞)中制備的核酸和蛋白質,以及化學合成的核酸分子,蛋白質和肽。在工程化改造基因以在植物中表達的過程中,可以確定預期的宿主植物的密碼子偏愛,例如通過使用公眾可獲得的DNA序列數據庫尋找關于植物基因組的密碼子分布或者各種植物基因的蛋白質編碼區的信息。一旦在紙上或在計算機上設計了優化的(例如植物優化的)DNA序列,則可以在實驗室中合成序列上精確地對應于設計序列的真實DNA分子。此類合成核酸分子可以接受分子克隆和以其它方式操作,就像它們來源于自然或天然來源一樣。如本文中使用,術語“多核苷酸”、“核酸”和“核酸分子”可互換使用,并且可以包括:單個核酸;多個核酸;其核酸片段,變體或衍生物;和核酸構建體(例如,信使RNA(mRNA)和質粒DNA(pDNA))。多核苷酸或核酸可以含有全長cDNA序列或其片段的核苷酸序列,包括未翻譯的5'和/或3'序列和編碼序列。多核苷酸或核酸可以由任何多核糖核苷酸或多脫氧核糖核苷酸構成,其可以包含未修飾的核糖核苷酸或脫氧核糖核苷酸或修飾的核糖核苷酸或脫氧核糖核苷酸。例如,多核苷酸或核酸可以由單鏈和雙鏈DNA;作為單鏈和雙鏈區域的混合物的DNA;單鏈和雙鏈RNA;和作為單鏈和雙鏈區域的混合物的RNA構成。包含DNA和RNA的雜合分子可以是單鏈,雙鏈或單鏈和雙鏈區的混合物。前述術語還包括多核苷酸或核酸的化學,酶和代謝修飾形式。應當理解,特定的DNA還指其互補序列,其序列根據脫氧核糖核苷酸堿基配對的規則確定。如本文中使用的,術語“基因”是指編碼功能產物(RNA或多肽/蛋白質)的核酸。基因可以包括編碼功能產物的序列之前(5'非編碼序列)和/或之后(3'非編碼序列)的調節序列。如本文中使用的,術語“編碼序列”是指編碼特定氨基酸序列的核酸序列。“調節序列”是指位于編碼序列的上游(例如,5'非編碼序列),內部或下游(例如3'非編碼序列),影響相關的編碼序列的轉錄、RNA加工或穩定性或翻譯的核苷酸序列。調節序列包括例如但不限于:啟動子;翻譯前導序列;內含子;多腺苷酸化識別序列;RNA加工位點;效應器結合位點;和莖-環結構。如本文中使用,術語“多肽”包括單個多肽,復數個多肽及其片段。該術語是指由通過酰胺鍵(也稱為肽鍵)線性連接的單體(氨基酸)構成的分子。術語“多肽”是指兩個或更多個氨基酸的任何一條或多條鏈,并且不是指產物的特定長度或大小。因此,肽,二肽,三肽,寡肽,蛋白質,氨基酸鏈和用于指兩個或多個氨基酸的一條或多條鏈的任何其它術語包括在“多肽”的定義內,并且前述術語在本文中與“多肽”可互換使用。多肽可以從天然生物來源純化或通過重組技術生成,但特定多肽不一定從特定核酸翻譯。多肽可以以任何適當的方式生成,包括例如但不限于通過化學合成。如本文中使用,術語“天然的”是指在自然界中與其自身調節序列(若有的話)一起發現的多核苷酸,基因或多肽的形式。術語“內源的”是指多核苷酸,基因或多肽在生物體中或生物體基因組中在其自然位置中的天然形式。相比之下,術語“異源”是指通常不在其參照(宿主)生物體中的位置處發現的多核苷酸,基因或多肽。例如,異源核酸可以是通常在參照生物體中在不同基因組位置處發現的核酸。作為另一個實例,異源核酸可以是在參照生物體中通常不存在的核酸。包含異源多核苷酸、基因或多肽的宿主生物體可以通過將異源多核苷酸、基因或多肽導入宿主生物體中來生成。在具體的例子中,異源多核苷酸包括天然編碼序列或其部分,其以不同于相應天然多核苷酸的形式被重新導入來源生物體中。在具體的例子中,異源基因包括天然編碼序列或其部分,其以不同于相應天然基因的形式重新導入來源生物體中。例如,異源基因可以包括作為被重新導入天然宿主的嵌合基因的一部分的天然編碼序列,所述嵌合基因包含非天然調節區。在具體的例子中,異源多肽是以不同于相應天然多肽的形式重新導入來源生物體中的天然多肽。異源基因或多肽可以是這樣的基因或多肽,其包含功能性多肽或編碼功能性多肽的核酸序列,該功能性多肽或編碼功能性多肽的核酸序列與另一種基因或多肽融合,生成嵌合多肽或融合多肽或編碼嵌合多肽或融合多肽的基因。具體實施方案的基因和蛋白質包括具體示例的全長序列和這些序列的部分、區段、片段(包括連續片段,以及與全長分子相比的內部和/或末端缺失)、變體、突變體、嵌合體和融合物。“內源的”是指源自生物體或細胞內的材料。“外源的”是指源自生物體或細胞外部的材料。如本文中使用的,“外源”意指來自除受體細胞或組織之外的來源的任何核酸,而不管相似(但不相同)核酸是否可能已經存在于受體細胞或組織中。如本文中使用,術語“修飾”可以指特定參照多核苷酸的變化,導致由參照多核苷酸編碼的多肽的活性的降低、基本上消除或消除。或者,術語“修飾”可以指參照多核苷酸的變化,導致由參照多核苷酸編碼的多肽的活性增加或增強,以及參照多肽的變化,導致參照多肽的活性增加或增強。當用于描述位點特異性核酸酶的活性時,“修飾”可意指參照分子的一部分的切割(例如,基因組DNA被切割;基因組DNA的雙鏈或單鏈被切割)。如前所述的變化可以導致例如但不限于:參照分子的一部分被刪除;參照分子突變(例如通過自發誘變,通過隨機誘變,通過由增變基因引起的誘變,以及通過轉座子誘變);參照分子的一部分吧取代;參照分子中插入元件;參照分子的表達下調;參照分子的細胞位置改變;參照分子的狀態改變(例如,通過參照多核苷酸的甲基化,以及通過參照多肽的磷酸化或泛素化);參照分子的輔因子除去;靶向參照分子的反義RNA/DNA的引入;靶向參照分子的干擾RNA/DNA的引入;參照分子的化學修飾;參照分子的共價修飾;用UV輻射或X射線照射參照分子;改變參照分子的同源重組;改變參照分子的有絲分裂重組;參照分子的啟動子的置換;和/或任何前述的組合。在具體實例中,可以通過比較參照多核苷酸或多肽的序列與同源(例如,同源的酵母或細菌)多核苷酸或多肽的序列,并且最大化高同源性區域(保守區域)或共有序列中進行的修飾的數目,來尋求哪些核苷酸或氨基酸殘基可以被修飾的指導。術語“啟動子”是指能夠控制核酸編碼序列或功能性RNA的表達的DNA序列。在例子中,受控編碼序列位于啟動子序列的3'。啟動子可以全部來源自天然基因,啟動子可以由來源于不同的天然存在啟動子的不同元件構成,或者啟動子甚至可以包含合成的DNA片段。本領域技術人員應當理解,不同的啟動子可以指導基因在不同組織或細胞類型中、或在不同的發育階段、或者響應不同的環境或生理條件表達。所有上述啟動子均有已知的例子,并且在本領域中已被用于控制異源核酸的表達。在大多數時候指導基因在大多數細胞類型中表達的啟動子通常被稱為“組成性(型)啟動子”。此外,盡管本領域技術人員(在許多情況下不成功)嘗試描繪調節序列的確切邊界,但是人們已經開始理解,不同長度的DNA片段可以具有相同的啟動子活性。可以使用本領域技術人員熟悉的技術測定特定核酸的啟動子活性。術語“可操作地連接”是指核酸序列在單個核酸上的聯合,其中核酸序列之一的功能受另一個影響。例如,當啟動子能夠實現編碼序列的表達(例如,編碼序列在啟動子的轉錄控制下)時,啟動子與編碼序列可操作地連接。編碼序列可以以有義或反義方向可操作地連接到調節序列。如本文中使用,術語“表達”可以指源自DNA的有義(mRNA)或反義RNA的轉錄和穩定積累。表達還可以指mRNA翻譯成多肽。如本文中使用的,術語“過表達”是指高于相同基因或相關基因的內源表達的表達。因此,如果異源基因的表達高于可比的內源基因的表達,那么它是“過表達的”。如本文中使用,術語“轉化”是指將核酸或其片段轉移和整合到宿主生物體中,導致遺傳上穩定的遺傳。含有轉化核酸的宿主生物稱為“轉基因的”,“重組的”或“經轉化的”生物體。已知的轉化方法包括例如:根癌土壤桿菌(Agrobacteriumtumefaciens)或發根土壤桿菌(A.rhizogenes)介導的轉化;磷酸鈣轉化;聚凝胺轉化;原生質體融合;電穿孔;超聲波方法(例如聲致穿孔(sonoporation));脂質體轉化;顯微注射;用裸DNA的轉化;用質粒載體轉化;用病毒載體轉化;生物射彈轉化(微粒轟擊);碳化硅WHISKERS介導的轉化;氣溶膠射束;和PEG介導的轉化。如本文中使用,術語“導入”(在將核酸導入細胞中的背景下)包括轉化細胞,以及使包含核酸的植物與第二植物雜交,使得第二植物含有核酸,如可利用常規植物育種技術進行的。此類育種技術是本領域已知的。關于植物育種技術的討論,參見Poehlman(1995)BreedingFieldCrops,4thEdition,AVIPublicationCo.,WestportCT。回交方法可以用于將核酸導入植物中。該技術已經使用了幾十年來將性狀引入植物中。回交(和其它植物育種方法)的描述的例子可以參見例如Poehlman(1995),見上文;及Jensen(1988)PlantBreedingMethodology,Wiley,NewYork,NY。在示例性回交方案中,將感興趣的原始植物(“輪回親本”)與攜帶待導入的核酸的第二植物(“非輪回親本”)雜交。然后將來自該雜交的所得后代再次與輪回親本雜交,并且重復該過程,直到獲得這樣的轉化的植物,在該轉化的植物中不但有來自非輪回親本的核酸,還恢復了輪回親本的基本上所有的期望形態和生理特征。如本文中使用的,術語“同基因”是指具有基本上相同的基因型(例如,不超過1個基因在個體之間不同)的兩個植物個體(或其部分,例如種子,細胞)。如本文中使用的,術語“穩定整合”或“穩定轉化”“遺傳穩定遺傳”或“穩定地”是指在生物體的基因組內引入核酸或多核苷酸區段(通常是異源核酸序列或基因),所述生物體例如為先前不含有該核酸或多核苷酸區段的植物、植物組織、植物細胞器(即質體或葉綠體)或植物細胞。所得的整合固定于植物的基因組中,并且可以傳遞到后代植物中。優選地,轉化導致核酸序列穩定整合到植物的基因組中。如本文中使用,術語“基因組”包括核基因組、質體基因組和線粒體基因組。相比之下,“瞬時轉化”是指將核酸片段引入宿主生物體的核或含DNA的細胞器中,導致基因表達而沒有遺傳上穩定的遺傳。“結合”是指大分子(例如,蛋白質和核酸之間)的序列特異性的、非共價相互作用。結合相互作用不需要所有組分都是序列特異性的(例如,與DNA主鏈中的磷酸殘基接觸),只要整個相互作用是序列特異性的即可。此類相互作用通常以10-6M-1或更低的解離常數(Kd)為特征。“親和力”是指結合的強度:增加的結合親和力與較低的Kd相關。“切割”是指DNA分子的共價主鏈的斷裂。切割可以通過多種方法引發,包括但不限于磷酸二酯鍵的酶促或化學水解。單鏈切割和雙鏈切割都是可能的,并且雙鏈切割可以作為兩個不同的單鏈切割事件的結果發生。DNA切割可以導致平末端或交錯末端的生成。在某些實施方案中,融合多肽用于靶向雙鏈DNA切割,使得基因組DNA被修飾。如本文中使用的,術語“質粒”和“載體”是指一種染色體外元件,其可以攜帶一個或多個不是細胞中心代謝的一部分的基因。質粒和載體通常是環狀雙鏈DNA分子。然而,質粒和載體可以是單鏈或雙鏈DNA或RNA的線性或環狀核酸,并且可以源自任何來源,其中許多核苷酸序列已經連接或重組成獨特的構造,該構造能夠將啟動子片段和編碼DNA序列連同任何合適的3'非翻譯序列一起導入細胞。在實例中,質粒和載體可以包含自主復制序列、基因組整合序列和/或噬菌體或核苷酸序列。術語“融合蛋白”表明蛋白質包括來源自超過一種親本蛋白質或多肽的多肽組分。通常,融合蛋白從融合基因表達,其中編碼來自一種蛋白質的多肽序列的核苷酸序列以符合讀框的方式附加到編碼來自另一種不同蛋白的多肽序列的核苷酸序列,并且任選地通過接頭與后者分開。然后,融合基因可以由重組宿主細胞表達為單一蛋白質。“單倍體”是指具有一套(n)染色體的植物細胞、組織或植物。“雙單倍體”或“加倍單倍體”或“二倍體”指來源自單倍體的植物細胞、組織或植物。雙單倍體具有兩套(2n)染色體,并且通常是純合的。然而,相比于通常在雙二倍體中觀察到的絕對純合性,DNA中的突變、缺失或插入或其它類似修飾有可能導致一些偏離。類似地,本領域技術人員可以通過隨機或靶向突變、缺失、插入,或通過改組DNA或其部分,來有意地修飾雙單倍體DNA。此類“經修飾的雙單倍體”包括在本公開內容中。如果想要的話,也可以使用本公開的方法獲得多倍體。多倍體將具有三套或更多套染色體,并且除了上面討論的修飾外,也應該是純合的。“染色體加倍劑”是指使得細胞中染色體數目加倍(例如,從單倍體到二倍體或二倍體到四倍體等)的化學品。此類試劑通常是抗微管劑,如秋水仙堿,神經酰胺或APM(甲基胺草磷(amiprophos-methyl))。氧化亞氮也被報道為加倍劑(美國專利申請2003/0005479,其全部內容通過提及并入本文)。本領域技術人員熟悉可以引起染色體加倍(例如通過阻斷正常細胞周期分裂等)的化合物。“愈傷組織”是指細胞或組織的去分化增殖團塊。“I型愈傷組織”是指作為形態上緊湊的玉米愈傷組織的愈傷組織,其中整株植物可以通過器官發生、胚發生、或兩者的組合而再生。“II型愈傷組織”是指形態學上脆弱的、高度胚發生性的玉米愈傷組織(Armstrong和Green,Planta.164:207-214.1985)。“成熟胚”是指可以在授粉后大約15天以后獲得,并且當在體外培養時通常不產生可再生的愈傷組織的合子胚。“未成熟胚”是指可以在授粉后約15天以內獲得,并且當在體外培養時通常可以產生可再生的愈傷組織的合子胚。術語“合子胚”用于涵蓋種子、從種子提取的成熟胚、成熟胚、或能夠萌芽的未成熟胚。“胚發生培養物”或“胚發生細胞”或“胚發生組織”或“胚”或“胚樣結構”是指能夠經培養的再生成植物的植物細胞和組織。“植物生長調節劑或植物激素”是指影響植物生長的化合物。植物生長調節劑包括但不限于生長素、細胞分裂素、ABA、赤霉素、乙烯、油菜素類固醇和多胺。生長素在低濃度下影響芽和根的延伸,但在更高水平抑制生長。常用的生長素包括毒莠定(picloram)(4-氨基-3,5,6-三氯吡啶甲酸),2,4-D(2,4-二氯苯氧基乙酸),IAA(吲哚-3-乙酸),NAA(α-萘乙酸)和麥草畏(dicamba)(3,6-二氯茴香酸)。細胞分裂素導致細胞分裂、細胞分化和芽分化。常用的細胞分裂素包括激動素、BA(6-芐基氨基嘌呤)、2-ip(2-異戊烯基腺嘌呤)、BAP(6-芐基氨基嘌呤),噻苯隆(TDZ),玉米素核苷和玉米素。“單子葉植物”或“單子葉”是指具有單個子葉的植物。例子包括谷物,如玉米,稻,小麥,燕麥和大麥。“表型”是指由于生物體的基因組(包括非基因組DNA和RNA,如質粒和人工染色體)和/或細胞器中的核酸的表達(或無表達),而由生物體展現出的性狀。“再生”是指從植物細胞或組織培養出植物的過程。“選擇標志物”或“可篩選標志物”是指這樣核酸序列,其表達賦予含有該核酸序列的細胞,組織或植物的易于鑒定的表型。“孢子體”是指生命周期階段中的植物,其特征在于具有雙倍染色體數目。這與包括小孢子和花粉在內的“配子體”相反。來源于雄性來源的單倍體細胞系的組織通常,基因組的倍性水平指存在于細胞核內的染色體套數。倍性水平可能隨著構成生物體的細胞類型和/或細胞來源而變化。單倍體數(n)是在生物體內僅存在一套染色體的指示。雙二倍體或二倍體數(2n)是在生物體內存在兩套染色體的指示。對于一些生物體,特別是植物物種,含有更大的染色體套數,例如三倍體(3n),四倍體(4n),五倍體(5n)和六倍體(6n),是常見的。此類增加的染色體套數的實例,如三倍體或更多者,通常稱為多倍體。通常在生物體的整個生命周期中,二倍體(2n)多細胞階段與單倍體(n)多細胞期交替出現。生物體生命周期的單倍體(n)階段被認為是配子體階段,例如配子生成。相比之下,生物體生命周期的二倍體(2n)階段被視為孢子體階段,例如產孢子。在孢子體階段中,生物體通過稱作減數分裂的過程生成單倍體(n)的小孢子(即孢子)。得到的小孢子可以生成配子,例如精子核,其在受精過程中與由大孢子生成的其它配子(例如卵子核)融合,生成二倍體合子。在植物中,小孢子在雄性生殖器官中生成。雄性生殖器官稱為花藥。花藥生成單倍體小孢子,單倍體小孢子成熟成為包含精子核的花粉。花粉代表著植物生命周期中一段短暫的雄性配子體階段的開始,該階段中兩個精子核被遞送到胚珠的胚囊中,用于進行雙受精和隨后的胚和胚乳形成。盡管高等植物生命周期的這個階段通常僅包括幾次細胞分裂,但是在某些實驗條件下,可以誘導小孢子發育改變而生成胚樣結構,中間沒有受精。因而,這些胚樣結構是單倍體(n)。此過程稱為單雄生殖(androgenesis),是名為花藥或小孢子培養的體外技術的生物學基礎。在一個實施方案中,提供了轉化感受態雄性來源的細胞系。在隨后的實施方案中,從所述轉化感受態雄性來源的細胞系獲得單倍體小孢子細胞系。在另一個實施方案中,所述轉化感受態單倍體組織來源自玉米小孢子。花藥來源的培養物提供了在意圖用于生產育種品系的植物中快速誘導純合性的方法。花藥培養包括從植物中分離未成熟的花藥,并將它們置于培養基上,培養基誘導花藥內通常將注定成為花粉粒的細胞,即小孢子,開始分裂并形成可從中再生植物的細胞培養物。關于花藥培養的一般討論,參見J.M.Dunwell,“AntherandOvaryCulture”,于S.W.J.Bright和M.G.K.Jones,(編),CerealTissueandCellCulture,MartinusNijhoffPublisher,1985,Dordrecht,pp.1-44。所得的培養物是單倍體,并且僅含有來自原始植物的單套染色體。來源自這些培養物的植物是不育的,除非發生染色體加倍(自發地或通過誘導)以創建完全能育且完全近交的雙倍單倍體。在過去幾十年中已經報道了許多以生成單倍體植物為目標的配子體細胞的體外培養的研究。也已經公開了大量的綜述,書章和研討會會刊(一般見Chu,“HaploidsinPlantImprovement”,于I.K.Vasil,W.R.Scowcroft,K.J.Frey(eds.),PlantImprovementandSomaticCellGenetics,NewYork:AcademicPress,1982,pp.129-158;Heberle-Bors,1985,“InVitroHaploidFormationofPollen:ACriticalReview”,Theor.Appl.Genet.71:361-374;及Hu和Yang,“HaploidsofHigherPlantsinVitro.”Berlin,Heidelberg,Springer-Verlag,1986)。花藥培養代表了方法,通過該方法在理論上可以在體外從花藥和/或小孢子直接生成大量的單倍體個體。參見Kelleretal.,“Haploidsfromgametophyticcells--recentdevelopmentsandfutureprospects”,于C.E.Green,D.A.Somers,W.P.Hackett,D.D.Biesoer(編),PlantTissueandCellCulture,AlanRLiss,NewYork,pp223-241,1986。單倍體可以通過花藥、小孢子、子房和胚珠的培養從雄性和雌性配子體細胞中再生。陽性體外響應將導致胚和/或愈傷組織的發育,從胚和愈傷組織可以再生植物。體外培養期間的早期事件已經在細胞學,超微結構和生物化學水平上得到了表征(Chenetal.,1984,“SegmentationPatternsandMechanismsofGenomeMultiplicationinCulturedMicrosporesofBarley”,J.Can,Genet.Cytol.,26:475-483;Raghavan,1984,“ProteinSyntheticActivityduringNormalPollenDevelopmentandDuringInducedPollenEmbryogenesisinHyoscyamusniger”,J.CanBot.,62:2493-2513;Huang,“UltrastructuralAspectsofPollenEmbryogenesisinHordeum,TriticumandPaeonia”,1986)。在另外的實施方案中,來源自雄性來源的細胞系(例如玉米小孢子)的單倍體組織是胚或愈傷組織。在進一步的實施方案中,提供的方法可以經歷,也可以不經歷愈傷組織形成階段。可以將單倍體胚置于“非愈傷組織促進培養基”上。術語“非愈傷組織促進培養基”是指不支持去分化的細胞或組織塊增殖的培養基。優選的“非愈傷組織促進培養基”用于胚搶救,其含有本領域中公知的典型的鹽和維生素配方。此類胚搶救或胚培養物含有很少或不含生長素(綜述參見Raghaven,V.,1986,Biol.Rev.,41:1-58)。在一些實施方案中,胚成熟培養基也代表另一種優選的“非愈傷組織促進培養基”。胚成熟培養基用于促進體外培養的胚的發育,防止過早萌發,并且通常含有標準的鹽/維生素配方(取決于物種),升高的糖水平和/或外源添加的脫落酸,很少或沒有生長素。另一種類型的培養基用于芽培養或多芽增殖。此多芽培養基可以同樣含有極少量或減量的生長素,但含有升高水平的細胞分裂素,能促進分生組織增殖和生長。已經采用花藥培養獲得了超過200個物種的小孢子來源的愈傷組織、胚和植物(Maheshwarietal.,1982,“HaploidsfromPollenGrains-RetrospectandProspect”,Amer.J.Bot.,69:865-879)。然而,花藥培養反應性在物種之間變化相當大。已經發現,反應性花藥(每100個鋪板的花藥中形成胚和/或愈傷組織的花藥)的最高產率在小麥中為87%(A.M.Wei,1982,“PollenCallusCultureinTriticumaertivum”,Theor.Appl.Genet.,63,pp.71-73),稻中為67%(S.L.Lin和H.S.Tsay,1983,J.Agr.Res.,China,在Dunwell中引用,1985),玉米中為17%(Tingetal.,1981,“ImprovedAntherCultureofMaize”(ZeamaysL.),PlantScienceLett.,23,pp.139-145),在大麥中為1%(Z.H.Xu和N.Sunderland,1982,“InnoculationDensityintheCultureofBarleyAnthers”,Scient.Sinic.,25,pp.961-968)。在黑麥中,每100個花藥觀察到43個發育結構(G.Wenzeletal.,1977,“IncreasedInductionandChromosomeDoublingofAndrogeneticHaploidRye”,Theor.Appl.Genet.,51,pp.81-86)。每100個培養花藥的生成綠色植物的愈傷組織的頻率在小麥中為72%(J.W.Ouyangetal.,1983,“TheResponseofAntherCulturetoTemperatureinTriticumAestivum”,Theor.Appl.Genet.,66,pp.101-109),在稻中為12%(L.J.Chenetal.,“MediumEvaluationforRiceAntherCulture”,收錄于A.Fujiwara(編),“PlantTissueCulture”,pp.551-551.Jap.Assoc.PlantTissueCultureTokyo,1982),在大麥中為10%(K.N.Kao,“PlantFormationfromBarleyAntherCultureswithFicollMedia”,Z.Pflanzenzuchtg.,103,1981,pp.437-443)。在另一個實施方案中,小孢子來自具有優良性能特征的玉米。在該實施方案的一個方面中,小孢子來自雜種玉米,所述雜種玉米是優良玉米品系與不同的具有高小孢子培養反應的玉米品系雜交而得到的。如美國專利No.5,306,864(在此通過提及整體并入)美國專利號No.5,602,310(本文通過提及整體并入)中提供的,花藥培養物作為玉米(玉蜀黍(ZeamaysL.))中的單倍體育種手段的應用容易推廣到不同的玉米基因型,包括優良性能系。能夠用來鑒定表現出對花藥培養物增強的應答的玉米種質的方法可以轉用于增加其它挑選的基因型中的花藥可培養性。此類方法是本領域中容易已知的,并且可以用于將玉米種質(包括優良性能品系)轉化成從培養的花藥和/或小孢子生成高水平的單倍體和/或雙單倍體組織培養物的植物。染色體加倍在一個實施方案中,任何公開的生成具有經修飾的單倍體組織基因組的單倍體植物組織的方法還包括用染色體加倍劑處理經修飾的單倍體組織以生成雙單倍體植物組織。在某些實施方案中,如此生成的雙單倍體組織包含就在單倍體基因組中生成的修飾(例如,整合的供體多核苷酸或突變)而言是純合的基因組。在另一個實施方案中,將包含經修飾的雙單倍體基因組的玉米組織繁殖成對基因組修飾而言為純合的成熟植物。染色體加倍的方法公開于Antoine-Michard,S.etat,Plantcell,tissueorgancult.,Cordrecht,theNetherlands,KluwerAcademicPublishers,1907,48(3):203-207;Kato,A.,MaizeGeneticsCooperationNewsletter1897,38-37;及Wan,Y.etal.,Theor.Appl.Genet.,1980,77:889-892,Wan,Y,etal.,Theor.Appl.Genet.,1991,81:205-211。其公開內容通過提及并入本文。典型的方法包括使細胞與秋水仙素、抗微管劑或抗微管除草劑、拿草特(pronamide)、氧化亞氮或任何有絲分裂抑制劑接觸,以創建純合的雙重單倍體細胞。其它作用劑可以與有絲分裂抑制劑一起使用以改善加倍效率。此類作用劑可以是二甲亞砜(DMSO),佐劑,表面活性劑等。另外的染色體加倍劑是本領域中已知的,且在美國專利號No.5,866,51(其全部內容通過提及并入本文)中列出的化學品適合用于生成雙單倍體植物。此外,表1列出了各種已知的染色體加倍劑。表1:染色體加倍劑。在一個實施方案中,本文中公開的用于幼苗浸泡方法的染色體加倍劑的合適劑量包括例如0.01μM,0.5μM,1μM,2μM,3μM,4μM,5μM,10μM,15μM,20μM,25μM,30μM,35μM,40μM,45μM,50μM,60μM,70μM,80μM,90μM,100μM,125μM,150μM,200μM,500μM,和1000μM。合適的范圍還包括例如0.1-10μM,1-100μM,5-125μM,25-200μM,50-500μM,15-150μM和1-10,000μM。在另一個實施方案中,染色體加倍劑的范圍可以為幼苗浸泡方法中使用的溶液的0.01%-0.5%。例如,可以使用0.01%,0.02%,0.025%,0.05%,0.075%,0.1%,0.125%,0.15%,0.175%,0.2%,0.225%,0.25%,0.275%,0.3%,0.325%,0.35%,0.375%,0.4%,0.425%,0.45%,0.475%,或0.5%的染色體加倍劑使染色體加倍。在進一步的實施方案中,當與秋水仙堿(例如,在0.025%)相比時,本文公開的染色體倍加倍劑的低幼苗死亡率的范圍可以例如為處理的幼苗或植物細胞總數的小于10%至約40%,或小于約5%至約20%,或小于約15%至約25%或小于50%。在其它實施方案中,用于本文中公開的幼苗葉施用方法的染色體加倍劑的合適劑量包括例如3.5gai/ha,70gai/ha,140gai/ha,280gai/ha。合適的應用率范圍包括例如5gai/ha至1120gai/ha,且更優選至2,800gai/ha。短語“接觸”包括提及“直接接觸”和“間接接觸”。例如,包含加倍劑的培養基可以與單倍體細胞直接接觸,或者包含加倍劑的培養基可以通過屏障,如濾紙、植物組織或其它細胞,與單倍體細胞分開,因此加倍劑透過濾紙或細胞或組織轉移到單倍體細胞。接觸以任何合適的方式實現,例如根的水培處理,噴霧,注射,浸潤,浸泡和潤濕。可以用染色體加倍劑處理單倍體細胞、單倍體胚、單倍體種子、單倍體幼苗或單倍體植物。可以通過使單倍體細胞,如單倍體胚細胞與染色體加倍劑接觸,從單倍體細胞再生純合植物。單倍體細胞可以與加倍劑接觸任何時間量。在一個實施方案中,單倍體細胞與加倍劑接觸1分鐘,2分鐘,5分鐘,10分鐘,15分鐘,20分鐘,25分鐘,30分鐘,35分鐘,45分鐘,1小時,2小時,5小時,10小時,24小時或48小時。可以分離單倍體胚。它可以包含在籽粒、胚珠或種子內,它也可以在穗(ear)上,如玉米穗上,或在穗(spike)上(在其它谷物如小麥的情況下是如此)。穗包括:單倍體胚可以在植物上或從植物分離。穗也可以切片。染色體加倍后,雙倍單倍體胚將包含2拷貝的母本來源的染色體。從單倍體胚中獲得雙倍單倍體植物的方法的效率可以大于10%,20%,30%,50%,60%,70%,80%或90%。植物轉化本公開文本所公開的方法包括植物轉化方法。可以用于本公開文本的方法的植物轉化方法包括但不限于:位點特異性微粒轟擊,土壤桿菌轉化法,磷酸鈣轉化法,聚凝胺轉化法,電穿孔轉化法,超聲轉化法,脂質體轉化法,顯微注射轉化法,裸DNA轉化法,質粒載體轉化法,病毒載體轉化法,碳化硅介導的轉化法,氣溶膠射束轉化法或PEG轉化法。通常,任何植物轉化方法均可用于將DNA或任何其它多核苷酸序列插入宿主細胞的基因組中。因此,可以使用任何可提供有效轉化/轉染的方法。已經開發了許多用于植物轉化的方法,包括用于雙子葉植物以及單子葉植物的生物和物理轉化方案(例如,Goto-Fumiyukietal.,NatureBiotech17:282-286(1999);Mikietal.,MethodsinPlantMolecularBiologyandBiotechnology,Glick,B.R.和Thompson,J.E.編,CRCPress,Inc.,BocaRaton,pp.67-88(1993))。此外,包含基因表達盒的載體和用于植物細胞或組織轉化和植物再生的體外培養方法可以在例如Gruberetal.,MethodsinPlantMolecularBiologyandBiotechnology,Glick,B.R.andThompson,J.E.Eds.,CRCPress,Inc.,BocaRaton,pp.89-119(1993)中找到。有許多技術可供用于將包含基因表達盒的DNA插入植物宿主細胞中。這些技術包括使用根癌土壤桿菌或發根土壤桿菌作為轉化劑用卸甲的(disarmed)T-DNA轉化,磷酸鈣轉染,聚凝胺轉化,原生質體融合,電穿孔,超聲方法(例如聲致穿孔),脂質體轉化,顯微注射,裸DNA,質粒載體,病毒載體,生物彈射(微粒轟擊),碳化硅WHISKERSTM介導的轉化,氣溶膠射束或聚乙二醇介導的轉化以及其它可能的方法。例如,可以使用諸如電穿孔和顯微注射植物細胞原生質體等技術將包含基因表達盒的DNA構建體直接引入植物細胞的基因組DNA中。此類植物轉化方法包括例如經由氯化鈣沉淀,聚乙二醇(PEG)或電穿孔介導的DNA攝取的原生質體轉化(參見Paszkowskietal.(1984)EMBOJ3:2717-2722,Potrykusetal.(1985)Molec.Gen.Genet.199:169-177;Frommetal.(1985)Proc.Nat.Acad.Sci.USA82:5824-5828;及Shimamoto(1989)Nature338:274-276)和植物組織的電穿孔(D'Halluinetal.(1992)PlantCell4:1495-1505)。可以使用生物射彈方法,如DNA顆粒轟擊,將DNA構建體直接導入植物組織(參見例如Kleinetal.(1987)Nature327:70-73)。生物射彈方法包括微粒介導的轉化,其中DNA攜帶在微射彈的表面上。在該方法中,用生物射彈裝置將表達載體導入植物組織中,該生物射彈裝置將微射彈加速至足以穿透植物細胞壁和膜的速度。Sanfordetal.,Part.Sci.Technol.5:27(1987),Sanford,J.C.,TrendsBiotech.6:299(1988),Sanford,J.C.,Physiol.Plant79:206(1990),Kleinetal.,Biotechnology10:268(1992)。用于植物細胞轉化的其它方法包括通過碳化硅WHISKERSTM介導的DNA攝取的顯微注射(Kaeppleretal.(1990)PlantCellReporter9:415-418)。或者,可以經由納米顆粒轉化將DNA構建體導入植物細胞中(參見例如美國專利申請No.12/245,685,其通過提及整體并入本文)。一種廣泛使用的將包含基因表達盒的載體導入植物中的方法是基于土壤桿菌的天然轉化系統。Horschetal.,Science227:1229(1985)。根癌土壤桿菌和發根土壤桿菌是已知可用于遺傳轉化植物細胞的植物病原性土壤細菌。根癌土壤桿菌的和發根土壤桿菌分別由Ti質粒和Ri質粒攜帶負責植物遺傳轉化的基因。Kado,C.I.,Crit.Rev.Plant.Sci.10:1(1991)。用于土壤桿菌介導的基因轉移的土壤桿菌載體系統和方法的描述也可以從,例如,Gruberetal.,見上文,Mikietal.,見上文,Moloneyetal.,PlantCellReports8:238(1989),和美國專利No.4,940,838和5,464,763獲取。當土壤桿菌用于植物轉化時,可以將待插入的DNA克隆到稱為中間載體的特殊質粒中或克隆到二元載體中。中間載體在不存在輔助質粒的情況下無法在土壤桿菌中復制(接合)。日本煙草超二元系統是這種系統的一個例子(參見綜述Komarietal.,(2006)收錄于:MethodsinMolecularBiologyNo.343:AgrobacteriumProtocols(2ndEdition,Vol.1)(K.Wang,ed.)HumanaPressInc.,Totowa,NJ,pp.15-41;及Komorietal.,(2007)PlantPhysiol.145:1155-1160)。二元載體可以在大腸桿菌和土壤桿菌中復制。它們包含被左右T-DNA邊界區所框定的選擇標志物基因和接頭或多接頭。可以將二元載體直接轉化到土壤桿菌中(Holsters,1978)。土壤桿菌可以用作包含質粒,例如攜帶vir區的Ti或RI質粒的宿主細胞,vir區對于T-DNA轉移到植物細胞中而言通常是必需的。可以利用根癌土壤桿菌宿主的毒力,指導含有T鏈的供體DNA插入通過土壤桿菌二元TDNA載體技術(Bevan(1984)Nuc.AcidRes.12:8711-8721)或共培養規程(Horschetal.(1985)Science227:1229-1231)感染的單倍體組織或細胞中。通常,土壤桿菌轉化系統用于工程化雙子葉植物(Bevanetal.(1982)Ann.Rev.Genet16:357-384;Rogersetal.(1986)MethodsEnzymol.118:627-641)。土壤桿菌轉化系統也可以用于將DNA轉化以及轉移到單子葉植物和植物細胞。參見美國專利No.5,591,616;Hernalsteenetal.(1984)EMBOJ3:3039-3041;Hooykass-VanSlogterenetal.(1984)Nature311:763-764;Grimsleyetal.(1987)Nature325:1677-179;Boultonetal.(1989)PlantMol.Biol.12:31-40;和Gouldetal.(1991)PlantPhysiol.95:426-434。在通過植物轉化導入包含基因表達盒的遺傳構建體后,可以培養植物細胞,并且在分化組織,如芽和根出現后,可以生成成熟的植物。在一些實施方案中,可以生成多個植物。用于再生植物的方法是本領域中普通技術人員已知的,并且可以參見例如:PlantCellandTissueCulture,1994,Vasil和Thorpe編KluwerAcademicPublishers和PlantCellCultureProtocols(MethodsinMolecularBiology111,1999HallEdsHumanaPress)。可以在發酵培養基中培養,或在合適的培養基如土壤中種植本文中描述的經遺傳修飾的植物。在一些實施方案中,用于高等植物的合適的生長培養基可以包括用于植物的任何生長培養基,包括但不限于土壤,沙,支持根生長的任何其它顆粒培養基(例如蛭石,珍珠巖等)或水培培養,以及適當的光,水和營養補充劑,其優化高等植物的生長。可以培養通過任何上述植物轉化技術生成的經轉化的植物細胞,以再生擁有經轉化的基因型、并因此具有期望的表型的全植物。此類再生技術依賴于在組織培養生長培養基中操作某些植物激素,通常依賴于與期望的核苷酸序列一起導入的殺生物劑和/或除草劑標記物。來自培養的原生質體的植物再生描述于Evans,etal.,“ProtoplastsIsolationandCulture”inHandbookofPlantCellCulture,pp.124-176,MacmillianPublishingCompany,NewYork,1983;和Binding,RegenerationofPlants,PlantProtoplasts,pp.21-73,CRCPress,BocaRaton,1985。再生也可以從植物愈傷組織,外植體,器官,花粉,胚或其部分獲得。此類再生技術在Kleeetal.(1987)Ann.Rev.ofPlantPhys.38:467-486中有一般性的描述。可以通過對經工程化改造的植物材料選擇或篩選由轉化DNA上存在的標志物基因編碼的性狀來鑒定并分離經轉化的植物細胞、愈傷組織、組織或植物。例如,轉化基因構建體賦予針對某種抗生素或除草劑的抗性,可以通過在含有抑制量的該抗生素或除草劑的培養基上培養經工程化改造的植物材料,來進行選擇。此外,還可以通過篩選可以存在于重組核酸構建體上的任何可見標志物基因(例如,β-葡糖醛酸糖苷酶,螢光素酶或gfp基因)的活性來鑒定經轉化的植物和植物細胞。選擇和篩選方法是本領域技術人員公知的。術語轉基因“事件”是指通過用異源DNA(例如,包括感興趣的轉基因的表達盒)轉化和再生單個植物細胞生成的重組植物。術語“事件”指包括異源DNA的轉化體的原始轉化體和/或轉化體的后代。術語“事件”還指通過轉化體和另一植物之間的有性異型雜交生成的后代。即使在與輪回親本重復回交后,插入的DNA和來自經轉化的親本的側翼DNA也存在于雜交后代中相同的染色體位置處。通常,植物組織的轉化生成多個事件,每個事件代表DNA構建體在植物細胞基因組的不同位置中的插入。基于轉基因或其它期望的特征的表達選擇特定的事件。在本公開的實施方案中,特定事件包括插入在靶定的基因組基因座內的供體DNA多核苷酸。如本文中使用,“插入DNA”是指異源DNA,如供體DNA多核苷酸內的轉基因,其可以包含用于轉化植物材料的基因表達盒,而“側翼DNA”或“接合部DNA”可以包括天然存在于生物體,如植物中的基因組DNA,或通過與插入DNA分子無關的轉化過程導入的外源(異源)DNA,例如與轉化事件相關聯的片段。如本文中使用的,“接合部”或“側翼區”或“側翼序列”是指至少20,50,100,200,300,400,1000,1500,2000,2500,或5000個堿基對或更大的序列,其位于插入DNA分子的緊鄰上游并與之連續,或位于插入DNA分子的緊鄰下游并與之連續。對于通過任何上述轉化技術得來的經轉化的單倍體胚,可以加以培養以再生擁有經轉化的基因型的全植物。此類再生技術稱作胚搶救(embryorescue)。胚搶救培養基可以包含某些植物激素和能源,或僅包含能源。生長培養基還可以含有選擇劑,如殺生物劑和/或除草劑。此選擇劑可以用于指示經由轉化過程導入的標志物。玉米的轉化和再生已經描述在例如Gordon-Kammetal.,ThePlantCell2:603-618(1990)中。從胚生成植物是本領域中公知的。可以用于將未成熟的雙倍單倍體胚生成為植物的胚搶救技術也是已知的(RecentResearchDevelopmentsinGenetics&Breeding.Vol.1,PartII,237-3032004)。其公開內容通過提及并入本文。載體和供體多核苷酸在一個實施方案中,本公開涉及導入插入靶定的基因組基因座內的一個或多個供體DNA多核苷酸。在一些實施方案中,供體多核苷酸包含編碼序列。編碼序列可以編碼例如賦予農藝性狀的基因(例如轉基因)。在進一步的實施方案中,農藝性狀選自包括殺蟲抗性性狀,除草劑耐性性狀,氮利用效率性狀,水利用效率性狀,營養質量性狀,DNA結合性狀和選擇標志物性狀的組。在另外的實施方案中,在植物內表達供體多核苷酸。本公開的實施方案包括包含一種或多種供體多核苷酸的植物。在實施方案的一個方面中,植物包含單倍體基因組。在實施方案的另一方面中,所述植物包含雙單倍體基因組。在一些實施方案中,供體多核苷酸包含基因表達盒。用于構建本文中使用的基因表達盒的標準重組DNA和分子克隆技術是本領域中公知的,并且描述于例如Sambrooketal.,MolecularCloning:ALaboratoryManual,SecondEdition,ColdSpringHarborLaboratoryPress,ColdSpringHarbor,NY(1989);和Silhavyetal.,ExperimentswithGeneFusions,ColdSpringHarborLaboratoryPress,ColdSpringHarbor,NY(1984);和Ausubeletal.,CurrentProtocolsinMolecularBiology,GreenePublishingAssoc.andWiley-Interscience(1987)出版。可以在供體多核苷酸中采用許多指導基因在植物中表達的啟動子。此類啟動子可以選自組成性,化學調節性,誘導型,組織特異性和種子優選性的啟動子。用于指導核酸表達的啟動子取決于具體應用。例如,適合于宿主細胞的組成性強啟動子通常用于表達和純化表達的蛋白質。植物啟動子的非限制性例子包括源自擬南芥(A.thaliana)泛素-10(ubi-10)的啟動子序列(Callis,etal.,1990,J.Biol.Chem.,265:12486-12493);根癌土壤桿菌甘露氨酸合酶(Δmas)(Petolinoetal.,U.S.PatentNo.6,730,824);和/或木薯葉脈花葉病毒(CsVMV)(Verdagueretal.,1996,PlantMolecularBiology31:1129-1139)。其它組成性啟動子包括例如核心花椰菜花葉病毒35S啟動子(Odelletal.(1985)Nature313:810-812);稻肌動蛋白啟動子(McElroyetal.(1990)PlantCell2:163-171);玉米泛素啟動子(美國專利號5,510,474;Christensenetal.(1989)PlantMol.Biol.12:619-632及Christensenetal.(1992)PlantMol.Biol.18:675-689);pEMU啟動子(Lastetal.(1991)Theor.Appl.Genet.81:581-588);ALS啟動子(美國專利號5,659,026);玉米組蛋白啟動子(Chaboutéetal.PlantMolecularBiology,8:179-191(1987));等等。其它有用的植物啟動子包括組織特異性和誘導型啟動子。誘導型啟動子是能夠響應誘導物而直接或間接激活一個或多個DNA序列或基因的轉錄的啟動子。在不存在誘導物的情況下,DNA序列或基因不會被轉錄。通常,與誘導型調節元件特異性結合以激活轉錄的蛋白因子以無活性形式存在,然后通過誘導物直接或間接轉化為活性形式。誘導劑可以是化學劑,例如蛋白質,代謝物,生長調節劑,除草劑或酚類化合物,或通過熱,冷,鹽或有毒元素直接施加,或在病原體或疾病介質(例如病毒)的作用下間接施加的生理應激。通常,與誘導型調節元件特異性結合以激活轉錄的蛋白質因子以無活性形式存在,然后通過誘導物直接或間接轉化為活性形式。誘導劑可以是化學試劑,例如蛋白質,代謝物,生長調節劑,除草劑或酚類化合物,或通過熱,冷,鹽或有毒元素直接施加的生理應激,或通過病原體或疾病介質(如病毒)的作用下間接施加的生理應激。通常,與誘導型調節元件特異性結合以激活轉錄的蛋白質因子以無活性形式存在,然后通過誘導物直接或間接轉化為活性形式。誘導劑可以是化學劑,如蛋白質,代謝物,生長調節劑,除草劑或酚類化合物,或通過熱,冷,鹽或有毒元素直接施加,或經由病原體或疾病介質,如病毒的作用間接施加的生理應激。可以通過將誘導物外部施加于細胞或植物,如通過噴霧,澆水,加熱或類似方法,而將含有誘導型調節元件的植物細胞暴露于誘導物。任何誘導型啟動子均可以在本公開的實施方案中使用。參見Wardetal.,PlantMol.Biol.22:361-366(1993)。示例性誘導型啟動子包括蛻皮激素受體啟動子(美國專利No.6,504,082);響應銅的來自ACE1系統的啟動子(Mettetal.,Proc.Natl.Acad.Sci.90:4567-4571(1993));響應苯磺酰胺除草劑安全劑的來自玉米的In2-1和In2-2基因(美國專利號5,364,780;Hersheyetal.,Mol.Gen.Genetics227:229-237(1991)和Gatzetal.,Mol.Gen.Genetics243:32-38(1994));來自Tn10的Tet阻遏物(Gatzetal.,Mol.Gen.Genet.227:229-237(1991);或來自類固醇激素基因的啟動子,其轉錄活性由糖皮質激素激發誘導,Schenaetal.,Proc.Natl.Acad.Sci.U.S.A.88:10421(1991)和McNellisetal.,(1998)PlantJ.14(2):247-257;玉米GST啟動子,其由用作萌發前除草劑的疏水性親電子化合物活化(參見美國專利號5,965,387和國際專利申請公開號WO93/001294);和煙草PR-1a啟動子,其由水楊酸活化(參見OnoS,KusamaM,OguraR,HiratsukaK.,“EvaluationoftheUseoftheTobaccoPR-1aPromotertoMonitorDefenseGeneExpressionbytheLuciferaseBioluminescenceReporterSystem,”BiosciBiotechnolBiochem.2011Sep23;75(9):1796-800)。感興趣的其它化學調節的啟動子包括四環素誘導型和四環素抑制型啟動子(參見,例如Gatzetal.,(1991)Mol.Gen.Genet.227:229-237,和美國專利號5,814,618和5,789,156)。感興趣的其它可調節啟動子包括冷響應性調節元件或熱休克調節元件,其轉錄可以分別響應對冷或熱的暴露而實現(Takahashietal.,PlantPhysiol.99:383-390,1992);醇脫氫酶基因的啟動子(Gerlachetal.,PNASUSA79:2981-2985(1982);Walkeretal.,PNAS84(19):6624-6628(1987)),可由厭氧條件誘導;和自豌豆rbcS基因或豌豆psaDb基因來源的光誘導型啟動子(Yamamotoetal.,(1997)PlantJ.12(2):255-265);光誘導型調節元件(Feinbaumetal.,Mol.Gen.Genet.226:449,1991;Lam和Chua,Science248:471,1990;Matsuokaetal.(1993)Proc.Natl.Acad.Sci.USA90(20):9586-9590;Orozcoetal.(1993)PlantMol.Bio.23(6):1129-1138),植物激素誘導型啟動子(Yamaguchi-Shinozakietal.,PlantMol.Biol.15:905,1990;Karesetal.,PlantMol.Biol.15:225,1990)等等。誘導型調節元件也可以是玉米In2-1或In2-2基因的啟動子,其響應苯磺酰胺除草劑安全劑(Hersheyetal.,Mol.Gen.Gene.227:229-237,1991;Gatzetal.,Mol.Gen.Genet.243:32-38,1994),和轉座子Tn10的Tet阻抑物(Gatzetal.,Mol.Gen.Genet.227:229-237,1991)。應激誘導型啟動子包括鹽/水應激誘導型啟動子,如P5CS(Zangetal.,(1997)PlantSciences129:81-89);冷誘導型啟動子,如cor15a(Hajelaetal.,(1990)PlantPhysiol.93:1246-1252),cor15b(Wilhelmetal.,(1993)PlantMolBiol23:1073-1077),wsc1(Ouelletetal.,(1998)FEBSLett.423-324-328),ci7(Kirchetal.,(1997)PlantMolBiol.33:897-909),ci21A(Schneideretal.,(1997)PlantPhysiol.113:335-45);干旱誘導型啟動子,如Trg-31(Chaudharyetal.,(1996)PlantMol.Biol.30:1247-57),rd29(Kasugaetal.,(1999)NatureBiotechnology18:287-291);滲透誘導型啟動子,如Rab17(Vilardelletal.,(1991)PlantMol.Biol.17:985-93)和逆滲透蛋白(Raghothamaetal.,(1993)PlantMolBiol23:1117-28);和熱誘導型啟動子,如熱休克啟動子(Barrosetal.,(1992)PlantMol.19:665-75;Marrsetal.,(1993)Dev.Genet.14:27-41),smHSP(Watersetal.,(1996)J.ExperimentalBotany47:325-338),和來自歐芹泛素啟動子的熱休克誘導型元件(WO03/102198)。其它應激誘導型啟動子包括rip2(美國專利號5,332,808和美國公開號2003/0217393)和rd29a(Yamaguchi-Shinozakietal.,(1993)Mol.Gen.Genetics236:331-340)。某些啟動子可由創傷誘導,包括土壤桿菌pMAS啟動子(Guevara-Garciaetal.,(1993)PlantJ.4(3):495-505)和土壤桿菌ORF13啟動子(Hansenetal.,(1997)Mol.Gen.Genet.254(3):337-343)。可以利用組織優選性啟動子靶向特定植物組織內的增強的轉錄和/或表達。當提及優先表達時,是指在特定植物組織中比在其它植物組織中更高水平的表達。這些類型的啟動子的例子包括種子優選的表達,如由菜豆球蛋白啟動子(Bustosetal.,(1989)ThePlantCellVol.1,839-853),和玉米球蛋白-1基因(Belanger,etal.(1991)Genetics129:863-972)提供的表達。對于雙子葉植物,種子優選性啟動子包括但不限于豆類β-菜豆球蛋白,napin,β-伴大豆球蛋白,大豆凝集素,十字花科素(cruciferin)等。對于單子葉植物,種子優選性啟動子包括但不限于玉米15kDa玉米醇溶蛋白,22kDa玉米醇溶蛋白,27kDa玉米醇溶蛋白,γ-玉米醇溶蛋白,蠟質蛋白(waxy),皺縮蛋白1(shrunken1),皺縮蛋白2,球蛋白1等。種子優選性啟動子還包括那些將大部分基因表達引導到種子內的特定組織的啟動子,例如,γ-玉米醇溶蛋白的胚乳優選啟動子,來自煙草的隱藏啟動子(Fobertetal.,(1994)T-DNAtaggingofaseedcoat-specificcrypticpromoterintobacco.PlantJ.4:567-577);來自玉米的P基因啟動子(Chopraetal.,(1996)AllelesofthemaizePgenewithdistincttissuespecificitiesencodeMyb-homologousproteinswithC-terminalreplacements.PlantCell7:1149-1158,ErratuminPlantCell.1997,1:109),來自玉米的球蛋白-1啟動子(Belenger和Kriz(1991)MolecularbasisforAllelicPolymorphismofthemaizeGlobulin-1gene.Genetics129:863-972),以及指導表達到玉米籽粒的種皮或外殼的啟動子,例如果皮特異性谷氨酰胺合成酶啟動子(Muhitchetal.,(2002)IsolationofaPromoterSequenceFromtheGlutamineSynthetase1-2GeneCapableofConferringTissue-SpecificGeneExpressioninTransgenicMaize.PlantScience163:865-872)。除了啟動子之外,表達盒(其可以在例如載體中)通常含有轉錄單元或表達盒,其含有在宿主細胞(原核或真核)中表達核酸需要的所有其他元件。因此,典型的表達盒含有可操作地連接于編碼基因產物(例如蛋白質)的核酸序列的啟動子。表達盒還可以包括根據本領域已知方法可操作地連接的別的元件:轉錄物的高效多聚腺苷酸化需要的信號、轉錄終止需要的信號、核糖體結合位點、或翻譯終止需要的信號。另外,表達盒可以包括增強子和/或異源剪接信號。可以包括供體多核苷酸或載體的其它組分,這也取決于供體多核苷酸的意圖用途。例子包括選擇標志物,靶向或調節序列,轉運肽序列,如優化的轉運肽序列(參見美國專利號5,510,471),穩定化序列如RB7MAR(參見Thompson和Myatt,(1997)PlantMol.Biol.,34:687-692和國際專利公開號WO9727207)或前導序列,內含子等。植物表達載體和報告基因的一般描述和例子可見于Gruber,etal.,“VectorsforPlantTransformation”收錄于MethodsinPlantMolecularBiologyandBiotechnology,Glicketal編;CRCPresspp.89-119(1993)。合適的表達載體的選擇將取決于宿主和將表達載體導入宿主中的方法。表達盒還將在感興趣的異源核苷酸序列的3’末端處包括在植物中有功能的轉錄和翻譯終止區。終止區可以是本公開的實施方案的啟動子核苷酸序列所固有的,可以是感興趣的DNA序列所固有的,或者可以來源自其他來源。方便的終止區可獲自根癌土壤桿菌的Ti質粒,如章魚氨酸合酶和胭脂氨酸合酶(nos)終止區(Depickeretal.,Mol.andAppl.Genet.1:561-573(1982)和Shawetal.(1984)NucleicAcidsResearchvol.12,No.20pp7831-7846(nos));還參見Guerineauetal.Mol.Gen.Genet.262:141-144(1991);Proudfoot,Cell64:671-674(1991);Sanfaconetal.GenesDev.5:141-149(1991);Mogenetal.PlantCell2:1261-1272(1990);Munroeetal.Gene91:151-158(1990);Ballasetal.,NucleicAcidsRes.17:7891-7903(1989);Joshietal.NucleicAcidRes.15:9627-9639(1987)。另外,表達盒可以含有5’前導序列。此類前導序列可以起到增強翻譯的作用。翻譯前導序列是本領域中已知的,并且舉例而言,包括細小核糖核酸病毒(picornavirus)前導,EMCV前導(腦心肌炎5’非編碼區),Elroy-Steinetal.,Proc.Nat.Acad.Sci.USA86:6126-6130(1989);馬鈴薯Y病毒組(potyvirus)前導,例如TEV前導(煙草蝕紋病毒)Carrington和FreedJournalofVirology,64:1590-1597(1990),MDMV前導物(玉米矮花葉病毒),Allisonetal.,Virology154:9-20(1986);人免疫球蛋白重鏈結合蛋白(BiP),Macejaketal.,Nature353:90-94(1991);來自苜蓿花葉病毒的殼體蛋白mRNA(AMVRNA4)的非翻譯前導,Joblingetal.,Nature325:622-625(1987);煙草花葉病毒前導(TMV),Gallieetal.,(1989)MolecularBiologyofRNA,第237-256頁;和玉米褪綠斑駁病毒(maizechloroticmottlevirus)前導(MCMV)Lommeletal.,Virology81:382-385(1991)。還可參見Della-Cioppaetal.,PlantPhysiology84:965-968(1987)。表達盒構建體還可以含有增強翻譯和/或mRNA穩定性的序列,例如內含子。一個例子是擬南芥的組蛋白H3.III變體的基因II的第一內含子。Chaubetetal.,JournalofMolecularBiology,225:569-574(1992)。在期望表達盒表達的基因產物被引導到特定細胞器,特別是質體,造粉體或內質網,或在細胞表面或細胞外分泌的情況下,表達盒可以進一步包含轉運肽的編碼序列。此類轉運肽是本領域中公知的,包括但不限于酰基載體蛋白的轉運肽,RUBISCO的小亞基,植物EPSP合酶和向日葵(Helianthusannuus)(美國專利號5,510,417),玉蜀黍Brittle-1葉綠體轉運肽(Nelsonetal.,PlantPhysiol117(4):1235-1252(1998);Sullivanetal.,PlantCell3(12):1337-48;Sullivanetal.,Planta(1995)196(3):477-84;Sullivanetal.,J.Biol.Chem.(1992)267(26):18999-9004)等。此外,嵌合葉綠體轉運肽是本領域中已知的,如優化的轉運肽(美國專利號5,510,471)。先前已經在美國專利號5,717,084和美國專利號5,728,925中描述另外的葉綠體轉運肽。本領域技術人員將容易理解可用于將產物表達到特定細胞器的許多選擇。例如,大麥α淀粉酶序列經常用于將表達引導到內質網(Rogers,J.Biol.Chem.260:3731-3738(1985))。本領域技術人員應當理解,可以使用重組DNA技術操縱例如宿主細胞內核酸分子的拷貝數、轉錄那些核酸分子的效力、翻譯所得的轉錄物的效率、和翻譯后修飾的效率,從而更好地控制轉染的核酸分子表達。另外,與天然啟動子相比,可以遺傳工程改造啟動子序列以提高表達水平。可用于控制核酸分子表達的重組技術包括但不限于:將核酸分子穩定整合到一個或多個宿主細胞染色體中,向質粒添加載體穩定性序列,取代或修飾轉錄控制信號(例如啟動子,操縱子,增強子),取代或修飾翻譯控制信號(例如,核糖體結合位點,Shine-Dalgarno或Kozak序列),修飾核酸分子使之對應于宿主細胞的密碼子選擇,和刪除使轉錄物不穩定的序列。可以在轉化載體中包括用于選擇經轉化的細胞或組織或植物部分或植物的報告基因或標志物基因。選擇標志物的例子包括賦予對抗代謝物,如除草劑或抗生素的抗性的那些,例如二氫葉酸還原酶,其賦予對甲氨蝶呤的抗性(Reiss,PlantPhysiol.(LifeSci.Adv.)13:143-149,1994;還可見HerreraEstrellaetal.,Nature303:209-213,(1983);Meijeretal.,PlantMol.Biol.16:807-820,(1991));新霉素磷酸轉移酶,其賦予對新霉素、卡那霉素和巴龍霉素(paromycin)等氨基糖苷的抗性(Herrera-Estrella,EMBOJ.2:987-995,1983及Fraleyetal.,Proc.Natl.Acad.SciUSA80:4803(1983)),和潮霉素磷酸轉移酶,其賦予對潮霉素的抗性(Marsh,Gene32:481-485,(1984);另見Waldronetal.,PlantMol.Biol.5:103-108,(1985);Zhijianetal.,PlantScience108:219-227,(1995));trpB,其允許細胞利用吲哚代替色氨酸;hisD,其允許細胞利用組氨醇代替組氨酸(Hartman,Proc.Natl.Acad.Sci.,USA85:8047,(1988));甘露糖-6-磷酸異構酶,其允許細胞利用甘露糖(國際專利申請號WO94/20627);鳥氨酸脫羧酶,其賦予對鳥氨酸脫羧酶抑制劑2(二氟甲基)-DL鳥氨酸的抗性(DFMO;McConlogue,1987,收錄于:CurrentCommunicationsinMolecularBiology,ColdSpringHarborLaboratoryed.);和土曲霉(Aspergillusterreus)的脫氨酶,其賦予對殺稻瘟素S的抗性(Tamura,Biosci.Biotechnol.Biochem.59:2336-2338,(1995))。另外的選擇標志物包括例如賦予咪唑啉酮或磺酰脲抗性的突變體乙酰乳酸合酶(Leeetal.,EMBOJ.7:1241-1248,(1988)),突變體psbA,其賦予對阿特拉嗪的抗性(Smedaetal.,PlantPhysiol.103:911-917,(1993))或突變原卟啉原氧化酶(參見美國專利號5,767,373)或賦予對除草劑例如草丁磷(glufosinate)的抗性的其它標志物。合適的選擇標志物基因的例子包括但不限于編碼對氯霉素(HerreraEstrellaetal.,EMBOJ.2:987-992,(1983));鏈霉素(Jonesetal.,Mol.Gen.Genet.210:86-91,(1987));壯觀霉素(Bretagne-Sagnardetal.,TransgenicRes.5:131-137,(1996));博萊霉素(Hilleetal.,PlantMol.Biol.7:171-176,(1990));磺酰胺(Guerineauetal.,PlantMol.Biol.15:127-136,(1990));溴苯腈(bromoxynil)(Stalkeretal.,Science242:419-423,(1988));草銨膦(glyphosate)(Shawetal.,Science233:478-481,(1986));膦絲菌素(phosphinothricin)(DeBlocketal.,EMBOJ.6:2513-2518,(1987))等的抗性的基因。使用選擇性基因的一個選項是草丁磷抗性編碼DNA,并且在一個實施方案中可以是在木薯葉脈花葉病毒啟動子控制下的膦絲菌素乙酰轉移酶(pat)、玉米優化的pat基因、或bar基因。這些基因賦予對雙丙氨膦(bialaphos)的抗性。參見,(參見Wohllebenetal.,(1988)Gene70:25-37);Gordon-Kammetal.,PlantCell2:603;1990;Uchimiyaetal.,BioTechnology11:835,1993;Whiteetal.,Nucl.AcidsRes.18:1062,1990;Spenceretal.,Theor.Appl.Genet.79:625-631,1990;及Anzaietal.,Mol.Gen.Gen.219:492,1989)。pat基因的形式是玉米優化的pat基因,記載于美國專利號6,096,947中。此外,可以采用便于鑒定含有編碼標志物的多核苷酸的植物細胞的標志物。可評分的或可篩選的標志物,其中序列的存在產生可測量的產物并且可以在不破壞植物細胞的條件下產生產物,是有用的。實例包括β-葡糖醛酸糖苷酶或uidA基因(GUS),其編碼已知具有各種生色底物的酶(例如,美國專利號5,268,463和5,599,670);氯霉素乙酰轉移酶(Jeffersonetal.TheEMBOJournal,第6卷,第13期,第3901-3907頁);和堿性磷酸酶。在優選的實施方案中,使用的標志物是β-胡蘿卜素或維生素原A(Yeetal.,Science287:303-305-(2000))。該基因已經用于增強稻的營養,但在此情況下,它是用作可篩選標志物,并且通過所提供的金色檢測與感興趣的基因連接的基因的存在。與該基因用于對植物的貢獻營養的情況不同,用于標記目的時,較少量的蛋白質就足夠了。其它可篩選標志物一般包括花色素苷/黃酮類基因(參見Taylor和Briggs,ThePlantCell(1990)2:115-127的討論),包括例如R基因座基因,其編碼的產物調節植物組織中花色素苷產物(紅色)生成(Dellaportaetal.,于ChromosomeStructureandFunction,KluwerAcademicPublishers,Appels和Gustafson編,pp.263-282(1988));控制黃酮類色素的生物合成的基因,如玉米C1基因(Kaoetal.,PlantCell(1996)8:1171-1179;Scheffleretal.,Mol.Gen.Genet.(1994)242:40-48)和玉米C2(Wienandetal.,Mol.Gen.Genet.(1986)203:202-207);B基因(Chandleretal.,PlantCell(1989)1:1175-1183),p1基因(Grotewoldetal.,Proc.Natl.Acad.SciUSA(1991)88:4587-4591;Grotewoldetal.,Cell(1994)76:543-553;Sidorenkoetal.,PlantMol.Biol.(1999)39:11-19);青銅色基因座基因(bronzelocusgenes)(Ralstonetal.,Genetics(1988)119:185-197;Nashetal.,PlantCell(1990)2(11):1039-1049)等。合適的標志物的其它例子包括青色熒光蛋白(CYP)基因(Bolteetal.,(2004)J.CellScience117:943-54和Katoetal.,(2002)PlantPhysiol129:913-42),黃色熒光蛋白基因(來自Evrogen的PHIYFPTM;參見Bolteetal.,(2004)J.CellScience117:943-54);lux基因,其編碼螢光素酶,所述螢光素酶的存在可以使用例如X射線膠片,閃爍計數,熒光分光光度法,低光攝像機,光子計數照相機或多孔發光測定法檢測(Teerietal.(1989)EMBOJ.8:343);綠色熒光蛋白(GFP)基因(Sheenetal.,PlantJ.(1995)8(5):777-84);和DsRed2,其中用標志物基因轉化的植物細胞是紅色的,因此可目視選擇(Dietrichetal.,(2002)Biotechniques2(2):286-293)。另外的例子包括β-內酰胺酶基因(Sutcliffe,Proc.Nat'l.Acad.Sci.U.S.A.(1978)75:3737),其編碼具有已知各種生色底物的酶(例如PADAC,生色頭孢菌素);xylE基因(Zukowskyetal.,Proc.Nat'l.Acad.Sci.U.S.A.(1983)80:1101),其編碼可以轉化生色兒茶酚的兒茶酚雙加氧酶;α淀粉酶基因(Ikutaetal.,Biotech.(1990)8:241);和酪氨酸酶基因(Katzetal.,J.Gen.Microbiol.(1983)129:2703),其編碼的酶能夠將酪氨酸氧化成DOPA和多巴醌,二者繼而縮合以形成可容易檢測的化合物黑色素。很明顯,許多此類標記物可用并且是本領域技術人員已知的。在某些實施方案中,表達盒中的編碼基因產物的轉基因的核苷酸序列任選地可以與盒和/或植物中的另一感興趣的核苷酸序列組合。術語“感興趣的核苷酸序列”是指可以是轉錄的RNA分子以及編碼期望的多肽或蛋白質的DNA分子的核酸分子(其也可以稱為多核苷酸),但也可以指不構成整個基因并且不一定編碼多肽或蛋白質的核酸分子(例如啟動子)。例如,在某些實施方案中,轉基因可以與另一種感興趣的核苷酸序列組合或“堆疊”,所述另一種感興趣的核苷酸序列提供對草甘膦或另一種除草劑的額外的抗性或耐受性,和/或提供對挑選的昆蟲或疾病的抗性和/或提供營養強化,和/或改進的農藝學特性,和/或可用于飼料,食物,工業,藥物或其它用途的蛋白質或其它產物。植物基因組內兩個或更多個感興趣的核酸序列的“堆疊”可以例如通過使用兩個或更多個事件進行常規植物育種、用含有感興趣的序列的構建體轉化植物、對轉基因植物的再轉化、或通過同源重組靶向整合添加新性狀等來實現。此類感興趣的核苷酸序列包括但不限于下文提供的賦予(1)對有害生物或疾病的抗性,(2)對除草劑的抗性,和(3)增值性狀的基因或編碼序列的那些例子:1.賦予對有害生物或疾病的抗性的基因或編碼序列(例如iRNA)(A)植物疾病抗性基因。通常通過植物中的疾病抗性基因(R)的產物與病原體中相應的無毒力(Avr)基因的產物之間的特異性相互作用來激活植物防御。可以用克隆的抗性基因轉化植物品種以工程化改造對特定病原體菌株有抗性的植物。此類基因的例子包括:對黃枝孢霉(Cladosporiumfulvum)(Jonesetal.,1994Science266:789)有抗性的番茄Cf-9基因,編碼蛋白激酶的番茄Pto基因,用于對丁香假單胞桿菌番茄致病變種(Pseudomonassyringaepv.tomato)的抗性(Martinetal.,1993Science262:1432)和用于對丁香假單胞菌的抗性的擬南芥RSSP2基因(Mindrinosetal.,1994Cell78:1089)。(B)蘇云金芽孢桿菌(Bacillusthuringiensis)蛋白,其衍生物或其上模擬的合成多肽,如Btδ-內毒素基因的核苷酸序列(Geiseretal.,1986Gene48:109)和營養型殺蟲(VIP)基因(參見例如Estruchetal.,(1996)Proc.Natl.Acad.Sci.93:5389-94)。此外,可以在ATCC保藏號40098,67136,31995和31998下從美國典型培養物保藏中心(Rockville,Md.)購買編碼δ-內毒素基因的DNA分子。(C)凝集素,如幾種君子蘭(Cliviaminiata)甘露糖結合凝集素基因的核苷酸序列(VanDammeetal.,1994PlantMolec.Biol.24:825)。(D)維生素結合蛋白,如可用作針對昆蟲有害生物的殺幼蟲劑的親合素和親合素同系物。參見美國專利號5,659,026。(E)酶抑制劑,例如蛋白酶抑制劑或淀粉酶抑制劑。此類基因的例子包括稻半胱氨酸蛋白酶抑制劑(Abeetal.,1987J.Biol.Chem.262:16793),煙草蛋白酶抑制劑I(Huubetal.,1993PlantMolec.Biol.21:985)和α-淀粉酶抑制劑(Sumitanietal.,1993Biosci.Biotech.Biochem.57:1243)。(F)昆蟲特異性激素或信息素,如脫皮素和保幼激素,其變體,基于其的模擬物,或其拮抗劑或激動劑,例如克隆的保幼激素酯酶的桿狀病毒表達,保幼激素的滅活劑(Hammocketal.,1990Nature344:458)。(G)昆蟲特異性肽或神經肽,其在表達時破壞受影響的有害生物的生理學(J.Biol.Chem.269:9)。此類基因的例子包括昆蟲利尿激素受體(Regan,1994),太平洋碩蠊(Diplopterapunctata)中鑒定的allostatin(Pratt,1989)和昆蟲特異性麻痹性神經毒素(美國專利號5,266,361)。(H)由蛇,黃蜂等自然生成的昆蟲特異性毒液,例如蝎子昆蟲毒性肽(Pang,(1992)Gene116:165)。(I)負責單萜,倍半萜,類固醇,異羥肟酸,苯丙素(phenylpropanoid)衍生物或另一種具有殺蟲活性的非蛋白質分子的高度積累的酶。(J)參與生物活性分子的修飾(包括翻譯后修飾)的酶;例如糖酵解酶,蛋白水解酶,脂肪分解酶,核酸酶,環化酶,轉氨酶,酯酶,水解酶,磷酸酶,激酶,磷酸化酶,聚合酶,彈性蛋白酶,殼多糖酶和葡聚糖酶,無論是天然的還是合成的。此類基因的例子包括愈傷組織基因(PCT公開申請WO93/02197),殼多糖酶編碼序列(其可例如從ATCC以保藏號3999637和67152獲得),煙草鉤蟲殼多糖酶(Krameretal.,(1993)InsectMolec.Biol.23:691)和歐芹ubi4-2聚泛素基因(Kawallecketal.,(1993)PlantMolec.Biol.21:673)。(K)刺激信號轉導的分子。此類分子的例子包括綠豆鈣調蛋白cDNA克隆的核苷酸序列(Botellaetal.,(1994)PlantMolec.Biol.24:757)和玉米鈣調蛋白cDNA克隆的核苷酸序列(Griessetal.,(1994)PlantPhysiol.104:1467)。(L)疏水性力矩肽。參見美國專利號5,659,026和5,607,914;后者教導了賦予疾病抗性的合成抗微生物肽。(M)膜通透酶,通道形成物或通道阻斷劑,如殺菌肽-β裂解肽類似物(Jaynesetal.,(1993)PlantSci.89:43),其使轉基因煙草植物對青枯假單胞菌(Pseudomonassolanacearum)有抗性。(N)病毒侵入性蛋白或由其來源的復合毒素。例如,轉化的植物細胞中病毒殼體蛋白的積累賦予對病毒感染和/或由來源殼體蛋白基因的病毒以及相關病毒實現的疾病形成的疾病形成的抗性。已經對經轉化的植物賦予針對苜蓿花葉病毒,黃瓜花葉病毒,煙草條紋病毒,馬鈴薯病毒X,馬鈴薯病毒Y,煙草蝕紋病毒,煙草脆裂病毒和煙草花葉病毒的殼體蛋白介導的抗性。參見例如Beachyetal.,(1990)Ann.Rev.Phytopathol.28:451。(O)昆蟲特異性抗體或由其來源的免疫毒素。因此,靶向昆蟲腸道中的關鍵代謝功能的抗體將滅活受影響的酶,殺死昆蟲。例如,Tayloretal.,(1994)Abstract#497,SeventhInt'l.SymposiumonMolecularPlant-MicrobeInteractions顯示經由生成單鏈抗體片段在轉基因煙草中的酶失活。(P)病毒特異性抗體。參見例如Tavladorakietal.,(1993)Nature266:469,其顯示保護表達重組抗體基因的轉基因植物免受病毒攻擊。(Q)自然界中由病原體或寄生物生成的發育阻滯蛋白。因此,真菌內切α-1,4-D聚半乳糖醛酸酶)通過溶解植物細胞壁同-α-1,4-D-半乳糖醛酸酶(homo-α-1,4-D-galacturonase促進真菌定殖和植物營養物釋放(Lambetal.,(1992)Bio/Technology10:1436)。編碼豆多聚半乳糖醛酸內切酶抑制蛋白的基因的克隆和表征由(Toubartetal.,(1992)PlantJ.2:367)描述。(R)由植物天然生成的發育阻遏蛋白,如對真菌疾病提供增強的抗性的大麥核糖體失活基因(Longemannetal.,(1992).Bio/Technology10:3305)。(S)RNA干擾,其中編碼RNA分子的DNA多核苷酸用于抑制靶基因的表達。在一個例子中,RNA分子是部分或完全雙鏈的,其觸發沉默反應,導致dsRNA切割成小的干擾RNA,然后將其摻入到破壞同源mRNA的靶向復合物中。參見例如,Fireetal.,美國專利號6,506,559;Grahametal.,美國專利號6,573,099。2.賦予對除草劑的抗性的基因或編碼序列(A)編碼對抑制生長點或分生組織的除草劑(如咪唑啉酮,磺酰苯胺或磺酰脲除草劑)的抗性或耐受性的基因。該類別中的示例性基因編碼突變體ALS酶(Leeetal.,(1988)EMBOJ.7:1241),其也稱為AHAS酶(Mikietal.,(1990)Theor.Appl.Genet.80:449)。(B)一種或多種其它基因,其編碼對草甘膦(由突變體EPSP合酶和aroA基因或通過由基因如GAT(草甘膦乙酰轉移酶)或GOX(草甘膦氧化酶)的代謝失活賦予)和其它膦酰基(phosphono)化合物,如草丁磷(pat和bar基因;DSM-2),和芳氧基苯氧基丙酸和環己烷二酮(ACC酶抑制劑編碼基因)抗性或耐受性。參見例如美國專利號4,940,835,其公開了可以賦予草甘膦抗性的EPSP形式的核苷酸序列。編碼突變型aroA基因的DNA分子可以在ATCC保藏號39256下獲得,并且在美國專利號4,769,061中公開突變體基因的核苷酸序列。歐洲專利申請號0333033和美國專利號4,975,374公開了賦予除草劑如L-膦絲菌素抗性的谷氨酰胺合成酶基因的核苷酸序列。在歐洲專利申請號0242246中提供了膦絲菌素乙酰轉移酶基因的核苷酸序列。DeGreefetal.,(1989)Bio/Technology7:61描述了表達嵌合bar基因的轉基因植物的生成,所述嵌合bar基因編碼膦絲菌素乙酰轉移酶活性。賦予對芳氧基苯氧基丙酸和環己二酮類(例如烯禾啶(sethoxydim)和吡氟氯禾靈)抗性的基因的例子是由Marshalletal.,(1992)Theor.Appl.Genet.83:435描述的Accl-S1,Accl-S2和Accl-S3基因。(C)編碼對抑制光合作用的除草劑例如三嗪(psbA和gs+基因)和芐腈(腈水解酶基因)的抗性或耐受性的基因。Przibillaetal.,(1991)PlantCell3:169描述了使用編碼突變體psbA基因的質粒轉化衣藻(Chlamydomonas)。腈水解酶基因的核苷酸序列公開于美國專利號4,810,648中,并且含有這些基因的DNA分子在ATCC保藏號53435,67441和67442下可獲得。Hayesetal.,(1992)Biochem.J.285:173描述了編碼谷胱甘肽S-轉移酶的DNA的克隆和表達。(D)編碼對結合羥基苯丙酮酸雙加氧酶(HPPD)(催化其中對羥基苯丙酮酸(HPP)轉化成尿黑酸的反應的酶)的除草劑的抗性或耐受性的基因。這包括除草劑如異惡唑(isoxazoles)(歐洲專利號418175,歐洲專利號470856,歐洲專利號487352,歐洲專利號527036,歐洲專利號560482,歐洲專利號682659,美國專利號5,424,276),特別是異惡唑草酮(其是玉米的選擇性除草劑),二酮腈(diketonitriles)(歐洲專利號496630,和歐洲專利號496631),尤其是2-氰基-3-環丙基-1-(2-SO2CH3-4-CF3苯基)丙烷-1,3-二酮和2-氰基-3-環丙基-1-(2-SO2CH3-4-2,3Cl2苯基)丙烷-1,3-二酮,三酮(歐洲專利號625505,歐洲專利號625508,美國專利號5,506,195),特別是磺草酮(sulcotrione)和吡唑啉鹽(pyrazolinates)。在植物中生成HPPD過多的基因可以提供對此類除草劑的耐受性或抗性,包括例如美國專利號6,268,549和6,245,968和美國專利申請公開號20030066102中描述的基因。(E)編碼對苯氧基生長素除草劑,如2,4-二氯苯氧基乙酸(2,4-D)的抗性或耐受性并且還可賦予對芳氧基苯氧基丙酸酯(AOPP)除草劑的抗性或耐受性的基因。此類基因的實例包括美國專利號7,838,733中描述的α-酮戊二酸依賴性雙加氧酶(aad-1)基因。(F)編碼對苯氧基生長素除草劑,如2,4-二氯苯氧基乙酸(2,4-D)的抗性或耐受性并且還可賦予對吡啶氧基生長素除草劑如氟草煙(fluroxypyr)或定草酯(triclopyr)的抗性或耐受性的基因。此類基因的例子包括WO2007/053482A2中描述的α-酮戊二酸依賴性雙加氧酶基因(aad-12)。(G)編碼對麥草畏的抗性或耐受性的基因(參見例如美國專利公開號20030135879)。(H)提供對抑制原卟啉原氧化酶(PPO)的除草劑的抗性或耐受性的基因(參見美國專利號5,767,373)。(I)提供對結合光系統II反應中心(PSII)的核心蛋白的尿素衍生物(例如敵草隆(diuron))除草劑和三嗪除草劑(例如阿特拉嗪(atrazine))的抗性或耐受性的基因(Brussianetal.,(1989)EMBOJ.1989,8(4):1237-1245。3.賦予或促成增值性狀的基因(A)經修飾的脂肪酸代謝,例如通過用反義基因或硬脂酰-ACP去飽和酶轉化玉米或蕓苔屬(Brassica)以增加植物的硬脂酸含量(Knultzonetal.,(1992)Proc.Nat.Acad.Sci.USA89:2624。(B)降低的肌醇六磷酸含量。(1)肌醇六磷酸酶編碼基因如黑曲霉(Aspergillusniger)肌醇六磷酸酶基因(VanHartingsveldtetal.,(1993)Gene127:87)的引入增強肌醇六磷酸的分解,向經轉化的植物添加更多的游離磷酸鹽。(2)可以引入降低肌醇六磷酸含量的基因。在玉米中,例如,這可以通過克隆并然后重新引入與負責以低水平肌醇六磷酸為特征的玉米突變體的單個等位基因相關的DNA來完成(Raboyetal.,(1990)Maydica35:383)。(C)例如通過用編碼改變淀粉分枝模式的酶的基因轉化植物而實現的經修飾的碳水化合物組成。此類酶的例子包括粘液鏈球菌(Streptococcusmucus)果糖基轉移酶基因(Shirozaetal.,(1988)J.Bacteriol.170:810),枯草芽孢桿菌(Bacillussubtilis)果聚糖蔗糖酶(levansucrase)基因(Steinmetzetal.,(1985)Mol.Gen.Genel.200:220),地衣芽孢桿菌(Bacilluslicheniformis)α-淀粉酶(Penetal.,(1992)Bio/Technology10:292),番茄轉化酶基因(Elliotetal.,(1993),大麥淀粉酶基因(Sogaardetal.,(1993)J.Biol.Chem.268:22480)和玉米胚乳淀粉分支酶II(Fisheretal.,(1993)PlantPhysiol.102:10450)。位點特異性核酸酶在實施方案中,本文中描述的方法和組合物利用一種或多種位點特異性核酸酶。公開的方法包括將一種或多種編碼位點特異性核酸酶的多核苷酸遞送至自玉米小孢子來源的轉化感受態單倍體組織。這些位點特異性核酸酶可以通過切割DNA或誘導DNA斷裂來修飾基因組DNA,所述DNA斷裂可以是雙鏈斷裂或單鏈斷裂。位點特異性核酸酶的實施方案包括TALEN、大范圍核酸酶、CRISPR核酸酶或鋅指核酸酶。在一個實施方案中,在公開的方法中使用的位點特異性核酸酶是工程化(非天然存在的)TALEN核酸酶。參見例如美國專利公開號20110301073,通過提及將其全部內容并入本文。已知黃單胞菌屬(Xanthomonas)的植物病原性細菌在重要的作物植物中引起許多疾病。黃單胞菌的致病性取決于保守的III型分泌(T3S)系統,其將超過不同效應物蛋白注射到植物細胞中。這些注射的蛋白質之一是轉錄激活物樣(TALEN)效應物,其可模擬植物轉錄激活物并操縱植物轉錄組(參見Kayetal(2007)Science318:648-651)。這些蛋白質含有TAL效應物DNA結合域和轉錄激活域。表征得最充分的TAL效應物之一是來自野油菜黃單胞菌葉斑病致病株(Xanthomonascampestgrispv.Vesicatoria)(參見Bonasetal(1989)MolGenGenet218:127-136和WO2010079430)。TAL效應物包含一個由串聯重復構成的中心化域,每個重復包含約34個氨基酸,其是這些蛋白質的DNA結合特異性的關鍵。此外,它們含有核定位序列和酸性轉錄激活域(綜述參見SchornackS,etal(2006)JPlantPhysiol163(3):256-272)。在植物病原菌青枯雷爾氏菌(Ralstoniasolanacearum)中,已經發現青枯雷爾氏菌生物變型菌株GMI1000和生物變型4菌株RS1000中稱為brg11和hpx17的兩個基因與黃單胞菌的AvrBs3家族同源(參見Heueretal(2007)ApplandEnviroMicro73(13):4379-4384)。這些基因在核苷酸序列上彼此是98.9%相同的,但在hpx17的重復域中由于缺失1575bp而不同。然而,這兩種基因產物與黃單胞菌的AvrBs3家族蛋白具有小于40%的序列同一性。參見例如美國專利公開號20110301073,其全部內容通過提及并入本文。這些TAL效應物的特異性取決于串聯重復域的序列。在某些實施方案中,每個重復序列包含約102bp;并且重復通常彼此91-100%同源(Bonas等人,同上)。重復通常包括多態性,多態性通常位于位置12和13,并且在位置12和13處的高變雙殘基的身份與在TAL效應物的靶序列中連續核苷酸的身份之間似乎存在一對一的對應關系(參見Moscou和Bogdanove,(2009)Science326:1501及Bochetal(2009)Science326:1509-1512)。實驗上,已經確定這些TAL效應物的DNA識別的天然代碼是這樣的:位置12和13處的HD序列導致與胞嘧啶(C)的結合,NG結合T,NI結合A,C,G或T,NN結合A或G,而ING結合T。已經有人將這些DNA結合重復序列裝配成具有新的組合和數目的重復序列的蛋白質,以制備能夠與新序列相互作用并激活植物細胞中的非內源報告基因表達的人工轉錄因子(Boch等人,同上)。已經有人將工程化的TAL蛋白連接到FokI切割半域以生成TAL效應物域核酸酶融合物(TALEN),在酵母報道分子測定法(基于質粒的靶標)中顯示了活性。在另一個實施方案中,可以將本公開方法中使用的位點特異性核酸酶工程化改造為包括(非天然存在的)大范圍核酸酶(也稱為歸巢內切核酸酶)。歸巢內切核酸酶或大范圍核酸酶如I-SceI,I-CeuI,PI-PspI,PI-Sce,I-SceIV,I-CsmI,I-PanI,I-SceII,I-PpoI,I-SceIII,I-CreI,I-TevI,I-TevII和I-TevIII的識別序列是已知的。也參見美國專利號5,420,032;美國專利號6,833,252;Belfortetal.(1997)NucleicAcidsRes.25:3379–303388;Dujonetal.(1989)Gene82:115–118;Perleretal.(1994)NucleicAcidsRes.22,11127;Jasin(1996)TrendsGenet.12:224–228;Gimbleetal.(1996)J.Mol.Biol.263:163–180;Argastetal.(1998)J.Mol.Biol.280:345–353和NewEnglandBiolabs目錄。此外,可以工程化改造歸巢內切核酸酶和大范圍核酸酶的DNA結合特異性以結合非天然的靶位點。參見,例如Chevalieretal.(2002)Molec.Cell10:895-905;Epinatetal.(2003)NucleicAcidsRes.531:2952-2962;Ashworthetal.(2006)Nature441:656-659;Paquesetal.(2007)CurrentGeneTherapy7:49-66;美國專利公開號20070117128。歸巢內切核酸酶和大范圍核酸酶的DNA結合域可以在整個核酸酶的背景中改變(即,使得核酸酶包括關聯切割域)或可以與異源切割域融合。在進一步的實施方案中,在公開的方法中使用的位點特異性核酸酶是工程化(非天然存在的)CRISPR核酸酶。CRISPR(聚簇規定散布短回文重復(ClusteredRegularlyInterspacedShortPalindromicRepeats))/Cas(CRISPR關聯)核酸酶系統是一種新近工程化的核酸酶系統,以一種可以用于基因組工程的細菌系統為基礎。它是基于許多細菌和古細菌的適應性免疫反應的一部分。當病毒或質粒侵入細菌時,侵入者的DNA的片段通過“免疫”應答轉化為CRISPRRNA(crRNA)。然后,此crRNA通過部分互補性區域與稱為tracrRNA的另一種類型的RNA結合,將Cas核酸酶(例如Cas9)引導至靶DNA中的與crRNA同源的區域,稱為“原間隔物(protospacer)”。Cas核酸酶在由包含在crRNA轉錄物內的引導序列規定的位點處切割DNA,在DSB處生成平端。Cas9的位點特異性DNA識別和切割需要crRNA和tracrRNA兩者。此系統現在已經被工程化,使得crRNA和tracrRNA可以組合成一個分子(“單引導RNA”),并且單引導RNA的crRNA等同物可以被工程化改造以引導Cas9核酸酶靶向任何期望的序列(參見Jineketal(2012)Science337,p.816-821,Jineketal,(2013),eLife2:e00471,及DavidSegal,(2013)eLife2:e00563)。因此,可以工程化改造CRISPR/Cas系統以在基因組中的期望靶標處生成雙鏈斷裂(DSB),并且可以通過使用修復抑制劑影響DSB的修復,從而引起易錯修復的增加。在某些實施方案中,Cas核酸酶可以是天然存在的Cas核酸酶的“功能性衍生物”。天然序列多肽的“功能性衍生物”是具有與天然序列多肽共同的質量性生物學性質的化合物。“功能性衍生物”包括但不限于天然序列的片段和天然序列多肽及其片段的衍生物,條件是它們具有與相應的天然序列多肽共同的核酸酶活性。本文中考慮的核酸酶活性是功能性衍生物將DNA底物水解成片段的能力。術語“衍生物”涵蓋:多肽的氨基酸序列變體、共價修飾、和其融合物。Cas核酸酶或其核酸酶片段的合適衍生物包括但不限于:Cas蛋白或其核酸酶片段的突變體、融合物、共價修飾。Cas核酸酶或其功能衍生物可以從細胞獲得,或者可以化學合成、或者通過這兩種程序的組合合成。細胞可以是天然生成Cas核酸酶的細胞,也可以是天然生成Cas核酸酶、然后經過遺傳工程化改造,從而以更高的表達水平生成內源Cas蛋白或從外源導入的核酸生成Cas核酸酶的細胞,所述核酸編碼的Cas核酸酶與內源Cas可以相同也可以不同。在一些情況下,細胞不天然生成Cas蛋白,而是被遺傳工程化改造以生成Cas核酸酶。通過用引導RNA共表達Cas核酸酶,將Cas核酸酶部署在哺乳動物細胞中(而且可推定在植物細胞內)。可以使用兩種引導RNA形式促進Cas介導的基因組切割,如LeCong,F.,etal.,(2013)Science339(6121):819-823中公開的。在某些實施方案中,用于細胞基因組的體內切割和/或靶向切割的一種或多種核酸酶的DNA結合域包含鋅指蛋白。在一些實施方案中,鋅指蛋白是非天然存在的,并且被工程化改造以結合選擇的靶位點。參見,例如Beerlietal.(2002)NatureBiotechnol.20:135-141;Paboetal.(2001)Ann.Rev.Biochem.70:313-340;Isalanetal.(2001)NatureBiotechnol.19:656-660;Segaletal.(2001)Curr.Opin.Biotechnol.12:632-637;Chooetal.(2000)Curr.Opin.Struct.Biol.10:411-416;美國專利No.6,453,242;6,534,261;6,599,692;6,503,717;6689,558;7,030,215;6,794,136;7,067,317;7,262,054;7,070,934;7,361,635;7,253,273;和美國專利公開號2005/0064474;2007/0218528;2005/0267061,其全部內容通過提及并入本文。與天然存在的鋅指蛋白相比,經工程化改造的鋅指結合域可以具有新的結合特異性。工程化方法包括但不限于合理設計和各種類型的選擇。合理設計包括例如使用包含三聯體(或四聯體)核苷酸序列和單個鋅指氨基酸序列的數據庫,其中每個三聯體或四聯體核苷酸序列與結合特定三聯體或四聯體序列的鋅指的一個或多個氨基酸序列相關聯。參見例如美國專利號6,453,242和6,534,261,其全部內容通過提及并入本文。靶位點的選擇;用于設計和構建融合蛋白(和編碼它們的多核苷酸)的ZFP和方法是本領域技術人員已知的,并且在美國專利號6,140,0815;789,538;6,453,242;6,534,261;5,925,523;6,007,988;6,013,453;6,200,759;WO95/19431;WO96/06166;WO98/53057;WO98/54311;WO00/27878;WO01/60970WO01/88197;WO02/099084;WO98/53058;WO98/53059;WO98/53060;WO02/016536和WO03/016496中詳細描述。此外,可以使用任何合適的接頭序列將鋅指域和/或多指鋅指蛋白連接在一起,所述接頭序列包括例如長度為5個或更多個氨基酸的接頭。對于長度為6個或更多個氨基酸的示例性接頭序列,也參見美國專利號6,479,626;6,903,185;和7,153,949。本文中所述的蛋白質可以包含蛋白質的個別鋅指之間的合適接頭的任何組合。因此,在整合本文中公開的供體多核苷酸的方法中,位點特異性核酸酶包含特異性結合玉米基因組中期望插入供體DNA多核苷酸(其可以包含至少一個轉基因)的基因座處的靶位點的DNA結合域。可以將任何合適的切割域與DNA結合域可操作連接以形成核酸酶融合蛋白。例如,已經有人將ZFPDNA結合域與核酸酶域融合以創建ZFN,ZFN是一種功能性實體,能夠借助其工程化改造的(ZFP)DNA結合域識別其意圖的核酸靶標,使得DNA在核酸酶活性的作用下在ZFP結合位點附近被切割。參見,例如,Kimetal.(1996)ProcNatlAcadSciUSA93(3):1156-1160。新近,ZFN已經用于多種生物體中的基因組修飾。參見,例如,美國專利公開20030232410;20050208489;20050026157;20050064474;20060188987;20060063231;和國際公開WO07/014275。同樣,TALENDNA結合域已經與核酸酶域融合以創建TALEN。參見例如美國公開號20110301073。如上所述,切割域可以與DNA結合域是異源的,例如鋅指DNA結合域和來自不同核酸酶的切割域,或TALENDNA結合域和來自不同核酸酶的切割域,或大范圍核酸酶DNA結合結構域和來自不同核酸酶的切割域。異源切割域可以從任何內切核酸酶或外切核酸酶獲得。可以作為切割域來源的示例性內切核酸酶包括但不限于限制性內切核酸酶和歸巢內切核酸酶。參見例如2002-2003Catalogue,NewEnglandBiolabs,Beverly,MA;及Belfortetal.(1997)NucleicAcidsRes.25:3379-3388。切割DNA的其它酶是已知的(例如S1核酸酶;綠豆核酸酶;胰腺DNA酶I;微球菌核酸酶;酵母HO內切核酸酶;也參見Linn等人(編)Nucleases,ColdSpringHarborLaboratoryPress,1993)。這些酶(或其功能片段)中的一種或多種可以用作切割域和切割半域的來源。類似地,切割半域可以來源于任何需要二聚化以產生切割活性核酸酶或其部分,如上文列舉的。通常,如果融合蛋白包含切割半域,則需要兩個融合蛋白用于切割。或者,可以使用包含兩個切割半域的單一蛋白質。兩個切割半域可以來源自相同的內切核酸酶(或其功能片段),或者,每個切割半域可以來源于不同的內切核酸酶(或其功能片段)。此外,優選地,兩個融合蛋白的靶位點具有這樣的相對排布,使得兩個融合蛋白與其各自靶位點的結合后,各切割半域彼此采取一定的空間取向,使得各切割半域能夠形成功能性切割域,例如通過二聚化。因此,在某些實施方案中,各靶位點的近緣相距5-8個核苷酸或15-18個核苷酸。然而,兩個靶位點之間可以插入任何整數數目的核苷酸或核苷酸對(例如,2至50個核苷酸對或更多)。通常,切割位點位于靶位點之間。限制性內切核酸酶(限制酶)存在于許多物種中,并且能夠與DNA(在識別位點)進行序列特異性的結合,并在結合位點處或附近切割DNA。某些限制酶(例如IIS型)在與識別位點遠離的位點切割DNA,并具有可分離的結合和切割域。例如,IIS型酶FokI催化DNA的雙鏈切割,在一條鏈上距其識別位點的9個核苷酸處切割,在另一條鏈上距其識別位點的13個核苷酸處切割。參見,例如,美國專利號5,356,802;5,436,150和5,487,994;以及Lietal.(1992)Proc.Natl.Acad.Sci.USA89:4275-4279;Lietal.(1993)Proc.Natl.Acad.Sci.USA90:2764-2768;Kimetal.(1994a)Proc.Natl.Acad.Sci.USA91:883-887;Kimetal.(1994b)J.Biol.Chem.269:31,978-31,982。因此,在一個實施方案中,融合蛋白包含來自至少一種IIS型限制酶的切割域(或切割半域)和一個或多個鋅指結合域,其可以是,也可以不是經工程化改造的。一種示例性IIS型限制酶(其切割域與結合域可分開)是FokI。這種酶是作為二聚體有活性的。Bitinaiteetal.,(1998)Proc.Natl.Acad.Sci.USA95:10,570-10,575。因此,為了本公開的目的,認為公開的融合蛋白中使用的FokI酶的部分是切割半域。因此,為了使用鋅指FokI融合物的靶向雙鏈切割和/或靶向替代細胞序列,可以使用兩個融合蛋白(分別包含一個FokI切割半域)來重建催化活性切割域。或者,也可以使用含有鋅指結合域和兩個FokI切割半域的單個多肽分子。使用鋅指FokI融合物的靶向切割和靶向序列改變的參數在本公開內容的其它地方提供。切割域或切割半域可以是蛋白質中任何保留切割活性或保留多聚化(例如二聚化)形成功能性切割域的能力的部分。示例性的IIS型限制酶描述于國際專利申請公開WO07/014275中,其全部內容并入本文。別的限制酶也含有可分開的結合域和切割域,并且這些是本公開考慮到的。參見例如Robertsetal.(2003)NucleicAcidsRes.31:418-420。在某些實施方案中,切割域包含一個或多個可極大減少或阻止同二聚化的工程化切割半域(也稱為二聚化域突變體),例如美國專利公開號20050064474;20060188987;20070305346和20080131962中公開的,所有這些的公開內容通過提及以其整體并入本文。FokI的位置446,447,479,483,484,486,487,490,491,496,498,499,500,531,534,537,和538處的氨基酸殘基都是影響FokI切割半域的二聚化的靶標。示例性的形成專性異二聚體的FokI的工程化切割半域包括這樣的成對切割半域,其中第一切割半域包括在FokI的位置490和538處的氨基酸殘基處的突變,并且第二切割半域包括在氨基酸殘基486和499處的突變。因此,在一個實施方案中,490處的突變用Lys(K)替換Glu(E);538處的突變用Lys(K)替代Iso(I);在486處的突變用Glu(E)替代Gln(Q);并且位置499處的突變用Lys(K)替代Iso(I)。具體地,本文中描述的工程化切割半域是這樣制備的:在一個切割半域中突變位置490(E→K)和538(I→K)生成稱為“E490K:I538K”的工程化切割半域,并且在另一切割半域中突變位置486(Q→E)和499(I→L)以生成稱為“Q486E:I499L”的工程化切割半域。本文中描述的工程化切割半域是專性的異二聚體突變體,其中極大減少或者消除了異常切割。參見例如美國專利公開號2008/0131962,其公開內容通過提及整體并入本文用于所有目的。在某些實施方案中,工程化的切割半域包含在位置486,499和496(相對于野生型FokI編號)處的突變,例如用Glu(E)殘基替換位置486處的野生型Gln(Q)殘基,用Leu(L)殘基替換位置499處的野生型Iso(I)殘基,用Asp(D)或Glu(E)殘基替換位置496處的野生型Asn(N)殘基的突變(也分別稱為“ELD”和“ELE”域)。在其它實施方案中,工程化切割半域包含在位置490,538和537(相對于野生型FokI編號)處的突變,例如在位置490處用Lys(K)替換野生型Glu(E)殘基,用Lys(K)殘基替換位置538處的野生型Iso(I)殘基和用Lys(K)殘基或Arg(R)殘基替換位置537處的野生型His(H)殘基(也分別稱為“KKK”和“KKR”域)。在其它實施方案中,工程化切割半域包含在位置490和537(相對于野生型FokI編號)處的突變,例如用Lys(K)殘基替換位置490處的野生型Glu(E)殘基和用Lys(K)殘基或Arg(R)殘基替換位置537處的野生型His(H)殘基的突變(也分別稱為“KIK”和“KIR”域)。(參見美國專利公開號20110201055)。在其它實施方案中,工程化切割半域包含“Sharkey”和/或“Sharkey”突變(參見Guoetal,(2010)J.Mol.Biol.400(1):96-107)。可以使用任何合適的方法制備本文中描述的工程化切割半域,例如通過野生型切割半域(FokI)的定點誘變,如美國專利公開號20050064474;20080131962;和20110201055中描述的。或者,可以使用所謂的“分裂酶(split-enzyme)”技術(參見例如美國專利公開號20090068164)在核酸靶位點處在體內裝配核酸酶。此類分裂酶的構件可以在分別的表達構建體上表達,或者可以連接在一個可讀框中,其中各個構件例如通過自切割2A肽或IRES序列分開。構件可以是單個鋅指結合域或大范圍核酸酶核酸結合域的域。可以在使用前篩選核酸酶的活性,例如在如WO2009/042163和20090068164中描述的基于酵母的染色體系統中。可以使用本領域中已知的方法容易地設計核酸酶表達構建體。參見例如美國專利公開20030232410;20050208489;20050026157;20050064474;20060188987;20060063231;和國際公開WO07/014275。核酸酶的表達可以在組成型啟動子或誘導型啟動子的控制下。“靶標”或“靶位點”或“靶定基因組基因座”或“基因組DNA靶區域”是限定核酸中會與結合分子(例如位點特異性核酸酶)結合的一部分的核酸序列,只要存在足夠的結合條件。在一個實施方案中,基因組基因座序列包括存在于染色體,附加體,細胞器基因組(例如線粒體,葉綠體),人工染色體和細胞中存在的任何其它類型的核酸中的那些,如例如擴增的序列,雙重微小染色體和內源性或感染性細菌和病毒的基因組。基因組基因座序列可以是正常(即野生型)或突變體;突變體序列可以包括例如插入(例如,先前插入的外源多核苷酸),缺失,易位,重排和/或點突變。基因組基因座序列還可以包含多種不同等位基因中的一種。本文中還描述了用于在基因組基因座內插入供體DNA多核苷酸序列的方法作為本公開的實施方案。報告和觀察到的靶向基因組修飾的頻率表明,在植物內對基因組基因座的靶向是相對低效的。此類方法的成功率低,部分是由于同源重組的效率差,以及供體DNA非特異性插入基因組中靶位點之外區域中的頻率高。本公開提供了用于鑒定被靶定的基因組基因座內的供體DNA多核苷酸的方法。本文中公開了使用位點特異性核酸酶(例如,與切割域融合的工程化鋅指結合域)在細胞DNA中生成一個或多個靶向的雙鏈斷裂的方法。盡管公開的方法不依賴于特定的作用機制,但是已知細胞DNA中的雙鏈斷裂在切割位點附近刺激細胞修復機制增加數千倍,這樣的靶向切割為改變或替換(通過同源指導性修復)基因組中幾乎任何位點的序列提供了條件。除了使用本文中描述的位點特異性核酸酶外,靶向替換(或插入)選定的基因組序列還需要導入供體DNA多核苷酸。可以在位點特異性核酸酶表達之前、同時、或之后將供體DNA多核苷酸導入細胞中。供體DNA多核苷酸含有與基因組序列足夠的同源性以支持供體DNA多核苷酸和同源基因組序列之間的同源重組(或同源性指導修復)。供體DNA多核苷酸和基因組基因座之間的約25,50,100,200,500,750,1,000,1,500,2,000個核苷酸或更多的序列同源性(或10和2,000個核苷酸或更多之間的任何整數值)將支持其間的同源重組。供體DNA多核苷酸序列的長度范圍可以為10至5,000個核苷酸(或其間的核苷酸的任何整數值)或更長。供體DNA多核苷酸序列不需要與其替換的基因組序列相同。例如,供體DNA多核苷酸的序列相對于基因組序列可以含有一個或多個單堿基改變,插入,缺失,倒位或重排,只要存在與染色體序列的足夠的同源性即可。或者,供體DNA多核苷酸序列可以含有由兩個同源性區域側翼的非同源序列。另外,供體DNA多核苷酸序列可以包含載體分子,載體分子含有不與細胞染色質中感興趣的區域同源的序列。通常,供體DNA多核苷酸序列的同源區與期望重組的基因組基因座具有至少50%的序列同一性。在某些實施方案中,供體DNA多核苷酸序列在供體DNA多核苷酸和基因組基因座之間的25個或更多個,50個或更多個,100個或更多個,200個或更多個,300個或更多個,400個或更多個,500個或更多個,750個或更多個,1,000個或更多個,1500個或更多個,或2,000個或更多個具有序列同源性的核苷酸跨度里具有60%,70%,80%,85%,90%,95%,98%,99%或99.9%序列同一性。供體DNA多核苷酸分子可以含有兩個或更多個與細胞染色質同源的不連續區域。例如,為了靶向插入通常不存在于感興趣的基因組區域中的轉基因序列,這樣的轉基因序列的側翼可以有與供體DNA多核苷酸中感興趣的基因組區域具有同源性的區域。在其它實施方案中,選定的基因組序列的靶向替換還需要通過非同源末端連接機制(NHEJ)在靶定的基因組基因座內引入替換或供體DNA多核苷酸序列。隨后,供體鏈整合供體多核苷酸序列不需要用到同源臂。由于靶定的基因組基因座內雙鏈斷裂,供體多核苷酸序列整合在染色體內。NHEJ修復途徑提供了在基因組內整合供體多核苷酸的另一種備選機制。參見WO2013169802,通過提及并入本文。供體多核苷酸可以是單鏈或雙鏈的DNA或RNA,并且可以以線性或環狀形式導入細胞中。如果以線性形式導入,那么可以通過本領域技術人員已知的方法保護供體序列的末端(例如,免于核酸外切降解)。例如,將一個或多個雙脫氧核苷酸殘基添加到線性分子的3'末端和/或將自身互補的寡核苷酸連接到一個或兩個末端。參見,例如,Changetal.,(1987)Proc.NatlAcad.Sd.USA84:4959-4963;Nehlsetal.,(1996)Science272:886-889。用于保護外源多核苷酸免于降解的其它方法包括但不限于添加末端氨基基團和使用經修飾的核苷酸間連接,如例如硫代磷酸酯,氨基磷酸酯和O-甲基核糖或脫氧核糖殘基。供體DNA多核苷酸可以以具有額外序列(如例如復制起點,啟動子和編碼抗生素抗性的基因)的載體分子的一部分的形式導入細胞中。此外,供體DNA多核苷酸可以作為裸核酸,以與諸如脂質體或泊洛沙姆(poloxamer)的試劑復合的核酸導入,或者可以通過細菌或病毒(例如土壤桿菌屬物種,根瘤菌屬物種NGR234,苜蓿中華根瘤菌(Sinorhizoboiummeliloti),百脈根中間根瘤菌(Mesorhizobiumloti),煙草花葉病毒,馬鈴薯病毒X,花椰菜花葉病毒和木薯葉脈花葉病毒遞送。參見例如Chungetal.(2006)TrendsPlantSd.11(1):1-4)。在另外的實施方案中,可以通過如本文中描述的微粒轟擊轉化方法將供體DNA多核苷酸導入細胞中(例如,在雄激素愈傷組織中)。申請人的方法可以將工程化ZFP的強大的靶向能力與切割域(或切割半域)結合,以將雙鏈斷裂特異性地靶向到基因組中期望插入外源序列的區域。盡管對申請人的方法而言并非必需,但似乎在細胞序列中雙鏈斷裂的存在,連同與鄰近或圍繞斷裂的區域具有同源性的外源DNA分子的存在,可激活修復斷裂的細胞機制;所述細胞基質通過將序列信息從供體分子轉移到細胞(例如,基因組或染色體)序列中,即通過同源性指導的修復(又稱“基因轉換”)的過程,修復斷裂。為了改變染色體序列,不必復制供體的整個序列到染色體中,只要足夠的供體序列被復制以實現期望的序列改變即可。通過同源重組插入供體序列的效率與細胞DNA中雙鏈斷裂和期望重組的位點之間的距離成反比。當雙鏈斷裂更接近需要重組的位點時,通常觀察到更高的同源重組效率。在不需要精確的重組位點的情況下(例如,期望的重組事件可以一段基因組序列內發生),可以選擇供體核酸的長度和序列以及切割位點以獲得期望的重組事件。在期望的事件被設計為改變基因組序列中單個核苷酸的序列的情況下,在該核苷酸的任一側的10,000個核苷酸內切割細胞染色質。例如,切割可發生在該核苷酸任一側的2到1,000個核苷酸之間的任何整數值內。在某些例子中,在基因組序列中改變的核苷酸的任一側的1,000,500,200,100,90,80,70,60,50,40,30,20,10,5,或2個核苷酸內發生切割。如上文詳述的,兩個分別包含鋅指結合域和切割半域的融合蛋白的結合位點可以相距5-8或15-18個核苷酸,自每個結合位點的最接近另一個結合位點的邊緣處測量,切割在結合位點之間發生。是否在結合位點之間的單個位點或在多個位點發生切割是無關緊要的,因為切割的基因組序列會被供體序列替代。因此,為了通過靶向重組高效地改變單個核苷酸對的序列,結合位點之間的區域的中點在距該核苷酸對的10,000個核苷酸內,優選在1,000個核苷酸,或500個核苷酸,或200個核苷酸,或100核苷酸,或50個核苷酸,或20個核苷酸,或10個核苷酸,或5個核苷酸,或2個核苷酸,或1個核苷酸內,或在感興趣的核苷酸對處。在某些實施方案中,同源染色體可以充當供體DNA多核苷酸。因此,例如,雜合子中的突變的校正可以通過工程化改造融合蛋白來實現,所述融合蛋白結合并切割一條染色體上的突變體序列,但不切割同源染色體上的野生型序列。帶有突變的染色體上的雙鏈斷裂刺激基于同源性的“基因轉換”過程,其中來自同源染色體的野生型序列被復制到切割的染色體中,從而恢復野生型序列的兩個拷貝。還提供了可以增強靶向重組水平的方法和組合物,包括但不限于使用另外的ZFP功能性域融合物來激活參與同源重組的基因的表達,如例如,RAD52上位性組的成員(例如,Rad50,Rad51,Rad51B,RadSIC,RadSID,Rad52,Rad54,Rad54B,Mrell,XRCC2,XRCC3),其產物與上述基因產物相互作用的基因(例如BRCA1,BRCA2)和/或在NBS1復合物中的基因。參見,例如Boykoetal.(2006)PlantPhysiology141:488-497和LaFargeetal.(2003)NucleicAcidsRes31(4):1148—1155。類似地,可以使用與本文中公開的方法和組合物組合的ZFP功能域融合抑制參與非同源末端連接的基因的表達(例如,Ku70/80,XRCC4,聚(ADP核糖)聚合酶,DNA連接酶4)。參見,例如,Rihaetal.(2002)EMBO21:2819-2826;Freisneretal.(2003)PlantJ.34:427-440;Chenetal.(1994)EuropeanJournalofBiochemistry224:135-142。使用鋅指結合域和功能域之間的融合來激活和抑制基因表達的方法公開于例如,與本申請具有共同擁有者的美國專利6,534,261;6,824,978和6,933,113中。另外的抑制方法包括使用靶向待抑制的基因序列的反義寡核苷酸和/或小干擾RNA(siRNA或RNAi)。檢測測定法在某些實施方案中,本公開涉及一種方法,其包括確認基因組DNA的修飾,如靶玉米基因組的切割、供體DNA多核苷酸在靶玉米基因組內的整合、或摻入靶玉米基因組內的突變。在某些實施方案中,確認基因組的此類修飾的方法包括通過基于PCR的測定法、Southern印跡測定法、Northern印跡測定法、蛋白質表達測定法、Western印跡測定法、ELISA測定法或下一代測序測定法來確認。因此,可以以多種方式,包括使用序列的引物或探針,確認基因組中的基因組DNA的修飾,如基因組中的切割、整合的轉基因或突變。在某些實施方案中,穩定整合的轉基因可以基于轉基因在植物的一些組織中或在某些發育階段的組成性或選擇性表達來檢測,或者轉基因可以基本上沿著其整個生命周期在基本上所有植物組織中表達。可以通過任何合適的擴增方法實施靶向基因組修飾,整合的轉基因或突變的確認。一般參見Kwohetal.,Am.Biotechnol.Lab.8,14-25(1990)。合適的擴增技術的例子包括但不限于聚合酶鏈式反應,連接酶鏈式反應,鏈置換擴增(一般參見G.Walkeretal.,Proc.Natl.Acad.Sci.USA89,392-396(1992);G.Walkeretal.,NucleicAcidsRes.20,1691-1696(1992)),基于轉錄的擴增(參見D.Kwohetal.,Proc.Natl.AcadSci.USA86,1173-1177(1989)),自身持續性序列復制(或“3SR”)(參見J.Guatellietal.,Proc.Natl.Acad.Sci.USA87,1874-1878(1990)),Qβ復制酶系統(參見P.Lizardietal.,BioTechnology6,1197-1202(1988)),基于核酸序列的擴增(或“NASBA”)(參見R.Lewis,GeneticEngineeringNews12(9),1(1992)),修復鏈反應(或“RCR”)(參見R.Lewis,見上文),和飛鏢DNA擴增(boomerangDNAamplification)(或“BDA”)(參見R.Lewis,見上文)。一般優選聚合酶鏈式反應。“擴增”是核酸復制的一種特殊情形,涉及模板的特異性。它與非特異性模板復制(即,模板依賴性但不依賴于特定模板的復制)形成對比。模板特異性在這里區別于復制的保真性(即正確的多核苷酸序列的合成)和核苷酸(核糖或脫氧核糖)的特異性。模板特異性通常用“靶”特異性為度量來描述。如本文中使用的,術語“聚合酶鏈式反應”和“PCR”通常是指在不克隆或純化的情況下增加基因組DNA混合物中靶序列的區段的濃度的方法(美國專利號4,683,195;4,683,202;和4,965,188;通過提及并入本文)。用于擴增靶序列的此方法包括將過量的兩種寡核苷酸引物引入含有期望的靶序列的DNA混合物,接著是在DNA聚合酶存在下的精確的熱循環序列。這兩個引物與它們各自的雙鏈靶序列的鏈互補。為了實現擴增,使混合物變性,然后將引物退火至其在靶分子內的互補序列。退火后,用聚合酶延伸引物以形成新的互補鏈對。變性,引物退火和聚合酶延伸的步驟可以重復許多次(即,變性,退火和延伸構成一個“循環”;可以有許多“循環”),以獲得高濃度的期望的靶序列的擴增區段。期望的靶序列的擴增區段的長度由引物相對于彼此的相對位置確定,因此,此長度是可控參數。憑借方法的重復方面,該方法被稱為“聚合酶鏈式反應”(下文為“PCR”)。由于靶序列的期望的擴增區段變為混合物中的主要序列(就濃度而言),它們被說成是“PCR擴增的”。術語“逆轉錄酶”或“RT-PCR”是指一種類型的PCR,其中起始材料是mRNA。使用逆轉錄酶將起始mRNA酶促轉化為互補DNA或“cDNA”。然后將cDNA用作“PCR”反應的“模板”。在一個實施方案中,量化擴增反應。在其它實施方案中,使用標簽概況(signatureprofile)定量擴增反應,其中標簽概況從包括解鏈溫度和熒光標記概況的組中選擇。本公開的實施方案的核酸分子或其區段可以用作PCR擴增的引物。在實施PCR擴增中,在引物和模板之間可以容許一定程度的錯配。因此,示例性引物的突變,缺失和插入(特別是5’或3’末端的核苷酸的添加)落入本公開的范圍內。可以通過普通技術人員已知的方法在給定引物中生成突變,插入和缺失。已經描述了用于序列檢測的分子信標。簡言之,設計與側翼基因組和插入DNA接合部重疊的FRET寡核苷酸探針。FRET探針的獨特結構導致其含有一種二級結構,該二級結構將熒光和淬滅部分保持得非常接近。在熱穩定聚合酶和dNTP的存在下循環FRET探針和PCR引物(一個引物在插入的DNA序列中,一個引物在側翼基因組序列中)。在成功的PCR擴增后,FRET探針與靶序列的雜交導致探針二級結構去除,而熒光和淬滅部分在空間上分離。由于成功的擴增和雜交,熒光信號指示側翼基因組/轉基因插入序列的存在。此類用于檢測擴增反應的分子信標測定法是本公開的實施方案。水解探針測定法,又稱為(LifeTechnologies,FosterCity,Calif.),是一種檢測和量化DNA序列存在的方法。簡言之,設計FRET寡核苷酸探針,其中一個寡聚物在轉基因內,并且一個在側翼基因組序列中用于事件特異性檢測。在熱穩定聚合酶和dNTP的存在下循環FRET探針和PCR引物(一個引物在插入的DNA序列中,一個引物在側翼基因組序列中)。FRET探針的雜交導致熒光部分從FRET探針上的淬滅部分切割下來并釋放出來。由于成功的擴增和雜交,熒光信號指示側翼/轉基因插入序列的存在。此類用于檢測擴增反應的水解探針測定法是本公開的實施方案。KASPar測定法是一種檢測和定量DNA序列的存在的方法。簡言之,使用稱為測定系統的基于聚合酶鏈反應(PCR)的測定法篩選包含靶定基因組基因座的基因組DNA樣品。在本公開的實踐中使用的測定法可以利用含有多種引物的PCR測定混合物。在PCR測定混合物中使用的引物可以包含至少一個正向引物和至少一個反向引物。正向引物含有對應于供體DNA多核苷酸的特定區域的序列,并且反向引物含有對應于基因組序列的特定區域的序列。此外,PCR測定混合物中使用的引物可以包含至少一個正向引物和至少一個反向引物。例如,PCR測定混合物可以使用對應于兩個不同等位基因的兩個正向引物和一個反向引物。正向引物之一含有對應于內源基因組序列的特定區域的序列。第二正向引物包含對應于供體DNA多核苷酸的特定區域的序列。反向引物含有對應于基因組序列的特定區域的序列。用于檢測擴增反應的此類測定法是本公開的實施方案。在一些實施方案中,熒光信號或熒光染料選自HEX熒光染料,FAM熒光染料,JOE熒光染料,TET熒光染料,Cy3熒光染料,Cy3.5熒光染料,Cy5熒光染料,Cy5.5熒光染料,Cy7熒光染料和ROX熒光染料。在其它實施方案中,使用合適的第二熒光DNA染料運行擴增反應,所述第二熒光DNA染料能夠以可被流式細胞術檢測的濃度范圍染色細胞DNA,并且具有可通過實時熱循環儀檢測的熒光發射譜。本領域普通技術人員應當理解,其它核酸染料是已知的并且不斷被鑒定出來。可以采用任何具有合適的激發和發射譜的合適的核酸染料,如SYTOXSYBRGreen和在一個實施方案中,第二熒光DNA染料是以小于10μM,小于4μM或小于2.7μM使用的在進一步的實施方案中,可以利用下一代測序(NGS)確認基因組修飾。如Brautigma等人,2010所述,DNA序列分析可以用于測定分離和擴增的片段的核苷酸序列。可以分離擴增的片段并亞克隆到載體中,并使用鏈終止法(也稱為Sanger測序)或染料終止劑測序來測序。此外,可以用下一代測序對擴增子進行測序。NGS技術不需要亞克隆步驟,并且可以在單個反應中完成多個測序讀取。有三種NGS平臺已商品化,來自454LifeSciences/Roche的GenomeSequencerFLX,來自Solexa的IlluminaGenomeSequencer和AppliedBiosystems的SOLiD(首字母縮寫詞,代表:“寡聚物連接和檢測測序(SequencingbyOligoLigationandDetection)”)。此外,目前正在開發兩種單分子測序方法。這些包括來自HelicosBioscience的真實單分子測序(tSMS)和來自PacificBiosciences的單分子實時測序(SMRT)。由454LifeSciences/Roche推出的GenomeSequencerFLX是長讀段NGS,其使用乳液PCR和焦磷酸測序來生成測序讀段。可以使用300-800bp的DNA片段或含有3-20kbp片段的文庫。反應每次運行可以生成超過100萬個約250至400個堿基的讀段,總產量為250至400兆堿基。與其它NGS技術相比,此技術生成的讀段最長,但每次運行的總序列輸出較低。由Solexa推出的Illumina基因組分析儀是一種短讀段NGS,其利用熒光染料標記的可逆終止劑核苷酸邊合成邊測序,并且以固相橋式PCR為基礎。可以使用含有高達10kb的DNA片段的配對末端測序文庫的構建。反應生成長度為35-76個堿基的超過1億個短讀段。此數據可以每次運行生成3-6千兆堿基。由AppliedBiosystems推出的寡聚物連接和檢測測序(SOLiD)系統是一種短讀段技術。此NGS技術使用長度最多可達10kbp的片段化雙鏈DNA。該系統使用通過染料標記的寡核苷酸引物的連接和乳液PCR測序以生成10億個短讀段,其導致每次運行高達30千兆堿基的總序列輸出。HelicosBioscience的tSMS和PacificBiosciences的SMRT應用使用單個DNA分子進行序列反應的不同方法。tSMSHelicos系統生成高達8億個短讀段,每次運行導致21千兆堿基。這些反應使用熒光染料標記的虛擬終止劑核苷酸完成,其被描述為“邊合成邊測序”方法。由PacificBiosciences銷售的SMRT下一代測序系統使用通過合成的實時測序。由于不受可逆終止劑限制,此技術可以生成長度高達1000bp的讀段。使用此技術每天可以生成相當于二倍體人類基因組的一倍覆蓋度的原始讀取通量。在另一個實施方案中,可以使用印跡法測定法完成基因組修飾的確認,包括Western印跡,Northern印跡和Southern印跡。此類印跡法測定法是用于生物樣品的鑒定和量化的生物研究中常用的技術。這些測定法包括首先通過電泳手段分離凝膠中的樣品組分,接著將電泳分離的組分從凝膠轉移到轉移膜,諸如用硝化纖維,聚偏二氟乙烯(PVDF)或尼龍的材料制成的轉移膜。分析物也可以直接點樣在這些支持物上,或通過施加真空,毛細管作用或壓力而定向到支持物上的特定區域,而不需要在先分離。然后通常對轉移膜進行轉移后處理,以增強分析物彼此區分的能力,和通過檢視或通過自動讀取器檢測的能力。在進一步的實施方案中,可以使用ELISA測定法來完成基因組修飾的確認,所述ELISA測定法使用固相酶免疫測定法檢測液體樣品或濕樣品中物質(通常是抗原)的存在。將來自樣品的抗原附著于平板的表面。然后,將另外的特異性抗體施加在表面上,使得其可以結合所述抗原。此抗體是與酶連接的,并且在最后的步驟中,添加含有酶底物的物質。隨后的反應生成可檢測的信號,最常見的是底物中的顏色變化。將轉基因漸滲入后代植物中本公開提供了用于將包含轉基因的供體多核苷酸從雄性愈傷組織來源的雙單倍體植物漸滲入后代植物中的方法。本文中描述了雙單倍體植物的生成,包括就轉基因而言為純合的雙單倍體植物。在一個實施方案中,該方法包括以下步驟:i)將雌性親本植物與雄性親本植物雜交,其中所述雄性親本植物是雙單倍體植物,并且其中所述雌性親本植物是能育的親本植物;ii)從(a)的雜交收獲后代種子;iii)種植后代種子;并且iv)種植所述后代種子,其中所述后代種子包含含有所述轉基因的供體多核苷酸。在該方法的某些實施方案中,雌性和雄性親本植物是玉米植物。在進一步的實施方案中,雌性親本植物是良種玉米植物。此類生成后代種子的雜交可以使用常規植物育種技術完成。關于植物育種技術的討論,參見Poehlman(1995)BreedingFieldCrops.AVIPublicationCo.,WestportConn,第4版。可以使用回交方法將基因導入植物中。關于這種技術和其它用于將性狀引入植物中的植物育種方法的描述,可以參見參考文獻,如Poehlman,見上文,和PlantBreedingMethodology,NealJensen編,JohnWiley&Sons,Inc.(1988)。在典型的回交方案中,將感興趣的原始品種(輪回親本)與攜帶待轉移的感興趣的單個基因的第二品種(非輪回親本)雜交。然后,將此次雜交得到的后代再次與輪回親本雜交,并重復該過程,直到獲得這樣的植物:其中轉化的植物不但獲得了來自非輪回親本的單一轉移基因,還恢復了輪回親本的基本上所有的期望形態和生理特征。因此,本公開提供了使用根據本文中的方法生成的雙單倍體植物制備玉米植物的方法,所述方法包括雜交。例如,本主題公開包括生成后代種子的方法,該方法使含有供體多核苷酸的雙單倍體植物(根據本文中公開的方法制備)與遺傳上不同的第二植物(例如近交親本)雜交,收獲所得的后代種子,并使用實時PCR等方法檢測整合的供體多核苷酸以確定接合性。可以如下育種玉米植物:(i)將第一親本玉米植物與第二親本玉米植物有性雜交,從而生成多個第一后代植物,所述第一親本玉米植物是從含有包含轉基因的供體多核苷酸的株系的種子種植而來的;(ii)然后選擇含有包含轉基因的供體多核苷酸的第一后代植物;并(iii)使所述第一后代植物自交,由此生成多個第二后代植物;然后從所述第二后代植物中選擇含有包含農藝學性狀的供體多核苷酸的植物。這些步驟還可以包括(iv)將第一后代植物或第二后代植物與第二親本玉米植物或第三親本玉米植物回交。當將本公開的玉米植物與另一近交植物雜交以生成后代或雜種時,原始親本可以在雜種中充當具有基本上相同特征的母本或父本植物。有時,母本遺傳特征可能差異表達,取決于決定哪個親本用作雌性。然而,往往親本植物之一由于種子產率較高和優選的生產特性,如最佳種子大小和質量或除去雄穗的容易性等,而優選作為母本植物。一些植物生成更緊密的穗殼,導致更多的損失,例如由于腐爛,或者穗殼可能太緊以致須不能完全推出尖端,阻礙完全授粉,從而導致種子產率較低。在須形成中可能有延遲,這會不利地影響一對親本近交系的繁殖周期的時機。在一個植物中種衣特征可能是優選的,這可能影響雜種種子產品的貨架期。一個植物可能更好地脫落花粉,使得該植物成為優選的雄性親本。在一些實施方案中,將雌性親本植物與雄性雙單倍體親本植物“雜交”的第一步包括種植第一玉米植物和不同的第二雌性近交玉米植物的種子,優選在可授粉的附近區域內種植。在一些實施方案中,可以使用手動傳粉雜交雄性和雌性親本。在其它實施方案中,用于雜交雄性和雌性親本的手動傳粉可以借助工具或通過機械手段來實施。在進一步的實施方案中,如下實施用于雜交雄性和雌性親本的手動傳粉:從雄性植物獲得花粉并將花粉施用于雌性植物的柱頭(通過花粉管)。進一步的步驟包括培育或種植帶有花的雌性親本植物和雄性親本植物的種子。如果親本植物在性成熟的時間不同,那么可以用技術獲得適當的時機,即,確保當指定為雌株的親本玉米植物上的須可接受花粉時,指定為雄株的親本玉米植物的花粉可用。可以用于獲得期望的時機的方法包括延遲較快成熟的植物的開花,例如但不限于推遲較快成熟的種子的種植,切掉或燒掉較快成熟的植物的頂葉(而不殺死植物)或加速較慢成熟植物的開花,如通過用設計成加速萌發和生長的膜覆蓋較慢成熟的植物,或通過切開幼穗芽(earshoot)的尖端以露出須。在某些實施方案中,用種植者認為合適的一種或多種農用化學品處理雌性親本植物和雄性親本植物。進一步的步驟包括從接收花粉的植物的穗收獲接近成熟或處于成熟的種子。在一個具體的實施方案中,從雌性親本植物收獲種子,并且當期望時,可以種植收獲的種子以生成后代或第一代(F1)雜種玉米植物。又一個步驟包括將種子干燥和調理(conditioning),包括種子的處理/分篩(或分級),并包裝以出售給種植者以用于生產谷物或草料。與近交種子一樣,可以用組合物處理雜種種子,使得種子和從其生長的幼苗在暴露于不利條件時更加耐寒(hardy)。可以出售所得的后代或雜種種子給種植者用于生產谷物和草料,而不用于育種或種子生產。仍進一步,本公開提供了通過種植在雌性親本植物上生成并收獲的種子所生成的后代玉米植物,以及由后代玉米植物生成的谷物。在隨后的實施方案中,本公開提供了將賦予期望的性狀的供體多核苷酸導入后代植物中的方法。在實施方案的一個方面中,期望的性狀選自下組:殺蟲劑抗性性狀,除草劑耐受性性狀,疾病抗性性狀,產量增加性狀,營養質量性狀,農藝增加性狀、及其組合。期望的性狀的其它例子包括改變的脂肪酸代謝,例如通過用硬脂酰-ACP去飽和酶的反義基因轉化植物以增加植物的硬脂酸含量。參見Knultzonetal.,Proc.Natl.Acad.Sci.USA89:2624(1992)。減少的肌醇六磷酸含量:(i)肌醇六磷酸酶編碼基因的引入將增強肌醇六磷酸鹽的分解,為轉化的植物添加更多的游離磷酸鹽。例如,關于黑曲霉肌醇六磷酸酶基因的核苷酸序列的公開,參見VanHartingsveldtetal.,Gene127:87(1993)。(ii)可以引入降低肌醇六磷酸鹽含量的基因。在玉米中,例如,這可以通過克隆并然后再導入與單個等位基因相關的DNA來實現,所述單個等位基因造成以低水平的肌醇六磷酸為特征的玉米突變體。參見Raboyetal.,Maydica35:383(1990)。(iii)修飾的碳水化合物組成,例如通過用編碼改變淀粉分支模式的酶的基因轉化植物而實現。參見Shirozaetal.,J.Bacteriol.170:810(1988)(變異鏈球菌(Streptococcusmutans)果糖基轉移酶基因的核苷酸序列),Steinmetzetal.,Mol.Gen.Genet.200:220(1985)(枯草芽孢桿菌果聚糖蔗糖酶基因的核苷酸序列),Penetal.,Bio/Technology10:292(1992)(表達地衣芽孢桿菌α-淀粉酶的轉基因植物的生成),Elliotetal.,PlantMolec.Biol.21:515(1993)(番茄轉化酶基因的核苷酸序列),Sogaardetal.,J.Biol.Chem.268:22480(1993)(大麥α-淀粉酶基因的定點誘變)和Fisheretal.,PlantPhysiol.102:1045(1993)(玉米胚乳淀粉分支酶II)。潛在期望的特征的其它例子包括更大的產率,更好的莖,更好的根,縮短的作物成熟前時間,更好的農藝質量,更高的營養價值,更高的淀粉可提取性或淀粉發酵能力,對殺蟲劑、除草劑、有害生物、熱和干旱、和疾病的抗性和/或耐受性,以及萌發時間、建植(standestablishment)、生長速率、成熟度和籽粒大小的一致性。可以使用包括實時PCR測定法的方法快速檢測包含玉米種子的玉米作物或其后代以確定接合性,然后種植,所述玉米種子含有包含農藝學性狀的供體多核苷酸。包括實時PCR測定法以確定接合性的方法可以改善此過程的效率。本主題的包括實時PCR測定法以確定接合性的方法可用于例如玉米育種程序以及質量控制,特別是用于玉米種子的商業化生產。此方法也可以幫助產品注冊和產品管理(stewardship)。可以使用此方法進行加速育種漸滲策略。本公開的檢測技術尤其可用于與植物育種漸滲結合,以確定在含有事件的親本植物與另一植物系雜交之后,哪些后代植物包含含有農藝學性狀的供體多核苷酸,以試圖將農藝學性性狀賦予到后代中。包括實時PCR測定法以確定接合性的公開的方法有益于玉米育種漸滲程序以及質量控制,特別是商業化玉米種子。本公開內容可以用于標志物輔助育種(MAB)方法。本公開可以與其它用于鑒定包含農藝性狀的供體多核苷酸附近的遺傳連鎖標志物的方法(例如,AFLP標記,RFLP標志物,RAPD標志物,SNP和SSR)組合使用。包括實時PCR測定法以確定接合性的方法允許追蹤在植物育種雜交的后代中包含農藝學性狀的供體多核苷酸。本公開的包括實時PCR測定法以確定接合性的方法可以用于鑒定任何含有包含農藝學性狀的供體多核苷酸的玉米品種。應當理解,本文中所述的實施例和實施方案僅用于說明性目的,本領域技術人員參考這些實施例和實施方案能夠作出各種修改或改變,這些修改或改變涵蓋在本申請的精神和范圍內,并落入所附權利要求書的范圍。這些實施例不應被解釋為限制性的。實施例實施例1:小孢子來源的單倍體愈傷組織的生成當小孢子處于早期雙核發育階段(花藥長約3mm,明亮,光澤黃色)時,從溫室種植的玉米植物(約5-6周齡)收獲玉米基因型139/39-05(美國專利號5,306,864)的萌前雄穗(Pre-emergenttassel)。將雄穗包裹在濕紙巾和鋁箔中,并置于設定在8℃的培養箱中7-14天。在表面滅菌(在0.08%v/vChloroxTM中15分鐘,接著無菌水漂洗)后,將花藥無菌分離,在6孔皿中在每孔6mL培養基中以60個花藥的密度置于液體“花藥培養基培養基”(N6鹽和維生素,60g/L蔗糖,5g/L活性炭,500mg/L酪蛋白水解產物,0.1mg/LTIBA,調節至pH5.8)的表面上,并在28℃在黑暗中溫育。將出現在14-28天之間的小孢子來源的胚樣結構轉移到“愈傷組織培養基”(MS鹽和維生素,30g/L蔗糖,700mg/LL-脯氨酸,500mg/LMES,100mg/L酪蛋白水解產物,15mg/L硝酸銀,3.3mg/L麥草畏和2.5g/LGelriteTM,調節至pH5.8)。每14天將結節性、胚發生的愈傷組織傳代培養至新鮮的“愈傷組織培養基”使之長大,之后進行倍性測定和轉化。前述提供了源自玉米小孢子的雄激素轉化感受態單倍體組織的例子,其可以用于修飾單倍體玉米基因組的公開的方法。實施例2:愈傷組織的倍性測定為了測定細胞倍性水平,將1g實施例1中制備的愈傷組織轉移至無菌PetriTM皿(FisherScientific,St.Louis,MO)。通過在1-2mL過濾的冰冷Gailbraith緩沖液(0.01MMgSO4,0.005MKCl,0.0005MHEPES,1mg/mLDTT)以及“MMG培養基”(4mMMES[pH6.0],0.6M甘露醇,15mMMgCl2)和0.25%TritonX-100TM存在下用單刃剃刀刀片切碎愈傷組織釋放出核。用另外2mL緩沖液漂洗PetriTM皿,將其與初始核提取物合并以使最終漿液體積為約5mL。然后通過轉移至玻璃組織勻漿器,柱塞上下泵動數次,溫和均化粗制核提取物。然后,勻漿通過濾茶器過濾,40μmSteri-flipTM(Millipore;Billerica,Massachusetts,USA)吸出所得的濾液以分離核。使用10μL/200μL樣品用碘化丙啶(Sigma-Aldrich;St.Louis,Missouri,USA)對分離的核染色并用BeckmanQuantaTM流式細胞儀(Beckman-Coulter,Brea,CA,USA)分析。對于每個樣品,收集至少50,000個核,并將75μL樣品加到細胞計數器中以使用對數標度顯示進行分析。流式細胞儀結果顯示大的單倍體(G0/G1)峰和較小的二倍體(G2)二倍體峰。結果證實,根據實施例1制備的愈傷組織由適合用于修飾單倍體玉米基因組的公開的方法中的單倍體細胞組成。實施例3:用于在從單倍體愈傷組織分離的原生質體中的靶向基因組修飾的構建體對于靶向基因組修飾,使用鋅指核酸酶(ZFN)構建體pDAB111879(描繪于圖1中)。ZFN的表達由玉米ubi1啟動子驅動,并用玉米per53’UTR終止。此表達盒含有“T2A”構造,該構造包含兩個鋅指單體域(zmPPL_1360-r23a1和zmPPL_1360-30a1),由單獨一個編碼區編碼并表達。表達的轉錄物包含T2A停頓信號(stuttersignal)(Mattionetal.,1996,J.Virol.,70:8124-7)以引入核糖體停頓,其在翻譯過程中釋放第一多肽,并且設計為在進一步翻譯時生成等摩爾量的第一和第二多肽。在用于靶向核的兩種ZF單體中包括opaque2核定位序列(NLS)。兩個NLS-ZF域融合物中都擁有對表2中所示的玉米基因組的獨特序列的結合特異性。鋅指單體還包括FokI核酸酶功能域(Kimetal.,1996,Proc.Natl.Acad.Sci.USA,100:1156-1160),利用單子葉優選密碼子表對其進行了密碼子偏倚設置。表2:由設計的鋅指蛋白識別的玉米基因組中的鋅指結合域和獨特序列。鋅指蛋白單體SEQIDNO:結合DNA序列5-3’zmPPL_1360-r23a1SEQIDNO:1ACTCCGTATGCGAAGGCAzmPPL_1360-30a1SEQIDNO:2TTCGCGGTGGGACACTTG使用供體多核苷酸構建體pDAB111845(在圖2中描繪),利用ZFN構建體定點雙鏈切割和隨后的DNA修復,將DNA靶向整合到單倍體愈傷組織來源的原生質體中。該構建體含有兩種ZF單體,zmPPL_1360-r23a1和zmPPL_1360-30a1的DNA結合序列。另外,此構建體含有稱為“UZI”的110bp序列,用于經由內/外PCR對靶向插入的下游分析,即引物位點設計。此質粒與pDAB111879(ZFN構建體)的共遞送導致當ZFN表達時,在獨特的基因組序列處和供體構建體pDAB118845內發生切割,促使供體構建體通過非同源末端連接DNA修復和重組而靶向整合到基因組切割位點中。前文提供了可以用于本公開的修飾單倍體玉米基因組的方法中的構建體的例子:用于遞送位點特異性鋅指核酸酶的pDAB111879和用于靶向整合供體多核苷酸的pDAB111845。實施例4:在從單倍體愈傷組織分離的原生質體中的靶向基因組修飾將單倍體愈傷組織(約5克)轉移到無菌PetriTM皿中,并添加5mL“MMG培養基”。使用單刃剃刀刀片將愈傷組織細碎成小塊,直到獲得奶油狀漿液。使用無菌刮刀將漿液轉移至無菌50mL錐形管(FisherScientific)和20mL“酶溶液”(溶解于“MMG培養基”中的3%CellulaseTM[OnozukaR10,YakultPharmaceuticals,Japan],0.3%PectolyaseTM[MPBiomedicals,SanDiego,CA])。將管用ParafilmTM包裹并置于Vari-MixTM平臺搖床(ThermoScientific,Waltham,MA)上,并在24℃在黑暗中劇烈搖動約16-18小時。在無菌的50mL錐形管中,用100μm細胞過濾器(Falcon)緩慢過濾“酶溶液”。漂洗該細胞過濾器(具有細胞),方法是移取10mL的“W5+培養基”(1.86mMMES[pH6.0],0.5mL0.2MMES[pH6.0],192mMNaCl,6.7mL1.54MNaCl,154mMCaCl2,8.3mL1MCaCl2,4.7mMKCl,1.25mLof0.2MKCl和37mL水),使之流過該100μm細胞過濾器。使用70μm細胞過濾器(Falcon)重復該步驟以捕獲較小的碎片。然后使用40μm細胞過濾器(Falcon)過篩濾液,并再次用10mL“W5+培養基”漂洗,得到40mL的最終濾液體積。然后,溫和倒轉管,將8mL“重梯度溶液”(500mM蔗糖,1mMCaCl2和5mMMES[pH6.0])緩慢添加到管中的原生質體/“酶溶液”/“W5+”混合物下的濾液。然后用轉臂浮桶式轉頭(來自Eppendorf,Hauppauge,NY)以1500rpm離心該管10分鐘。然后,使用10mL窄孔移液管尖端緩慢移出原生質體層(可見于“重梯度溶液”和“酶溶液”/“W5+培養基”之間),并置于無菌的50mL錐形管中。然后,使用“W5+培養基”使管達到35mL的體積,緩慢倒轉幾次,并以1000rpm離心10分鐘。然后,除去上清液而不干擾離心沉淀。然后,將含有原生質體的離心沉淀重懸于5mL“MMG培養基”中。首先將離心沉淀重懸于5mL“MMG培養基”中,然后在96孔板中添加30μL至270μL“MMG培養基”,使用BeckmanQuantaTM流式細胞儀測定每mL原生質體的濃度。對于轉染,使用“MMG培養基”將原生質體稀釋至每mL167萬個。將300μL的每個樣品(約500,000個原生質體)轉移到無菌的2mL管中。向每個管添加總共40μg的質粒DNA(36μg的pDAB111845[供體多核苷酸]+4μg的pDAB111879[編碼ZFN的多核苷酸]),并通過翻轉管緩慢混合,并在室溫溫育5分鐘。將PEG4000TM(Sigma-Aldrich,St.Louis,MO)緩慢添加(300μL)至原生質體/DNA混合物中,并溫和倒轉直至內容物完全混合。將管在室溫下溫育5分鐘,偶爾溫和倒轉混合。溫育后,緩慢添加1mL“W5+培養基”,將管溫和倒轉5-10次。然后,將管在微量離心機(Eppendorf)中以1500rpm離心5分鐘。小心地除去上清液,確保不干擾離心沉淀。一旦除去上清液,每個管加1mL“WI培養基”(4mMMES[pH6.0],1mL0.2mMMES[pH6.0],0.6M甘露醇,30mL1M甘露醇,20mMKCl,5mL0.2MKCl和14mL水),并溫和倒轉以重懸離心沉淀。然后用鋁箔覆蓋管以避光,并且將它們側放過夜溫育,此后提取基因組DNA并分析靶向基因組修飾。前文演示了本公開的方法用于在從小孢子來源的愈傷組織分離的原生質體中靶向修飾(例如位點特異性整合)單倍體玉米基因組的一個實例,所述原生質體用供體多核苷酸和編碼鋅指核酸酶(ZFN)的多核苷酸轉化。實施例5:具有靶向基因組修飾的單倍體原生質體的分子分析使用不對稱巢式內-外(in-out)PCR(ANIO)(美國臨時申請號61/873719)檢測從實施例4的轉染原生質體提取的基因組DNA中的靶向基因組修飾。表3中顯示用于檢測的引物對。一對引物設計用于特異性結合基因組序列,另一對引物設計用于結合供體多核苷酸DNA序列。在初始變性后,使用EX-TAQHSTMPCR試劑盒(ClontechLaboratories,Inc.;MountainView,California,USA),擴增程序包括:98℃12秒和66℃30秒,15個循環;然后72℃10分鐘,最后保持在4℃。然后,將第一PCR產物用于巢式第二PCR反應。在第一PCR產物初始變性后,擴增程序包括:98℃12秒、66℃30秒、然后68℃1分鐘,30個循環;然后72℃10分鐘,最后保持在4℃。使用1%E-gelTM(Invitrogen,Carlsbad,CA)通過凝膠電泳解析PCR產物。電泳的結果產生PCR產物的預期凝膠片段大小(700bp和1053bp,分別為5'和3'接合部),指示靶向插入的存在。由此,前文表明,本公開的方法導致了供體多核苷酸轉基因在玉米單倍體基因組中的靶向插入。表3:用于ANIOPCR反應的引物。前文演示了本公開的方法于確認供體多核苷酸在玉米小孢子來源的單倍體組織的基因組中的靶向整合的一個實例。實施例6:用于單倍體愈傷組織的靶向基因組修飾的構建體為了對單倍體愈傷組織的靶向轉基因整合,使用供體構建體pDAB118783,其含有一條約500bp的序列,該序列與在玉米基因組中的獨特zmPPL_1360-r23a1和zmPPL_1360-30a1識別序列的側翼序列同源(圖3)。這些序列被稱為“同源臂”。此供體構建體還含有用于在含有吡氟氯禾靈(haloxyfop)的培養基上進行體外選擇的aad-1表達盒。該aad-1基因表達受玉米ubi1啟動子控制,并以玉米per53’UTR終止。作為該構建體與pDAB111879(ZFN構建體)的共遞送的結果,獨特基因組序列處的雙鏈基因組DNA由于ZFN表達而被切割。“同源臂”提供同源性指導的修復的模板,從而將aad-1表達盒整合到基因組切割位點中。前文演示了供體多核苷酸(pDAB118783),其包含選擇標志物轉基因aad1,并且適合用于本文公開的通過將轉基因靶向整合到單倍體基因組中來修飾單倍體玉米基因組的方法。實施例7:在單倍體愈傷組織中的靶向基因組修飾在轟擊前三天,使用一次性解剖刀將單倍體愈傷組織切成約1-2mm的塊,置于新鮮“愈傷組織培養基”的表面上并在28℃在黑暗中溫育。在轟擊之前約4小時,將愈傷組織塊排列在含有“滲透培養基”(“愈傷組織培養基”中添加山梨糖醇和甘露醇各45.5g/L)的100x15mmPetriTM皿的中心的一個1cm直徑的圓圈中,并在黑暗中在28℃溫育。使用PDS-1000顆粒加速裝置TM(BioRad;Hercules,California,USA),在900psi和6cm飛行距離下,用總共0.5μgDNA(僅pDAB111879[ZFN];或pDAB118783[供體]與pDAB111879[ZFN]的10:1組合)轟擊愈傷組織,所述DNA用2.5μgCaCl2和0.1M亞精胺沉淀到150μg0.6μ金的表面上。前文演示了本公開的方法用于以ZFN和供體多核苷酸對小孢子來源的單倍體愈傷組織進行微粒轟擊來靶向修飾單倍體玉米基因組的一個實例。實施例8:具有靶向基因組修飾的單倍體愈傷組織的分子分析將實施例7中僅用pDAB111879(ZFN)通過微粒轟擊轉化的愈傷組織樣品凍干,使用Qiagen(Germantown,Maryland,USA)植物DNA提取試劑盒TM根據制造商的說明進行基因組DNA提取。將基因組DNA重懸浮于200μL水中,并通過(Invitrogen,Carlsbad,California,USA)測定濃度。所有樣品在0.8%瓊脂糖E-gelsTM(Invitrogen)上電泳以估計DNA的完整性。將所有樣品標準化(25ng/μL)用于PCR擴增,使用來自(SanDiego,CA)的系統對產生的擴增子測序。對于制備性PCR,合并來自每個重復的5μL,對每個模板進行5個單獨的小規模PCR反應,所述PCR反應使用24μL反應體系,其中有0.2μM適當的帶條碼的引物、AccuprimePfx(Invitrogen)、和25ng模板基因組DNA。循環參數包括在95°(5分鐘)初始變性,接著是35個循環的變性(95℃,15秒)、退火(55℃,30秒)、延伸(68℃,1分鐘);和最終延伸(72℃,7分鐘)。將PCR產物合并在一起,使用QiagenMinEluteTM凝膠提取/純化試劑盒在4%瓊脂糖凝膠上進行凝膠純化。測定凝膠純化的擴增子的濃度,并且通過合并來自ZFN靶向的和對應的野生型對照的約200ng的帶條碼的擴增子來制備PCR擴增子樣品(表4)。表4:用于擴增基因組靶序列的引物。進行測序并使用序列分析腳本進行分析。濾出低質量序列(質量評分截止<5的序列),剩余的序列根據條碼進行解析。然后,將條碼目錄與參照序列比對,并對插入和/或缺失進行打分。切割活性作為具有由易錯NHEJ修復導致的插入和/或缺失的高質量序列的函數來檢測。一組有代表性的改變的序列(SEQIDNO:33至SEQIDNO:45)作為與基因組DNA靶序列(SEQIDNO:32)的比對提供,以顯示得到的缺失和添加(圖4)。在表5中示出了頻率的匯總。表5:在經轟擊的愈傷組織對對照愈傷組織中PPL1基因座處的插入-缺失(Indel)頻率。因此,上文表明,本公開的方法在玉米單倍體基因組的PPL1基因座處產生了靶向誘變。上文還演示了本公開的方法用于確認單倍體基因組的靶向誘變的例子。實施例9:單倍體愈傷組織的染色體加倍、選擇和植物再生次日早晨將經過pDAB118783(供體)和pDAB111879(ZFN)共轟擊的來自實施例7的愈傷組織轉移到含有新鮮“愈傷組織培養基”的100x25PetriTM皿中,放置在皿表面上的濾紙(Whatman#4)上,用1mL的0.025%秋水仙素溶液浸泡,并且在黑暗中在28℃溫育。48小時后,使用100μ細胞過濾器(Falcon352360),用4mL液體“愈傷組織培養基”漂洗經過秋水仙素處理的愈傷組織,在無菌濾紙上吸干,并轉移至含有新鮮“愈傷組織培養基”的100x20mmPetriTM皿。在黑暗中在28℃再過4天(轟擊后8天)后,通過流式細胞儀確認愈傷組織的加倍單倍體性質,其結果示于圖5中。然后,將愈傷組織轉移至“選擇培養基”(具有100μM吡氟氯禾靈TM的“愈傷組織培養基”)。在“選擇培養基”上14天后,將愈傷組織轉移到新鮮的“選擇培養基”,再過14天,并于28℃在低光中放置。在“選擇培養基”上經過總共4周(自轟擊起5周)后,將愈傷組織轉移至含有“預再生培養基”(MS鹽和維生素,45g/L蔗糖,350L-脯氨酸,250mg/LMES,100mg/L肌醇,2.5mg/LABA,1mg/LBAP,0.5mg/LNAA,1mg/L硝酸銀,2.5g/LGelriteTM,具有100μM的吡氟氯禾靈,調節至pH5.8)的100x25mmPetriTM皿,并置于28℃的光照(50μM)中。7天后,將愈傷組織轉移到含有“再生培養基”(MS鹽和維生素,60g/L蔗糖,100mg/L肌醇,2.5g/LGelriteTM,對于pDAB118873+pDAB111879具有100μM吡氟氯禾靈TM],調節到5.8)的PhytaTrayTMII(Sigma-Aldrich;St.Louis,Missouri,USA),并在28℃置于光照(160μM)中。14-21天后,將芽轉移至“芽伸長培養基”(MS鹽,N6維生素,30g/L蔗糖,500mg/LMES,5.5g/L瓊脂,具有100μM吡氟氯禾靈TM,調節至pH5.8),和于28℃置于光照(190μM)。將生根的植物移植到含有Pro-MixBXTM(PremierTech;Riviere-du-Loup,Canada)的10cm塑料盆中,并放置在具有16/8小時光周期和27/24℃溫度的生長室(Conviron;Winnipeg,Canada)中。然后將植物移植到含有95%Pro-MixBXTM和5%粘土/壤土土壤的混合物的5加侖盆中,并轉移到具有由金屬鹵化物和高壓鈉燈提供的補充光照的溫室中,光周期16/8小時,溫度30/20℃。然后,讓植物生長至成熟并自花授粉。前文演示了本公開的方法用于從小孢子來源的單倍體愈傷組織再生加倍單倍體植物的一個實例,所述愈傷組織包含整合到其基因組中的靶向轉基因。實施例10:加倍單倍體轉基因植物的分子分析將實施例9的雙單倍體植物的組織樣品收集在96孔收集板中,并凍干2天。使用Genogrinder2010TM(SPEXSamplePrep)和不銹鋼珠進行組織浸軟。在組織浸軟后,使用BioSprint試劑盒TM(Qiagen;Germantown,Maryland,USA)根據制造商建議的方案以高通量形式分離基因組DNA。用Quant-ITPicoGreenDNA測定試劑盒TM(MolecularProbes;Invitrogen,Carlsbad,California,USA)定量基因組DNA。使用BiomekNXPTM自動化液體處理器(BeckmanCoulter;Pasadena,California,USA)將經定量的基因組DNA調整至2ng/μL以便進行水解探針測定法。水解探針測定法利用實時PCR測定轉基因拷貝數,實時PCR使用480系統(RocheAppliedScience;Indianapolis,Indiana,USA)。使用ProbeDesign軟件2.0為aad-1和內部參照基因轉化酶(Genbank登錄號:U16123.1)設計了測定法。為了擴增,以1X終濃度制備480探針主混合物(RocheAppliedScience),多重反應體積10μL,含有0.4μM的每種引物和0.2μM的每種探針(表6)。對于aad-1/轉化酶進行兩步擴增反應,在60℃延伸40秒,采集熒光。實時PCR數據的分析基于ΔΔCt方法,使用軟件版本1.5,使用相對定量模塊。為此,每次運行中包括來自單拷貝校準品的gDNA樣品和已知的2拷貝核對品。表6:用于aad-1和內部參照(轉化酶)的水解探針測定法的引物和探針信息。引物名稱SEQIDNO:序列檢測GAAD1FSEQIDNO:155’TGTTCGGTTCCCTCTACCAA3’---GAAD1RSEQIDNO:165’CAACATCCATCACCTTGACTGA3’---GAAD1PSEQIDNO:175’FAM-CACAGAACCGTCGCTTCAGCAACA3’FAMIVF-TaqSEQIDNO:185’TGGCGGACGACGACTTGT3’---INR-TaqSEQIDNO:195’AAAGTTTGGAGGCTGCCGT3’---IV-ProbeSEQIDNO:205’HEX-CGAGCAGACCGCCGTGTACTTCTACC3’HEX使用個別的“內-外”PCR反應檢測具有靶向轉基因插入的事件。表7中顯示了用于檢測的引物對(一個對側翼基因組序列特異性,另一個對供體構建體特異性)。初始變性后,擴增程序包括:94℃30秒、60℃30秒、72℃1分鐘,35個循環;然后72℃10分鐘,之后最后保持在4℃。PCR反應使用EX-TAQPCR試劑盒TM(ClontechLaboratories,Inc)。使用1%瓊脂糖凝膠解析和鑒定PCR產物。表7:用于內-外PCR反應的引物。引物名稱SEQIDNO:序列MAS863SEQIDNO:215’AAGCGGTGCGTTGGTATTAG3’MAS872SEQIDNO:225’GCGTTTAACAGGCTGGC3’MAS873SEQIDNO:235’CGATGCTCACCCTGTTGTTTG3’MAS864SEQIDNO:245’TCGCATACGACGGGCAT3’通過水解探針測定法測定切割位點的ZFN介導的破壞,使用480系統(RocheAppliedScience)進行實時PCR。測定法的設計使得引物和探針與位于ZFN結合位點及內部參照轉化酶的側翼的序列退火。為了擴增,在10μL體積多重反應中以1X終濃度制備480探針主混合物,所述多重反應含有0.4μM每種引物和0.2μM每種探針(表8)。進行兩步擴增反應,在60℃延伸30秒,采集熒光。實時PCR數據的分析使用軟件版本1.5,使用相對定量模塊,比較靶標參照比(targettoreferenceratio)。在每次運行中包括來自非轉基因對照植物的基因組DNA的樣品。表8:用于基因組基因座破壞的水解探針測定法的引物和探針信息。對于通過“內-外”PCR和基因座破壞qPCR測定法確定的含有靶向aad-1構建體的T0雙倍單倍體玉米植物,選用于進行Sothern印跡分析。如先前描述進行Southern印跡和探查。然后,用HindIII(NewEnglandBioLabs,Ipswich,MA)在37℃消化樣品過夜。使用表9中顯示的引物產生探針,這些引物結合“同源臂”外部的基因組序列。所得的Southern印跡確認了轉基因事件含有靶向aad-1構建體的全長拷貝。表9:用于生成探針以進行Southern印跡分析的引物。引物名稱SEQIDNO:序列MAS864SEQIDNO:305’TCGCATACGACGGGCAT3’MAS865SEQIDNO:315’TGGCAGCCGGTGCGA3’前文演示了本公開的方法用于確認加倍單倍體植物(從小孢子來源的單倍體愈傷組織再生的)展現靶向轉基因整合的幾個例子。序列表<110>美國陶氏益農公司J·F·佩達利諾T·F·斯特蘭奇J·P·塞繆爾R·C·布盧M·A·辛普森.<120>單倍體玉米轉化<130>75428<160>45<170>PatentInversion3.5<210>1<211>18<212>DNA<213>人工序列<220><223>ZFP單體<400>1actccgtatgcgaaggca18<210>2<211>18<212>DNA<213>人工序列<220><223>ZFP單體<400>2ttcgcggtgggacacttg18<210>3<211>21<212>DNA<213>人工序列<220><223>引物<400>3cgccacaaatctgaaccagca21<210>4<211>24<212>DNA<213>人工序列<220><223>引物<400>4ccacgatcgacattgatctggcta24<210>5<211>21<212>DNA<213>人工序列<220><223>引物<400>5ccagcatacagttagggccca21<210>6<211>20<212>DNA<213>人工序列<220><223>引物<400>6gttgccttggtaggtccagc20<210>7<211>21<212>DNA<213>人工序列<220><223>引物<400>7gcgacatatcaggccaacagg21<210>8<211>25<212>DNA<213>人工序列<220><223>引物<400>8gggatatgtgtcctaccgtatcagg25<210>9<211>21<212>DNA<213>人工序列<220><223>引物<400>9cgaaaactcagcatgcgggaa21<210>10<211>21<212>DNA<213>人工序列<220><223>引物<400>10gagccatcagtccaacactgc21<210>11<211>26<212>DNA<213>人工序列<220><223>引物<400>11tacgtatggcactaatctcaccggct26<210>12<211>28<212>DNA<213>人工序列<220><223>引物<400>12tacgtaagtcttagaagtacgctaccgt28<210>13<211>26<212>DNA<213>人工序列<220><223>引物<400>13acgtactggcactaatctcaccggct26<210>14<211>28<212>DNA<213>人工序列<220><223>引物<400>14acgtacagtcttagaagtacgctaccgt28<210>15<211>20<212>DNA<213>人工序列<220><223>引物<400>15tgttcggttccctctaccaa20<210>16<211>22<212>DNA<213>人工序列<220><223>引物<400>16caacatccatcaccttgactga22<210>17<211>24<212>DNA<213>人工序列<220><223>引物<400>17cacagaaccgtcgcttcagcaaca24<210>18<211>18<212>DNA<213>人工序列<220><223>引物<400>18tggcggacgacgacttgt18<210>19<211>19<212>DNA<213>人工序列<220><223>引物<400>19aaagtttggaggctgccgt19<210>20<211>26<212>DNA<213>人工序列<220><223>引物<400>20cgagcagaccgccgtgtacttctacc26<210>21<211>20<212>DNA<213>人工序列<220><223>引物<400>21aagcggtgcgttggtattag20<210>22<211>17<212>DNA<213>人工序列<220><223>引物<400>22gcgtttaacaggctggc17<210>23<211>21<212>DNA<213>人工序列<220><223>引物<400>23cgatgctcaccctgttgtttg21<210>24<211>17<212>DNA<213>人工序列<220><223>引物<400>24tcgcatacgacgggcat17<210>25<211>30<212>DNA<213>人工序列<220><223>引物<400>25ataagacatcgagctagtgtaagcgtaggc30<210>26<211>28<212>DNA<213>人工序列<220><223>引物<400>26tcacaactgtttaggcgtgtcctcttaa28<210>27<211>27<212>DNA<213>人工序列<220><223>引物<400>27aaagctgcagctgcctgttccctgtac27<210>28<211>26<212>DNA<213>人工序列<220><223>引物<400>28caaataagacatcgagctagtgtaag26<210>29<211>20<212>DNA<213>人工序列<220><223>引物<400>29ctgtttaggcgtgtcctctt20<210>30<211>17<212>DNA<213>人工序列<220><223>引物<400>30tcgcatacgacgggcat17<210>31<211>15<212>DNA<213>人工序列<220><223>引物<400>31tggcagccggtgcga15<210>32<211>76<212>DNA<213>人工序列<220><223>GenomicDNArecognitiontargetsequence<400>32gctacgtgccttcgcatacggagtagtttattcgcggtgggacacttgatagaaaggcta60cggtagcgtacttcta76<210>33<211>69<212>DNA<213>人工序列<220><223>靶位點處的ZFN切割所致的插入缺失<400>33ctacgtgccttcgcatacggagtttcgcggtgggacacttgatagaaaggctacggtagc60gtacttcta69<210>34<211>69<212>DNA<213>人工序列<220><223>靶位點處的ZFN切割所致的插入缺失<400>34ctacgtgccttcgcatacggagtttcgtggtgggacacttgatagaaaggctacggtagc60gtacttcta69<210>35<211>69<212>DNA<213>人工序列<220><223>靶位點處的ZFN切割所致的插入缺失<400>35ctacgtgccttcgcatacggagtattcgcggtgggacacttgatagaaaggctacggtag60cgtacttca69<210>36<211>69<212>DNA<213>人工序列<220><223>靶位點處的ZFN切割所致的插入缺失<400>36tacgtgccttcgcatacggagtaggcgcggtgggacacttgatagaaaggctacggtagc60gtacttcta69<210>37<211>69<212>DNA<213>人工序列<220><223>靶位點處的ZFN切割所致的插入缺失<400>37tacgtgccttcgcatacggagtattcgcggtgggacacttgatagaaaggctacggtagc60gtacttcta69<210>38<211>69<212>DNA<213>人工序列<220><223>靶位點處的ZFN切割所致的插入缺失<400>38tacgtgccttcgcatacggagtcattcgcggtgggacacttgatagaaaggctacggtag60cgtacttct69<210>39<211>68<212>DNA<213>人工序列<220><223>靶位點處的ZFN切割所致的插入缺失<400>39tacgtgccttcgcatacggagtttcgcggtgggacacttgatagaaaggctacggtagcg60tacttcta68<210>40<211>69<212>DNA<213>人工序列<220><223>靶位點處的ZFN切割所致的插入缺失<400>40tacgtgccttcgcatacggagtcattcgcggtgggacacttgatagaaaggctacggtag60cgtactcta69<210>41<211>69<212>DNA<213>人工序列<220><223>靶位點處的ZFN切割所致的插入缺失<400>41acgtgccttcgcatacggagtcattcgcggtgggacacttgatagaaaggctacggtagc60gtacttcta69<210>42<211>68<212>DNA<213>人工序列<220><223>靶位點處的ZFN切割所致的插入缺失<400>42acgtgccttcgcatacggagtaggcgcggtgggacacttgatagaaaggctacggtagcg60tacttcta68<210>43<211>68<212>DNA<213>人工序列<220><223>靶位點處的ZFN切割所致的插入缺失<400>43acgtgccttcgcatacggagtattcgcggtgggacacttgatagaaaggctacggtagcg60tacttcta68<210>44<211>69<212>DNA<213>人工序列<220><223>靶位點處的ZFN切割所致的插入缺失<400>44cgtgccttcgcatacggagtagtttcgcggtgggacacttgatagaaaggctacggtagc60gtacttcta69<210>45<211>67<212>DNA<213>人工序列<220><223>靶位點處的ZFN切割所致的插入缺失<400>45cgtgccttcgcatacggagtaggcgcggtgggacacttgatagaaaggctacggtagcgt60acttcta67當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1