沙棘黃酮及其應用的制作方法
本發明涉及生物醫藥
技術領域:
,特別是涉及一種沙棘黃酮及其應用。
背景技術:
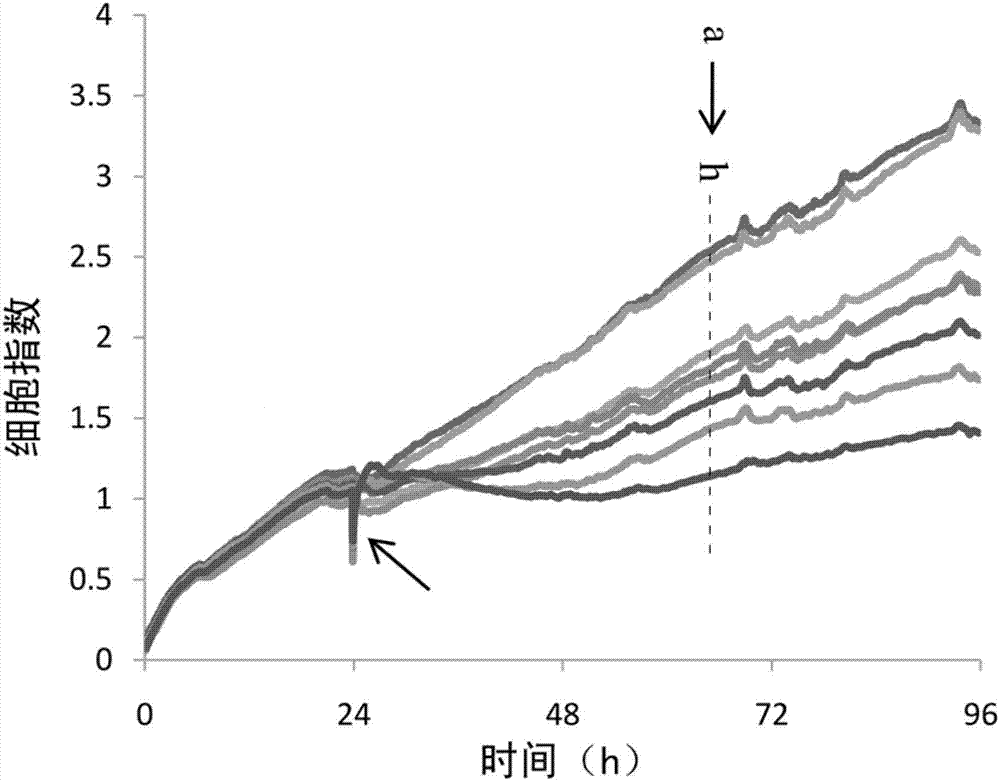
:前列腺癌是指發生在前列腺的上皮性惡性腫瘤。2004年who《泌尿系統及男性生殖器官腫瘤病理學和遺傳學》中前列腺癌病理類型上包括腺癌(腺泡腺癌)、導管腺癌、尿路上皮癌、鱗狀細胞癌、腺鱗癌。其中前列腺腺癌占95%以上,因此,通常所說的前列腺癌就是指前列腺腺癌。前列腺癌是西方國家男性發病率居于第一位、致死率居于第二位的惡性腫瘤。近幾年,我國男性的前列腺癌發病率也逐年升高,尤其是我國正步入老齡化社會,未來數十年很有可能出現前列腺癌發病高峰。2012年我國腫瘤登記地區前列腺癌發病率為9.92/10萬,列男性惡性腫瘤發病率的第6位。發病年齡在55歲前處于較低水平,55歲后逐漸升高,發病率隨著年齡的增長而增長,高峰年齡是70~80歲。家族遺傳型前列腺癌患者發病年齡稍早,年齡≤55歲的患者占43%。前列腺癌由于其生理位置的隱蔽性,且早期常無癥狀,往往容易被忽視,診斷發現后大多處在中晚期,從而失去了治療的最佳時間。化學藥物療法在治療前列腺癌中占有重要地位。然而,近幾年新生產的化療藥物在藥物靶向性和全身毒性方面效果一直不好,這使得從天然植物中尋找藥物活性成分成為開發抗前列腺癌藥物的重要手段。沙棘(hippophaerhamnoidesl.)又名醋柳、黑刺,屬胡頹子科沙棘屬植物,廣泛分布于我國西北部地區,是我國藏醫傳統習用藥材。目前,沙棘作為藥食兩用作物被允許使用在食品、藥品等行業,具有廣泛的應用前景。沙棘黃酮是沙棘果實和沙棘葉中黃酮的總稱,不同產地來源和不同活性部位其黃酮成分和含量有較大差異,但主要都以槲皮素苷元、異鼠李素苷元、山奈酚及其苷類為主。黃酮類物質是沙棘最主要的活性成分之一,現代醫學證明,沙棘黃酮在降血脂、降血糖、提高心肌耐缺氧能力、抗氧化、抗腫瘤等方面具有較好的生理功效。公開號為cn105982928a的中國發明專利公開了沙棘果抗腫瘤提取物及其組合物的醫藥用途和制備方法。一種維吾爾藥沙棘果提取物,維吾爾藥沙棘果經溶劑超聲提取,提取液濃縮后,用硅膠柱分離,上樣后的硅膠柱,先用體積比為100∶0-100∶10的二氯甲烷:甲醇混合溶劑洗脫,繼用體積比100∶12-100∶17的二氯甲烷:甲醇混合溶劑洗脫,用體積比為100∶12-100∶17的二氯甲烷:甲醇混合溶劑洗脫的洗脫液經回收溶劑,干燥即為該提取物。還公開了所述維吾爾藥沙棘果提取物在制備預防及治療乳腺癌、肺癌、胃癌、結腸癌、胰腺癌、宮頸癌、腦膠質瘤或肝癌中的應用。目前尚無沙棘黃酮用于抗前列腺癌的相關文獻報道。技術實現要素:本發明提供了一種沙棘黃酮及其應用,該沙棘黃酮為利用本發明方法從沙棘中提取,對前列腺癌具有一定的療效。沙棘黃酮,由沙棘果提取獲得,所述提取方法包括以下步驟:(1)沙棘果經有機溶劑超聲提取獲得提取液;(2)提取液濃縮并去除有機溶劑獲得粗提物;(3)粗提物經柱層析分離純化獲得洗脫液;(4)洗脫液經酸水解獲得所述沙棘黃酮。步驟(1)用于初步提取沙棘果的有效成分,可以多次抽提后合并提取液。所述的沙棘黃酮,步驟(1)中有機溶劑為60%~80%的乙醇溶液。所述的沙棘黃酮,超聲時的溫度為50℃~60℃。超聲輔助提取,超聲時,適當的提高溫度有利于有效成分溶解到有機溶劑中。步驟(2)中去除步驟(1)中的有機溶劑,可以通過多種方法,比如說減壓蒸餾,或者濃縮后冷凍干燥得到粉末狀的粗提物,下一步分離純化時再用水復溶。步驟(3)中,柱層析分離主要去除的是糖類、蛋白質、鞣制等物質。所述柱層析使用ab-8大孔樹脂作為填料。ab-8型大孔吸附樹脂是苯乙烯型弱極性共聚體,比表面積在480-520m2/g左右,適合黃酮類化合物的純化;其他類似的填料還有d-101,hp-20等。所述的沙棘黃酮,大孔吸附樹脂分離時使用50%乙醇作為洗脫溶劑。使用ab-8大孔樹脂作為填料時,上樣后,先用水洗,再用10%乙醇、30%乙醇梯度洗,洗去雜質后,最后再用50%乙醇洗脫,以50%乙醇洗脫下來的組分用于下一步的酸水解。當然,洗雜時的乙醇濃度可以適當變動,以洗凈雜質為準,而洗脫時乙醇的濃度也可以適當變動,以能夠將目標物洗脫下來為宜。所述的沙棘黃酮,步驟(4)中酸水解所使用的水解液為鹽酸-甲醇溶液,由質量濃度為2%~6.5%的鹽酸與甲醇按體積比1∶3~5混合獲得。酸水解,也可以使用硫酸或醋酸等其他酸。甲醇是作為溶劑使用,其他醇也是可以使用具有相同作用,比如乙醇。酸水解是將糖苷水解成為苷元和糖基。所述的沙棘黃酮,酸水解前,將洗脫液濃縮、冷凍干燥去除溶劑。所述的沙棘黃酮,酸水解溫度為60~80℃,水解時間為3~5h。所述的沙棘黃酮,以質量比計,槲皮素苷元含量不低于4.20%、異鼠李素苷元含量不低于17.50%。本發明還提供了所述的沙棘黃酮在制備預防或治療前列腺癌的藥物或保健食品中的應用。本發明沙棘黃酮由沙棘果經有機溶劑粗提,再經柱層析分離純化,然后酸水解獲得。不同的提取方法對沙棘黃酮中各有效成分的含量具有較大的影響。本發明沙棘黃酮經研究發現對前列腺癌具有一定的治療和預防效果,能夠被用于制備預防或治療前列腺癌的藥物或保健食品。附圖說明圖1為實施例5中mtt法檢測細胞活性結果圖,其中,*表示與對照組相比,p<0.01,具有顯著性。圖2為rtca實時監測沙棘黃酮對細胞影響的結果圖,其中,曲線a~h分別代表沙棘黃酮濃度0、0.78、1.56、3.13、6.25、12.5、25、50μg/ml。圖3為細胞遷移實驗24h時的結果圖,其中,圖a為對照組,圖b沙棘黃酮濃度為100μg/ml,圖c沙棘黃酮濃度為200μg/ml。圖4為實施例8中細胞凋亡實驗結果圖,其中,圖a為對照組,圖b為沙棘黃酮濃度為50μg/ml。圖5為實施例8中細胞凋亡實驗的統計結果圖,其中,“*”表示與對照組相比具有顯著性差異。圖6為實施例9中細胞周期實驗結果圖,其中,圖a為對照組,圖b為沙棘黃酮濃度為50μg/ml。圖7為實施例9中細胞周期實驗的統計結果圖,其中,“*”表示與對照組相比具有顯著性差異。圖8為對比例1中mtt法檢測細胞活性結果圖。具體實施方式實驗材料和儀器:雄激素非依賴性前列腺癌pc-3細胞(來源:中國科學院上海生命科學研究院細胞庫);bio-rad680酶標儀(美國bio-rad公司);rtcas16實時無標記細胞功能分析儀(艾森生物(杭州)有限公司);噻唑藍(mtt)(北京雷根生物技術有限公司);6ht流式細胞計(美國bd公司);annexinv/pi細胞凋亡檢測試劑盒(索萊寶生物科技有限公司);dna含量(細胞周期)檢測試劑盒(索萊寶生物科技有限公司)培養基:含有10%胎牛血清和1%鏈霉素、赤霉素的dmem/f12培養基(hyclone公司)。實施例1取干燥沙棘果100g,加入10倍體積(1.0l)70%乙醇溶液,55℃超聲輔助提取1h,重復3次,過濾,合并濾液,減壓蒸餾,除去乙醇,濃縮樣品,經冷凍干燥后得到沙棘果粗提物粉末23.6g;取上述沙棘果粗提物粉末10.0g,加水100ml復溶,取上清液過ab-8大孔樹脂,其中,上樣速率為0.2bv/h,吸附一晚。依次用10%、30%、50%乙醇梯度洗脫,洗脫流速為40ml/min,共洗脫1.5bv,保留50%乙醇洗脫組分,濃縮,冷凍干燥;取冷凍干燥所得粉末1.0g,加入600ml水解液,水解液由質量濃度為4%的鹽酸與甲醇按體積比1∶4混合,其余為水,70℃水解4h,減壓蒸餾,除去甲醇,冷凍干燥即得到沙棘黃酮樣品。取樣進行檢測,以槲皮素苷元、異鼠李素苷元標準品對對照品,通過高效液相色譜(hplc)法進行檢測,其中,槲皮素苷元含量5.20%,異鼠李素苷元含量19.02%。實施例2取干燥沙棘果150g,加入10倍體積(1.5l)60%乙醇溶液,60℃超聲輔助提取1h,重復3次,過濾,合并濾液,減壓蒸餾,除去乙醇,濃縮樣品,經冷凍干燥后得到沙棘果粗提物粉末40.18g;取上述沙棘果粗提物粉末20.2g,加水200ml復溶,取上清液過ab-8大孔樹脂,其中,上樣速率為0.2bv/h,吸附一晚。依次用10%、30%、50%乙醇梯度洗脫,洗脫流速為40ml/min,共洗脫1.5bv,保留50%乙醇洗脫組分,濃縮,冷凍干燥;取冷凍干燥所得粉末1.2g,加入650ml水解液,水解液由質量濃度為6.5%的鹽酸與甲醇按體積比1∶3混合制得,其余為水,60℃水解3h,除去甲醇,冷凍干燥即得到沙棘黃酮樣品。取樣進行檢測,以槲皮素苷元、異鼠李素苷元標準品對對照品,通過高效液相色譜(hplc)法進行檢測,其中,槲皮素苷元含量4.98%,異鼠李素苷元含量20.87%。實施例3取干燥沙棘果250g,加入10倍體積(2.5l)80%乙醇溶液,50℃超聲輔助提取1h,重復3次,過濾,合并濾液,減壓蒸餾,除去乙醇,濃縮樣品,經冷凍干燥后得到沙棘果粗提物粉末60.2g;取上述沙棘果粗提物粉末30.0g,加入300ml蒸餾水復溶,取上清液過ab-8大孔樹脂,其中,上樣速率為0.2bv/h,吸附一晚。依次用10%、30%、50%乙醇梯度洗脫,洗脫流速為40ml/min,共洗脫1.5bv,保留50%乙醇洗脫組分,濃縮,冷凍干燥;取冷凍干燥獲得的粉末2.0g,加入1200ml水解液,水解液由質量濃度為2%的鹽酸與甲醇按體積比1∶5混合制得,其余為水,80℃水解5h,除去甲醇,冷凍干燥即得到沙棘黃酮樣品。取樣進行檢測,以槲皮素苷元、異鼠李素苷元標準品對對照品,通過高效液相色譜(hplc)法進行檢測,其中,槲皮素苷元含量5.21%,異鼠李素苷元含量19.47%。實施例4取干燥沙棘果200g,加入2.0l70%乙醇溶液,60℃超聲輔助提取1h,重復3次,過濾,合并濾液,減壓蒸餾除去乙醇,濃縮樣品,經冷凍干燥后得到沙棘果渣粗提物粉末45.8g;取上述沙棘果渣粗提物粉末15.0g,加入150ml蒸餾水復溶,取上清液過ab-8大孔樹脂,其中,上樣速率為0.2bv/h,吸附一晚。依次用0、10%、30%、50%乙醇梯度洗脫,洗脫流速為40ml/min,共洗脫1.5bv,保留50%乙醇洗脫組分,濃縮,冷凍干燥;取上述干燥粉末2.0g,加入1.2l水解液,水解液由質量濃度為6.5%的鹽酸與甲醇按體積比1∶4混合,其余為水,60℃水解3h,除去甲醇,冷凍干燥即得到沙棘黃酮樣品。以槲皮素苷元、異鼠李素苷元標準品為對照品,通過高效液相色譜(hplc)進行檢測,其中槲皮素苷元含量4.20%,異鼠李素苷元含量17.50%。實施例5取新復蘇的pc-3細胞于37℃,5%co2培養箱中培養,待細胞穩定傳代2次后,用于后續實驗。取對數生長期的pc-3細胞,用0.25%胰酶消化后,計數,調整細胞濃度為2×104個/ml,接種200μl細胞懸浮液于96孔培養板,在37℃、5%co2培養箱培養24h使細胞貼壁。更換培養液,每孔加入沙棘黃酮樣品(實施例1制備)的培養液200μl(樣品用0.5%dmso溶解)。設置空白組和樣品組,每組6個復孔,濃度分別為50、100、150、200μg/ml,繼續培養24h,48h,72h。終止反應前4h,每孔加入5g/lmtt20μl繼續培養4h。吸棄孔內培養液,每孔加入dmso150μl,振蕩10min使紫色結晶完全溶解后,在570nm測定吸光度。相對細胞活力=(加藥組od值-本底od值)/(空白對照組od值-本底od值)其中,空白對照組為0.5%dmso的培養基組;本底組為未加細胞組。實驗數據以mean±sd表示,采用spss軟件分析,統計檢驗用t檢驗和單因素f檢驗,檢驗水平p=0.01。結果如圖1所示,相比于對照組,一定劑量的沙棘黃酮可以明顯抑制pc-3細胞的活力,且呈劑量和時間依賴性。各樣品處理時間段的ic50值見表1。表1時間24h48h72hic50(μg/ml)91.07549.74227.921實施例6rtca(realtimecellularanalysis)實時無標記細胞分析技術是將微電子細胞傳感器芯片整合到表面適于細胞貼附與生長的細胞檢測板的底部或細胞浸潤遷移板的微孔膜,用以構建實時、動態、定量跟蹤細胞形態和增殖分化等改變的細胞阻抗檢測傳感系統。本實驗中的細胞培養板e-plate16的底部整合有微金電子傳感器芯片,貼壁生長在微電極表面的細胞狀態改變會引起電極阻抗的變化,這種改變與細胞的實時狀態改變成相關性,因此可基于電阻抗的測定用細胞指數(cellindex,ci)來表示細胞狀態,實現實時監測。取對數生長期的pc-3細胞,以5000/孔的密度接種于rtca16孔板中,培養24h,加入不同濃度的樣品溶液50μl,繼續培養72h,實時監測電極阻抗變化,每個濃度設置3個重復。結果如圖2所示,相比于對照組,一定劑量的沙棘黃酮可以明顯抑制pc-3細胞的增殖,且呈劑量和時間依賴性,通過rtca實時監測沙棘黃酮對細胞的影響,發現低劑量的沙棘黃酮樣品(6.25μg/ml)即可明顯改變細胞的狀態,造成細胞指數的下降。實施例7對數生長期的pc-3細胞經胰酶消化后,調節細胞濃度,加入適量(1×105個)細胞至6孔板中,待一段時間的培養后細胞貼壁。當細胞長至基本鋪滿6孔板時,用10μl的槍頭在6孔板上進行劃痕,劃痕后用pbs清洗3次去除脫落的細胞。分別向6孔板中加入不同濃度的沙棘黃酮樣品(實施例1制備),同時設置空白組,放入培養箱繼續培養。別在12h、24h、36h進行拍照觀察細胞在劃線區域的遷移情況。結果如圖3所示,相比于對照組,100μg/ml的沙棘黃酮即可明顯抑制pc-3細胞的橫向遷移,當濃度達到200μg/ml時,pc-3細胞基本失去遷移的能力。實施例8annexinv是一種磷脂結合蛋白,能與細胞凋亡過程中翻轉到膜外的磷酯酰絲氨酸高親和力特異結合,在藍色光的激發下,發出綠色熒光,從而區分出凋亡細胞和正常細胞;碘化丙啶(pi)是一種核酸染料,它不能穿透完整細胞膜,但對凋亡晚期細胞和死細胞的破損細胞膜能夠穿透,并使細胞核紅染。將annexinv與pi匹配使用,可以將凋亡早期、凋亡晚期的細胞區分開來。取對數生長期的pc-3細胞,調節細胞濃度,以20000/孔的密度接種于6孔板中,培養24h,棄去原培養基,加入含有不同濃度(25、50、100μg/ml)沙棘黃酮樣品(實施例1制備)的培養基,繼續培養48h。按照annexinv/pi細胞凋亡檢測試劑盒說明書上的操作收集細胞染色后,流式細胞計檢測細胞凋亡情況。結果如圖4所示,其中圖4a為不加藥的對照組,圖4b為加入了50μg/ml沙棘黃酮的實驗組。左下象限代表正常細胞,左上象限代表機械損傷細胞,右下象限代表早期凋亡細胞,右上象限代表晚期凋亡細胞或壞死細胞。統計結果如圖5所示,處理48h后,與正常對照組比較,各實驗組中細胞早期凋亡率雖然沒有明顯變化,但晚期凋亡(壞死)率和總凋亡率都顯著升高(p<0.01),且呈一定的劑量依賴性,說明實施例1制備的沙棘黃酮具有誘導pc-3細胞凋亡的作用。實施例9細胞周期是指連續分裂細胞從一次有絲分裂結束到下一次有絲分裂結束所經歷的整個過程,包括g0/g1期、s期、g2/m期。熒光染料碘化丙啶pi可以與細胞內dna結合,細胞各個時期其dna含量不同從而導致結合的熒光染料不同,流式細胞儀可以根據熒光強度的不同來檢測dna含量,從而判斷細胞周期分布。取對數生長期的pc-3細胞,調節細胞濃度,以20000/孔的密度接種于6孔板中,培養24h,棄去原培養基,加入含有不同濃度(25、50、100μg/ml)沙棘黃酮樣品(實施例1制備)的培養基,繼續培養48h。按照dna含量(細胞周期)檢測試劑盒說明書上的操作收集細胞染色后,流式細胞計檢測細胞周期情況。結果如圖6所示,其中圖6a為不加藥的對照組,圖6b為加入了50μg/ml沙棘黃酮的實驗組,各個峰代表不同的細胞周期階段。統計結果如圖7所示,沙棘黃酮樣品作用pc-3細胞48h后,與正常對照組比較,樣品組中細胞g2/m期比例顯著升高(p<0.01),且呈一定劑量依賴性。因此樣品主要通過將細胞周期阻滯在g2/m期,延緩細胞完成有絲分裂過程,并進一步延遲進入下一個細胞周期的時間,影響物質合成和dna復制,從而抑制pc-3細胞增殖。影響dna合成并延緩細胞周期的進行,從而抑制pc-3細胞增殖。對比例1沙棘黃酮未水解樣的制備,沙棘黃酮的制備工藝:取干燥沙棘果,加入10倍體積70%乙醇溶液,55℃超聲輔助提取1h,重復3次,過濾,合并濾液,濃縮,經冷凍干燥后得到沙棘果粗提物粉末;取上述沙棘果粗提物粉末,加水復溶,取上清液過ab-8大孔樹脂。其中,上樣速率為0.2bv/h,吸附一晚。依次用10%、30%、50%乙醇梯度洗脫,洗脫流速為40ml/min,共洗脫1.5bv,保留50%乙醇洗脫組分,濃縮,冷凍干燥,得到沙棘黃酮未水解樣品。其中測得槲皮素苷元含量0.1%,異鼠李素苷元含量0.08%。mtt法檢測細胞活力的方法同實施例5。沙棘黃酮未水解樣品對pc-3細胞活力的影響見圖8,相比于對照組,250μg/ml的沙棘樣品仍能促進pc-3細胞的生長,不存在抑制細胞增殖作用,由此分析可知,本發明中的沙棘黃酮必須經過水解才能發揮抑制前列腺增殖的作用。當前第1頁12
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1