一種多汁乳菇多糖的干酪乳桿菌發酵乳及其制備方法與流程
本發明屬于乳酸菌和乳品加工的技術領域,具體涉及一種可提高人體免疫力的多糖發酵乳及其制備方法。
背景技術:
研究已經證實,真菌多糖作具有調節免疫、降血脂、抗衰老和抗腫瘤等多種生理功能,深受人們的重視,極具開發價值。發酵乳因具有極佳的口感和營養成分,被認為是添加功能性成分、實現產品功能的最佳載體之一。乳酸菌在人體內有極其重要的生理功能,其數量的多少,影響著人體健康乃至人的壽命。而乳酸菌在人體中所發揮重要生理功能則主要通過其所產生的有機酸、細菌素、細菌表面成分和特殊酶系這4類物質來實現的。乳酸菌的生理功能主要包括:(1)賦予食品良好的風味,提高食品營養價值;(2)促進胃液的分泌,促進胃腸的蠕動,防治消化不良和習慣性便秘;(3)能夠抵御外來細菌的入侵,抑制病原性細菌的生長繁殖,維持腸道菌群的平衡;(4)增強機體免疫力,抑制腫瘤的生長和轉移;(5)降低血清中膽固醇的含量,預防心血管疾病的發生。發酵乳因含有活的益生菌或乳酸菌和活性成分,在改善人體健康有重要作用,近年來受到極大關注。據文獻報道,真菌多糖能應用于發酵乳,例如將金針菇多糖、黑木耳多糖、姬松茸多糖、香菇多糖和云芝多糖應用于發酵乳中,結果表明,真菌多糖具有促進乳酸菌的生長、提高發酵產生乳酸的速度、減少發酵周期,還可以增加乳酸菌的活菌數量。
多汁乳菇(lactariusvolemusfr.),俗名紅奶漿菌、牛奶菇、奶汁菇,是可食用的野生真菌,但對其中的活性多糖的提取、活性成分的評價及其多糖在發酵乳中的應用,未曾有報道。
技術實現要素:
本發明針對多汁乳菇多糖免疫活性不明及其在發酵乳中應用的現狀,提供一種可提高免疫力的多汁乳菇多糖干酪乳桿菌發酵乳及其制備方法。
本發明采用了如下技術方案:
通過對上述發酵乳添加劑、質構不穩定等問題進行了深入研究,結果發現在發酵乳的制備工序中添加多汁乳菇多糖,使其作為益生元因子在發酵過程中發生作用,與不添加多汁乳菇多糖時相比,可在不影響發酵乳固有風味的前提下顯著增強發酵乳中的活菌總數及質構的穩定性。因此,本發明在優化配方的基礎上同時改進工藝:添加多汁乳菇多糖進行發酵,促進發酵劑的生長繁殖,延長保存發酵乳的保存期,制備風味獨特、質地細膩、口感順滑的發酵乳產品,減少了乳清析出。
一種多汁乳菇多糖的干酪乳桿菌發酵乳的制備方法,將發酵用奶液與多汁乳菇多糖和干酪乳桿菌發酵劑,混合均勻后發酵,發酵后制成含多汁乳菇多糖的發酵乳;所述發酵用奶液還經均質和消毒預處理,或者發酵用奶液與多汁乳菇多糖混合后再經均質和消毒預處理。
所述多汁乳菇多糖的制備方法為:先將多汁乳菇原料進行預處理得到多汁乳菇細粉,經脫脂后,再用水進行多糖提取;之后經脫蛋白質處理;用95%乙醇沉淀多糖,所得濃縮液用75%乙醇洗滌多糖并真空冷凍干燥,制得多汁乳菇多糖。
所述多汁乳菇多糖的制備包含如下步驟:
(1)原材料預處理:洗滌多汁乳菇,將其烘干去柄,用子實體部分磨粉,然后過150目~200目篩網,得到多汁乳菇細粉;
(2)脫脂:向多汁乳菇細粉中加入無水乙醇及石油醚,在85℃~95℃回流3h~4h,抽濾得到濾渣;
(3)用水進行多糖提取:向濾渣中加入蒸餾水,浸泡1h~2h后,100w超聲波處理10min~20min,于90℃~95℃的水浴條件下浸提3h~5h;用150目~200目濾袋過濾,收集浸提液用旋轉蒸發儀進行濃縮,得到15倍~25倍濃縮的多汁乳菇多糖濃縮液;
(4)脫蛋白質處理:將多汁乳菇多糖濃縮液與1/3~1/5倍體積的sevag試劑混合,靜置20min~40min后分層,再低溫離心得上層浸提液,用蒸餾水稀釋再用旋轉蒸發儀去除有機溶劑,得到脫蛋白的多汁乳菇多糖濃縮液i;
(5)用95%乙醇沉淀多糖:在多汁乳菇多糖濃縮液i中,加入2倍~4倍體積預冷95%乙醇,于1℃~4℃下放置10h~20h,再進行低溫離心得到絮狀沉淀,為多汁乳菇多糖濃縮液ii;
(6)用75%乙醇洗滌多糖:用75%乙醇將多汁乳菇多糖濃縮液ii進行3次洗滌后,重新溶解于水用低溫離心去除不溶物,上清液預凍后進行真空冷凍干燥,得到多汁乳菇多糖粉。
所述多汁乳菇多糖的含量為0.05%~0.15%,優選0.05%~0.10%。
所述發酵溫度為35℃~43℃。
加入的多汁乳菇多糖先配制成溶液,并經過膜處理。
所述發酵用奶液組成為:
全脂乳粉的復原奶與蔗糖、穩定劑按比例配制而成;
或脫脂奶粉和稀奶油的復原奶與蔗糖、穩定劑按比例配制而成;
或鮮奶與蔗糖、穩定劑按比例配制而成。
制備干酪乳桿菌發酵劑包含如下步驟:
(1)采用mrs液體培養基進行干酪乳桿菌凍干菌粉活化培養2~3次,得活化菌液;
(2)將活化菌液接種于活化用奶液中活化處理,得到干酪乳桿菌發酵劑。
所述活化用奶液為10.0%~12.5%的全脂乳粉、7.5%~8.5%蔗糖混合后,經均質和消毒而成。
本發明與現有的技術相比,具有如下的優點:
(1)本發明采用的多汁乳菇多糖,為純天然物質,具有良好的免疫活性,在發酵乳中性質穩定,能耐受巴氏消毒強度,不會影響發酵乳的保質期和口感。
(2)相比于未添加多糖的發酵乳,本發明的多糖發酵乳具有很好的流變學特性、持水力、酸甜適中、含有較豐富的必需氨基酸和游離氨基酸等,乳酸菌活菌數高達1010cfu/ml;香氣成分較濃郁,口感較好,色澤、口感等感官性質均符合發酵乳國家標準gb19302-2010中的各項指標。
(3)本發明的發酵乳的原料豐富,可以是全脂乳粉的復原奶與蔗糖、穩定劑等發酵乳原料按比例配制而成,也可以是脫脂奶粉和稀奶油的復原奶與蔗糖、穩定劑等發酵乳原料按比例配制而成,還可以是鮮奶與蔗糖、穩定劑等發酵乳原料按比例配制而成。
(4)生產工藝簡單和容易控制,口感細膩,香氣濃郁,乳酸菌的活菌數高,質構較好,粘稠度適宜,持水力較好,無乳清析出。
附圖說明
圖1中a、b、c、d分別為正常組(ck)、cp損傷組(cp-)、cp損傷陽性組(cp+)和多糖中劑量組(mp)小鼠在注射墨汁后的肝臟病理切片圖。
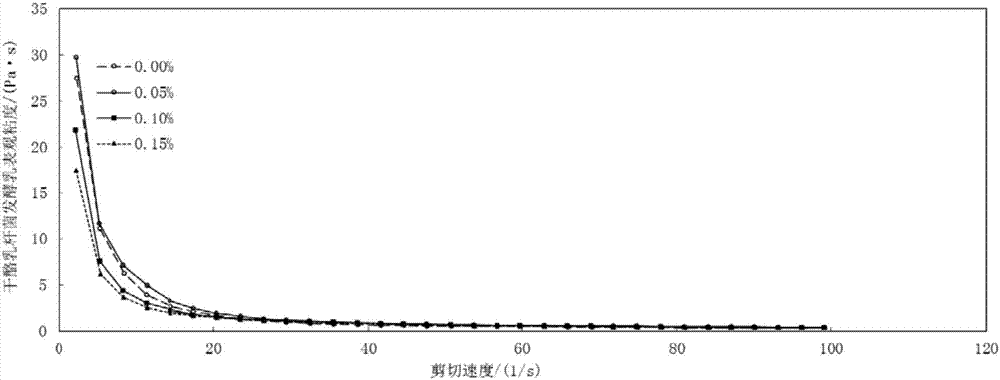
圖2是多汁乳菇多糖干酪乳桿菌發酵乳剪切掃描流變學特性曲線,圖2a為表觀粘度隨剪切速率的變化,圖2b為剪切應力歲剪切速率的變化。
圖3是多汁乳菇多糖干酪乳桿菌發酵乳頻率掃描流變學特性曲線,其中g′為彈性模量,g〞為粘性模量。
具體實施方式
下面結合實施例對本發明作進一步詳細說明,但是本發明要求保護的范圍并不局限于此。
實施例1
多汁乳菇多糖的提取
洗滌多汁乳菇,將其烘干去柄,用子實體部分磨粉,然后過200目篩網,得到多汁乳菇細粉,在90℃回流3.5h進行脫脂后,按料液比1:30浸泡1.5h后,用100w超聲波處理15min,于95℃水浴浸提4h,用200目濾袋過濾,收集浸提液,于55℃旋轉蒸發儀中濃縮至20倍,再加入1/5倍體積的sevag試劑(正丁醇:氯仿的體積比為1:4)脫蛋白質,在低溫下用5000r/min離心5min后得到上層浸提液,用適量的蒸餾水稀釋,再用旋轉蒸發儀去除有機試劑,于多汁乳菇多糖濃縮液i中加入3倍體積的95%乙醇,于4℃放置20h后用5000r/min離心5min得多汁乳菇多糖濃縮液ii,再用75%乙醇洗滌多汁乳菇多糖濃縮液ii數3次,重新溶解于水后在低溫下用5000r/min離心5min去除不溶物,再將上清液其預凍后進行真空冷凍干燥,得多汁乳菇多糖粉iii,置于密封袋中4℃保存,多糖得率為2.18%(以干重計)。
實施例2
在體內多汁乳菇多糖提高免疫力作用評價
(1)小鼠分組:7~8周齡spf級近交系balb/c小鼠72只,體重18~22g,根據小鼠的體重隨機分為6組,詳細分組信息如表1。并經過spss17.0軟件進行顯著性差異分析,顯示組別之間無顯著性差異。所有小鼠由專業人員飼養,4只/籠。在溫度22~24℃、濕度50%~60%的條件下,每天光照12h,黑暗12h。實驗期間,小鼠自由飲水和進食,每天上午9:00對各實驗組小鼠進行灌胃,灌胃量均為200ml/(kg·bw·d),cp-和cp+組是提前7天在小鼠的腹腔注射免疫系統損傷藥物環磷酰胺(簡稱cp),每天注射30mg/(kg·bw)的cp,連續注射7天,第25天再注射80mg/(kg·bw)的cp。
表1小鼠分組信息表
(2)各種免疫指標測定
①遲發型變態反應測定:在飼喂25個日齡后,每只小鼠腹腔注射0.2ml的2%的srbc綿羊紅細胞,免疫5天后,小鼠稱重并測量左后足跖部厚度(h0),于測量部位注射20μl的20%的srbc綿羊紅細胞,24h后測定同一部位的左后足跖部厚度(h),注射前后足跖部厚度之差表示為dth=h-h0,單位為mm。
②碳廓清指數測定:第30日測量結束,尾部靜脈注射33%的印度墨汁,注射量為0.1ml/(kg·bw),分別于注射完2min、10min后,從內眥靜脈取血20μl,并立即加于盛有2ml0.1%na2co3的ep管中,測定od600nm并計算相應的吞噬速率k=(lgod1-lgod2)/(t2-t1)和吞噬指數a=(體重×k1/3)/(肝重+脾重),碳廓清指數即是吞噬指數a。
③臟器系數測定:在實驗終止時,將全部小鼠禁食一夜,摘除眼珠取小鼠全血,然后頸部脫臼處死小鼠,分離肝臟、脾臟、胸腺,用生理鹽水洗滌臟器表面血污并用濾紙吸干稱重,臟器系數包括肝臟系數、脾臟系數和胸腺系數,計算公式為:臟器系數=臟器質量(mg)/體重(g)。對于碳廓清受試小鼠的臟器而言,6個組別的顏色均呈暗紅色,未代謝完印度墨汁,肉眼可觀察到cp-比劑量組的色澤狀態更暗沉,代謝情況要差于lp、mp和hp等3個多糖劑量組和ck組,可判定多汁乳菇多糖液具備一定的免疫功效性。經計算,得到各組小鼠臟器系數結果如表2所示。lp、mp和hp等3個多糖劑量組與ck比較,小鼠的體重和肝臟系數、脾臟系數和胸腺系數等3項免疫器官系數有明顯升高,具有統計學意義(p<0.05),而cp-與ck比較,小鼠的體重和3項免疫器官系數有明顯下降,這驗證了小鼠免疫損傷模型已經建立,cp+與cp-比較,小鼠的免疫力略有恢復,說明多汁乳菇粗多糖有免疫提高作用。
表2第4周(d28)各組小鼠的體重(g)及免疫臟器系數(m±sd,n=12)
注:臟器系數=臟器重量/體重,單位為mg/g。不同符號(a~d)表示同一列數據之間具有顯著性差異(p<0.05);顯著性差異采用spss17.0中的dunan’s分析法。
如表3所示,第4周時,對小鼠進行足跖部過敏腫脹(dth)和碳廓清試驗,lp、mp和hp等3個多糖劑量組與ck比較,小鼠的足跖部過敏腫脹癥狀更為明顯,同時,其巨噬細胞清除碳粒的能力(吞噬指數a)也更強,且具有統計學意義(p<0.05),而cp-與ck比較,小鼠的足跖腫脹程度及巨噬細胞功能遠不如ck組,這驗證了小鼠免疫損傷模型的建立;cp-與cp+比較,小鼠的免疫力略有恢復,說明多汁乳菇粗多糖有免疫提高作用。
表3第4周(d28)各組小鼠dth及碳廓清指數檢測結果(m±sd,n=12)
注:足跖部過敏腫脹程度用dth表示,單位為mm;碳廓清指數指吞噬指數a。注:不同字母(a~f)表示同一列數據之間具有顯著性差異(p<0.05);顯著性差異采用spss17.0中的dunan’s分析法。
④全血分析:將小鼠全血立即送檢中山大學東校區實驗動物中心進行十八項全血自動分析,重點分析其中的淋巴細胞及白細胞數量,小鼠全血中淋巴細胞數量及白細胞數量如表4所示,lp、mp和hp等3個多糖劑量組的淋巴細胞占比明顯高于其他組,與正常組水平相當,且lp的白細胞數量和淋巴細胞數量均顯著高于其他組(p<0.05)。而cp-與正常組比較,小鼠的白細胞數量和淋巴細胞數量都有所下降,這也驗證了小鼠免疫損傷模型的建立;另外,cp+與cp-相比較,小鼠的免疫指標略有恢復,介于cp-和ck之間,表明多汁乳菇多糖顯示出免疫提高作用。cp+的白細胞數量和淋巴細胞數量也都顯著高于cp-,這表明當小鼠受到抗原的襲擊時,多糖可以明顯增強小鼠細胞免疫功能且低劑量的促進效果最顯著。
表4第4周(d28)各組小鼠全血檢測結果(m±sd,n=12)
注:不同字母(a~e)表示同一列數據之間具有顯著性差異(p<0.05);顯著性差異采用spss17.0中的dunan’s分析法。wbc表示白細胞數量,單位為109個/l;lym表示淋巴細胞數量,單位為109個/l;lym%表示淋巴細胞占全血細胞的百分比。
⑤臟器病理切片分析:將經過聚甲醛初步固定處理的小鼠臟器立即送檢中山大學東校區實驗動物中心進行蘇木精-伊紅染色,顯微鏡下觀察注射墨汁的各組小鼠的肝臟正常組織形態及病變組織結構形態,病理切片結果如附圖1所示,其中圖1a為正常組(ck)的肝竇周邊可見5~10%的吞噬色素并參與免疫調節的枯否細胞,10~20%的由炎癥引起的可表征肝細胞損傷程度的肝細胞核空泡化;cp損傷組(cp-)的肝竇周邊可見10~20%吞噬色素的枯否細胞及10~20%的肝細胞核空泡化(圖1b);cp+的肝竇周邊可見10~20%的吞噬色素的枯否細胞,10~20%的肝細胞核空泡化及5~10%的肝細胞漿空泡化(圖1c);中劑量多糖組(mp)的肝竇周邊可見20~30%的吞噬色素的枯否細胞,10~20%的肝細胞核空泡化,1~5%的肝細胞漿空泡化(圖1d)。mp的枯否細胞數目明顯高于其他組,肝細胞漿空泡化程度最低,且cp+的肝細胞空泡化程度也低于cp-,說明多汁乳菇多糖有利于肝巨噬細胞的激活,參與碳粒異物的清除反應且對肝細胞損傷具有一定的修復作用。
對肝臟切片中的未清除碳粒采用imageplus-pro軟件進行面積積分處理,得如表5所示結果,顯然,cp-未清除碳粒比例0.60%稍大于cp+的0.50%,mp則小于cp+和ck。進一步說明了多糖可以增強小鼠的肝巨噬細胞功能。
表5各組小鼠肝臟碳粒分布積分結果
注:不同字母(a~d)表示同一列數據之間具有顯著性差異(p<0.05);顯著性差異采用spss17.0中的dunan’s分析法
實施例3
多汁乳菇多糖在發酵乳中的應用
第一步發酵劑制備:用1ml無菌水重懸干酪乳桿菌(編號cicc6013,lactobacilluscaseisubsp.rhamnosus6013,中國工業微生物菌種保藏管理中心保藏,地址:北京市朝陽區霄云路32號,郵編:100027,電話:010-64666552,傳真:010-64616613,電子郵箱:sales@china-cicc.org,由吳煥章分離)凍干粉,然后全部轉接至mrs液體培養基中,于37℃下培養16h,再以5%~10%接種量轉接至新鮮的mrs液體培養基中活化3次,于4000r/min低溫離心收集菌體,并將其全部轉接至活化用奶液在37℃下活化培養2~3次,即得干酪乳桿菌發酵劑;所述活化用奶液為12.5%的全脂乳粉、8.5%蔗糖混合后,經消毒而成。
第二步發酵用奶液制備及與多糖混合:將12.5%的全脂乳粉、8.5%的蔗糖、0.1%的穩定劑粉,按質量體積比加入0.00%、0.05%、0.10%、0.15%的多汁乳菇多糖粉混合均勻后,預熱至60℃在18mpa下均質,并于95℃消毒5min后降溫至43℃,備用;
第三步接種和發酵:按體積比10%的干酪乳桿菌發酵劑加入發酵用奶液中,于43℃進行發酵,當滴定酸度達到75°t后終止發酵,得到多汁乳菇多糖發酵乳。
第四步多汁乳菇多糖發酵乳各項指標評價
(1)感官質量評價按照發酵乳國家標準gb19302-2010的要求進行,具體評定項目如表6所示,總分為100分,其中風味指標和口感指標各占30分,外觀指標滿分為15分,質地指標滿分為25分。每項指標按照可接受程度分三個評分段:不太接受、一般接受、喜歡接受,分值分布如表6。評分結果如表7,從風味、口感、外觀和質地看,多糖含量0.10%的發酵乳比較好,0.15%的發酵乳顏色有點深,完全偏離了發酵乳原有的顏色。多糖含量0.05%的發酵乳也可以接受。
表6發酵乳感官評價指標
表7多汁乳菇多糖添加量對發酵乳感官的影響
注:不同字母(a~c)表示同一列數據之間具有顯著性差異(p<0.05);顯著性差異采用spss17.0中的dunan’s分析法。
(2)多汁乳菇多糖發酵乳理化指標評價測定發酵結束后發酵乳的ph、持水力、游離氨基酸、乳酸菌活菌數、流變學性質
ph不同多糖含量對發酵乳的ph的影響如表8,可看出,隨著多糖濃度的增加,發酵乳的ph先下降后有所回升,這表明添加一定量的多糖可以促進干酪乳桿菌的產酸能力,但超過一定范圍,可能對乳酸菌的生長有一定的抑制作用,從而導致發酵乳的ph有所回升。
持水力稱量15ml的ep管的質量記為w0,分別再稱量每種酸奶樣品10g于ep管中,5000r/min離心5min,棄乳清后倒置ep管10min后,稱量總質量記為w。平行測3次取平均值,持水力=(w-w0)/10×100%。不同多糖含量對發酵乳持水力的影響如表8,從中可以看出,添加多糖不會影響發酵乳的持水力,均約在99.0%左右。
表8多糖含量對干酪乳桿菌發酵乳的ph、持水力、活菌數的影響
乳酸菌活菌數取出上述制備的發酵乳樣品1ml與9ml滅菌的生理鹽水混合,即此時稀釋倍數為101,再依次取前一個稀釋樣品1ml與9ml滅菌的生理鹽水混合,即得到稀釋倍數為102的樣品,依此類推,稀釋至1010倍,取稀釋后的發酵乳1ml于平皿中,然后傾入mrs固體培養基覆蓋于菌液表面,置于37℃恒溫培養24h后進行菌落計數。多糖含量對發酵乳的干酪乳桿菌的影響如表8,隨多糖含量增加,乳酸菌的活菌數在增加,再次證實多汁乳菇多糖可以促進干酪乳桿菌的生長繁殖,多糖含量為0.10%時,活菌數最大為2.01×1010cfu/ml,4種配方的發酵乳都滿足發酵乳國家標準gb19302-2010的要求。
游離氨基酸稱取10g的酸奶與5ml的蒸餾水混合,充分攪拌后,于4500r/min冷凍離心5min,取上清4ml與1ml的15%的磺基水楊酸溶液混合,于4℃放置6h以上,然后于10000r/min離心15min,取上清,重復離心一次,通過凱氏定氮法確定樣品含氮量后,再將樣品稀釋至含氮量在0.6~1.0%之間。用0.22μm過濾膜過濾后裝進樣品瓶中,使用c18的柱子,四元泵,紫外檢測,opa自動衍生裝置,自動進樣分析。多糖含量對干酪乳桿菌發酵乳中游離氨基酸的影響如表9,當多糖含量為0.05%時,必需氨基酸的凈含量比對照組(不加多糖)增加了1809.46nmol/l,每一種必需氨基酸的含量均有大幅度的增加;與對照組相比,總游離氨基酸含量也在增加,3781.93nmol/l,遠遠超過了對照組總游離氨基酸的含量。但多糖添加量為0.10%和0.15%的發酵乳與對照組相比,總的游離氨基酸含量有所降低,可能與多糖的抗菌活性有關,當多糖濃度超出一定范圍時,將不再促進干酪乳桿菌的生長繁殖。再次表明,一定濃度的多汁乳菇多糖才能促進干酪乳桿菌的生長繁殖,從而更多地產生了必需氨基酸和游離氨基酸,提高了發酵乳生物效價。
表9多糖對干酪乳桿菌發酵乳中17種游離氨基酸的影響(m±sd)(nmol/l)
流變學性質取發酵乳5ml于哈克流變儀的載物臺,選擇適宜的程序對樣品的抗形變能力及黏度等參數進行測定,每做完一組程序,打開探頭,小心處理掉探頭及載物臺上的樣品,更換試樣,保存所有的測定數據,應用origin8.5對其進行分析處理。多糖含量對干酪乳桿菌發酵乳的流變學性質影響如圖2和圖3。可知,隨著剪切速率的增大,表觀粘度(圖2a)和剪切應力均呈現減小的趨勢,且各組發酵乳的表觀粘度區別不大。當剪切速率控制在20s-1以上三時,添加多糖可提高發酵乳的剪切應力(圖2b),當多糖含量為0.15%時,其表觀粘度和剪切應力均最高且變化較為緩慢,多糖可增加乳酸菌的活力,改善發酵乳的質構。圖3為干酪乳桿菌發酵乳經頻率掃描后的測定結果,g′、g″分別表示彈性模量和粘性模量,可分別表征發酵乳抗形變能力和黏度。從圖3可以看出,多糖添加量為0.10%干酪乳桿菌發酵乳抗形變能力最好,黏度最大,交聯情況最佳,這可能與多糖促進乳酸菌產生大量的胞外多糖所致,從而改善了發酵乳的交聯結構。綜合上述,在干酪乳桿菌發酵乳中,多糖乳菇多糖的添加量推薦為0.05%~0.10%。
實施例4
多汁乳菇多糖提取和在發酵乳中的應用
第一步洗滌多汁乳菇,將其烘干去柄,用子實體部分磨粉,然后過150目篩網,得到多汁乳菇細粉,在85℃回流4h進行脫脂后,按料液比1:30浸泡2h后,用100w超聲波處理10min,于90℃水浴浸提5h,用150目濾袋過濾,收集浸提液,于55℃旋轉蒸發儀中濃縮至15倍,再加入1/3倍體積的sevag試劑(正丁醇:氯仿的體積比為1:4)脫蛋白質,在低溫下用5000r/min離心5min后得到上層浸提液,用適量的蒸餾水稀釋,再用旋轉蒸發儀去除有機試劑,于多汁乳菇多糖濃縮液i中加入2倍體積的95%乙醇,于4℃放置18h后用5000r/min離心5min得多汁乳菇多糖濃縮液ii,再用75%乙醇洗滌多汁乳菇多糖濃縮液ii數2~3次,重新溶解于水后在低溫下用5000r/min離心5min去除不溶物,再將上清液其預凍后進行真空冷凍干燥,得多汁乳菇多糖粉iii,置于密封袋中4℃保存,多糖得率為2.01%(以干重計)。
第二步發酵劑制備及與多糖混合:用1ml無菌水重懸干酪乳桿菌凍干粉,然后全部轉接至mrs液體培養基中,于37℃下培養16h~20h,再以5%~10%接種量轉接至新鮮的mrs液體培養基中活化3次,于4000r/min低溫離心收集菌體,并將其全部轉接至發酵用奶液在35℃下活化培養2~3次,即得干酪乳桿菌發酵劑;所述活化用奶液為12.5%的全脂乳粉、8.5%蔗糖混合后,經消毒而成。
第三步發酵用奶液制備:將鮮奶、8.5%的蔗糖、0.1%的穩定劑粉,按質量體積比加入0.05%多汁乳菇多糖粉iii混合均勻后,預熱至60℃在18mpa下均質,并于95℃消毒5min后降溫至35℃,備用;
第四步接種和發酵:按體積比5%的干酪乳桿菌發酵劑加入發酵用奶液中,于35℃進行發酵,當滴定酸度達到75°后終止發酵,得到多汁乳菇多糖發酵乳,發酵終點的ph、持水力和活菌數分別為4.33、99.60%和1.06×1010cfu/ml,口感質量符合要求。若將經過上述步驟得到的凝固型發酵乳,經過蠕動泵破乳,即為攪拌型發酵乳。
實施例5
多汁乳菇多糖提取和在發酵乳中的應用
第一步洗滌多汁乳菇,將其烘干去柄,用子實體部分磨粉,然后過150目篩網,得到多汁乳菇細粉,在95℃回流3h進行脫脂后,按料液比1:30浸泡1h后,用100w超聲波處理20min,于93℃水浴浸提3.5h,用200目濾袋過濾,收集浸提液,于55℃旋轉蒸發儀中濃縮至25倍,再加入1/4倍體積的sevag試劑(正丁醇:氯仿的體積比為1:4)脫蛋白質,在低溫下用5000r/min離心5min后得到上層浸提液,用適量的蒸餾水稀釋,再用旋轉蒸發儀去除有機試劑,于多汁乳菇多糖濃縮液i中加入4倍體積的95%乙醇,于3℃放置15h后用5000r/min離心5min得多汁乳菇多糖濃縮液ii,再用75%乙醇洗滌多汁乳菇多糖濃縮液ii數2~3次,重新溶解于水后在低溫下用5000r/min離心5min去除不溶物,再將上清液其預凍后進行真空冷凍干燥,得多汁乳菇多糖粉iii,置于密封袋中4℃保存,多糖得率為2.15%(以干重計)。
第二步發酵劑制備:用1ml無菌水重懸干酪乳桿菌凍干粉,然后全部轉接至mrs液體培養基中,于37℃下培養16h~20h,再以5%~10%接種量轉接至新鮮的mrs液體培養基中活化3次,于4000r/min低溫離心收集菌體,并將其全部轉接至發酵用奶液在35℃下活化培養2~3次,即得干酪乳桿菌發酵劑;所述活化用奶液為10.0%的全脂乳粉、7.5%蔗糖混合后,經消毒而成。
第三步發酵用奶液制備及與多糖混合:將鮮奶、8.5%蔗糖、0.1%穩定劑粉,按質量體積比加入0.05%多汁乳菇多糖粉iii混合均勻后,預熱至60℃在18mpa下均質,并于95℃消毒5min后降溫至37℃,備用;
第四步接種和發酵:按體積比5%的干酪乳桿菌發酵劑加入發酵用奶液中,于37℃進行發酵,當滴定酸度達到75°后終止發酵,得到多汁乳菇多糖發酵乳,發酵終點的ph、持水力和活菌數分別為4.35、99.50%和1.25×1010cfu/ml,口感質量符合要求。若將經過上述步驟得到的凝固型發酵乳,經過蠕動泵破乳,即為攪拌型發酵乳。
實施例6
多汁乳菇多糖提取和在發酵乳中的應用
第一步洗滌多汁乳菇,將其烘干去柄,用子實體部分磨粉,然后過180目篩網,得到多汁乳菇細粉,在90℃回流3.5h進行脫脂后,按料液比1:30浸泡2h后,用100w超聲波處理18min,于95℃水浴浸提3h,用200目濾袋過濾,收集浸提液,于55℃旋轉蒸發儀中濃縮至20倍,再加入1/3倍體積的sevag試劑(正丁醇:氯仿的體積比為1:4)脫蛋白質,在低溫下用5000r/min離心5min后得到上層浸提液,用適量的蒸餾水稀釋,再用旋轉蒸發儀去除有機試劑,于多汁乳菇多糖濃縮液i中加入3.5倍體積的95%乙醇,于4℃放置15h后用5000r/min離心5min得多汁乳菇多糖濃縮液ii,再用75%乙醇洗滌多汁乳菇多糖濃縮液ii數2~3次,重新溶解于水后在低溫下用5000r/min離心5min去除不溶物,再將上清液其預凍后進行真空冷凍干燥,得多汁乳菇多糖粉iii,置于密封袋中4℃保存,多糖得率為2.05%(以干重計)。
第二步發酵劑制備:用1ml無菌水重懸干酪乳桿菌凍干粉,然后全部轉接至mrs液體培養基中,于37℃下培養16h~20h,再以5%~10%接種量轉接至新鮮的mrs液體培養基中活化3次,于4000r/min低溫離心收集菌體,并將其全部轉接至發酵用奶液在41℃下活化培養2~3次,即得干酪乳桿菌發酵劑;所述活化用奶液為11.0%的全脂乳粉、8.0%蔗糖混合后,經消毒而成。
第三步發酵用奶液制備及與多糖混合:將8.5%脫脂奶粉、3.0%稀奶油、7.5%的蔗糖、0.1%的穩定劑粉,按質量體積比加入0.10%多汁乳菇多糖粉iii混合均勻后,預熱至60℃在18mpa下均質,并于95℃消毒5min后降溫至41℃,備用;
第四步接種和發酵:按體積比5%的干酪乳桿菌發酵劑加入發酵用奶液中,于41℃進行發酵,當滴定酸度達到75°后終止發酵,得到多汁乳菇多糖發酵乳,發酵終點的ph、持水力和活菌數分別為4.30、99.40%和3.20×1010cfu/ml,口感質量符合要求。若將經過上述步驟得到的凝固型發酵乳,經過蠕動泵破乳,即為攪拌型發酵乳。
- 還沒有人留言評論。精彩留言會獲得點贊!