一種可降解含鎂和鍶的硫磷灰石多孔復合生物支架的制作方法
本發明涉及醫用材料領域,特別涉及一種可降解含鎂和鍶的硫磷灰石多孔復合生物支架。
背景技術:
骨移植是僅少于輸血的組織移植,骨替代材料的研究、開發是目前醫學研究的重點之一,中國十二五國家攻關項目中就有關于骨替代材料與機體作用機理的研究。
構成人骨骨礦有Ca、P、O、H、C、S、Fe、Mg、Cu、Si、Zn、Mn、Na、K等元素,在人骨礦化過程中存在廣泛的同質替換行為,人骨具有復雜的組成及結構。在骨組織工程支架或人工骨的設計過程中,關鍵要考慮人骨這種嚴重礦化組織的復雜組成及結構;人骨不能被單一材料所提供的有限特性所完全替代,更為重要的是,支架還必須為骨組織的再生提供三維多孔微結構以引導細胞的分化增殖,而且要能維持或較快取得足夠的力學強度來滿足被替代材料的力學要求。理想的骨移植替代材料或骨組織工程支架材料應具有以下條件:1)具有良好的骨傳導性,材料具有孔徑理想的三維互通網孔結構,盡可能高的孔隙率及比表面積2)具有骨誘導性;3)具有良好的生物相容性以及支持骨細胞生長和功能分化的表面化學性質與微結構;4)具有良好的生物降解性;5)材料中承擔骨傳導作用的部分必須有足夠的力學強度及承載能力;6)易加工等。
Johan等2010年在一篇綜述中把新西蘭臨床可得到的骨移植替代材料歸納為四類:1、單相鈣磷材料包括羥基磷灰石轉化生物陶瓷三種、合成羥基磷灰石水泥一種,β-磷酸三鈣人工陶瓷兩種;2、復合材料包括磷酸四鈣/磷酸氫鈣、62.5%α-磷酸三鈣/26.8%無水磷酸氫鈣/8.9%碳酸鈣/1.8%羥基磷灰石、60%羥基磷灰石/40%b-磷酸三鈣、73%b-磷酸三鈣/21%磷酸二氫鈣/5%磷酸氫鎂、磷酸四鈣/磷酸氫鈣/無定形磷酸鈣、α-磷酸三鈣/碳酸鈣/磷酸二氫鈣等配方的合成水泥6種,配方為80%磷酸三鈣/20%磷酸氫鈣的人工陶瓷一種;3、單相硫酸鈣制備的泥膏或顆粒共四種;4、含硅生物玻璃一種。磷灰石、硫酸鈣是目前臨床上最為常見的骨移植替代材料或構成成分。目前臨床缺少理想的骨移植替代材料,主要表現在理想三維互通網孔結構、極大的孔隙率及比表面積、可降解性、骨傳導性、骨誘導性及力學強度等特性多不能兼而有之。
臨床已經應用的具有較為理想三維互通網孔微結構的人工骨均為動物材料轉化而來:其中兩個來源于牛松質骨經過高溫燒結工序制備的多孔羥基磷灰石陶瓷骨,特點是保留了牛松質骨自然骨礦的三維互通網孔微結構且成分接近人骨骨礦成分,具有良好的生物相容性、良好的骨傳導性及較好抗壓縮強度,因高溫燒結程序而免卻異種骨免疫排斥反應及病原體導入之可能,且易于加工。來自牛骨的多孔羥基磷灰石具有60-90%的良好孔隙率且牛骨資源豐富,其孔徑為390-1360μm,稍大于150-400μm的骨移植替代材料及骨組織工程支架的理想孔徑;具備1-20MPa的良好的抗壓縮強度;植入機體內有利于骨修復細胞募集、血管的進入、氧氣及組織液的交換,為骨修復細胞提供良好的生理活動空間與黏附支持;其巨大的缺點是高溫燒結牛松質骨得到的骨礦—羥基磷灰石太過穩定,在體內降解太過慢長,在鈣磷類植骨材料中溶解度最低,降解速度遠遠不能與新骨形成速度匹配,亦不能持續釋放較高濃度鈣等成骨有益離子、因此缺乏良好的成骨活性,不利于骨的修復及改造。
理想的降解速度是人工骨或骨組織工程支架的另一重要要求,理想的人工骨降解速度應該與新骨形成速度相匹配,在引導新骨形成的同時逐漸降解為新骨替代進一步提供空間,其降解過程中不斷釋放的鈣離子等成骨有益離子為骨礦的重新沉積、改造與代謝提供礦物重組成分,這一過程可能刺激新骨形成即具備某種程度潛在的骨誘導性;人工骨或骨組織工程材料降解速度過快不利于對骨修復過程提供足夠時空的支持與引導,而降解過慢則會阻礙新骨的形成、替代及塑形。無機物植骨材料在體內的降解主要通過兩個途徑:體液介導的溶降和細胞介導的降解過程。溶降過程是在體液的作用下,材料及粘結劑水解,材料逐步離解成顆粒、分子、離子的物理溶降過程。而細胞介導的降解過程主要是巨噬細胞和破骨細胞對材料的吞噬作用的生物降解過程。無機物植骨材料在體外的降解過程與其組成成分有關,其降解速度與材料的顆粒大小、孔隙率、比表面積、結晶度和溶解度亦有密切相關,其中溶解度是最重要的影響因素。在臨床上最為常見的骨移植替代材料中硫酸鈣具有最快的降解速度【硫酸鈣在體內完全降解時間為45-72d,比自體骨快兩倍多】,鈣磷材料中的羥基磷灰石具有最慢的降解速度【無孔塊狀羥基磷灰石在體內10年都不能完全降解】、有遠大于新骨形成速度,其他鈣磷成分如磷酸三鈣、磷酸氫鈣、磷酸二氫鈣、多聚磷酸氫鈣、焦磷酸鈣等的降解率處于兩者之間,具備相對適中的降解速度。為了克服煅燒牛松質骨多孔羥基磷灰石的明顯缺點,近20年來,有科學工作者試圖將煅燒牛松質骨多孔羥基磷灰石轉化為磷酸三鈣或含磷酸三鈣的復相磷灰石陶瓷。俗稱巴黎水泥的單質硫酸鈣泥膏、水泥顆粒是應用于骨缺損填充的最久遠的材料,因其1、良好的耐生物;2良好的空間充填特性;3較快的吸收速度及生物吸收完全;4、潛在的成骨活性;5良好的骨傳導作用且因為較快的吸收能為骨修復提供空間而延用至今。硫酸鈣在100毫升水中常溫下溶解0.2克左右,硫酸鈣體內降解時在局部形成高鈣環境,為新生骨組織骨礦形成提供鈣源,與體液中的磷酸根等結合從而促進新骨的礦化,其潛在的骨誘導活性與硫酸鈣溶解過程中局部高鈣、偏酸微環境有關;硫酸鈣在體內降解在局部形成的高鈣環境為新骨形成提供鈣源的同時,還不同程度促進成骨細胞形成、分化;硫酸鈣在體內降解形成局部偏酸微環境可能促進人骨骨礦微溶降,造成成骨活性蛋白顯露,而有利于新骨形成;但臨床目前應用的硫酸鈣泥膏或顆粒同樣有合成材料的共同缺點即難以具備理想三維互通網孔結構,同時硫酸鈣體內完全降解時間為45-72d,比自體骨快兩倍多,難以對新骨的形成做持續、穩定的骨傳導支持,不能為骨組織的再生提供三維多孔微結構即缺乏良好的骨傳導性的結構基礎修復細胞、血管進入移植物內,不利于立新骨的生物形成;即使成功制備成高孔隙率、高比表面積的三維互通網孔結構的硫酸鈣單質支架,其降解速度會更快,強度更差;硫酸鈣材料溶降后還可使局部微環境偏酸而有可能引起炎癥反應。合成復合材料的優點是可通過選擇不同降解特性的成分及其成分構成比例,使復合材料的降解速率、pH值等物性達到某種平衡,并且可能吸附更多種人體內活性蛋白(信號蛋白),改善材料的生物活性,更多地滿足骨移植替代材料的理想要求。
另外,磷酸鈣及其他生物基材料的生物活性因摻入生物活性離子可能被提高。已有的研究表明,這些生物活性離子能有效的刺激蛋白活性,促進細胞生長和骨生長。低劑量的鍶具有促進骨形成,抑制骨吸收的雙重作用。低劑量鍶置換磷灰石中部分鈣而獲得含鍶羥基磷灰石,不僅具有較之純羥基磷灰石更好的組織相容性、骨傳導性、甚至具有一定程度上的骨誘導性。人體約含有25g鎂,鎂在人體骨形成和所有生長過程、維護骨細胞結構與功能、骨代謝及重塑方面具有重要作用。低含鎂量的磷酸鎂鈣基骨水泥能夠顯著提高細胞的粘附能力。摻鎂磷酸鈣骨水泥因為可促進植入材料與骨組織間界面生成成為日益受到重視的新型骨修復生物材料:摻鎂骨水泥較容易配制,新西蘭等西方國家已有73%b-磷酸三鈣/21%磷酸二氫鈣/5%磷酸氫鎂配方的骨水泥在臨床上應用。復合配方含鎂的骨水泥具備降解性,可釋放鈣、磷、鎂等骨形成有益元素,移植后在機體內能進行降解、離子交換,也不具備三維互通網孔結構而阻礙修復細胞及血管早期深入移植物內部,缺乏良好的骨傳導性的三維互通網孔結構基礎。
我們現在嘗試將硫、磷、鍶、鎂摻入煅燒牛骨多孔支架,將單質的羥基磷灰石多孔支架轉變為含有良好降解特性的含鎂和鍶的硫磷灰石復合多孔生物支架。
技術實現要素:
本發明的目的在于解決現有骨移植替代材料難以兼具良好三維互通網孔結構、機械強度、可降解性及生物活性等問題,將硫、磷、鎂、鍶同時摻入具備自然骨礦復雜精妙的三維互通網孔結構的牛煅燒松質骨骨礦多孔支架中,將煅燒牛松質單質多孔羥基磷灰石轉化摻雜骨活性離子鎂和鍶的可降解含鎂和鍶的硫磷灰石多孔復合生物支架,本發明的可降解含鎂和鍶的硫磷灰石多孔復合生物支架兼具良好三維互通網孔結構與骨傳導性、可降解性、較好機械強度和生物相容性;同時網孔內有較大長徑比的晶須生長,可增加材料的比表面積,可能改善細胞粘附。因有效摻入了成骨活性離子鎂、鍶及降解時可產生局部高鈣環境的硫酸鈣,復合生物支架可能具備潛在的骨誘導性。該復合生物支架可能更多地滿足了骨移植替代材料或骨組織工程支架材料的理想的條件。
本發明解決其技術問題所采用的技術方案是:
一種可降解含鎂和鍶的硫磷灰石多孔復合生物支架,其材料組成為如下復合成分中的一種:硫酸鍶/磷酸鎂鈣/焦磷酸鈣、硫酸鍶/多聚磷酸氫鎂鈣/焦磷酸鈣、硫酸鍶/多聚磷酸氫鎂鈣/焦磷酸鈣/羥基磷灰石、硫酸鍶/多聚磷酸氫鎂鈣/焦磷酸鈣、硫酸鍶/磷酸鎂鈣/羥基磷灰石、硫酸鍶/多聚磷酸氫鎂鈣/羥基磷灰石、硫酸鍶/硫酸鈣/磷酸鎂鈣/羥基磷灰石、硫酸鍶/硫酸鈣/多聚磷酸氫鎂鈣/羥基磷灰石、硫酸鍶/硫酸鈣/磷酸鎂鈣、硫酸鍶/硫酸鈣/磷酸鎂鈣/焦磷酸鈣。
X線粉末衍射分析該復合生物支架材料為含活性離子鎂和鍶的硫磷灰石多孔復合生物支架材料如硫酸鍶/磷酸鎂鈣/焦磷酸鈣、硫酸鍶/多聚磷酸氫鎂鈣/焦磷酸鈣、硫酸鍶/多聚磷酸氫鎂鈣/焦磷酸鈣/羥基磷灰石、硫酸鍶/多聚磷酸氫鎂鈣/焦磷酸鈣、硫酸鍶/磷酸鎂鈣/羥基磷灰石、硫酸鍶/多聚磷酸氫鎂鈣/羥基磷灰石、硫酸鍶/硫酸鈣/磷酸鎂鈣/羥基磷灰石、硫酸鍶/硫酸鈣/多聚磷酸氫鎂鈣/羥基磷灰石、硫酸鍶/硫酸鈣/磷酸鎂鈣、硫酸鍶/硫酸鈣/磷酸鎂鈣/焦磷酸鈣等。復合生物支架的構成成分多有較好降解速度,該復合生物支架材料可能有較好降解。復合生物支架材料的在模擬體液環境下有鈣、鎂、鍶離子持續釋放。該復合生物支架材料保留了牛自然骨骨礦精妙的三維互通網孔微結構及其良好的機械強度,并且同時網孔內生長內有較大長徑比的晶須生長,可增加材料的比表面積,可改善細胞及蛋白的黏附。動物骨松質骨缺損區移植觀察到骨修復細胞在支架內良好的黏附、增殖、分化、分泌骨基質,在支架內可見極早的血管形成,成骨過程類似生理狀態的膜內成骨;觀察期未見明顯免疫排斥反應及炎性反應,提示復合生物支架材料具有良好的生物相容性,動物骨缺損區移植有快而良好的骨修復也提示復合生物支架材料可能的潛在成骨活性。
作為優選,所述可降解含鎂和鍶的硫磷灰石多孔復合生物支架中含鍶成分占可降解含鎂和鍶的硫磷灰石多孔復合生物支架總質量的1-18%,含鎂成分占可降解含鎂和鍶的硫磷灰石多孔復合生物支架總質量的5-60%。
作為優選,所述可降解含鎂和鍶的硫磷灰石多孔復合生物支架制備方法為:通過將牛煅燒松質骨骨礦多孔支架經含有鎂源、鍶源、硫源及磷源的四元體系處理,取出干燥后,高溫煅燒而得。
作為優選,所述將牛煅燒松質骨骨礦多孔支架含有鎂源、鍶源、硫源及磷源的四元體系處理的選擇以下方案之一:
方案一:將牛煅燒松質骨骨礦多孔支架先在鎂源-鍶源復合溶液中浸漬并蒸干后,再進入硫源-磷源復合溶液中水熱反應;
方案二:將牛煅燒松質骨骨礦多孔支架先在鍶源溶液中浸漬并蒸干后,再進入鎂源-硫源-磷源復合溶液中水熱反應。
作為優選,所述水熱反應采用恒溫水熱方式,控制溫度60-90℃,時間36-72小時。
作為優選,方案一中,牛煅燒松質骨骨礦多孔支架與鎂源-鍶源復合溶液的料液比為10g:40-80mL,牛煅燒松質骨骨礦多孔支架與硫源-磷源復合溶液的料液比為10g:40-100mL;方案二中,牛煅燒松質骨骨礦多孔支架與鍶源溶液的料液比為10g:20-80mL,牛煅燒松質骨骨礦多孔支架與鎂源-硫源-磷源復合溶液的料液比為10g:100-200mL。
作為優選,所述高溫煅燒的參數為750-900℃煅燒3-9小時。
作為優選,所述鎂源為硝酸鎂、硫酸鎂、磷酸氫鎂中的一種或兩種;所述鍶源為硝酸鍶;所述硫源為硫酸或硫酸與可溶性硫酸鹽的組合,所述可溶性硫酸鹽為硫酸鎂和/或硫酸鈉;所述磷源為磷酸或磷酸與可溶性磷酸鹽的組合,可溶性磷酸鹽選自磷酸氫鎂、磷酸氫二銨、磷酸二氫銨、磷酸氫鎂與磷酸氫二銨、磷酸氫鎂與磷酸二氫銨中的一種。
作為優選,所述含有鎂源、鍶源、硫源及磷源的四元體系中鎂離子的終濃度為0.05-0.2mol/L,鍶離子的終濃度為0.05-0.5mol/L,硫酸終濃度為0.06-0.1mol/L,由硫酸鹽提供的硫酸根終濃度為0.05-0.5mol/L,磷酸終濃度為1.7-15.3wt%,由磷酸鹽提供的磷終濃度為0.05-0.5mol/L。硫酸鹽包含鎂源、硫源中的硫酸鹽。磷酸鹽包含鎂源、硫源中的磷酸鹽。
作為優選,所述可降解含鎂和鍶的硫磷灰石多孔復合生物支架其材料可梯度降解;所述可降解含鎂和鍶的硫磷灰石多孔復合生物支架保持了牛煅燒松質骨骨礦多孔支架的三維互通網孔結構及機械強度,同時網孔內有較大長徑比的晶須生長,晶須長徑比為5-20:1,可有效增加材料的比表面積,所述可降解含鎂和鍶的硫磷灰石多孔復合生物支架孔隙率70-85%,孔徑400-1400μm。
作為優選,所述牛煅燒松質骨骨礦多孔支架的制備方法為:
(1)將牛松質骨切割成厚0.5-2cm的骨條或骨塊得原料骨;
(2)原料骨置于蒸餾水內在高壓鍋內蒸煮40-60min,然后用40-60℃飲用水清洗干凈,重復本步驟4-6次;
(3)將步驟(2)處理后的原料骨在恒溫烘箱內80-120℃干燥12-24小時,然后置于煅燒爐內,900-1200℃煅燒8-12小時,冷卻后得牛煅燒松質骨骨礦多孔支架。
本發明的有益效果是:
本發明可穩定有效地將鍶、鎂、硫、磷摻入煅燒牛松質骨礦多孔支架,將單質羥基磷灰石多孔支架轉化組分變化豐富的可降解含鎂和鍶的硫磷灰石多孔復合支架材料如硫酸鍶/磷酸鎂鈣/焦磷酸鈣、硫酸鍶/多聚磷酸氫鎂鈣/焦磷酸鈣、硫酸鍶/多聚磷酸氫鎂鈣/焦磷酸鈣/羥基磷灰石、硫酸鍶/多聚磷酸氫鎂鈣/焦磷酸鈣、硫酸鍶/磷酸鎂鈣/羥基磷灰石、硫酸鍶/多聚磷酸氫鎂鈣/羥基磷灰石、硫酸鍶/硫酸鈣/磷酸鎂鈣/羥基磷灰石、硫酸鍶/硫酸鈣/多聚磷酸氫鎂鈣/羥基磷灰石、硫酸鍶/硫酸鈣/磷酸鎂鈣、硫酸鍶/硫酸鈣/磷酸鎂鈣/焦磷酸鈣等。本發明有效摻入了成骨活性離子鎂離子、鍶離子及硫酸根離子、磷離子等;含鍶成分為硫酸鍶,硫酸鍶質量占材料總質量的1.0-18%;含鎂成分為具有良好降解特性的磷酸三鎂鈣或多聚磷酸氫鎂鈣等,含鎂成分占材料總質量的5-60%;部分復合支架含具有較快降解速度、能完全生物降解并具潛在骨誘導活性離子的硫酸鈣;部分復合支架還含有羥基磷灰石和/或焦磷酸鈣。
復合生物支架材料保持了自然骨骨礦三維互通網孔微結構及其較好的機械強度,同時網孔內有束狀較大長徑比的晶須生長,晶須長徑比為5-20:1,可有效增加材料的比表面積而改善細胞粘附。由于復合生物支架的組分多具備較好的降解特性,因此復合生物支架材料可能具備較好溶降特性。材料在較大比例的溶降后仍可保持良好的機械強度及網孔結構,這些在模擬體液溶降實驗可得到證實,電鏡下可見含鎂、鍶硫磷灰石復合支架的溶降與重新沉積。本發明的多孔復合生物支架材料在動物松質骨骨缺損區移植時,可見修復細胞良好的募集、黏附、增殖分化、分泌基質及快速的血管網形成,材料可實現類似生理狀態的膜內成骨,提示復合生物支架良好的骨傳導性及潛在的骨誘導活性;觀察過程中未發現免疫排斥反應及明顯的炎癥,提示復合生物支架具備良好的生物相容性。
總之,本發明的復合生物支架材料兼具良好三維互通網孔結構與骨傳導性、可降解性、較好機械強度和生物相容性;同時網孔內有較大長徑比的晶須生長,可增加材料的比表面積改善細胞粘附。因有效摻入了成骨活性離子鎂和鍶,部分材料還有效摻入了可完全生物降降解并可產生局部高鈣環境的硫酸鈣,復合生物支架材料可能具備潛在的骨誘導性。該復合生物支架可能更多地滿足了骨移植替代材料或骨組織工程支架材料的理想的條件。
附圖說明
圖1是本發明產品的一種的掃描電鏡圖。
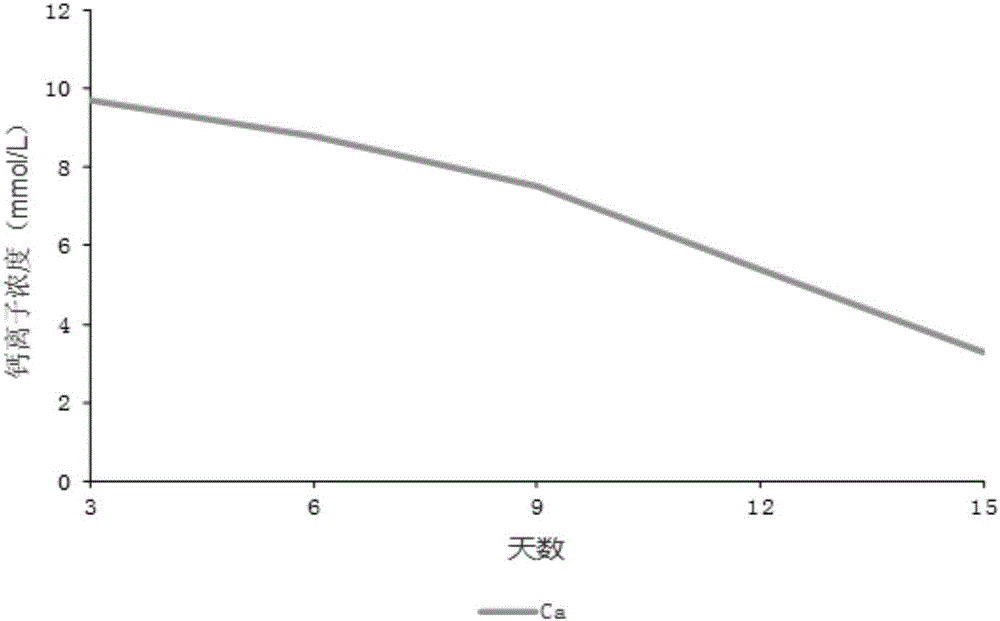
圖2是本發明產品在模擬體液溶降實驗早期鈣值(n=3,人血清鈣離子參考值2-2.67mmol/l)。
圖3本發明產品的一種模擬體液溶降實驗后材料的掃描電鏡圖。
圖4是本發明產品的一種移植實驗早期組織學圖示。
圖5是本發明產品的另一種移植實驗早期組織學圖示。
圖6是本發明產品的一種移植實驗后期期組織學圖示。
具體實施方式
下面通過具體實施例,對本發明的技術方案作進一步的具體說明。
本發明中,若非特指,所采用的原料和設備等均可從市場購得或是本領域常用的。下述實施例中的方法,如無特別說明,均為本領域的常規方法。
牛煅燒松質骨骨礦多孔支架的制備例1:
(1)將牛松質骨(牛股骨髁松質骨)切割成厚0.5cm的骨條得原料骨;
(2)原料骨置于蒸餾水內在高壓鍋內蒸煮40分鐘,然后用40℃水清洗干凈,重復本步驟6次;
(3)將步驟(2)處理后的原料骨在恒溫烘箱內80℃干燥24小時,然后置于煅燒爐內,900℃(升溫速率10℃/分鐘)煅燒12小時,隨爐冷卻后得牛煅燒松質骨骨礦多孔支架。牛煅燒松質骨骨礦多孔支架的制備例2:
(1)將牛松質骨(牛股骨髁松質骨)切割成厚1㎝的骨塊得原料骨;
(2)原料骨置于蒸餾水內在高壓鍋內蒸煮60min,然后用60℃水清洗干凈,重復本步驟4次;
(3)將步驟(2)處理后的原料骨在恒溫烘箱內120℃干燥12小時,然后置于煅燒爐內,1200℃(升溫速率10℃/分鐘)煅燒8小時,隨爐冷卻后得牛煅燒松質骨骨礦多孔支架。
牛煅燒松質骨骨礦多孔支架的制備例3:
(1)將牛松質骨(牛股骨髁松質骨)切割成厚0.8㎝的骨條得原料骨;
(2)原料骨置于蒸餾水內在高壓鍋內蒸煮50min,然后用50℃水清洗干凈,重復本步驟5次;
(3)將步驟(2)處理后的原料骨在恒溫烘箱內100℃干燥18小時,然后置于煅燒爐內,1000℃(升溫速率10℃/分鐘)煅燒10小時,隨爐冷卻后得牛煅燒松質骨骨礦多孔支架。
總實施方案1:
A:按所述含有鎂源、鍶源、硫源及磷源的四元體系中鎂離子的終濃度為0.05-0.2mol/L,鍶離子的終濃度為0.05-0.5mol/L;硫酸終濃度為0.06-0.1mol/L,由硫酸鹽提供的硫酸根終濃度為0.05-0.5mol/L,磷酸終濃度為1.7-15.3wt%,由磷酸鹽提供的磷終濃度為0.05-0.5mol/L進行配料。
B:稱取硝酸鍶、硝酸鎂先配制硝酸鍶、硝酸鎂溶液,牛煅燒松質骨骨礦多孔支架與鎂源-鍶源復合溶液固液比為10g:40-80毫升;將牛煅燒松質骨骨礦多孔支架浸入鍶、鎂復合溶液中,浸漬15-30分鐘后微波蒸干:微波輸出功率300-500w,時間15-24分鐘。
C:按牛煅燒松質骨骨礦多孔支架與硫源、磷源復合溶液的固液比為10g:40-100毫升配制硫源、磷源復合溶液,將步驟B處理后的牛煅燒松質骨骨礦多孔支架沉浸浸漬及水熱反應,水熱反應采取恒溫水熱反應,控制反應溫度60℃,反應時間為12小時。
D:取出多孔支架恒溫烘箱內70-90℃干燥產24-48小時。
E:將步驟D處理后的牛煅燒松質骨骨礦多孔支架在置于煅燒爐內,900℃(升溫速率2.5℃/分鐘)煅燒3-9小時,隨爐冷卻后得牛煅燒松質骨骨礦多孔支架轉化材料。
總實施方案2:
A:按所述含有鎂源、鍶源、硫源及磷源的四元體系中鎂離子的終濃度為0.05-0.2mol/L,鍶離子的終濃度為0.05-0.5mol/L;硫酸終濃度為0.06-0.1mol/L,由硫酸鹽提供的硫酸根終濃度為0.05-0.5mol/L,磷酸終濃度為1.7-15.3wt%,由磷酸鹽提供的磷終濃度為0.05-0.5mol/L進行配料。
B:稱取硝酸鍶先配制硝酸鍶溶液,牛煅燒松質骨骨礦多孔支架與鍶源溶液固液比為10g:20-80毫升;將牛煅燒松質骨骨礦多孔支架浸入鍶源溶液中,浸漬15-30分鐘后微波蒸干:微波輸出功率300-500w,時間15-30分鐘。
C:按鎂源-硫源-磷源復合溶液的料液比為10g:100-200mL配制鎂源-硫源-磷源復合溶液,用鎂源-硫源-磷源復合溶液浸沒步驟B處理的牛煅燒松質骨骨礦多孔支架進行浸漬及水熱反應,水熱反應采取恒溫水熱反應,控制反應溫度70-90℃,反應時間為20-36小時。
D:取出牛煅燒松質骨骨礦多孔支架至恒溫烘箱內70-90℃干燥產24-48小時。
E:將步驟D處理后的牛煅燒松質骨骨礦多孔支架在置于煅燒爐內,750-900℃(升溫速率2.5℃/分鐘)煅燒2-9小時,隨爐冷卻后得產品。
每一樣品進行大體觀察進行X射線粉末衍射(Xray diffraction,XRD)分析;選擇部分樣品進行用掃描電鏡進行顯微結構觀察;進行模擬體液溶降實驗、骨缺損修復的動物實驗等。大體觀察觀察材料的大體形態、強度等,部分樣品用INSTRON—5566測試壓縮強度。模擬體液溶降實驗用醫用氯化鈉注射液作為模擬體液,檢測材料與模擬體液的固液質量體積比為1-2克:100毫升,置入有蓋燒杯內,在37℃恒溫條件下進行模擬體液溶降實驗,溶降實驗時30天,每隔3天取標本用AU5800全自動生化分析儀檢測模擬體液內鈣、磷、鎂、鍶離子測定,溶降的前15天在每3天更換模擬體液40%,后期不更換模擬體液;用國產電子天平測定溶降實驗30天后樣品的質量并計算降解率;進行溶降實驗開始前、結束時材料的XRD分析與掃描電鏡觀察等。動物骨缺損修復試驗選擇8只健康新西蘭白兔,在兔股骨髁造成直徑8mm的骨缺損,采用多孔復合生物材料進行骨缺損修復,術后1、2、4、12周處死實驗動物,進行骨缺損修復的組織學檢查。
實施例1
605242
取硝酸鎂0.51克、硝酸鍶0.42在燒杯中配制0.1mol/L硝酸鎂、0.1mol/L硝酸鍶20毫升,用孔隙率約70-85%的牛煅燒松質骨骨礦多孔支架5克吸附半小時,微波中低火干燥6×2分鐘;取硫酸2毫升、磷酸3.5毫升配制0.1mol/L硫酸、15.3w%磷酸溶液20毫升,將牛煅燒松質骨骨礦多孔支架投入其中60℃反應12小時,取出后90℃干燥24小時;每分鐘升溫2.5℃至900℃,維持3小時后隨爐降至室溫得605242A;每分鐘升溫2.5℃至900℃,維持6小時后隨爐降至室溫得605242E;每分鐘升溫2.5℃至900℃,維持9小時后隨爐降至室溫得605242K;
實施例2
605243
取硝酸鎂0.51克、硝酸鍶0.84在燒杯中配制0.1mol/L硝酸鎂、0.2mol/L硝酸鍶20毫升,用孔隙率約70-85%的牛煅燒松質骨骨礦多孔支架5克吸附半小時,微波中低火干燥6×2分鐘;取硫酸2毫升、磷酸3.5毫升配制0.1mol/L硫酸、15w%磷酸溶液20毫升,將牛煅燒松質骨骨礦多孔支架投入其中,60℃浸漬、水熱反應12小時,取出后90℃干燥24小時;每分鐘升溫2.5℃至900℃,維持2小時后隨爐降至室溫得605243A;取出后90℃干燥24小時重9-10.5克;每分鐘升溫2.5℃至900℃,維持3小時后隨爐降至室溫得605243A;每分鐘升溫2.5℃至900℃,維持6小時后隨爐降至室溫得605243E;每分鐘升溫2.5℃至900℃,維持9小時后隨爐降至室溫得
實施例3
605244
取硝酸鎂1.53克、硝酸鍶3.17克在燒杯中配制0.2mol/L硝酸鎂、0.5mol/L硝酸鍶30毫升,用孔隙率約70-85%的牛煅燒松質骨骨礦多孔支架5克吸附半小時,微波中低火干燥6×2分鐘;取1mol/L硫酸3毫升、無水硫酸鈉2.16克、85w%磷酸0.6毫升、磷酸氫二銨1.58克配制0.3mol/L硫酸鈉、0.1mol/L硫酸、1.7w%磷酸、0.4mol/L磷酸氫二銨溶液30毫升,用其浸沒牛煅燒松質骨骨礦多孔支架,60℃浸漬、水熱反應12小時,取出后90℃干燥24小時;每分鐘升溫2.5℃至900℃,維持3小時后隨爐降至室溫得605244A;每分鐘升溫2.5℃至900℃,維持6小時后隨爐降至室溫得605244E;每分鐘升溫2.5℃至900℃,維持9小時后隨爐降至室溫得605244K。
實施例4
605245
取硝酸鎂0.77克、硝酸鍶2.54在燒杯中配制0.1mol/L硝酸鎂、0.4mol/L硝酸鍶30毫升,用孔隙率約85%的牛煅燒松質骨骨礦多孔支架5克吸附半小時,微波中低火干燥6×2分鐘;取1mol/L硫酸3毫升、無水硫酸鈉1.44克、磷酸氫二銨0.79克配制0.1mol/L硫酸、0.2mol/L硫酸鈉、0.2mol/L磷酸氫二銨溶液20毫升,用其浸沒牛煅燒松質骨骨礦多孔支架,60℃浸漬、水熱反應反應12小時,取出后90℃干燥24小時;每分鐘升溫2.5℃至900℃,維持3小時后隨爐降至室溫得605245A;每分鐘升溫2.5℃至900℃,維持9小時后隨爐降至室溫得605245K;
實施例6
605246
取硝酸鎂0.77克、硝酸鍶1.27克在燒杯中配制0.1mol/L硝酸鎂、0.2mol/L硝酸鍶30毫升,用孔隙率約85%的牛煅燒松質骨骨礦多孔支架5克吸附半小時,微波中低火干燥6×2分鐘;取1摩爾/升硫酸3毫升、無水硫酸鈉0.72克、磷酸氫二銨0.4克配制0.1摩爾/升硫酸、0.1摩爾/升磷酸氫二銨溶液30毫升,將牛煅燒松質骨骨礦多孔支架投入其中,60℃反應12小時,取出后90℃干燥24小時重克;每分鐘升溫2.5℃至900℃,維持2小時后隨爐降至室溫得605246A;每分鐘升溫2.5℃至900℃,維持3小時后隨爐降至室溫得605246A;每分鐘升溫2.5℃至900℃,維持6小時后隨爐降至室溫得605246E;每分鐘升溫2.5℃至900℃,維持9小時后隨爐降至室溫得605246K;
實施例7
509032
按配制0.05mol/L硝酸鍶、0.08mol/L硫酸、0.3mol/L硫酸鈉、0.2mol/L磷酸氫鎂、1.7w%磷酸復合溶液100毫升計算配料:硝酸鍶1.06克、1mol/L硫酸5毫升、硫酸鈉4.26克、磷酸氫鎂3.46克、85w%磷酸2毫升;先取硝酸鍶1.06克加去離子水配制含鍶溶液40毫升,用孔隙率70-85%的牛煅燒松質骨骨礦多孔支架10克浸漬半小時,微波輸出功率500-700瓦24-30分鐘蒸干;取1mol/L硫酸10毫升、硫酸鈉4.26克、磷酸氫鎂3.46克、85w%磷酸2毫升加去離子水配制硫、磷、鎂復合溶液100毫升,用其浸沒牛煅燒松質骨骨礦多孔支架沉浸其中,燒杯反罩保護下70℃恒溫浸漬、水熱反應20小時取出,80℃干燥24小時;每分鐘升溫2.5℃至750℃,維持6小時后隨爐降至室溫得509032E;
實施例8
601291
按配制0.1mol/L硝酸鍶、0.05mol/L硫酸鎂、0.1mol/L硫酸、0.15mol/L硫酸鈉、0.1mol/L磷酸氫鎂、1.7w%磷酸復合體系100毫升計算配料;先取硝酸鍶、七水硫酸鎂配制鎂源-鍶源復合溶液20毫升;用孔隙率約85%的牛煅燒松質骨骨礦多孔支架5克浸漬半小時,微波500瓦8×2分鐘蒸干;取1mol/L硫酸10毫升、硫酸鈉2.26克、磷酸氫鎂1.74克、85w%磷酸2毫升配制0.05mol/L硫酸、0.15mol/L硫酸鈉、0.1mol/L磷酸氫鎂、1.7w%磷酸復合溶液100毫升;將牛煅燒松質骨骨礦多孔支架投入其中,燒杯反罩下90℃恒溫條件下浸漬、水熱處理24小時取出,90℃干燥24小時;每分鐘升溫2.5℃至900℃,維持8小時后隨爐降至室溫得603292E;
603292E
SrSO4 6.2%
CaSO4 45.3%
Ca2.89Mg0.11(PO4)2 48.5%。
實施例9
601294
配制0.3mol/L硝酸鍶、0.05mol/L硫酸鎂、0.1mol/L硫酸、0.1mol/L磷酸氫鎂、1.7w%磷酸復合溶液100毫升計算配料:硝酸鍶3.18克、七水硫酸鎂0.65克、1mol/L硫酸5毫升、硫酸鈉2.13克、磷酸氫鎂0.86克、85w%磷酸1毫升;先取硝酸鍶3.18克、七水硫酸鎂0.65克加去離子水配制硝酸鍶、硫酸鎂復合溶液20毫升;將孔隙率約85%的牛煅燒松質骨骨礦多孔支架5克投入其中浸漬半小時,微波500瓦8×2分鐘蒸干;取1mol/L硫酸5毫升、85w%磷酸1毫升、磷酸氫鎂0.86克加去離子水配制復合溶液50毫升,用其浸沒牛煅燒松質骨骨礦多孔支架,70℃恒溫條件下浸漬、水熱處理24小時,取出后80℃干燥48小時;每分鐘升溫2.5℃至900℃,維持6小時后隨爐降至室溫得603294E;
603294E
SrSO4 10.3%
CaSO4 59.8%
Ca2.89 Mg0.11(PO4)2 29.9%。
實施例10
509052
按配制0.05mol/L硝酸鍶、0.1mol/L硫酸、0.3mol/L硫酸鈉、0.05mol/L磷酸氫鎂、1.7w%磷酸、0.5mol/L磷酸二氫銨復合溶液100毫升復合體系計算配料:硝酸鍶1.06、1mol/L硫酸10毫升、硫酸鈉4.26克、磷酸氫鎂0.86克、磷酸二氫銨5.78克、磷酸2毫升;先取硝酸鍶1.06配制硝酸鍶溶液20毫升,將孔隙率約85%的牛煅燒松質骨骨礦多孔支架10克投入其中浸漬半小時,微波500瓦6×2分鐘蒸干;取1mol/L硫酸10毫升、硫酸鈉4.26克、磷酸氫鎂0.86克、磷酸二氫銨5.78克、磷酸2毫升加去離子水配制硫、磷、鎂復合溶液100毫升,用其浸沒牛煅燒松質骨骨礦多孔支架,燒杯反罩下70℃恒溫浸漬、水熱反應20小時后取出,ph值約2.5;80℃干燥48小時;每分鐘升溫2.5℃至750℃,維持6小時后隨爐降至室溫得509052E;
實施例11
512121
按配制0.05mol/L硝酸鍶、0.1mol/L硫酸鎂、0.1mol/L硫酸、0.4mol/L硫酸鈉、1.7w%磷酸、0.4mol/L磷酸氫二銨復合溶液50毫升計算配料:硝酸鍶0.5克、硫酸鎂1.3克、硫酸5毫升、硫酸鈉2.84克、85w%磷酸1毫升、磷酸氫二銨2.64克;先取硝酸鍶、硫酸鎂1.3克加去離子水配制硝酸鍶、硫酸鎂溶液20毫升,用孔隙率70-85%的牛煅燒松質骨骨礦多孔支架5克浸漬半小時,微波輸出功率300-500瓦30分鐘蒸干;取1mol/L硫酸5毫升、硫酸鈉2.84克、85w%磷酸1毫升、磷酸氫二銨2.64克配制復合溶液50毫升,用其浸沒牛煅燒松質骨骨礦多孔支架,燒杯反罩下90℃恒溫浸漬、水熱反應36小時取出,取出后70℃干燥48小時;每分鐘升溫2.5℃至750℃,維持6小時后隨爐降至室溫得512121E;每分鐘升溫2.5℃至750℃,維持9小時后隨爐降至室溫得512121K;
檢測結果:
材料大體觀察、強度測定、XRD成分分析及掃描電鏡觀察
各種產品完好保持牛松質骨的預制形態,無碎裂、崩塌或粉末化等,具有較好的機械強度;10×10×10mm的1-4號標本用INSTRON—5566松質骨測試壓縮強度見表1。X線衍射(XRD)檢測證實在鍶、鎂、硫、磷溶液中浸漬及水熱反應的煅燒牛松骨礦支架,干燥后經煅燒可轉化為摻鎂、鍶的可降解硫磷灰石多孔復合生物支架材料如硫酸鍶/磷酸鎂鈣/焦磷酸鈣、硫酸鍶/多聚磷酸氫鎂鈣/焦磷酸鈣、硫酸鍶/多聚磷酸氫鎂鈣/焦磷酸鈣/羥基磷灰石、硫酸鍶/多聚磷酸氫鎂鈣/焦磷酸鈣、硫酸鍶/磷酸鎂鈣/羥基磷灰石、硫酸鍶/多聚磷酸氫鎂鈣/羥基磷灰石、硫酸鍶/硫酸鈣/磷酸鎂鈣/羥基磷灰石、硫酸鍶/硫酸鈣/多聚磷酸氫鎂鈣/羥基磷灰石、硫酸鍶/硫酸鈣/磷酸鎂鈣、硫酸鍶/硫酸鈣/磷酸鎂鈣/焦磷酸鈣等等,含鍶成分硫酸鍶占材料總質量的1-18%;含鎂成分為磷酸鎂鈣或磷酸氫鎂鈣,含鎂成分占材料總質量的5-60%;復合支架含具有較快降解速度、能完全降解并具潛在骨誘導活性離子的硫酸鈣;部分復合支架還含有羥基磷灰石。電鏡掃描發現(參照圖1),產品保持了牛松質骨自然骨骨礦的三維互通網孔微結構的主體結構,同時網孔內有較大長徑比的硫酸鈣晶須生長,晶須長徑比為5-20:1可增加材料的比表面積,可能改善細胞粘附。
表1壓縮強度
2、材料的體外溶降實驗
模擬體液溶降實驗用醫用氯化鈉注射作為模擬體液,檢測材料與模擬體液的固液質量體積比為1-2克:100毫升,置入有蓋燒杯內,在37℃恒溫條件下進行模擬體液溶降實驗,溶降實驗時間4周,用AU5800全自動生化分析儀檢測模擬體液內鈣、磷、鎂等離子測定,用國產電子天平測定4周時材料的質量并計算降解率;進行溶降實驗開始前、結束時材料的XRD分析與掃描電鏡觀察等。實驗發現材料有較好的降解率(表2),模擬體液實驗的早期(半月內)多數樣品模擬體液中有較高的鈣離子濃度即維持在人血清正常參考值(2-2.67mmol/l)中間值的1-4倍之間(圖2);亦有活性離子鎂、鍶釋放。溶降實驗結束時支架網孔變大、機械強度良好(表3)。模擬體液實驗材料的XRD分析發現,材料的成分及質量比隨時間變化而發生變化,硫酸鈣及含鎂、鋅磷磷灰石成分等逐漸減少或消失、支架材料漸變為羥基磷灰石。掃描電鏡可發現材料的溶降及礦物成分的重新沉積(圖3)。
表2材料在模擬體液內浸泡4周的降解率(n=3)
表3溶降實驗后壓縮強度
3、動物骨缺損修復試驗
多孔復合生物材料組的移植早期(1周)即可見細胞、血管進入支架的整個空間,可見修復細胞增殖、分化、分泌骨基質(圖4);2、4周即有骨小梁形成,新生骨組織與支架有完美的結合(圖5);12周有板層骨形成(圖6)。骨修復快而好觀察過程中未發現免疫排斥反應及明顯的炎癥,材料具備良好的生物相容性。
以上所述的實施例只是本發明的一種較佳的方案,并非對本發明作任何形式上的限制,在不超出權利要求所記載的技術方案的前提下還有其它的變體及改型。
- 還沒有人留言評論。精彩留言會獲得點贊!