TNF受體相關因子5(Traf5)在肝缺血再灌注損傷中的應用的制作方法
技術領域:
本發明屬于基因的功能與應用領域,涉及TNF受體相關因子5(Traf5)在肝缺血再灌注損傷中的應用,具體涉及Traf5在篩選或制備預防、緩解和/或治療肝缺血再灌注損傷藥物中的應用。
背景技術:
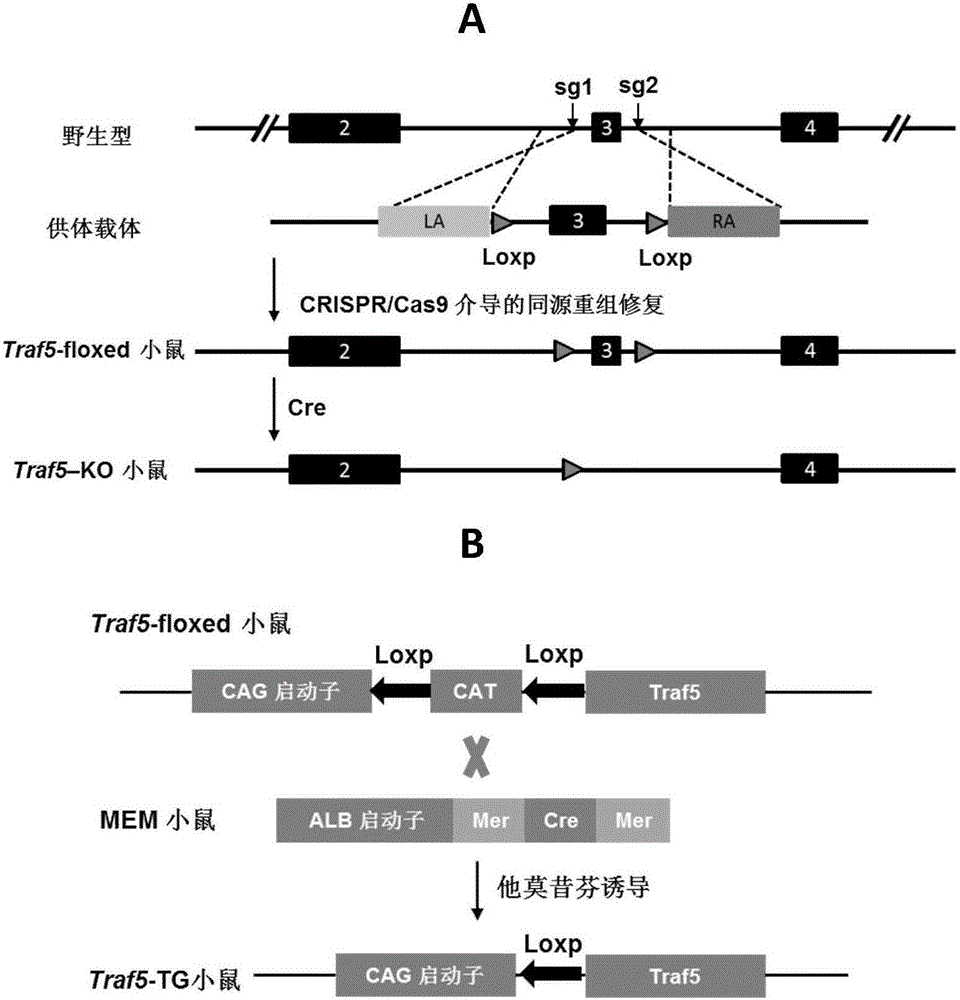
:肝臟缺血再灌注損傷(ischemiareperfusioninjury,IRI)是在肝臟外科手術或者肝臟移植中,因肝臟血流阻斷或肝臟供體的體外灌注引起肝臟缺血,當肝臟血流灌注恢復后,導致肝臟損傷加重甚至功能障礙的生理病理過程[1]。肝臟IR是一個涉及多種細胞類型和不同通路分子介質的復雜過程。細胞損傷可發生在缺血期,也可發生在再灌注期間,最終通過細胞凋亡和壞死導致細胞死亡。供應肝臟的血流在正常體溫下中斷(如切除肝臟)時,可產生熱缺血損傷;在移植肝臟冷灌注和保存過程中則產生冷缺血損傷[2]。導致肝缺血再灌注損傷的機制比較復雜,研究表明,Kupffer細胞的激活、氧化應激以及炎癥性細胞信號通路的激活等都參與了這一病理生理過程[3]。肝臟IRI在臨床上常表現為肝功能的損害,術后并發癥發生率及死亡率增加;肝臟作為體內產生細胞因子的主要器官,也是諸多細胞因子作用的靶器官之一,肝臟IRI可嚴重影響肝臟術后功能,是誘發肝功能不全和肝衰竭的關鍵原因[4],進而出現多器官功能障礙的級聯反應;關于肝臟缺血再灌注損傷的機制及其預防措施的研究,對于減少肝臟IRI的發生或減輕IRI的程度,減少肝臟手術的并發癥,提高肝移植成功率,促進術后肝功能的恢復,具有重要的臨床意義;進一步探尋IRI的發生機制及并據此研制出更有針對性的防治措施將對未來肝臟外科的發展起到至關重要的作用。腫瘤壞死因子(TNF)受體相關因子(tumornecrosisfactorreceptor-associatedfactor,Traf)是細胞內重要的信號傳導蛋白,它可與多種TNFR和IL-1R/TLR家族成員結合,參與調節NF-κB和JNK等多種信號轉導通路的激活,具有調節正常和腫瘤細胞的增殖、存活、凋亡、參與炎癥反應、誘導內皮細胞出芽等多種功能[5]。哺乳動物體內目前共發現7個Traf家族成員,分別是Traf1-7。TRAF包含一個大約230氨基酸的C末端特征性結構域,介導Traf蛋白形成同源或異源二聚體或結合其他銜接分子及信號轉導分子。除Traf1外,Traf2-7還包含一個高度保守的N末端指環結構域(RINGfingerdomain)。Traf5是Traf家族成員中的一種。既往的研究結果表明Traf5可以介導CD30、CD40、LT-βR、LMP-1、Fn14等的信號轉導,通過激活NF-κB和JNK等信號轉導通路,發揮抑制細胞凋亡、參與炎癥反應等多種功能。Traf5表達較廣泛,高表達于肺,中度表達于脾、胸腺、腎,但在乳腺等其它組織中水平很低[6]。近來的研究表明Traf5在缺血性腦梗塞[7]、炎癥性腸疾病[8]中發揮重要的作用;Traf5可通過MEK-ERK信號通路影響動脈弓縮窄引起的心肌肥厚的發生發展[9]。目前,Traf5在肝臟缺血再灌注損傷中的作用還不清楚。參考文獻:1.KapoorS.Hepaticischemia-reperfusioninjuryfrombenchtobedside(BrJSurg2010;97:1461-1475).BrJSurg.2011;98(3):459,459-460.2.Abu-AmaraM,YangSY,TapuriaN,etal.Liverischemia/reperfusioninjury:processesinflammatorynetworks-areview.LiverTranspl,2010,16(9):1016-1032.3.Massip-SalcedoM,Rosello-CatafauJ,PrietoJ,etal.Theresponseofthehepatocytetoischemia.LiverInt.2007;27(1):6-16.4.OrciLA,TosoC,MenthaG,eta1.Systematicreviewandmeta-analysisoftheeffectofperioperativesteroidsonischemiareperfusioninjuryandsurgicalstressresponseinpatientsundergoingliverresection.BrJSurg,2013,100(5):600-609.5.AggarwalBB.Tumournecrosisfactorsreceptorassociatedsignalingmoleculesandtheirroleinactivationofapoptosis,JNKandNF-κB.AnnRheumDis,2000,59(supplI):i6-i16.6.ZapataJM,KrajewskaM,KrajewskiS,etal.TNFR-associatedfactorfamilyproteinexpressioninnormaltissuesandlymphoidmalignancies.JImmunol,2000,165(9):5084-5096.7.WangL,LuY,GuanH,etal.Tumornecrosisfactorreceptor-associatedfactor5isanessentialmediatorofischemicbraininfarction.JNeurochem,2013,126(3):400-144.8.ShenJ,QiaoYQ,RanZH,etal.Up-regulationandpre-activationofTRAF3andTraf5ininflammatoryboweldisease.IntJMedSci,2013,10(2):156-163.9.BianZetal.Disruptionoftumornecrosisfactorreceptorasfactor5exacerbatespressureoverloadcardiachypertrophyandfibrosis.JCellBiochem,2014,115(2):349-358。技術實現要素:為解決臨床防治肝缺血再灌注損傷現有技術的缺陷和不足,本發明的目的在于確定Traf5基因的表達與肝缺血再灌注損傷之間的相互關系,提供一種用于治療肝缺血再灌注損傷的靶基因Traf5的新應用,即Traf5作為藥物靶標在篩選預防、緩解和/或治療肝缺血再灌注損傷的藥物中的應用,以及Traf5在制備用于預防、緩解和/或治療肝缺血再灌注損傷的藥物中的應用,進而把Traf5基因應用于肝缺血疾病的治療。本發明的目的通過下述技術方案實現:本發明以肝細胞特異性Traf5基因敲除小鼠和Traf5轉基因小鼠為實驗對象,通過肝缺血再灌注損傷模型研究Traf5基因的功能。結果表明:與野生型C57BL/6小鼠相比,肝細胞特異性Traf5基因敲除小鼠肝臟壞死面積明顯增加;與非轉基因小鼠相比,Traf5轉基因小鼠的肝臟壞死面積則明顯減小。這提示Traf5基因具有保護肝功能的作用,為研究Traf5在防治肝缺血的新靶點和新策略中所發揮的作用提供了理論依據和臨床基礎。本發明的研究證明了:在肝缺血再灌注損傷模型中,Traf5具有抑制肝臟壞死、減少肝細胞凋亡、保護肝功能的作用。一種Traf5基因在肝缺血再灌注損傷中的功能,主要體現在Traf5具有保護肝功能的作用,特別是Traf5具有改善肝缺血再灌注損傷的作用。針對Traf5改善肝缺血再灌注損傷的功能,Traf5具有如下應用:Traf5作為藥物靶標在篩選預防、緩解和/或治療肝缺血再灌注損傷的藥物中的應用。該應用是非診斷和治療的目的;所述的篩選預防、緩解和/或治療肝缺血再灌注損傷的藥物,是指篩選夠促進Traf5基因表達的藥物。本發明相對于現有技術具有如下的優點及效果:(1)本發明發現Traf5基因的新功能,即Traf5基因能夠抑制肝組織缺血再灌注損傷,且與肝細胞凋亡密切相關。(2)基于Traf5在抑制肝組織缺血再灌注損傷中的作用,其可以用于篩選或制備預防、緩解和/或治療肝缺血再灌注損傷的藥物。附圖說明圖1肝細胞特異性Traf5基因敲除小鼠和Traf5轉基因小鼠構建策略圖。A為肝細胞特異性Traf5基因敲除小鼠的構建策略圖;B為肝細胞特異性Traf5轉基因小鼠的構建策略圖。圖2是WesternBlot檢測肝細胞特異性Traf5基因敲除小鼠和Traf5轉基因小鼠組織中Traf5表達量的結果圖。A為肝細胞特異性Traf5基因敲除小鼠的檢測結果圖;B為肝細胞特異性Traf5轉基因小鼠的檢測結果圖(TG1、TG2、TG3、TG4為不同的轉基因小鼠個體)。圖3是小鼠在不同時間點肝臟的壞死情況對比圖。A為WT和Traf5-KO小鼠在不同時間點肝臟HE染色圖及壞死面積統計柱狀圖;B為NTG和Traf5-TG小鼠在不同時間點肝臟HE染色圖及壞死面積統計柱狀圖(#:P<0.05vsWT/NTGI/R組)。圖4小鼠在不同時間點血清中ALT及AST的含量統計比較圖。A為WT和Traf5-KO小鼠在不同時間點肝臟血清中ALT及AST的含量統計柱狀圖;B為NTG和Traf5-TG小鼠在不同時間點肝臟血清中ALT及AST的含量統計柱狀圖(*:P<0.05vsWT/NYGSham組;#:P<0.05vsWT/NTGI/R組)。圖5小鼠缺血在再灌注24h時TUNEL細胞數的柱狀統計圖。A為WT和Traf5-KO小鼠在再灌注24h時TUNEL免疫熒光柱狀統計圖;B為NTG和Traf5-TG小鼠在再灌注24h時TUNEL免疫熒光柱狀統計圖(#:P<0.05vsWT/NTGI/R組)。具體實施方式下面結合實施例及附圖對本發明作進一步詳細的描述,但本發明的實施方式不限于此。實驗用動物及飼養:實驗動物:選用8-10周齡、體重在24g-27g、背景為雄性C57BL/6品系的野生型小鼠(WT,購自北京華阜康生物科技股份有限公司)、肝細胞特異性Traf5基因敲除小鼠及Traf5轉基因小鼠(由武漢大學動物實驗中心李紅良老師實驗室構建),及非轉基因小鼠(NTG,同窩對照非轉基因小鼠)為實驗對象。飼養環境:所有實驗小鼠均飼養在武漢大學SPF級實驗動物中心。SRF級小鼠飼料購自北京華阜康生物科技股份有限公司。飼養條件:室溫在22-24℃之間,濕度在40-70%之間,明暗交替照明時間為12h,自由飲水攝食。實施例1肝細胞特異性Traf5基因敲除小鼠以及Traf5轉基因小鼠的構建(1)肝細胞特異性Traf5基因敲除小鼠的構建(構建策略見圖1A)根據Traf5基因的信息,利用CRISPRDesign分別在內含子2和3中各設計一個CRISPR的打靶位點。靶序列分別為:Traf5-sRNA1:GgAGGCTGTAGTACAGTGTGACGGCCGG;Traf5-sRNA2:gGTTTTAAGGGTTATCTAGACTAGAAGG。此外還設計了一個用于同源修復的供體載體(DonorVector),它包括兩側同源臂、中間的外顯子3以及兩個同向的loxp序列。1)打靶載體的構建:分別將sgRNA1和sgRNA2對應的兩條引物融合成雙鏈DNA,然后用T4DNA連接酶連入經過限制性內切酶BsaI處理過的pUC57-sgRNA(Addgene51132)載體中。該載體上游有一個T7啟動子,可以用于后續的體外轉錄實驗。2)條件性敲除骨架載體pBluescriptSK(+)-2loxp的構建:分別合成4條寡聚單鏈核苷酸序列:loxp1-F:AGCTTGACGTCATAACTTCGTATAGCATACATTATAGCAATTTATACCGGTGAT;loxp1-R:ATCACCGGTATAAATTGCTATAATGTATGCTATACGAAGTTATGACGTCA;loxp2-F:GATCCCTTAAGATAACTTCGTATAGCATACATTATAGCAATTTATACGCGTA;loxp2-R:CTAGTACGCGTATAAATTGCTATAATGTATGCTATACGAAGTTATCTTAAGG;上述寡核苷酸序列退火后形成loxp1和loxp2兩條雙鏈。將pBluescriptIISK(+)載體用HindIII(NEB,R0104L)和EcoRV(NEB,R0195L)雙酶切后連接入loxp1退火雙鏈,再將測序正確的載體用BamHI(NEB,R0136L)和SpeI(NEB,R0133L)雙酶切,連接入loxp2退火雙鏈,得到條件性敲除骨架載體,命名為pBluescriptSK(+)-2loxp。3)供體載體(DonorVector)的構建:根據引物設計原則,設計如下引物(表1),以小鼠gDNA為模板,擴增供體載體的左右同源臂(LA和RA)以及中間的外顯子部分(M)。上述擴增得到的產物及pBluescriptSK(+)-2loxp載體經表1中所示限制性內切酶酶切后一一連接,得到供體載體。表1構建供體載體所需引物序列及對應酶切位點引物名稱引物序列酶切位點Traf5LA-FtcgagCTCCAGTAAGCTCTAGGTTCTAAAGGTGAAGAACCCGGCCgacgtXhoITraf5LA-RCGGCCGGGTTCTTCACCTTTAGAACCTAGAGCTTACTGGAGCAatIITraf5M-FCCGGAATTCGTCACACTGTACTACAGCCTGCEcoRITraf5M-RCGGGATCCAGAAGGTCAACCCCCACCABamHITraf5RA-FcgcgtAGTCTAGATAACCCTTAAAACATTGTTCTGTTTAATGACAgcMluITraf5RA-RggccgcTGTCATTAAACAGAACAATGTTTTAAGGGTTATCTAGACTaNotI4)打靶載體的轉錄:對CRIPR/Cas9系統包含的兩個部分(負責切割作用的Cas9蛋白和引導Cas9蛋白定位到靶位點的gRNA)分別進行轉錄。對于Cas9蛋白,將其表達載體pST1374-Cas9(Addgene44758)用PmeI進行酶切,以純化后回收線性化質粒為轉錄模板,用T7mMESSAGEmMACHINE試劑盒(AM1345,Ambion公司)進行體外轉錄,獲得加帽的mRNA產物。并用Poly(A)Tailing試劑盒(Ambion公司)對上述產物加尾,獲得成熟的mRNA產物;對于sgRNA,使用MEGAshortscript?Kit(AM1354,Ambion公司)進行體外轉錄。將轉錄得到的Cas9和sgRNA的mRNA使用miRNeasyMicroKit(Qiagen,217084)進行純化。5)Traf5-floxed條件性敲除小鼠的制作將上述成熟的mRNA產物與供體載體一同注入小鼠受精卵中,移植到代孕母鼠體內進行培育。得到的小鼠進行鑒定。取出生一周后的小鼠腳趾或尾部組織,提取基因組,并通過PCR方法篩選陽性首建鼠。從確定發生同源重組的小鼠中隨機挑選一只作為F0代進行后續的繁殖,最終獲得Traf5-floxed純合小鼠。6)肝細胞特異性Traf5基因敲除小鼠的制作將上述Traf5-floxed小鼠與肝臟特異性Alb-Cre(購自TheJacksonLaboratory,貨號003574)轉基因小鼠交配,篩選得到Traf5floxed/floxed/Alb-Cre小鼠,待該小鼠長至6周齡左右后,腹腔注射Tamoxifen,誘導Cre酶的表達,Cre酶特異性的識別兩個同向的loxp,并切除兩者之間的序列及其中的一個loxp,最后得到肝細胞特異性Traf5基因敲除小鼠。通過蛋白質印跡法(WesternBlot)實驗檢測肝細胞特異性Traf5基因敲除小鼠肝臟中Traf5蛋白的表達量。提取肝臟、心臟、腦組織、腎臟組織蛋白以及肝細胞蛋白,通過聚丙烯酰胺凝膠電泳(SDS-PAGE),驗證Mincle表達,結果見圖2A。在小鼠心臟、腦、腎臟組織中,WT型小鼠和基因敲除小鼠Traf5蛋白表達含量變化不大;而在肝臟組織中,相比于WT型小鼠,基因敲除小鼠Traf5蛋白表達含量明顯降低,且在肝細胞中Traf5蛋白幾乎不表達。(2)肝細胞特異性Traf5轉基因小鼠的構建(構建策略見圖1B):為進一步研究Traf5過表達對于肝臟缺血再灌注損傷的影響,本發明構建了幾株Traf5轉基因小鼠(Traf5-TG)。以野生型C57BL/6小鼠Traf5基因cDNA為模板,用上游引物(5’-AGCTTTGTTTAAACGCCACCATGGCTCATTCGGAGGAGCA-3’)、下游引物(5’-CTAGCTAGCCTACAGATCCTCCAAGTCAGTTAAATCC-3’)擴增小鼠Traf5基因(NCBI,GeneID:22033,NM_011633.2),把擴增得到的產物以及pCAG-CAT-LacZ載體(北京協和醫學院基礎學院楊青林老師實驗室,制備過程參見參考文獻:KimT,ZhelyabovskaO,LiuJ,etal.GenerationofanInducible,Cardiomyocyte-SpecificTransgenicMouseModelwithPPARb/dOverexpression[J].PeroxisomeProliferator-ActivatedReceptors(PPARs),57.)用PmeI(NEB,#R0560L)和NheI(NEB,#R0131L)雙酶切后連接,得到轉基因載體pCAG-loxP-CAT-loxP-Traf5-hGHpA,Traf5的表達由CAG啟動子驅動得到。將構建的載體通過顯微注射構造成受精胚胎(C57BL/6J背景),得到Traf5-floxed轉基因小鼠。肝細胞特異性Traf5轉基因小鼠由Traf5-floxed轉基因小鼠和Alb-Cre(購自TheJacksonLaboratory,貨號003574)小鼠雜交繁殖得到。通過蛋白質印跡法(WesternBlot)實驗檢測不同轉基因小鼠肝臟中Traf5蛋白的表達量。提取不同轉基因小鼠肝臟組織蛋白,通過聚丙烯酰胺凝膠電泳(SDS-PAGE),驗證Traf5過表達,結果見圖2B。相比于野生型小鼠,肝細胞特異性Traf5轉基因小鼠肝臟組織中Traf5蛋白表達含量顯著提高。實施例2小鼠肝缺血再灌注損傷模型(ischemia/reperfusioninjury,I/R)的獲得(1)實驗動物分組:雄性C57BL/6品系野生型小鼠、肝細胞特異性Traf5基因敲除小鼠及Traf5轉基因小鼠、非轉基因小鼠,通過肝臟缺血再灌注建立肝缺血再灌注損傷(I/R)模型。隨機分為8組:C57BL/6J品系野生型小鼠假手術組(WTSham)及I/R手術組(WTI/R)、Traf5基因敲除小鼠假手術組(KOSham)及I/R手術組(KOI/R)、非轉基因小鼠假手術組(NTGSham)及I/R手術組(NTGI/R)、肝細胞特異性Traf5轉基因小鼠假手術組(TGSham)及I/R手術組(TGI/R)。(2)肝缺血再灌注損傷模型I/R手術(采用無創血管夾夾閉中葉和左葉的門靜脈和肝動脈,使約70%的肝臟缺血)操作流程:1)手術前12h給小鼠禁食,可自由飲水。2)手術前用3%戊巴比妥鈉成功麻醉小鼠后,將其平臥固定肢體,用剃毛器將小鼠腹部術區毛刮凈,用10%碘酒和75%乙醇對術區消毒。3)取腹正中切口進腹,暴露肝臟左、中葉之肝蒂。4)用無創血管夾夾閉中葉和左葉的門靜脈和肝動脈,使約70%的肝臟缺血,以防止發生嚴重腸系膜靜脈淤血。0.5min后,與非阻斷的右葉相比,可見阻斷葉變白,說明阻斷成功。此時,注意記錄缺血開始時間,維持缺血約60分鐘,期間用濕的鹽水紗布覆蓋切口,并注意小鼠的保溫(Sham組的小鼠在阻斷成功即刻去除血管夾,恢復缺血肝血流)。5)缺血60分鐘后去除血管夾,恢復缺血的肝臟血流,然后關閉腹腔,分兩層關腹,先把內層縫好,再縫皮,將手術后的小鼠置于干凈的籠子中單獨飼養,觀察。實施例3肝臟壞死面積及肝功能指標(AST,ALT)的測定肝臟缺血再灌注損傷嚴重程度的評估指標主要包括肝臟壞死面積和肝功能指標(AST,ALT),這些指標均與肝臟缺血再灌注損傷嚴重程度正相關。(1)取材分別于術后1h、3h、6h、24h取假手術組(Sham)以及缺血/再灌注組小鼠,頸椎脫臼處死,立即自下腔靜脈取血1mL,分離血清。同時統一取缺血區肝左葉組織大小約1.5cm×1cm×0.2cm于10%中性福爾馬林中固定24h后脫水,包埋,進行石蠟切片后進行HE染色。分離血清:收集血液的EP管于室溫下靜置1-2h使血液自然凝固。4℃、4000rpm/min離心30min,充分分離血清。用微量移液器分別吸取血清20μL、20μL、30μL、30μL置0.2mL無菌EP管中,對EP管進行標記,隨后保存于-80℃冰箱備用。(2)制備石蠟標本切片1)主要操作程序包括:包埋框處理→流水沖洗→脫水→透明→浸蠟→包埋→切片→攤片→晾干或烘烤后備用。2)用石蠟切片機的標準程序切5μm的石蠟切片備用。(3)HE染色主要步驟為:55℃烘烤30min→二甲苯5min,3次→100%酒精1min→95%酒精1min→70%酒精1min→雙蒸水1min→蘇木素溶液5min→水洗1min→1%鹽酸酒精1-3s→水洗1min→Scott液(碳酸氫鈉0.35g,硫酸鎂2g,蒸餾水100mL)1min→水洗1min→伊紅溶液3-5min→蒸餾水洗去浮色→70%酒精1s→95%酒精1s→100%酒精30s,3次→二甲苯2min,3次→趁二甲苯未干立即封片→通風櫥內吹干,顯微鏡拍照。(4)小鼠血清ALT、AST含量測定1)從-80℃冰箱中取出血清樣本,迅速置于冰上,在室溫下待樣品融化;2)在室溫下,4000轉/分鐘離心1分鐘,讓EP管壁的血清聚集至管底。3)按照操作流程,打開全自動生化分析儀(Sysmex,Chemix180i),清洗加樣器。4)按照全自動生化分析儀樣品盤的標記順序,逐一放入待測的EP管。5)準確安裝試劑檢測盤,開始使用全自動生化分析儀檢測ALT、AST水平。Traf5-KO、WT、Traf5-TG和NTG組在肝臟缺血再灌注損傷后的HE染色結果見圖3:顯微鏡下可見Sham組肝組織基本正常,肝組織結構整齊,無明顯的纖維組織增生。I/R組隨著再灌注的時間的延長,肝組織結構模糊,排列紊亂。其內有大小不等、形狀不規則的壞死灶,壞死灶內肝細胞結構模糊,排列紊亂,離斷,與正常肝臟比較,壞死肝臟的肝小葉內見大片壞死灶,壞死組織邊緣可見炎性反應帶,肝細胞核發生典型的壞死改變,可見核固縮。這種現象在缺血再灌注后24h達到高峰。實驗結果表明,給予Traf5-KO小鼠I/R后的梗死面積明顯大于WT組小鼠(圖3A);同樣Traf5-TG小鼠I/R后的梗死面積明顯小于NTG組小鼠(圖3B),因此,Traf5在肝臟缺血再灌注引起的損傷中起到重要作用。血清中ALT及AST的含量統計結果見圖4。結果表明在I/R組各時間點ALT、AST水平均明顯高于Sham組,在再灌注后6h達到高峰,隨后下降,Traf5-KO小鼠I/R后的ALT、AST水平明顯高于WT組小鼠(圖4A);Traf5-TG小鼠I/R后的ALT、AST水平顯著低于NTG組小鼠(圖4B)。實施例4缺血再灌注后肝細胞凋亡情況測定用TUNEL試劑盒染色檢測凋亡,TUNEL試劑盒:ApopTag?PlusInSituApoptosisFluoresceinDetectionKit(S7111,Chemicon)。具體過程為:1)將石蠟切片置于烤箱中,60℃烤片30分鐘;2)二甲苯,5分鐘×3次;3)100%乙醇,5分鐘×2次;95%乙醇,5分鐘;70%乙醇,5分鐘;4)ddH2O漂洗,5分鐘×2次;5)蛋白酶K37℃孵育15分鐘;6)PBS漂洗5min×2次;7)直接滴加EquilibrationBuffer于組織上(13μL/cm2),室溫孵育至少10s;8)棄去EquilibrationBuffer,滴加TdTEnzyme工作液(77μLReactionBuffer+33μLTdTEnzyme)于組織上(11μL/cm2),置濕盒于37℃孵育1h;9)將切片置于盛有Stop/WashBuffer工作液(1mLStop/WashBuffer+34mLddH2O)的染色缸中振蕩15s后室溫孵育10min(等待過程中,將適當量的Anti-DigoxigeninConjugate吸出,至于EP管中,避光放置在室溫下,使其平衡至室溫);10)PBS漂洗1min×3次;11)輕輕甩去組織多余殘留的液體,將組織周圍液體吸3滴加Anti-DigoxigeninFluorescein工作液(53%BlockingSolution+47%Anti-DigoxigeninConjugate)于組織上(13μL/cm2),置濕盒中室溫避光孵育30min;12)PBS漂洗2min×4次(每次換新的PBS);13)SlowFadeGoldantifadereagentwithDAPI(Invitrogen,S36939)封片;熒光鏡下觀察,拍照。若需保存,于暗濕盒中4℃保存。通過TUNEL試劑盒檢測了各組小鼠I/R術后24小時肝細胞凋亡情況,結果如圖5所示,Traf5-KO小鼠肝細胞凋亡數量明顯比野生型小鼠增加(圖5A),Traf5-TG小鼠肝細胞凋亡數量明顯比非轉基因小鼠減少(圖5B),這表明Traf5與肝細胞缺血再灌注時的細胞凋亡相關。這些結果表明,增加Traf5表達可以抑制肝組織缺血再灌注損傷,且與肝細胞凋亡密切相關。上述成果表明,在肝臟缺血再灌注引起的損傷中,肝細胞特異性Traf5基因敲除小鼠肝臟壞死面積顯著增加,肝功能明顯降低,肝細胞凋亡數量也明顯增多;而肝細胞特異性Traf5轉基因小鼠的肝臟壞死面積明顯減少,肝功能增強,肝細胞凋亡數量明顯減少。證明Traf5基因在肝臟缺血疾病模型中有著重要的保護作用。上述實施例為本發明較佳的實施方式,但本發明的實施方式并不受上述實施例的限制,其他的任何未背離本發明的精神實質與原理下所作的改變、修飾、替代、組合、簡化,均應為等效的置換方式,都包含在本發明的保護范圍之內。SEQUENCELISTING<110>武漢大學<120>TNF受體相關因子5(Traf5)在肝缺血再灌注損傷中的應用<130>1<160>14<170>PatentInversion3.5<210>1<211>28<212>DNA<213>Musmusculus<400>1ggaggctgtagtacagtgtgacggccgg28<210>2<211>28<212>DNA<213>Musmusculus<400>2ggttttaagggttatctagactagaagg28<210>3<211>54<212>DNA<213>ArtificialSequence<220><223>loxp1-F<400>3agcttgacgtcataacttcgtatagcatacattatagcaatttataccggtgat54<210>4<211>50<212>DNA<213>ArtificialSequence<220><223>loxp1-R<400>4atcaccggtataaattgctataatgtatgctatacgaagttatgacgtca50<210>5<211>52<212>DNA<213>ArtificialSequence<220><223>loxp2-F<400>5gatcccttaagataacttcgtatagcatacattatagcaatttatacgcgta52<210>6<211>52<212>DNA<213>ArtificialSequence<220><223>loxp2-R<400>6ctagtacgcgtataaattgctataatgtatgctatacgaagttatcttaagg52<210>7<211>50<212>DNA<213>ArtificialSequence<220><223>Traf5LA-F<400>7tcgagctccagtaagctctaggttctaaaggtgaagaacccggccgacgt50<210>8<211>42<212>DNA<213>ArtificialSequence<220><223>Traf5LA-R<400>8cggccgggttcttcacctttagaacctagagcttactggagc42<210>9<211>31<212>DNA<213>ArtificialSequence<220><223>Traf5M-F<400>9ccggaattcgtcacactgtactacagcctgc31<210>10<211>27<212>DNA<213>ArtificialSequence<220><223>Traf5M-R<400>10cgggatccagaaggtcaacccccacca27<210>11<211>47<212>DNA<213>ArtificialSequence<220><223>Traf5RA-F<400>11cgcgtagtctagataacccttaaaacattgttctgtttaatgacagc47<210>12<211>47<212>DNA<213>ArtificialSequence<220><223>Traf5RA-R<400>12ggccgctgtcattaaacagaacaatgttttaagggttatctagacta47<210>13<211>40<212>DNA<213>ArtificialSequence<220><223>上游引物<400>13agctttgtttaaacgccaccatggctcattcggaggagca40<210>14<211>37<212>DNA<213>ArtificialSequence<220><223>下游引物<400>14ctagctagcctacagatcctccaagtcagttaaatcc37當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1
- 一種阿法替尼有關物質的分離檢測方法與流程
- 用于檢測人血清中HER2含量的ELISA試劑盒、使用方法及用途與流程
- 用于預防或治療皮疹的藥物組合物的制造方法與工藝
- 用于汽車內飾表皮的30ST/R雙面布的制造方法與工藝
- 檢測EGFR耐藥性突變的方法和組合物與制造工藝
- 一種肝素結合表皮生長因子的單域抗體及其應用的制造方法與工藝
- 3?[(3?{[4?(4?嗎啉基甲基)?1H?吡咯?2?基]亞甲基}?2?氧代?2,3?二氫?1H?吲哚?5?基)甲基]?1,3?噻唑烷?2,4?二酮和EGFR TYR激酶抑制劑的組合的制造方法與工藝
- 一種二甲苯磺酸拉帕替尼片劑及其制備方法與制造工藝
- 苯并咪唑衍生物作為ERBB酪氨酸激酶抑制劑用于治療癌癥的制造方法與工藝
- 包含STP和生長因子的活性組合物及其化妝品或護膚品的制造方法與工藝