一種能進行MR?熒光雙模態成像的可降解納米膠束及其制備方法和應用與流程
本發明涉及納米醫學與生物醫學工程領域,具體地,涉及納米膠束技術領域,更具體地,涉及一種能進行MR-熒光雙模態成像的可降解納米膠束及其制備方法和應用。
背景技術:
急性缺血性腦梗塞(Acute Ischemic Stroke,AIS),是由于腦動脈的閉塞導致的腦組織的梗死,不可避免的伴有神經元、星形膠質細胞、少突膠質細胞死亡以及神經通路的破壞。目前,臨床治療上主要通過超早期溶栓、腦神經保護及后期康復鍛煉等措施,雖然部分患者神經功能恢復較好,然而仍有50%~70%的存活者遺留癱瘓、失語等嚴重殘疾。雖然研究證明腦梗死發生后,位于室管膜下區或海馬齒狀回顆粒細胞下層的內源性神經干細胞(neural stem cells,NSCs)可激活、增殖、遷移、分化為新生的神經元,但是由于內源性NSCs數目、自我更新及轉化為神經元的速度緩慢,腦梗塞后大腦的自我修復能力是非常有限的。移植的研究為腦梗死治療開辟了一條新的途徑。多項研究成果已經表明移植NSCs通過分泌神經營養因子或者直接的腦組織細胞替代等作用,能有效地促進神經功能修復作用。干細胞移植后需要對體內的存活、分布、遷徙、增殖及分化進行連續監測,從而評估其療效和安全性,然而如何監測其在宿主體內的情況一直是NSCs移植中的一項關鍵技術難題。
傳統的示蹤方法主要有熒光染料標記、核酸標記、轉基因、染色體等方法,而這些方法均需在體外狀態下進行組織學分析和鑒定,然而對于干細胞移植進入臨床應用還遠遠不夠。干細胞體內示蹤技術是以非侵入性方式在活體內示蹤干細胞的存活、分布和功能等。目前最為常用的分子影像學技術有光學成像、超聲成像、核醫學、磁共振成像(MRI)等,不同的成像技術敏感性、分辨率、組織特異性不同,各成優勢、互相補充。例如熒光成像信號強,可直接探測發出的信號,操作簡單,但其組織分辨率差;MRI因其具有極佳的分辨率(可對深部組織進行精確定位和定量分析)、無創傷、可重復性強等優點,但其對設備及成像條件要求較高。多模態成像綜合2種及以上成像技術,例如光學成像和MRI,聯合各成像技術的優勢,更準確有效地實現干細胞活體示蹤,推動干細胞研究的臨床轉化。
然而,干細胞本身在常用的分子成像技術上均不具有特異性信號,給臨床檢測帶來了相當程度的困難。為了提高干細胞的分辨和對比度,臨床上需要對干細胞進行特異性的造影劑標記,使得干細胞出現特異性信號改變而被識別。高分子聚合物載體因其具有輸送效率高、生物安全性及組織相容性高、細胞毒副作用低,易進行化學修飾、結構穩定性好、具有主動及被動靶向效應等優點,在干細胞示蹤領域顯示出獨特的優勢。盡管已經有多篇關于納米載體用于干細胞多模態示蹤的報道,甚至出現了能對干細胞同時進行MRI、熒光成像和PET三種成像模式的納米載體的報道。然而這些納米載體多數基于二氧化硅或釓劑,生物相容性或可降解性差,對干細胞及人體存在潛在毒性,難以真正運用于臨床;或者僅通過對磁性納米顆粒(SPIO)進行表面修飾后,鏈接熒光分子或放射性核素造影劑,造影劑負載量低,難以實現對干細胞的有效標記;或者通過對干細胞進行基因修飾插入報告基因而到達干細胞光學成像示蹤的目的,而非真正的多模態納米載體,并且報告基因操作復雜。報告基因會導致NSCs內基因產物的蓄積,可能對其增殖、分化等能力產生影響。如何實現安全、有效的干細胞示蹤,仍然是干細胞治療向臨床轉化的重要難題。
技術實現要素:
本發明為了克服現有技術的上述不足,提供一種能自組裝、且能同時負載SPIO和尼羅紅的可降解兩親性嵌段聚合物。
本發明的另一個目的是提供上述兩親性嵌段聚合物的制備方法。
本發明的另一個目的是提供上述兩親性嵌段聚合物在制備能進行MR-光學雙模態成像的納米膠束中的應用。
本發明的另一個目的是提供一種能進行MR-熒光雙模態成像的可降解納米膠束。
本發明的另一個目的是提供一種能進行MR-熒光雙模態成像的可降解納米膠束的制備方法。本發明的另一個目的是提供上述納米膠束在對神經性干細胞進行高效、安全標記中的應用。所述納米膠束能對干細胞進行高效標記,且易水解,水解產物可用于臨床使用,安全無毒副作用。
本發明的另一個目的是提供上述納米膠束在對神經性干細胞進行MR-熒光雙模態成像中的應用。所述納米膠束能負載高敏磁造影劑及熒光染料,就干細胞治療中對其遷移及分布進行有效的、實時的定位監測。
為了實現上述目的,本發明是通過以下技術方案予以實現的:
一種能共同負載SPIO和尼羅紅的兩親性嵌段聚合物,所述聚合物由聚天冬酰二甲基乙二胺親水段和膽酸疏水支鏈段兩嵌段共聚物構成;所述聚天冬酰二甲基乙二胺親水段分子量為900~3600Da,再引入賴氨酸連接2個、4個或8個膽酸。
本發明為了實現體外培養時對NSCs的高效標記,選取帶有正電荷的聚天冬酰二甲基乙二胺為親水段;選取膽酸為疏水段,能夠同時負載疏水性SPIO和尼羅紅,同時使SPIO在細胞內的再聚集,可滿足高靈敏度MR-熒光雙模態造影劑的要求。
本發明為了實現對藥物的可控性負載,可以通過控制聚天冬酰二甲基乙二胺上連接的膽酸數目,實現對有效的提高藥物負載效率。
本發明為了實現體外培養時對NSCs的安全標記,將及易得到且生物安全的改性天冬氨酸聚合物和膽酸通過及易水解的酰胺鍵鏈接,水解產物均對干細胞毒性極小,能夠保留干細胞干性,對人體安全無毒副作用。
如上所述能同時負載SPIO和尼羅紅的兩親性嵌段聚合物的制備方法,由以下方法制備得到:
S1.苯甲醇和L-天冬氨酸合成β-天冬氨酸芐脂;再加入雙(三氯甲基)碳酸酯合成芐氧羰基天冬氨酸酐(BLA-NCA);
S2.由正丁胺引發,芐氧羰基天冬氨酸酐(BLA-NCA)開環聚合成正丁胺-聚芐基天冬氨酸(BA-PBLA);
S3.將雙(叔丁氧羰基)-L-賴氨酸(Boc-Lys(Boc)-OH)對接于正丁胺-聚芐基天冬氨酸(BA-PBLA)氨基末端,合成聚芐基天冬氨酸-雙(叔丁氧羰基)L-賴氨酸(PBLA-Lys-BOC2);用三氟乙酸除去聚芐基天冬氨酸-雙(叔丁氧羰基)L-賴氨酸(PBLA-Lys-BOC2)末端的BOC基團,得到聚芐基天冬氨酸-賴氨酸(PBLA-Lys);
S4.將膽酸對接于聚芐基天冬氨酸-賴氨酸(PBLA-Lys)的氨基端,得到聚芐基天冬氨酸芐脂-賴氨酸-膽酸(PBLA-Lys-CA2);
S5.聚芐基天冬氨酸芐脂-賴氨酸-膽酸(PBLA-Lys-CA2)經無水二甲基甲酰胺(DMA)氨解得到聚天冬酰二甲基乙二胺-賴氨酸-膽酸(PAsp(DMA)-Lys-CA2)。
如上所述的可降解兩親性嵌段聚合物在制備能進行MR-熒光雙模態成像的納米膠束中的應用。
一種能進行MR-熒光雙模態成像的納米膠束,所述納米膠束由如上所述的可降解的兩親性嵌段聚合物自組裝后,將疏水性的SPIO及尼羅紅負載于其疏水內核,得到能夠進行MR-熒光雙模態成像的納米膠束。
本發明所述的可降解的兩親性嵌段聚合物自組裝后能形成一種納米尺寸的正電荷納米膠束,將疏水性的SPIO及尼羅紅負載于其疏水內核,得到同時負載MRI造影劑及熒光造影劑的納米膠束,將這種納米膠束與神經干細胞在體外共同培養,實現了對神經干細胞高效率雙模態標記,同時,由于該兩親性嵌段聚合物易水解,水解產物可用于臨床使用,納米膠束對神經干細胞顯示了極小的細胞毒性,保留干細胞干性,對人體安全無毒副作用。
優選地,所述能進行MR-熒光雙模態成像的納米膠束的具體制備方法為:2mg SPIO、0.2mg尼羅紅和20mg PAsp(DMA)-Lys-CA2同時溶于2mL的DMSO和氯仿混合溶劑中(v:v=1:3)。超聲乳化作用下加入溶有20mL的PBS溶液,乳化均勻后旋蒸除去氯仿,經針筒濾過器(0.45μm)除去大顆粒,Millipore離心過濾裝置((標稱分子量(MW)臨界值:100kDa)超濾除去DMSO和其他親水性雜質,得到同時負載SPIO和尼羅紅的納米膠束。
如上所述的納米膠束在對神經干細胞進行體外標記及體內MR-熒光雙模態示中的應用。
與現有技術相比,本發明具有以下有益效果:
本發明提供了一種多功能納米膠束的制備及應用方法,針對現有神經干細胞體外標記難度大、標記后細胞活力受損嚴重的問題,得到同時負載MRI造影劑及熒光造影劑的納米膠束,將這種納米膠束與神經干細胞在體外共同培養,能夠對干細胞進行高效的SPIO、熒光雙標記,在后續的干細胞體內移植治療中,能實現對干細胞的遷移及分布進行有效的、實時的動態MR-熒光雙模態定位監測。同時,由于該兩親性嵌段聚合物極易水解,水解產物可用于臨床使用,該納米膠束對神經干細胞顯示了極小的細胞毒性,保留了神經細胞干性,對人體安全無毒副作用,有望真正實現納米載體標記神經干細胞從基礎研究向臨床應用的轉化。
附圖說明
圖1為納米膠束的制備示意圖。
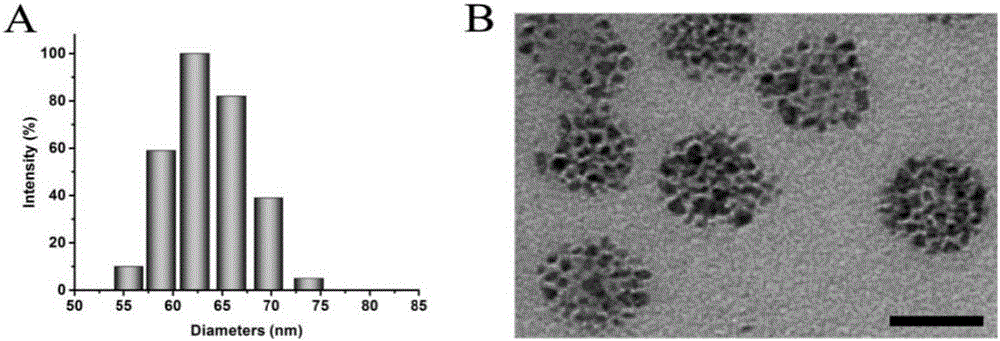
圖2為納米膠束的粒徑、TEM圖。
圖3為納米膠束弛豫率的MRI檢測。
圖4為納米膠束標記神經干細胞的熒光標記檢測:流式細胞計數法。
圖5為納米膠束標記神經干細胞的鐵標記檢測:(A)MRI T2值測量法;(B)普魯士藍鐵染色法。
圖6為納米膠束對神經干細胞細胞的毒性測試:(A)流失細胞儀凋亡檢測法;(B)CCK8法。
具體實施方式
下面結合說明書附圖和具體實施例,進一步闡述本發明。這些實施例僅用于說明本發明而不用于限制本發明的范圍。下例實施例中未注明具體條件的實驗方法,通常按照本領域常規條件或按照制造廠商建議的條件。本領域的技術人員在本發明的基礎上所做的任何非實質性的變化及替換均屬于本發明所要求保護的范圍。
實施例1兩親性嵌段聚合物的合成
(1)芐氧羰基天冬氨酸酐(BLA-NCA)的合成,反應機理及過程如下:
苯甲醇和L-天冬氨酸合成β-天冬氨酸芐脂;再加入雙(三氯甲基)碳酸酯合成芐氧羰基天冬氨酸酐(BLA-NCA)。具體步驟參照文獻1。
(2)正丁胺-聚芐基天冬氨酸(BA-PBLA)的合成,反應機理及過程如下:
由十二醇引發,BLA-NCA開環聚合成正丁胺-聚芐基天冬氨酸(BA-PBLA)。稱取73.14mg的正丁胺(1.0nmol,0.74g/mL)至50mL的反應瓶中,加入30mL的無水CH2Cl2充分溶解。稱取2.49g BLA-NCA(10mmol)溶于20mL無水二甲基甲酰胺后,在氮氣保護下,加入到正丁胺溶液中,在35℃下攪拌反應72h。反應結束后,反應液沉淀在大量無水乙醚中。分離沉淀并用無水乙醇洗滌,真空干燥后得到最終產物BA-PBLA。
(3)聚芐基天冬氨酸-賴氨酸(PBLA-Lys)的合成,反應機理及過程如下:
使用O-苯并三氮唑-四甲基脲六氟磷酸鹽(HBTU)及1-羥基苯并三唑(HOBT)作為偶聯試劑,將雙(叔丁氧羰基)-L-賴氨酸(Boc-Lys(Boc)-OH)耦合至正丁胺-聚芐基天冬氨酸(BA-PBLA)的氨基末端,合成聚芐基天冬氨酸-雙(叔丁氧羰基)L-賴氨酸(PBLA-Lys-BOC2)。稱取雙(叔丁氧羰基)-L-賴氨酸(Boc-Lys(Boc)-OH)(1.5mmol)于干燥的50mL反應瓶中,加入二甲基甲酰胺(DMF)溶解,再加入O-苯并三氮唑-四甲基脲六氟磷酸鹽(HBTU)(1.5mmol)、1-羥基苯并三唑(HOBT)(1.5mmol)及正丁胺-聚芐基天冬氨酸(0.75mmol),很快有白色沉淀產生,室溫攪拌反應24h。反應結束后,將反應液倒入過量無水乙醚中沉淀。分離沉淀并用無水乙醇洗滌,真空干燥后得到產物PBLA-Lys-BOC2。
用三氟乙酸除去PBLA-Lys-BOC2末端的BOC基團,得到PBLA-Lys。稱取PBLA-Lys-BOC2至25mL反應瓶中,加入三氟乙酸(TFA)10mL攪拌溶解,成淡黃色溶液。反應1h后,將反應液倒入過量無水乙醚中沉淀。分離沉淀并用無水乙醇洗滌,真空干燥后得到產物PBLA-Lys。
(4)聚芐基天冬氨酸芐-賴氨酸-膽酸(PBLA-Lys-CA2)合成,反應機理及過程如下:
稱取膽酸(CA)(3mmol)于干燥的50mL反應瓶中,加入N,N-二異丙基乙胺(DIPEA)溶解,再加HBTU(3mmol)、HOBT(3mmol)及PBLA-Lys(1.5mmol),室溫攪拌反應24h。反應結束后,將反應液倒入過量無水乙醚中沉淀。分離沉淀并用無水乙醇洗滌,真空干燥后得到產物PBLA-Lys-CA2。
(5)聚天冬酰二甲基乙二胺-賴氨酸-膽酸(PAsp(DMA)-Lys-CA2)合成,反應機理及過程如下:
PBLA-Lys-CA2經無水二甲基甲酰胺(DMA)氨解得到聚天冬酰二甲基乙二胺-賴氨酸-膽酸(PAsp(DMA)-Lys-CA2)。于50mL反應瓶中用20mL無水二甲基亞砜(DMSO)溶解0.90g PBLA-Lys-CA2(0.3mmol)和2.6g DMA(30mmol,相當于芐基10eq.),在35℃下攪拌反應24h。將反應液逐滴加入100mL并用超聲波分散,用透析袋(14kDa)在無氧水中透析3d,冷凍干燥得到終產物PAsp(DMA)-Lys-CA2。
實施例2兩親性嵌段聚合物的合成
參照實施例1合成兩親性嵌段聚合物,改變正丁胺-聚芐基天冬氨酸(BA-PBLA)的分子量,設計聚合度分別為5和20(實施例1為10),其余反應步驟均與實施例1一致,得到正電嵌段長度不同的嵌段聚合物PAsp(DMA)-Lys-CA2,聚天冬酰二甲基乙二胺(PAsp(DMA))的分子量分別為900Da和3600Da。
實施例3兩親性嵌段聚合物的合成
參照實施例1合成兩親性嵌段聚合物,得到聚芐基天冬氨酸-賴氨酸后(PBLA-Lys),其末端兩個氨基經與雙(叔丁氧羰基)-L-賴氨酸(Boc-Lys(Boc)-OH)耦合、脫保護后,可得到末端帶四個氨基的PBLA-Lys3,PBLA-Lys3再接一次Boc-Lys(Boc)-OH并脫保護可得到末端帶8個氨基的PBLA-Lys7。PBLA-Lys3和PBLA-Lys7按實施例1的方法接度膽酸并氨解,可得到末端接不同數目膽酸的兩親性聚合物,膽酸接枝數目分別是4個和8個。
實施例4納米膠束的制備及表征
取實施例1制備得到的兩親性嵌段聚合物按納米復合物制備方法準備同時負載SPIO和尼羅紅的納米膠束,制備思路如圖1所示。
得到的納米粒子溶液,用測定其水力學直徑及形貌結構,結果如圖2所示。(A)納米膠束粒徑為64.1±1.7nm。(B)電鏡結果表明,納米粒子呈均勻的球形結構。
實施例5納米膠束弛豫率的MRI檢測
將實施例4制備的PAsp(DMA)-CA2納米膠束于96孔板內按濃度梯度逐級稀釋,進行MRI(Philips Inter,3.0T)體外測試。MRI掃描參數如下:單次激發多次采集的自旋回波序列:重復時間(TR)/回波時間(TE)=2000/20-80ms,4次梯度回波采集,采集次數(NSA)=1,采集矩陣=160×266,視野(FOV)=80×80mm2,層厚=2mm。獲取T2的弛豫時間。以鐵濃度(mM)為橫坐標,T的倒數(r2)為縱坐標,采用線性最小二乘回歸分析,直線斜率即為T2的弛豫度。圖3結果顯示,負載于納米膠束內的SPIO由于團簇效應,具有很高的T2弛豫率,能夠實現對干細胞的有效標記。
實施例6納米膠束標記神經干細胞的熒光標記檢測
將實施例4制備的納米膠束在鐵濃度為10μg/mL的情況下標記神經干細胞4小時后,流式細胞儀、熒光顯微鏡納米膠束對神經干細胞的熒光標記情況。圖4結果顯示:流式細胞儀示神經干細胞被載有熒光染料尼羅紅的納米膠束高效標記,標記高達97.55%。
實施例7納米膠束對神經干細胞的鐵標記檢測
將實施例4制備的納米膠束在鐵濃度為10μg/mL的情況下標記神經干細胞4小時后,收集細胞PBS洗滌三次后重懸細胞于200μL 1%瓊脂糖凝膠中(細胞密度為2.5×106/mL),MRI、普魯士藍檢測納米膠束對神經干細胞的SPIO標記情況,MRI參數同實施例5。圖5結果顯示:(A)MR示標記后細胞的T2值為35.70±8.95,明顯低于對照組;(B)普魯士藍染色示標記后神經干細胞胞質內有較多藍染鐵顆粒。滿足后續活體MR示蹤的條件。
實施例8納米膠束的細胞毒性檢測
采用CCK8法檢測實施例4制備的納米膠束與NSCs孵育后細胞的存活率,用流式細胞計數儀定量檢測了孵育后NSCs的凋亡情況,綜合評價納米膠束對細胞的毒性,結果如圖6所示,納米膠束顯示了極小的細胞毒性,對人體安全無毒副作用,有望真正實現囊米載體標記神經干細胞從基礎研究向臨床應用的轉化。
- 還沒有人留言評論。精彩留言會獲得點贊!