一種雙適配體修飾的介孔二氧化硅靶向載藥納米粒的制作方法
本發明屬于生物醫藥技術領域,具體涉及一種雙適配體修飾的介孔二氧化硅靶向載藥納米粒及其制備和應用。
背景技術:
癌癥是當今威脅人類健康的主要原因之一,而且至今難以治愈。90%以上的癌癥病人死于腫瘤轉移。腫瘤轉移被認為是因腫瘤細胞由原位瘤脫落,經過血液循環到達新的位點而形成新的轉移病灶。因此,研發針對腫瘤轉移的靶向納米載體能夠有效抑制腫瘤轉移,從而減少癌癥死亡人數。
血液中的循環腫瘤細胞(Circulating Tumor Cells,CTCs)表面具有許多特異性蛋白,如EpCAM、CD44、HER2等,而這些蛋白在正常細胞中不表達或者表達量很低。因此,通過特異性識別這些細胞,利用納米載體靶向給藥抑制其活性,可使CTCs失去轉移能力。另一方面,由于CTCs表面的各種特異性抗原的表達量會受病人體內環境影響而產生變化,因此,納米粒表面的靶向基團若能特異性靶向兩個或多個受體將大大提高納米載體的靶向識別能力。但目前大多數靶向給藥的納米載體都是利用單一抗體或適配體,如(Liu J, Wei T, Zhao J, Huang Y, et al. Multifunctional aptamer-based nanoparticles for targeted drug delivery to circumvent cancer resistance. J. Biomaterials. 2016. 91: 44-56.),其識別位點單一,特異性并不高。另有采取雙抗體修飾納米粒的研究(Jingjing Xie, Yusheng Lu, Haiyan Dong, et al. Enhanced Specificity in Capturing and Restraining Circulating Tumor Cells with Dual Antibody–Dendrimer Conjugates. Advanced Functional Materials. 2015, 25 (8): 1304-1313.),但由于抗體體積較大,納米載體表面修飾的抗體數量有限,所以特異性識別能力也有限。
核酸適配體是一種能識別特異性抗原的DNA或RNA序列,與傳統抗體相比,它具有體積小、穩定、生物相容性高、合成簡便等優點。在作為靶向基團,核酸適配體由于體積較小,產生的位阻會很少,從而加大了和靶點的結合能力。
介孔二氧化硅納米粒(MSN)是一種廣泛用于疾病的診斷和治療的納米材料。它獨特的介孔結構、可變的粒徑、良好的生物相容性和穩定的化學特性,讓MSN成為一種理想的納米載體。
阿霉素(DOX)是一種周期非特異性廣譜抗腫瘤藥物,對各種周期的腫瘤細胞都有殺傷作用,其作用機理是嵌入目標細胞的DNA中,從而抑制DNA的復制和RNA的合成。
基于以上背景,本發明設計了一種基于MSN的靶向載藥納米粒,其通過裝載化療藥物DOX后,再在MSN表面修飾一種或多種核酸適配體,使其具有高效地識別靶細胞的能力,可用于預防腫瘤轉移,目前尚未有此類報道。
技術實現要素:
本發明針對現有靶向給藥載體特異性差等不足,提供了一雙適配體修飾的介孔二氧化硅靶向載藥納米粒,其能夠利用兩種適配體的特異性識別能力,協同增加介孔二氧化硅納米粒對靶細胞的識別能力,從而達到準確給藥的目的。
為實現上述目的,本發明采用如下技術方案:
一種雙適配體修飾的介孔二氧化硅靶向載藥納米粒,其是由介孔二氧化硅納米粒、包載在介孔二氧化硅納米粒孔道內部的抗癌藥物及修飾在介孔二氧化硅納米粒表面的能識別癌細胞表面特異性蛋白的兩種核酸適配體構成。
其中,所述介孔二氧化硅納米粒的粒徑為100-500 nm。
所述抗癌藥物為DOX,其裝載量為20wt%-80wt%。
兩種核酸適配體的連接量均為10-1000 pmol/mg。
所述雙適配體修飾的介孔二氧化硅靶向載藥納米粒的制備方法,是將介孔二氧化硅納米粒MSN經表面修飾后,將能特異性識別癌細胞表面EpCAM和CD44的兩種核酸適配體E-AP、C-AP連接到介孔二氧化硅納米粒表面,再用其裝載抗癌藥物DOX,制得所述雙適配體修飾的介孔二氧化硅靶向載藥納米粒;其包括以下步驟:
1)將十六烷基三甲基氯化銨與三乙醇胺、四乙基硅烷混合攪拌,得到羥基修飾的納米粒MSN-OH;
2)利用3-氨丙基三乙氧基硅烷對所得MSN-OH進行修飾,得到氨基修飾的納米粒MSN-NH2;
3)在1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽(EDC)/N-羥基琥珀酰亞胺(NHS)的作用下,將所得MSN-NH2與靶向EpCAM的核酸適配體E-AP、靶向CD44的核酸適配體C-AP進行共價連接,得到雙適配體修飾的納米粒EC-MSN;
4)在磷酸緩沖液中,將所得EC-MSN與DOX混合進行裝載,得到靶向載藥納米粒EC-MSN-D。
所述雙適配體修飾的介孔二氧化硅靶向載藥納米粒在用于制備預防和治療腫瘤轉移藥物上的應用。
本發明靶向載藥納米粒由介孔二氧化硅納米粒、包載在介孔二氧化硅納米粒孔道內部的抗癌藥物及修飾在介孔二氧化硅納米粒表面的能特異性識別癌細胞表面特異性蛋白的兩種核酸適配體構成。其中,以介孔二氧化硅納米粒作為藥物載體,對廣譜抗腫瘤藥物進行裝載,在達到運載藥物目的的同時,對各周期的腫瘤細胞均有殺傷作用;以兩種核酸適配體作為靶向基團修飾載藥后的介孔二氧化硅納米粒,使其具有靶向目標細胞的能力,從而實現靶向給藥,抑制CTCs活性,最終達到抑制腫瘤細胞轉移的目的。
本發明的效益在于:
(1)本發明以介孔二氧化硅納米粒作為藥物載體,通過控制納米粒的粒徑,能很好控制抗癌藥物的裝載量和釋放量;以多種核酸適配體做為靶向基團,能夠有效作用于血液中的CTCs,達到抑制腫瘤轉移的效果。
(2)針對不同的靶細胞和細胞表面的特異性抗原,本發明所用到的核酸適配體的種類和數量可以根據需求改變,即可用于兩種以上核酸適配體的修飾。因此,本發明能適用于預防和治療多種癌癥的轉移。
附圖說明
圖1為所合成MSN-NH2的TEM圖。
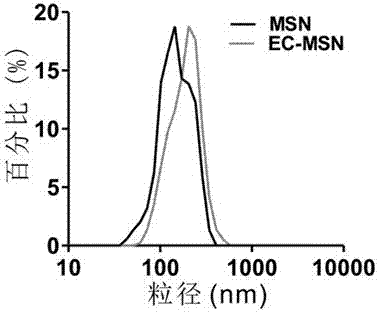
圖2為MSN與適配體連接后的MSN的粒徑分布。
圖3為不同納米粒對DOX的裝載特性曲線。
圖4為不同納米粒在pH=5.5和pH=7.4條件下的釋放特性曲線。
圖5為SW620細胞對MSN-D、E-MSN-D、C-MSN-D、EC-MSN-D和游離藥物Free DOX的攝取量化圖。
圖6為HT29細胞對MSN-D、E-MSN-D、C-MSN-D、EC-MSN-D和游離藥物Free DOX的攝取量化圖。
圖7為不同納米粒對SW620細胞粘附HUVECs的抑制作用情況圖(A)及其抑制率(B)。
圖8為不同納米粒處理后裸鼠腫瘤轉移肺組織的情況圖(A)及肺組織上轉移位點個數(B)。
具體實施方式
為了使本發明所述的內容更加便于理解,下面結合具體實施方式對本發明所述的技術方案做進一步的說明,但是本發明不僅限于此。
所用核酸適配體E-AP及C-AP的具體序列分別參見文獻Y.L. Song, Z. Zhu, Y. An, W.T. Zhang, H.M. Zhang, D. Liu, et al., Selection of DNA Aptamers against Epithelial Cell Adhesion Molecule for Cancer Cell Imaging and Circulating Tumor Cell Capture, Anal Chem 85 (8) (2013) 4141-4149;K. Sefah, K.M. Bae, J.A. Phillips, D.W. Siemann, Z. Su, S. McClellan, et al., Cell-based selection provides novel molecular probes for cancer stem cells, Int J Cancer 132 (11) (2013) 2578-2588。
實施例1
取2.0 g十六烷基三甲基氯化銨(CTAC)與0.1 g的三乙醇胺(TEA),溶于20 mL超純水中,95℃油浴中恒溫攪拌1 h,之后逐滴加入1.5 mL的四乙基硅烷(TEOS),繼續在95℃油浴中恒溫攪拌1 h;停止加熱,待反應液冷卻到室溫后,15000 rpm下離心10 min,移除上清,所得沉淀用無水乙醇洗滌3次,以除去反應殘留,然后將洗滌后的固體物質加入到20 mL氯化鈉-甲醇溶液中(每100 mL甲醇中含1 g氯化鈉),室溫攪拌4 h以去除CTAC,再將所得的固體物質冷凍干燥,得的白色固體MSN-OH。
實施例2
將100 mg所得MSN-OH與2.5 mL 3-氨丙基三乙氧基硅烷(APTES)溶于20 mL無水乙醇中,常溫下攪拌12h,然后將樣品液在15000 rpm下離心10 min,移除上清,所得沉淀分別用無水乙醇與超純水洗滌3次以除去反應殘留,再將所得的固體物質冷凍干燥后即得到MSN-NH2。所得MSN-NH2的TEM圖如圖1。
實施例3
將7 nmol羧基修飾的E-AP和(或)C-AP與8 mg的EDC、8 mg的NHS加入到5 mL的超純水中,攪拌15 min后加入10 mg MSN-NH2,再繼續攪拌12 h;然后將反應混合液在15000 rpm下離心10 min,移除上清,干燥,分別得E-MSN、C-MSN與EC-MSN。
所得MSN-NH2與EC-MSN的粒徑分布對比圖如圖2。
實施例4
于避光條件下將DOX溶于PBS中,制得濃度為0.5 mg/mL的藥液;然后稱取MSN-NH2、E-MSN、C-MSN、EC-MSN各5 mg,分別加入到配制的藥液中,避光攪拌24h,得MSN-D、E-MSN-D、C-MSN-D與EC-MSN-D;此過程中于不同時間點取樣品,15000 rpm離心10 min后取上清測定DOX含量,并繪制DOX裝載的特性曲線,如圖3。
實施例5
稱取MSN-D、E-MSN-D、C-MSN-D與EC-MSN-D各5 mg,將其分別分散于5 mL pH=5.5與pH=7.4的緩沖液中,避光攪拌,在不同時間點取樣品,15000 rpm下離心10 min,測定上清液中DOX的含量,并繪制DOX釋放的特性曲線,如圖4。
由圖4可見,在pH=5.5的緩沖液中DOX的釋放更高,可達到45%。這種釋放特性有利于藥物在細胞中的釋放,而減少在血液中的釋放,有利于減少副反應。
實施例6
將SW620細胞與HT29細胞消化后鋪到24孔板上,待細胞貼壁后移除培養基,分別與5μg/mL的MSN-D、E-MSN-D、C-MSN-D與EC-MSN-D在37 ℃下孵育2 h,然后用預冷的PBS洗滌2遍,消化后進行流式分析,其結果如圖5、6所示。
由圖5、6可見,EC-MSN-D與靶細胞SW620及HT29的識別能力均高于其他納米粒子,且對SW620細胞的識別能力顯著。
實施例7
將人臍靜脈內皮細胞(HUVECs)鋪到24孔板中,用刺激因子IL-1β刺激細胞蛋白表達;待HUVECs長滿后,用胰蛋白酶消化結腸癌細胞SW620,用預冷的PBS洗滌兩遍,再用羅丹明123在避光條件下染色20 min,染色結束后,再用PBS洗滌兩遍。將細胞計數后,調整細胞數為3×106個,并分別加入濃度為5μg/mL的MSN-D、E-MSN-D、C-MSN-D與EC-MSN-D,然后將24孔板置于37 ℃下孵育1 h;孵育完成后,吸去上清液,并用PBS洗去未粘附的SW620細胞。用熒光顯微鏡觀察粘附到HUVECs上的SW620細胞,每個樣品挑選10個視野,并計算其粘附率,結果如圖7所示。
實施例8
將實驗用裸鼠隨機分為6個小組,每組4只;將SW620細胞消化后懸浮于生理鹽水中,每只裸鼠通過尾靜脈注射200 μL含1.5×106個SW620細胞的生理鹽水;10 min后,各組裸鼠再分別尾靜脈注射200 μL生理鹽水、MSN-D、E-MSN-D、C-MSN-D、EC-MSN-D和Free DOX。注射后繼續飼養15天,每3天稱一次裸鼠體重;15天后處死所有裸鼠,解剖并取出肺組織,布氏液處理,并計算轉移位點個數,結果如圖8所示。
由圖8可見,EC-MSN-D對裸鼠腫瘤轉移肺組織的抑制效果最顯著。
以上所述僅為本發明的較佳實施例,凡依本發明申請專利范圍所做的均等變化與修飾,皆應屬本發明的涵蓋范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 靶向腦膠質瘤的雙重修飾脂質體給藥系統的制備和應用的制作方法與工藝
- 一種基于強電荷修飾的靶向基團作為藥物包覆劑的設計方法與流程
- 用于靶向遺傳修飾的方法和組合物,以及這些組合物的使用方法與流程
- DUOX2修飾的DC疫苗及其靶向殺傷胰腺癌起始細胞的應用的制造方法與工藝
- 用于豬APN基因編輯的靶向sgRNA、修飾載體及其制備方法和應用與流程
- 腦部引經藥修飾的腦靶向納米給藥系統及其制備方法與流程
- 腫瘤抑制基因的雜合修飾和1型神經纖維瘤病的豬模型的制造方法與工藝
- 修飾的人類U1snRNA分子、編碼修飾的人類U1snRNA分子的基因、包括該基因的表達載體及其在基因治療中的用途的制造方法與工藝
- 用于通過單步多重靶向進行靶向遺傳修飾的方法和組合物與流程
- 導致單性結實坐果的經修飾的基因的制造方法與工藝
- 介孔碳?二氧化硅復合體負載納米鈀催化劑及其合成方法與流程
- 一種雙適配體修飾的介孔二氧化硅靶向載藥納米粒的制作方法與工藝
- 一種中空核殼式磁性介孔氮化碳及其制備方法與流程
- 功能化中空介孔二氧化硅納米微球及其制備方法與在吸附重金屬離子中的應用與流程
- 一種介孔二氧化硅微球的淀粉復合止血敷料的制作方法與工藝
- 介孔二氧化硅負載的高分散鎳鑭氧化物催化劑的制備方法與流程
- 氨基化介孔二氧化硅?葡萄糖?二氧化錳納米復合材料及其制備方法和應用與流程
- 苯硼酸修飾的介孔二氧化硅/胰島素納米粒的制備及應用的制作方法與工藝
- 一種基于介孔納米二氧化硅的電致化學發光納米材料及其制備方法與流程
- 一種具有高效凝血功能的介孔二氧化硅顆粒的高效制備方法與流程
- 大孔徑介孔碳/二氧化硅負載金納米催化劑及其合成方法與流程
- 介孔碳?二氧化硅復合體負載納米鈀催化劑及其合成方法與流程
- 一種雙適配體修飾的介孔二氧化硅靶向載藥納米粒的制作方法與工藝
- 功能化中空介孔二氧化硅納米微球及其制備方法與在吸附重金屬離子中的應用與流程
- 一種原位制備納米二氧化硅/端羥基聚二甲基硅氧烷雜化材料的方法與流程
- 一種介孔二氧化硅微球的淀粉復合止血敷料的制作方法與工藝
- 介孔二氧化硅負載的高分散鎳鑭氧化物催化劑的制備方法與流程
- 氨基化介孔二氧化硅?葡萄糖?二氧化錳納米復合材料及其制備方法和應用與流程
- 苯硼酸修飾的介孔二氧化硅/胰島素納米粒的制備及應用的制作方法與工藝
- 一種基于介孔納米二氧化硅的電致化學發光納米材料及其制備方法與流程
- 一種雙適配體修飾的介孔二氧化硅靶向載藥納米粒的制作方法與工藝
- 功能化中空介孔二氧化硅納米微球及其制備方法與在吸附重金屬離子中的應用與流程
- 一種介孔二氧化硅微球的淀粉復合止血敷料的制作方法與工藝
- 介孔二氧化硅負載的高分散鎳鑭氧化物催化劑的制備方法與流程
- 氨基化介孔二氧化硅?葡萄糖?二氧化錳納米復合材料及其制備方法和應用與流程
- 苯硼酸修飾的介孔二氧化硅/胰島素納米粒的制備及應用的制作方法與工藝
- 一種基于介孔納米二氧化硅的電致化學發光納米材料及其制備方法與流程
- 一種具有高效凝血功能的介孔二氧化硅顆粒的高效制備方法與流程
- 一種毛刷狀介孔二氧化硅纖維材料及其制備方法與流程
- 一種介孔二氧化硅包覆磁性多壁碳納米管復合材料及其制備方法與流程