外周血單核細胞活化抑制劑在制備治療急性肝衰竭的藥物中的用途的制作方法
本發明屬于醫學領域,具體涉及外周血單核細胞活化抑制劑在制備治療急性肝衰竭的藥物中的用途。
背景技術:
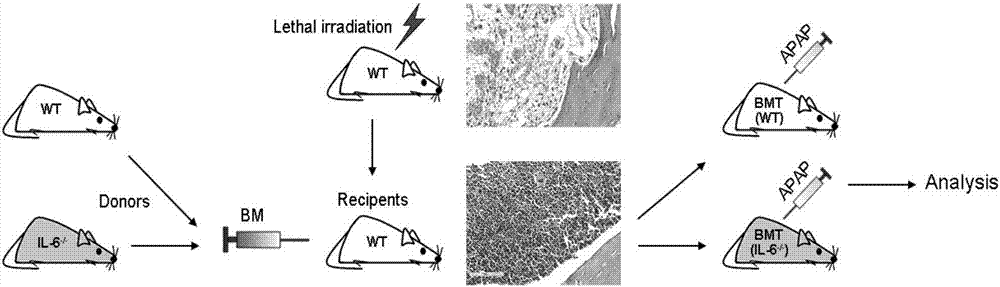
:急性肝衰竭(acuteliverfailure,alf)發病急驟,死亡率高,危害極大。在發達國家,alf發病率不到百萬分之十,但在包括中國在內的發展中國家,盡管缺乏準確數據,但alf發病率顯然高出許多。2013年bernalw等在《新英格蘭醫學雜志》發表綜述,沿用了1970年提出的alf定義:無基礎肝臟疾病的嚴重的、具有潛在可逆性的肝臟損傷,在出現首發癥狀后8周內發生肝性腦病。根據首發癥狀與肝性腦病之間的間隔,又可分為超急性、急性、亞急性,等等。之后世界各大肝病研究機構相繼發布了多個alf診療指南,并對alf的定義進行相應的修訂。我國肝病學家在2012年《肝衰竭診治指南》中提出將2周內出現以ⅱ期以上肝性腦病為特征者定義為alf。我國alf病因與西方國家差異顯著。國外的alf定義強調本次發病為“孤立”的,突發的,此前并沒有肝臟基礎疾病,以藥物性肝損傷為主。而我國alf的常見原因仍然是病毒性肝炎或合并有肝炎。事實上,隨著人群中hbv攜帶率的下降,我國alf病因也在發生著深刻變化。解放軍302醫院肝衰竭診療與研究中心從7家三級醫院納入177例alf患者進行研究,在病因中,藥物毒性占43.5%,僅11.3%的alf由急性病毒性肝炎所致(大部分為hbv感染,其余包括hev、hav、cmv和ebv感染等)。據該報告,我國alf的主要原因已不再是急性病毒性肝炎,而是與發達國家類似,以藥物性肝損傷為主。急診肝移植是alf有效治療手段,常規內科治療死亡率極高。在上述研究中,所有納入病例均未接受肝移植,死亡率高達63.82%。受限于供肝的極度短缺,我國每年肝移植適應癥患者如愿獲得供肝的比例不到1%。alf治療策略主要包括去除病因、促進肝再生、肝功能支持、抗炎癥反應以及對癥支持等,但效果均不甚滿意。組織工程肝、生物人工肝和肝細胞移植可能對alf有效,但技術尚欠成熟、缺乏足夠臨床病例積累和循證醫學證據,尤其是缺乏大樣本隨機臨床對照試驗,仍然難以作為常規治療手段,alf的治療依然是世界性的難題。技術實現要素:為了解決上述問題,本發明提供了一種新的治療和/或預防急性肝衰竭的藥物。外周血單核細胞活化抑制劑在制備治療和/或預防急性肝衰竭的藥物中的用途。其中,所述外周血單核細胞活化抑制劑是抑制外周血單核細胞的il-6表達水平和/或ccr2表達水平的物質。外周血單核細胞:是血液中一群體積最大的白細胞,來源于骨髓,是脊椎動物先天性免疫系統重要組成部分,也參與適應性免疫功能,能分化為成熟的巨噬細胞或髓系樹突狀細胞。優選地,所述抑制劑是臍帶間充質干細胞。優選地,所述抑制劑是il-6基因敲除型單核細胞。優選地,所述抑制劑是il-6基因沉默劑。本發明還提供了一種治療和/或預防急性肝衰竭的藥物,它是以外周血單核細胞活化抑制劑為活性物質,加上藥學上可接受的輔料或者輔助性成分制備而成的制劑。其中,所述外周血單核細胞活化抑制劑是抑制外周血單核細胞的il-6表達水平和/或ccr2表達水平的物質。其中,所述抑制劑是臍帶間充質干細胞、il-6基因敲除型單核細胞或者il-6基因沉默劑。其中,所述制劑為注射制劑。本發明還提供了藥物在制備治療治療和/或預防急性肝衰竭的藥物中的用途。本發明實驗證實了抑制單核細胞的活化能夠有效治療和預防急性肝損傷,臍帶間充質干細胞驗證了抑制單核細胞的活化的確能夠有效治療和預防急性肝損傷,說明單核細胞活化抑制劑可以有效治療和預防急性肝損傷,可以作為治療和預防急性肝損傷的藥物使用,其中,單核細胞活化抑制劑可以是il-6基因敲除型單核細胞,也可以是臍帶間充質干細胞,還可以是其他抑制單核細胞活化的物質,如il-6基因沉默劑。本發明為臨床治療急性肝損傷提供了一種新的選擇,應用前景優良。顯然,根據本發明的上述內容,按照本領域的普通技術知識和慣用手段,在不脫離本發明上述基本技術思想前提下,還可以做出其它多種形式的修改、替換或變更。以下通過實施例形式的具體實施方式,對本發明的上述內容再作進一步的詳細說明。但不應將此理解為本發明上述主題的范圍僅限于以下的實例。凡基于本發明上述內容所實現的技術均屬于本發明的范圍。附圖說明圖1小鼠尾組織pcr基因型鑒定結果圖2小鼠骨髓移植實驗流程圖。圖3wt小鼠x射線全身輻照后骨組織清髓he染色(左為正常骨髓,右為清髓后)。×400圖4股骨組織he染色鑒定骨髓重建。左:wt小鼠來源全骨髓移植重建1月后股骨he染色;右:il-6-/-小鼠來源全骨髓移植重建1月后股骨he染色。×400圖5apap誘導肝損傷后肝臟he染色,顯示bmt(il-6-/-)組小鼠肝損傷更為輕微,其修復也更迅速。×400圖6apap誘導肝損傷后肝功生化指標檢測。*p<0.05圖7luminex液相芯片檢測兩組小鼠肝損傷后血清炎性細胞因子表達水平。*p<0.05圖8fcm檢測兩組小鼠外周血單核細胞cd11b/ccr2的表達。***p<0.001圖9外周血細胞因子的表達變化。*p<0.05,&p<0.01,$p<0.001圖10毒素給予后一天動物外周血scd163表達水平。***p<0.001圖11huc-mscs抑制c-mos向肝臟遷移。(a)毒素誘導猴alf后各時間點肝臟內kcs(cd68+)和招募的c-mos(mac387+)。scalebars=50μm。(b-c)定量統計肝小葉周圍cd68+和mac387+兩種巨噬細胞在各時間點的陽性數目,計數方法為每10個不同400倍視野(樣品至少來自3只猴)進行計數并取其平均值。*p<0.05,**p<0.01,***p<0.001。圖12免疫熒光雙染檢測肝內kcs增殖情況(圖中未見增殖的kcs,而ki67陽性的細胞為增殖的肝細胞)圖13fcm檢測動物外周血cd14+cd16+ccr2+單核細胞。***p<0.001圖14外周血cd14+cd16+ccr2單核細胞il-6mrna水平。***p<0.001圖15alf猴第3天時肝臟cd45+炎癥細胞浸潤情況。圖16預防性干細胞輸入組實驗流程圖。圖17預防性給予huc-mscs顯著抑制肝細胞損傷及巨噬細胞活化。***p<0.001圖18健康組與預防組動物外周血清scd163水平。圖19fcm分析外周血cd14+cd16+ccr2+細胞和定量pcr檢測il-6的mrna表達。圖20fcm檢測預防組白細胞群和treg細胞亞群數量的變化。圖21預防組第2天和第5天外周循環中細胞因子水平。**p<0.01,***p<0.001具體實施方式主要縮寫詞表:實施例1抑制外周血單核細胞活化與急性肝衰竭的關系一、基因敲除的單核細胞顯著改善急性肝損傷(一)材料1實驗動物c57bl/6jil-6-/-kopf(il-6-/-)小鼠由四川大學華西醫院余希杰教授惠贈。小鼠分籠飼養于spf級動物房,每天12h光照,自由飲水和進食。由四川大學華西醫院實驗動物中心(持一級動物飼養合格證)按照“四川省醫學類實驗動物飼養和管理條例”及“實驗動物管理條例”進行喂養和處理。敲除il-6基因可以抑制單核細胞的活化,并且骨髓細胞中,只有單核細胞會表達il-6,通過骨髓移植il-6-/-敲除小鼠的骨髓的方式可以有效考察單核細胞活化與疾病之間的關系。2主要實驗試劑1)小鼠基因型鑒定相關試劑:pcr試劑、瓊脂糖、電泳緩沖液、核酸染料等2)全骨髓獲取和移植相關試劑:75%乙醇,rpmi-1640培養基,紅細胞裂解液,3%臺盼藍等3)apap:n-乙酰對氨基酚(sigma,美國)4)組織固定、包埋及病理學染色相關試劑:甲醛、乙醇、二甲苯、石蠟、蘇木素染液、伊紅染液、濃鹽酸(科隆試劑,成都)、油紅o染料5)cd11b,ccr2流式抗體(bd,美國)3主要儀器1)x射線輻照儀x-rad320:(pxi,美國)2)骨髓分選相關手術器械3)電泳系統:bio-rad4)pcr儀:(ptc-200peltierthermalcycler,mjresearch)5)凝膠成像系統(mqx200,biotek,美國)6)luminex200(millipore,美國)7)流式細胞儀fc500(二)方法1基因型鑒定il-6基因敲除小鼠由遺傳背景為c57bl/6的野生型小鼠將新霉素抗性基因插入il-6基因的第二外顯子誘導il-6基因突變產生,得到特異性il-6-/-敲除小鼠(詳細制備方法如lingxiangkong,deletionofinterleukin-6inmonocytes/macrophagessuppressestheinitiationofhepatocellularcarcinomainmice,kongetal.journalofexperimental&clinicalcancerresearch(2016)35:131doi10.1186/s13046-016-0412-1所示)。通過pcr檢測鼠尾樣品,確定小鼠的基因型。il-6小鼠基因型鑒定方法:1)剪取出生2-4周齡小鼠尾巴于ep管中(1-2cm)。2)加入75μlbuffera堿溶液,100℃沸水煮40-45min。3)加入225μlbufferb酸溶液中和buffera,得到小鼠基因組dna模板溶液。4)按照表1配置反應體系,總體積20μl。引物序列如表2所示。基因分型buffera(ph≈12.0):100μl的0.5medta(ph8.0)、625μl的10mol/l雙蒸水定容至250ml。基因分型bufferb(ph=3.0):濃度為40mm的trisbase,濃鹽酸調ph值至3.0。表1.基因分型pcr反應體系(20μl)根據以下條件進行pcr反應:表2.基因分型pcr引物配置3%瓊脂糖凝膠,配制100mltae:瓊脂糖粉(agrose)2g,加入三角燒瓶的tae溶液混勻,微波爐加熱煮沸至完全溶解;加入8μlgoldviewdna染料輕輕混勻,溶液室溫冷卻后倒入電泳槽中,放入梳子,待膠冷卻凝固;電泳時,加8μl反轉錄產物樣品,130v電壓下電泳25min;電泳結束后,取出,凝膠成像系統紫外光下觀察及采集圖像。2骨髓移植(bonemarrowtransplantation,bmt)1)骨髓移植受體為c57bl/6野生型(wt),小鼠x射線輻照清髓處理:spf級,8-12周成年鼠;致死劑量輻照清髓:小鼠在輻照清除骨髓前一周,即開始飲用添加抗生素(慶大霉素320000u/l和紅霉素250mg/l)的酸化水,全身輻照總劑量為8.0gy,劑量率為0.5gy/min;2)全骨髓細胞制備:il-6-/-或wt小鼠頸椎脫位處死后,置于75%的乙醇中浸泡10min,超凈臺無菌條件下剝離股骨和脛骨;將所取骨頭轉移至預先加入rpmi-1640培養基的研缽內,冰上輕輕研磨數分鐘后,200μm濾器過濾,離心1000rpm/10min;去上清,加入紅細胞裂解液,裂解10min,離心1500rpm/10min;去上清,加入1mlrpmi-1640重懸細胞,洗滌,臺盼藍鑒定活性不小于95%,計數,調整骨髓細胞濃度2×107/ml(該骨髓細胞中的單核細胞為il-6基因敲除型單核細胞),備用;3)骨髓移植(bmt):將分離所得的il-6-/-或wt全骨髓細胞以2×107/只,經尾靜脈移植入受體wt小鼠體內。3apap誘導建立小鼠急性肝損傷(ali)模型骨髓移植存活一個月后的小鼠用來誘導肝損傷模型。小鼠分組情況:野生型骨髓重建組和il-6-/-基因缺陷小鼠骨髓重建組,每組分別6只。所有小鼠均禁食不禁飲水12h后,腹腔注射300mg/kg的apap溶液,注射apap后恢復自由進食和飲水。4he染色預計時間點獲取小鼠肝臟行he常規染色,染色步驟同前。骨組織he染色中涉及的脫鈣方法和步驟:(1)10%中性福爾馬林固定骨股組織4-5天,流水沖洗標本20min;(2)使用10%edta脫鈣液進行脫鈣處理后常規he染色。5小鼠肝功能檢測采用乙醚吸入麻醉小鼠后,眼球取血至ep管中,離心1200rpm/10min,取上清送檢肝功檢測,包括:alt,ast和tbil。6小鼠血清細胞因子檢測方法簡述如下:提前20min從冰箱中取出試劑盒及凍存的樣本,以平衡室溫。在板上的每個孔中加入200ul的洗滌液。封板,室溫(20-25℃),放在振蕩器上10min清洗。倒掉洗滌液,把板反過來在可吸附的紙上輕叩幾次以去掉殘余物質。在適當的孔中加每種標準品和質控品,用分析緩沖液作為(本底)。在背景孔和所有標本孔中加入25ul分析緩沖液。在本底、標準品和質控品中加入25ul基體溶液。加入25ul標本到適當孔中。渦旋混合瓶,每個孔中加入25ul混合的珠子,在加珠子過程中間歇的搖動裝珠子的瓶子,避免沉淀。用封板膜封板,在板的外面上鋁箔,放在振蕩器上室溫(20-25攝氏度)振蕩孵育2h或者4℃孵育過夜。輕輕地去掉板里的內容物,洗板兩次。在每個孔中加入25ul檢測抗體。封板,包上鋁箔,在振蕩器上室溫振蕩孵育1h。在每個含有25ul檢測抗體的孔中加入25ul鏈霉親和素-藻紅蛋白。封板,包上鋁箔,在振蕩器上室溫振蕩孵育30min。輕輕地去掉板里的內容物,洗板兩次。在所有孔中加入150ul鞘液。在振蕩器上重懸珠子15min。將板放在flexmap上用xponent運行。保存并使用樣條曲線擬合法分析中間熒光強度數據,計算標本中細胞因子的濃度。7小鼠外周血單核細胞ccr2表達小鼠眼球取血(體積約為200μl)至肝素鈉洗滌過的ep管,與肝素鈉混勻后,直接加入cd11b,ccr2流式檢測抗體,室溫孵育20min,流式細胞儀檢測。(三)結果1小鼠基因型鑒定對特定基因片段擴增基因型鑒定結果(圖1)顯示,il-6基因缺陷(il-6-/-)小鼠pcr產物擴增片段為1400bp,野生型(wt)擴增片段為900bp。2小鼠骨髓移植實驗流程骨髓移植實驗流程如圖2:wt野生型小鼠輻照清髓6h內,使用wt和il-6-/-不同基因型來源小鼠骨髓重建清髓小鼠骨髓系統。骨髓重建成功后,再經apap誘導建立急性肝損傷模型。3wt和il-6-/-來源的全骨髓均可重建wt小鼠骨髓造血系統wt野生型小鼠股骨組織清髓he結果顯示,經x射線輻照清髓后,骨髓腔中骨小梁附近的的骨髓細胞成分幾乎完全被摧毀(圖3)。he染色結果顯示wt或il-6-/-基因型來源的全骨髓移植1月后,均可重建輻照清髓小鼠的骨髓造血系統(圖4)。4wt和il-6-/-來源骨髓重建后的小鼠apap誘導肝損傷情況apap腹腔注射1天后,he染色結果顯示兩組動物肝臟中央靜脈區域出現不同程度的壞死區域(圖5)。其中,wt小鼠來源骨髓受體小鼠,記做bmt(wt)小鼠,其壞死區域面積顯著大于il-6-/-小鼠來源骨髓受體小鼠,記做bmt(il-6-/-)小鼠,提示其肝損傷更為嚴重。第2天時bmt(wt)小鼠肝臟仍表現為大片狀的壞死區域,而bmt(il-6-/-)組的壞死區域逐漸修復消退,僅表現出嗜酸性和水腫變性。表明在apap同等劑量誘導的急性肝損傷條件下,bmt(il-6-/-)組小鼠的肝損傷情況顯著輕于bmt(wt)組。肝功能生化指標也驗證了上述組織病理學結果。apap誘導第1天和/或第二天,bmt(wt)組血清中轉氨酶alt、ast和tbil水平顯著高于bmt(il-6-/-)組。之后兩組肝功生化指標均回落,第3天時都逐漸恢復至接近正常水平值(圖6)。以上結果表明,接受il-6基因剔除的骨髓重建小鼠,apap誘導急性肝損傷條件下表現出較接受wt骨髓組更輕的肝損傷表現。5小鼠血清炎性細胞因子檢測bmt(wt)和bmt(il-6-/-)兩組小鼠血清中炎性細胞因子的表達水平結果如圖7所示。bmt(il-6-/-)組il-6表達水平在各時間點均顯著低于bmt(wt)組。apap誘導肝損傷1天和2天后,bmt(il-6-/-)組炎性細胞因子tnf-α、ifnγ和趨化因子mcp-1表達水平顯著低于在bmt(wt)組,兩組有顯著性差異,p<0.05;第3天時隨著肝損傷的修復,炎性因子表達水平回落。6流式細胞術檢測小鼠外周血單核細胞ccr2的表達接下來我們分析了兩組不同基因型骨髓來源的小鼠在肝損傷時外周單核細胞(c-mos)ccr2的表達水平。如圖8所示,bmt(il-6-/-)組小鼠c-mosccr2的表達的確被顯著抑制,低于bmt(wt)組2倍多,具有顯著性差異,說明敲除單核細胞的il-6基因,可以有效抑制單核細胞的活化。(四)討論我們使用il-6基因缺陷小鼠來源的骨髓重建輻照清髓的野生型小鼠,觀察il-6基因缺陷的單核細胞在apap誘導肝損傷后,小鼠單核細胞活化情況。首先,il-6基因缺陷小鼠來源的骨髓和野生型小鼠骨髓均能夠成功重建輻照小鼠的骨髓造血系統;其次,相同肝損傷誘導條件下,il-6基因缺陷骨髓重建的小鼠肝組織病理及肝功生化表現出較野生型更輕微的損傷。同時,炎性細胞因子表達水平亦顯著低于野生型對照組。最后流式細胞術也發現外周血單核細胞的ccr2(ccr2為單核細胞活化的標志物)表達百分比顯著低于對照組。以上結果表明,正是由于單核細胞il-6基因的缺失,導致了單核細胞活化受到抑制,進而導致了兩種不同基因型來源骨髓重建小鼠肝損傷后不同的病理損傷表現。(五)結論il-6基因剔除小鼠來源的骨髓重建的小鼠與wt骨髓來源小鼠相比,由于其可以抑制外周血單核細胞活化,降低單核細胞il-6的表達水平,因而在同等劑量apap肝毒性藥物誘導的急性肝損傷中,表現出較輕的肝組織病理損傷、炎性細胞因子水平以及更低水平的單核細胞活化狀態。實驗結果說明,通過抑制外周血單核細胞的活化,可以有效治療和預防急性肝損傷,具體地,可以使用il-6基因敲除型單核細胞替代外周血中的正常單核細胞,從而達到治療和預防急性肝損傷的目的。二、間充質干細胞通過抑制單核細胞活化來改善急性肝損傷(一)材料1恒河猴及人臍帶間充質干細胞。2恒河猴外周血清、肝穿刺活檢組織及猴外周血單核細胞。3主要實驗試劑1)免疫組化相關試劑:甲醛、乙醇、二甲苯、石蠟、蘇木素染液、伊紅染液、濃鹽酸(科隆試劑,成都)等2)抗體:詳見下表抗體及相關試劑信息3)luminex液相芯片試劑盒:acytokinemonkeymagnetic29-plexpanel(lifetechnologies)4)humancd163quantikineelisakit(r&dsystems,美國)5)ficoll淋巴細胞分離液(ge,美國)6)trizol(invitrogen,美國)7)pcr相關試劑:10×taqbuffer,taqdnapolymerase,25mmmgcl2dntp混合物(tiangen,中國)4瓊脂糖凝膠電泳相關試劑瓊脂糖,50×tae電泳緩沖液,核酸染料(goldview,賽百勝,北京)5主要儀器設備1)流式細胞儀fc500cytomics(beckmancoulter,fullerton,calif.,美國)2)巴德mg15-22全自動活檢槍(bard,美國)3)超純凈水產生系統(milli-q,美國millipore公司)4)各型號移液器(eppedorf公司,德國)5)全自動脫水機(dako,美國)6)石蠟包埋機(bm2135,leica,德國)7)石蠟切片機(eq1150c,leica,德國)8)光學顯微鏡(020-518.500,olympus,日本),熒光顯微鏡(leica,德國)9)圖像采集系統(olympusdpcontroller70,日本)10)微型低溫離心機(thermolfisher,美國)11)pcr儀(ptc-200peltierthermalcycler,mjresearch)12)圖像編輯軟件(photoshopcs2,graphpad5.0,美國)13)統計分析軟件(spss19.0,美國)14)流式細胞術分析軟件(kaluzav1.20software,德國;cxp2.1流式軟件,德國)15)超低溫冰箱(thermoscientific公司,美國),液氮生物容器(成都液氮容器廠)全自動脫水機(dako,美國)16)luminex200system(millipore,美國)(二)方法1免疫組織化學(ihc)染色肝臟穿刺組織石蠟包埋完成后,5μm連續切片,撈片后將切片置于65℃烤箱中烤片6過夜。取出過夜烤好的切片,按照常規步驟進行脫蠟水化:二甲苯溶液10min×2,無水乙醇3min×2,95%酒精,85%酒精,75%酒精各3min,流水沖洗5min,蒸餾水洗3min×3次。ihc時,先用3%h2o2滅活內源性過氧化物酶,蒸餾水漂洗兩次后用tris-edta(ph=9.0)抗原修復液進行抗原修復;然后用組化標記筆將待切片組織外圍圈好,滴加事先已稀釋好的一抗抗體于組織上,37℃孵育2h。pbs漂洗3次后滴加envision二抗,37℃孵育45min。pbs漂洗3次后使用dab顯色液顯色;蘇木素染色液復染;脫水透明之后用中性樹膠封片。2免疫熒光(if)染色1)將肝臟石蠟切片脫蠟水化(見上述步驟);pbs沖洗2次,每次5min;2)抗原修復:將切片濕盒浸泡在抗原修復液(檸檬酸鹽緩沖液)中,微波爐30min,冷卻到室溫,pbs沖洗3次,每次5min;3)封閉:5%正常山羊血清工作液封閉,室溫孵育15min,傾倒封閉液;滴加配制好的抗體工作液(cd68與ki67混合配制),4℃過夜;4)次日,復溫后,pbs沖洗三次;滴加適量熒光標記二抗工作液(混合配制),室溫孵育1h;pbs清洗三次,每次5min;5)dapi工作液染核5min后,清洗2次;6)緩沖甘油封片,熒光顯微鏡觀察,采集圖像。3elisa檢測血清scd163使用人可溶性cd163試劑盒,此方法檢測靈敏度范圍為1.56-100ng/ml,為確保樣本能夠準確測出,將血清樣本稀釋100倍,之后按照試劑盒說明書指導下進行定量檢測,具體方法:1)包被:每個聚苯乙烯反應孔中加入100μl稀釋成工作液的兔抗cd163,4℃過夜,次日棄去孔內溶液,緩沖液洗滌3次,每次3min(簡稱洗滌,下同);2)加樣:棄去孔內液體,洗滌。加入100μl用pbs稀釋100倍的樣品于反應孔中,同時做空白孔,陰性對照孔及陽性對照孔,室溫孵育1h;3)加入酶標抗體:洗滌反應孔,加入100μl稀釋的cd163單克隆抗體(1:500),室溫孵育1h,洗滌,加入100μl過氧化酶標記的抗體(山羊抗小鼠免疫球蛋白,dakop447,1:4000),室溫孵育1h,洗滌;4)加底物顯色:先加入100μl過氧化氫/鄰苯二胺鹽酸鹽底物溶液,再加入50μl的硫酸,在elisa酶標儀上于492/620nm波長處讀取數值。批間精密度變異系數cv分別為6.3和9.6%,對應數值分別為1.84和3.91mg/l(n=19×2)。4恒河猴外周血單核細胞(monocyte)分離和純化1)后腿隱靜脈無菌采集約5ml外周血于肝素鋰抗凝管中,室溫2000r/min離心20min,移液槍吸棄上層液體,沉淀層為細胞。2)細胞沉淀層中按1:1體積比加入pbs緩沖液,混勻;取一新15ml離心管加入一定體積的ficoll淋巴細胞分離液;3)使用移液槍吸取混勻的細胞緩慢小心加入ficoll淋巴細胞分離液的上層,離心,結束后,可見離心管中液體分為4層。4)其中第二層云霧狀,即主要為個單核細胞。吸棄第一層的血漿,收集血漿和第三層ficoll分離液之間的白膜層于新離心管中。5)加入5倍以上體積pbs吹打混勻,離心洗去所收集的單核細胞中的ficoll淋巴細胞分離液,共洗滌2次。6)rpmi-1640培養基以上述同樣的離心條件洗滌1次,離心結束后,用小量程移液槍盡量吸走全部的上清。再用一定體積添加10%胎牛血清的rpmi1640重懸細胞。7)吸取50μl細胞懸液,血小板計數統計并調整細胞濃度至106/ml;濃度為2%臺盼藍染色檢測細胞的活力;取一定體積的細胞懸液,測試單核細胞表面標志物cd14,以確保所得單核細胞的純度。5流式細胞術檢測單核細胞活化收集恒河猴外周血2ml于抗凝管中,離心,1500rpm,5min,棄掉上次血清;按照一定比例加入紅細胞裂解液,8-11min左右;離心棄上清液,清洗下層細胞團。加入用pbs稀釋的熒光素標記的anti-cd14、cd16、ccr2抗體200μl,移液槍輕輕吹打混勻,室溫避光孵育15-20min;離心棄上清液,加入pbs繼續洗滌2次;加入500μl冷pbs,移液槍混勻細胞,轉移置流式管中,4℃冰箱保存,待測。6單核細胞總rna提取及il-6mrna水平檢測提取mrna使用的移液槍槍頭、ep管等用含0.1%焦炭酸二乙酯(depc)ddh2o浸泡過夜后,高溫高壓滅菌除去depc殘留,100℃烘箱烘干備用。1)trizol裂解得到的單核細胞,提取rna:在離心管中加入1mltrizol溶液,移液槍吹打離心管底部的細胞團,充分裂解,室溫下靜置10min。2)離心管中加入氯仿:加入1/3trizol體積的氯仿,蓋緊離心管,渦旋儀劇烈振蕩30s,室溫下靜置5-10min,12,000×g,4℃離心15min。3)離心機中小心取出離心管,緩慢吸取上清液轉移至新的離心管管中,注意不要吸出中間白色蛋白質層。4)向上清中加入等體積的異丙醇,輕柔上下搖晃數次至混勻,在室溫下靜置10-20min。12,000×g,4℃離心10min,離心管底部出現沉淀,即rna。5)輕柔棄去上清液,沿離心管管壁加入1ml75%的乙醇,輕輕上下顛倒離心管,洗滌管壁。12,000×g,4℃離心5min。輕柔傾倒乙醇,輕放室溫干燥2-5min。6)加入適量的rnasefreewater溶解rna樣品,待rna沉淀溶解后,立即進行反轉錄,剩余樣本分裝并凍存于-80℃冰箱。逆轉錄反應測定總rna的濃度和od260/od280值。按下表所示配制逆轉錄反應液(20μl體系),反應液配制全部在冰上進行。(3)根據以下逆轉錄程序進行rt-pcr:5minat25℃30minat42℃5minat85℃10minat10℃,反應結束后cdna樣品放入-80℃冰箱長期凍存。逆轉錄pcr反應體系(20μl)熒光定量pcr按照下表配制qpcr反應液(20μl體系),所有操作反應全部在冰上進行。熒光定量pcr反應體系(20μl)根據以下條件進行qpcr反應:qrt-pcr引物購自上海生工生物技術有限公司,具體信息如下表所示。geneforwarprimersequencereverseprimersequenceil-65'atgaggacacttgcctggtg3'5'gctggcatttgtggttggtt'3'gapdh5'tcgagagtcagccgcattttc3'ggaacttgccatgggtggaa3'7luminex檢測恒河猴血清細胞因子方法簡述如下:提前20min從冰箱中取出試劑盒及凍存的樣本,以平衡室溫。在板上的每個孔中加入200ul的洗滌液。封板,室溫(20-25℃),放在振蕩器上10min清洗。倒掉洗滌液,把板反過來在可吸附的紙上輕叩幾次以去掉殘余物質。在適當的孔中加每種標準品和質控品,用分析緩沖液作為(本底)。在背景孔和所有標本孔中加入25ul分析緩沖液。在本底、標準品和質控品中加入25ul基體溶液。加入25ul標本到適當孔中。渦旋混合瓶,每個孔中加入25ul混合的珠子,在加珠子過程中間歇的搖動裝珠子的瓶子,避免沉淀。用封板膜封板,在板的外面上鋁箔,放在振蕩器上室溫(20-25攝氏度)振蕩孵育2h或者4℃孵育過夜。輕輕地去掉板里的內容物,洗板兩次。在每個孔中加入25ul檢測抗體。封板,包上鋁箔,在振蕩器上室溫振蕩孵育1h。在每個含有25ul檢測抗體的孔中加入25ul鏈霉親和素-藻紅蛋白。封板,包上鋁箔,在振蕩器上室溫振蕩孵育30min。輕輕地去掉板里的內容物,洗板兩次。在所有孔中加入150ul鞘液。在振蕩器上重懸珠子15min。將板放在flexmap上用xponent運行。保存并使用樣條曲線擬合法分析中間熒光強度數據,計算標本中細胞因子的濃度。8細胞計數使用ipp圖像分析軟件對采集到的免疫組化圖像進行陽性細胞計數。不同時間點的標本在400x顯微鏡下陽性細胞數進行統計,每個時間點取3個樣品,每個樣品取5個視野,然后取其平均值。使用graphpadprism5軟件進行繪圖和數據分析。9數據分析及統計學分析所有實驗數據均代表3次以上實驗結果,以平均值±標準差進行統計。數據均由專業統計軟件spss或graphpadprism5進行分析(13.0版),兩組數據間采用單因素方差分析處理。p值小于0.05表示具有顯著性差異。*p<0.05,**p<0.01,***p<0.001。(三)結果1恒河猴外周血細胞因子、趨化因子和生長因子的動態變化我們利用luminex技術檢測了恒河猴外周血清中細胞因子、趨化因子和生長因子共29個因子的動態表達變化。如圖9所示,兩組動物外周血清炎癥因子tnf-α、il-1β、il-1ra、il-15、ifn-γ,趨化因子mcp-1、mip1α、mip1β和生長因子hgf、vegf、fgf-basic于amanitin毒素注射后3天內均略微升高,之后在msc-組隨肝功能惡化而持續上升,第4-5天時顯著高于msc+組。在msc+組,上述因子表達水平在各時間點均無顯著變化或僅有輕微升高,第5天時迅速回落,至第7天已恢復至正常水平。msc-組il-6在第1天時迅速達到峰值,較毒素誘導前升高達100余倍,也高于msc+組34倍。之后il-6水平急轉直下,但至第5天時仍6倍高于msc+組。兩組動物il-2、il-8、il-10、il-12、g-csf、egf、rantes、eotaxin、mif、i-tac、mdc、mig、ip-10等因子在各時間點兩組的表達水平無顯著性差異。il-4、il-5、il-17和gm-csf等因子低于檢測閾值,未能測出結果。2單核細胞活化檢測外周循環中炎性細胞因子檢測結果提示,毒素輸入引起了恒河猴全身性的炎癥反應。外周血il-6在第1天就急劇升高,提示其在alf啟動及進展中可能起重要作用。多種細胞均可分泌il-6,例如活化的t細胞、單核細胞甚至成纖維細胞。然而,急性肝損傷發生后,首先激活肝內巨噬細胞即庫否細胞(kcs),后者成為分泌il-6的主要細胞群。kcs的活化及分泌il-6是促進肝臟修復的重要保護性因素。但kcs的過度活化也成為促進局部和全身系統性炎癥反應的關鍵環節。il-6在alf早期的急劇升高提示kcs的大量動員活化,這可能是毒素導致alf病情進展的關鍵環節。cd163是血紅蛋白清道夫受體,特異性表達于活化的巨噬細胞膜。血清中的可溶性cd163(solublecd163,scd163)的水平能反映巨噬細胞活化狀況,也可間接反映肝衰竭病情嚴重程度[60-62]。我們用elisa分析了兩組動物血清中scd163水平。在第1天時msc-組scd163就急劇升高,而msc+組僅略微升高,兩組相比具有極顯著性差異(p<0.001),這也提示了msc-組巨噬細胞的顯著活化(圖10)。肝臟內的kcs是體內最大的巨噬細胞群,早期急劇升高的il-6和scd163提示kcs的大量活化。cd68是成熟kcs的特異標志物。免疫組化染色結果顯示在msc-組,直到第3天才見到明顯增多的cd68陽性細胞,盡管其kcs胞漿豐富,細胞體積較大,但與msc+組相比,其數量并無顯著性差異(圖11)。肝臟巨噬細胞的增多,一部分可能為kcs分裂增殖,另一部分可能來源于循環中的單核細胞(circulatingmonocytes,c-mos),受到ccr2(單核細胞趨化蛋白mcp-1受體)等信號趨化而遷移到肝損傷局部,分化為kcs。我們檢測了肝臟內kcs增殖情況,如圖12所示,肝臟內罕見cd68+ki67+細胞,表明kcs的增殖并不活躍。接下來我們利用免疫組化檢測了由循環中遷移入肝臟的單核細胞(c-mos)。mac387是外周血遷移入肝而又尚未分化成熟的單核-巨噬細胞。結果顯示早在第2天,msc-組即可觀察到大量mac387+細胞聚集于肝臟壞死灶周圍,第3天繼續增多,至第4天時隨著肝實質的大量丟失其形態發生改變(圖11a,b);而msc+組在各時間點均未出現mac387的顯著增多(圖11a,c)。以上結果提示,肝內巨噬細胞的大量活化,絕大部分是從c-mos募集而來。單核細胞趨化蛋白1(mcp-1)與特異性趨化因子受體2(ccr2)結合后,激活單核-巨噬細胞,被認為具有促進炎癥反應的作用,高表達ccr2的單核細胞被視作活化的單核細胞。我們采用流式細胞術檢測了外周血cd14+cd16+ccr2+的單核細胞。毒素誘導后第1天,盡管我們前面未發現單核細胞總數升高,但msc-組動物外周血cd14+cd16+ccr2+陽性的c-mos比例顯著升高,且遠高于msc+組(圖13)。為明確活化的c-mos是否是il-6的來源,我們采用rt-pcr檢測了其il-6mrna的水平。結果顯示,從msc-組分選所得的c-mos其il-6的mrna顯著性升高(圖14)。cd45是炎癥細胞的共同表面標志,我們進而通過cd45免疫組化檢測了兩組動物第3天時肝內炎性細胞浸潤情況。與msc-組相比,msc+組局部炎性細胞的浸潤被明顯抑制(圖15)。本部分結果表明,msc-組肝內巨噬細胞主要是由ccr2趨化的c-mos遷移至肝臟聚集而成,而il-6在第1天時急劇升高,正是來自于cd14+cd16+ccr2+的c-mos。huc-mscs輸入后,顯著減少了活化的c-mos并抑制其分泌il-6,進而有效地阻斷了系統性炎癥反應的過度放大,逆轉了毒素引起的恒河猴alf的發生。3預防性輸入huc-mscs有效抑制毒素誘導的肝損傷huc-mscs的輸入強有力地抑制了c-mos活化進而改善了毒素引起的alf。我們進而探討了預防性給與huc-mscs是否同樣能保護肝細胞免于毒素損傷。我們在毒素誘導建模前的-9,-8和-7天分別通過外周靜脈給予1×107個huc-mscs,共計3×107huc-mscs,作為預防組(pre-msc+)。實驗流程如圖16所示。結果顯示,預防組動物除了在毒素給予后的前兩天食欲有所減退,之后始終保持良好的生理和精神狀態,動物無一死亡。肝功生化指標顯示,與毒素誘導前相比,pre-msc+組第2天時酶學指標、膽紅素和血氨水平幾乎沒有發生改變,第5天時alt僅為501u/l,膽紅素和血氨水平與正常水平相當(圖17a)。其肝功能指數明顯好于msc-組,甚至好于msc+組。第3天時肝活檢組織的he染色結果顯示為正常的肝小葉結構,cd68和mac387陽性細胞極少(圖17b)。外周血清scd163水平檢測也顯示第1天時pre-msc+組僅較注射毒素前略有上升,但無統計學差異,表明scd163也被顯著抑制(圖18)。同樣,流式細胞術檢測pre-msc+組cd14+cd16+ccr2+單核細胞比例,也顯示其外周血活化的c-mos接近于正常健康動物,并且這群單核細胞的il-6mrna表達水平也不升高(圖19)。同樣,提前輸入huc-mscs并未引起外周血白細胞數目和treg等淋巴細胞亞群比例發生變化(圖20)。我們又采用luminex液相芯片檢測了細胞因子水平。與健康對照比較,從第2天到第5天,pre-msc+組動物外周血清中炎癥介質,如il-1α、tnf-α、il-1β、ifn-γ,趨化因子,如mcp-1、mip1α、mip1β等幾乎無顯著改變或僅有輕微升高,外周血il-6亦被顯著抑制。某些炎性因子如il-1α等較huc-msc+組更低(圖21)。該結果提示預防性給予huc-mscs似乎能更顯著地抑制局部及后續的系統性炎癥反應。(四)討論通過流式我們分析了外周血cd14+cd16+ccr2+單核細胞亞群,結果證實alf猴c-mos被顯著活化,高表達il-6mrna,成為血清中il-6的主要來源。huc-mscs能明顯抑制c-mos的活化和遷移過程,并抑制其產生il-6。同時,我們的研究也證實huc-mscs治療和預防alf的的靶細胞正是c-mos。(五)結論外周血輸入的huc-mscs通過抑制c-mos的過度活化及產生il-6,從而顯著抑制繼發性系統性炎癥反應,使恒河猴免于致死性alf。實驗結果說明,通過抑制外周血單核細胞的活化,可以有效治療和預防急性肝損傷,其中,huc-mscs即可以有效抑制單核細胞的活化,具體地,可以抑制活化標志物ccr2的表達,同時抑制il-6的分泌,說明huc-mscs是一種外周血單核細胞的活化抑制劑,可以通過抑制外周血單核細胞的活化,進而治療和預防急性肝損傷。綜上,本發明實驗從基因水平證實了抑制單核細胞的活化能夠有效治療和預防急性肝損傷,再以臍帶間充質干細胞驗證了抑制單核細胞的活化的確能夠有效治療和預防急性肝損傷,說明單核細胞活化抑制劑可以有效治療和預防急性肝損傷,可以作為治療和預防急性肝損傷的藥物使用,其中,單核細胞活化抑制劑可以是il-6基因敲除型單核細胞,也可以是臍帶間充質干細胞,還可以是其他抑制單核細胞活化的物質,如il-6基因沉默劑。本發明為臨床治療急性肝損傷提供了一種新的選擇,應用前景優良。sequencelisting<110>四川大學華西醫院<120>外周血單核細胞活化抑制劑在制備治療急性肝衰竭的藥物中的用途<130>gy026-17p1109<160>7<170>patentinversion3.5<210>1<211>20<212>dna<213>il-6pcr引物f<400>1tcgagtatctgacaatgtgg20<210>2<211>21<212>dna<213>il-6pcr引物r1<400>2tagccagaagttccaaattgg21<210>3<211>22<212>dna<213>il-6pcr引物r2<400>3atagcctgaaaccaactgtgcc22<210>4<211>20<212>dna<213>il-6qrt-pcr引物f<400>4atgaggacacttgcctggtg20<210>5<211>20<212>dna<213>il-6qrt-pcr引物r<400>5gctggcatttgtggttggtt20<210>6<211>21<212>dna<213>gapdhqrt-pcr引物f<400>6tcgagagtcagccgcattttc21<210>7<211>20<212>dna<213>gapdhqrt-pcr引物r<400>7ggaacttgccatgggtggaa20當前第1頁12
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1
- 干擾素調節因子5(IRF5)及其抑制劑在治療心肌肥厚中的應用的制作方法與工藝
- 作為因子XIA抑制劑的環狀P1連接體的制作方法與工藝
- 能夠結合組織因子途徑抑制劑(1?161)上的兩個表位的抗體的制作方法與工藝
- 針對組織因子途徑抑制劑(TFPI)的優化的單克隆抗體的制作方法與工藝
- 一種作為自分泌運動因子抑制劑的咔唑類化合物及其制備方法和應用與流程
- 外周血單核細胞活化抑制劑在制備治療急性肝衰竭的藥物中的用途的制造方法與工藝
- 對NEDD8活化酶(NAE)抑制劑的反應的生物標記的制造方法與工藝
- 一種肺癌調節因子SRSF5及其抑制劑與應用的制造方法與工藝
- 自分泌運動因子抑制劑的制造方法與工藝
- 一種BCL?2抑制劑Venetoclax的合成方法與流程