可用于藥物加載和釋放的可注射型自愈合凝膠及其制備方法和應用與流程
本發明屬于生物醫用材料技術領域,涉及一種可用于藥物加載和釋放的、可注射型自愈合凝膠生物材料及其制備方法和應用。具體而言,本發明涉及一種基于明膠顆粒的、生物相容性的、可降解膠體凝膠材料,可直接施用于外科手術(含微創手術)以及外傷等原因造成的人及其他哺乳動物的組織器官創面或缺損的修復填充及再生重建。
背景技術:
自愈合材料為一類新型功能材料,這類材料在受到外力破壞后能自動修復愈合,可完全或部分恢復破壞前的結構和力學強度,已成為非常重要的一類新型、智能化、工程材料。其中,具有自愈合能力的水凝膠材料因其自修復能力、具有生物相容性、和人體組織類似的高含水率等特點,在生物醫藥工程領域具有重要的應用價值。近來,科學家們借助可逆的高分子鏈間相互作用,即高分子間的鍵合可被打破和重建這一特性,開發出多種具有自愈合效應的新型水凝膠材料。然而這些自愈合材料因普遍采用高分子鏈間的分子間相互作用,包括氫鍵、金屬離子配體的配位作用、靜電作用或疏水性作用等,易產生微觀相分離,且這類水凝膠高分子網絡無法實現對藥物分子的可控加載和釋放。同時傳統的自修復高分子水凝膠材料存在諸多難以克服的瓶頸,包括力學強度較弱,無法對藥物釋放進行準確控制,同時難以兼顧生物相容性和生物降解性。這些都限制了其在生物醫藥領域,尤其是作為可植入生物材料的應用。
技術實現要素:
鑒于上述所述的自愈合材料在現有技術中存在的問題,本發明提供一種可用于藥物加載和釋放的可注射型自愈合凝膠生物材料及其制備方法。該凝膠生物材料具有自愈合功能,并可加載水溶性小分子化學藥物、蛋白藥物或活細胞,實現藥物或生物因子的可控釋放,可誘導組織再生,適用于皮膚組織、牙周組織、軟骨組織等病缺損組織的修復,也可作為3d生物打印墨水。
本發明的技術方案如下:
一種可注射型自愈合膠體凝膠的制備方法,包括以下步驟:
(1)以明膠為原料,使其在去離子水中加熱溶解,配置濃度為0.1~20w/v%的明膠水溶液,調ph值為1-6或8-14,向溶液中加入>2倍體積的極性有機溶劑,生成明膠微凝膠顆粒分散液,加入交聯劑交聯反應1~12h,離心、清洗得到明膠微凝膠顆粒;
其中,所述明膠微凝膠顆粒的zeta電勢為-30~+30mv,所述明膠微凝膠顆粒的直徑為20nm~5μm;
(2)將步驟(1)制備得到的表面zeta電勢>+10mv的明膠微凝膠顆粒,分散在ph<5的酸性水溶液或ph>9的堿性水溶液中,得明膠微凝膠顆粒的分散液,再與帶負電荷的有機高分子顆粒分散液按照顆粒數比1:1000~1000:1共混,用ph調節劑調ph至7.0,冷凍干燥,得到明膠微凝膠顆粒凍干粉末i;
(3)將步驟(1)制備得到的表面zeta電勢<-10mv的明膠微凝膠顆粒,分散在ph<5的酸性水溶液或ph>9的堿性水溶液中,得明膠微凝膠顆粒的分散液,再與帶正電荷的有機高分子顆粒分散液按照顆粒數比1:1000~1000:1,混合,用ph調節劑調ph至7.0,冷凍干燥,得到明膠微凝膠顆粒凍干粉末ii;
(4)將步驟(1)制備得到的表面zeta電勢為-10~+10mv的明膠微凝膠顆粒分散在中性水溶液中,再與另一種表面zeta電勢在-10~+10mv的有機高分子顆粒分散液按照顆粒數比1:1000~1000:1共混,冷凍干燥,得明膠微凝膠顆粒凍干粉末ⅲ;
(5)明膠微凝膠顆粒凍干粉末i、明膠微凝膠顆粒凍干粉末ii或明膠微凝膠顆粒凍干粉末ⅲ分別與水性溶液共混,攪拌混合,得可注射型自愈合膠體凝膠;
其中,所述的帶正電荷的有機高分子顆粒的表面電荷為+5~+60mv,帶負電荷的有機高分子顆粒的表面電荷為-5~-60mv;所述有機高分子顆粒的直徑為20nm~500μm,優選20nm~50μm。
本發明上述可注射型自愈合膠體凝膠的制備方法中,將步驟(1)制備得到的明膠微凝膠顆粒,冷凍干燥得到的明膠微凝膠顆粒凍干粉末與水性溶液共混,也可以得到本發明所述的可注射型自愈合膠體凝膠,但其性能差于本發明中其他方法制備得到的可注射型自愈合膠體凝膠。
本發明上述可注射型自愈合膠體凝膠的制備方法中,在步驟(1)中,根據調整明膠水溶液的濃度、極性有機溶劑的加入量、交聯反應時間等,可以制備得到帶有不同zeta電勢和直徑大小的明膠微凝膠顆粒。本發明上述技術方案中,明膠水溶液濃度優選為0.1~20w/v%,更優選為2.5~10w/v%;極性有機溶劑的加入量優選為明膠水溶液的>2倍,更優選為3~6倍。明膠微凝膠顆粒的尺寸優選為20nm~5μm,更優選為100nm~2000nm。
本發明上述可注射型自愈合膠體凝膠的制備方法中,步驟(2)、(3)和(4)中,明膠微凝膠顆粒的分散液和各有機高分子顆粒分散液中的顆粒數的比例影響所制備膠體凝膠的彈性模量和自修復效率,本發明中兩種分散液中顆粒數的比例優選為1:10~10:1,更優選為1:5~5:1,共混的兩種顆粒直徑比為1:5~5:1時,可得到具有更高彈性模量和自修復效率的可注射型自愈合凝膠,若直徑的差異過大,則所得到的膠體凝膠彈性模量下降,自修復效率降低。
進一步地,在上述技術方案中,所述的帶正電荷的有機高分子顆粒分散液以殼聚糖、a型明膠、聚丙烯酰胺、聚(n-異丙基丙烯酰胺)、聚乙烯亞胺中的一種或幾種作為原料制備得到,所述的帶負電荷的有機高分子顆粒分散液以透明質酸、海藻酸、a型明膠、b型明膠或聚丙烯酸中的一種或幾種作為原料制備得到,所述的表面zeta電勢在-10~+10mv的有機高分子顆粒分散液以膠原蛋白、白蛋白、明膠中的一種或幾種作為原料制備得到。所述帶正電荷的高分子顆粒分散液、帶負電荷的高分子顆粒分散液或表面zeta電勢在-10~+10mv的高分子顆粒分散液,本領域技術人員可以根據高分子顆粒的常規制備技術來制備得到,在本申請中不再詳細陳述。
進一步地,在上述技術方案中,在步驟(1)中所述的極性有機溶劑為甲醇、乙醇、異丙醇、丁醇、丙酮、乙腈、四氫呋喃中的一種或幾種的組合;所述的交聯劑為戊二醛、甘油醛、甲醛、碳二亞胺、二鹵代烷、異氰酸酯、二異氰酸酯、谷氨酰胺轉胺酶、京尼平中的一種或幾種。
進一步地,在上述技術方案中,在步驟(1)中所述的交聯反應的反應體系中交聯劑與明膠中氨基基團的摩爾比>0.1;優選0.5~5。交聯劑與明膠中氨基基團的摩爾比影響所形成的明膠微凝膠顆粒的交聯度,交聯度過高明膠微流強度更高、表面電荷更傾向于帶負電,交聯度過低明膠微球強度低、表面電荷取決于明膠原料的等電點,本發明優選的技術方案中交聯度較低時較為好,優選的,本發明中所述交聯劑與明膠中氨基基團的摩爾比要控制在0.5~5。
進一步地,在上述技術方案中,在步驟(2)和步驟(3)中所述的酸性水溶液和堿性水溶液中所含有的離子濃度均小于200mm。所述的酸性水溶液和堿性水溶液中所含有的離子的種類不特別限定,可以采用本領域常規的用于調節酸性或堿性的試劑,如鹽酸、硫酸、醋酸、氫氧化鈣、氫氧化鉀、氨水、碳酸鈉等。
進一步地,在上述技術方案中,在步驟(2)和步驟(3)中所述的ph調節劑包括酸性物質和堿性物質,所述酸性物質為葡萄糖酸內酯、hcl、hno3、h2so4中的一種或幾種,所述堿性物質為尿素和脲酶的組合、或者氫氧化鈉、氫氧化鈣、氫氧化鉀、氨水中的一種或幾種。
進一步地,在上述技術方案中,在步驟(5)中制備得到的可注射型自愈合膠體凝膠中膠體顆粒占膠體凝膠總體積的百分比為2.5vol%~150vol%,優選50vol%~100vol%;膠體顆粒占凝膠總質量的百分比為2.5wt%-50wt%,優選10wt%~25wt%;相應的膠體凝膠儲存(彈性)模量為1pa~100kpa,優選1kpa~100kpa。
進一步地,在上述技術方案中,在步驟(5)中所述的水性溶液是任意離子濃度<1000mm、ph值為5~9的水溶液、親水性高分子的水溶液、非水溶性的納米顆粒分散液中的一種或幾種的組合,優選離子濃度<150mm,ph值為7。
本發明還提供一種可注射型自愈合凝膠載體,該凝膠載體是將本發明所述的方法制備得到的明膠微凝膠顆粒凍干粉末i、明膠微凝膠顆粒凍干粉末ii、明膠微凝膠顆粒凍干粉末ⅲ或可注射型自愈合膠體凝膠與含有生物活性物質或活細胞的水性溶液按照一定比例共混而制備得到,所述的水性溶液的離子濃度優選100~200mm,ph值優選6.5~7.8。其中,所述的生物活性物質為天然藥物成分、合成的化合物或蛋白類藥物分子,所述的活細胞選自原代培養細胞、傳代培養細胞、細胞株培養細胞和雜合體中的一種。含有活細胞的水性溶液中細胞的濃度優選為1~109個/ml,所述的蛋白類藥物分子為骨形態發生蛋白、凝血viii因子、成血管生長因子、成纖維細胞生長因子、類胰島素生長因子、表皮生長因子、血小板來源增殖因子、生長激素釋放抑制因子、轉化生長因子tgfα和tgfβ、神經生長因子、白細胞介素類生長因子、紅細胞生長素、集落刺激因子中的一種或幾種;成骨誘導因子,生長因子、蛋白藥物的濃度在10ng/ml-1mg/ml范圍。加載有生物活性物質的凝膠載體中,生物活性物質在高分子微凝膠膠體料在注射和固化過程無需引入化學交聯反應,不同于化學高分子,也沒有引入小分子交聯劑,生物相容性好,可降解吸收,無毒副作用,安全性好,使其在生物醫學領域的廣泛應用成為可能。
2.與傳統自愈合材料的區別
傳統自愈合材料主要分為兩類。一類是將包埋有交聯劑或交聯反應引發劑的微膠囊分散在水凝膠的連續相網絡中,當材料發生破壞,微膠囊在剪切力作用下破裂而釋放出交聯劑而誘發進一步的交聯或固化反應實現材料的自愈合;另一類是利用高分子間的物理相互作用構建的水凝膠材料,基于分子鏈間可逆的物理交聯形成穩定的凝膠網絡,當材料受力被破壞后分子鏈間相互作用斷裂,但由于鍵合的可逆性,分子鏈間相互作用可以快速重建,實現材料的自愈合(cn201610538145.6)。
本發明的自愈合水凝膠是以微納米尺寸的微凝膠膠體顆粒為基本單元,通過利用膠體顆粒表面形成可逆的靜電作用和氫鍵作用,實現結構穩定的凝膠網絡的制備,這樣以膠體顆粒為基本單元構建的水凝膠體系成為膠體凝膠。這種膠體凝膠的自修復性能來源于微凝膠膠體顆粒間的可逆相互作用。當凝膠被剪切力破壞時,膠體顆粒間物理鍵合斷裂,但隨著外力取消后,膠體顆粒重新分布排列,膠體間鍵合重新形成,使水凝膠重新恢復其結構和力學強度,實現材料的自愈合。與傳統自愈合水凝膠依托分子鏈間的可逆鍵合不同,自愈合膠體凝膠是依托凝膠顆粒間的可逆相互作用實現自修復。
3.在蛋白釋放方面的優勢
生物活性藥物,例如蛋白類大分子藥物的可控釋放一直是生物醫藥領域的難題。尤其是在組織工程應用方面,生物活性分子,例如生長因子、激素等蛋白藥物有著誘導細胞增殖、分化和進一步組織修復再生的功效。然而,這些生長因子類蛋白藥物在體內易失活,并且生長因子誘導細胞和組織修復再生的作用是與藥量和給藥時間緊密相關的。生長因子的可控釋放有利于組織修復再生,反之則會出現不可控的副作用,包括組織增生肥大、異位成骨、甚至發生腫瘤的風險。傳統的組織工程技術通常利用預加工好的支架材料,通過蛋白藥物在支架的表面物理吸附實現藥物的加載,這種方式往往導致支架植入體內后,蛋白藥物的暴釋,不能實現長期的持續的釋放。并且,由于蛋白藥物的快速不可控釋放,容易造成不可預期的負面效果。凍干溶脹過程中,在高滲透壓納米級的高分子網絡中,緩慢釋放,實現在植入部位中藥物緩釋,通過藥物持續的作用,提高治療效果。要加載活細胞時,將懸浮有活細胞的水性溶液按照適當的比例直接與本發明的可注射型自愈合凝膠生物材料的凍干粉混合,得到加載活細胞的凝膠載體,活細胞分布在膠體凝膠內部,膠體凝膠為細胞提供力學支撐和生長繁殖的空間。加載生物活性物質或活細胞的膠體凝膠可作為用于皮膚組織、骨軟骨組織、牙周組織等組織缺損修復填充和治療的可注射型組織工程支架材料、可植入填充材料來應用,也可以作為3d生物打印墨水來應用。
本發明還提供可用于多種不同藥物有序釋放的可注射型自愈合藥物載體,具體為:將不同交聯度的明膠微凝膠顆粒與不同蛋白藥物分子共混,經冷凍干燥得到載有不同蛋白分子的微凝膠凍干粉末;再與水性溶液共混,并攪拌混合均勻,得到加載多種蛋白藥物分子且可有序釋放不同藥物分子的、可注射型自愈合藥物載體。
本發明的有益效果:
1.和傳統可注射材料的區別和優勢:
傳統的可注射型水凝膠材料多數是基于高分子水凝膠的前驅體,在注射器中未發生聚合/交聯反應,是具有良好流動性的液體,因此具有良好的可注射性,當水凝膠預聚體通過針管注射后,通過快速的化學交聯/聚合反應實現預聚體水溶液的固化。例如專利cn105176080a報道了一種基于聚乙二醇水凝膠的可注射材料,是通過雙鍵和胺基的邁克爾加成反應實現聚合物單體水溶液在注射后固化并形成水凝膠(cn201510452759.8)。這類由化學反應誘導水凝膠固化的反應在生物醫學應用過程中由于難以避免引入化學交聯劑或催化劑,因此容易造成細胞毒性問題,限制了其作為生物醫用材料的應用。
而本發明的可注射凝膠使用帶表面電荷的高分子微凝膠顆粒,通過顆粒間的靜電相互作用自組裝得到膠體凝膠材料。由于微凝膠之間的靜電作用是物理交聯且具有可逆性,因此當這種膠體凝膠受到破壞性的剪切力破壞時,微凝膠顆粒間的靜電相互作用被外力破壞,膠體凝膠從具有剛性的固體材料向具有流動性的流體材料轉變,這一過程被稱為剪切變稀行為。當外力取消時,膠體間的相互作用快速恢復,膠體顆粒通過重新形成物理交聯組裝成膠體凝膠。因此本發明的膠體凝膠具有可注射性和自愈合性能。更重要的是,本發明的凝膠材
本發明的膠體凝膠材料對比與傳統載體材料具有更多優勢。1)凝膠由具有微納米尺寸的微凝膠顆粒為基本單元,相比傳統多孔支架材料具有更高比表面積,因此可表面吸附的蛋白量更高;2)生長因子的加載是將微凝膠顆粒的凍干粉直接與生長因子水溶液共混,在顆粒溶脹過程中蛋白分子在滲透壓作用下進入微凝膠顆粒網絡內部,因此蛋白的釋放主要是由微凝膠的降解速率控制的;3)生長因子的釋放速率主要由明膠微凝膠的降解速率調控,因此通過控制微凝膠的交聯度可以實現對加載的生長因子的釋放速率進行調控,進一步將不同的生長因子加載入不同交聯度的膠體顆粒,可以實現多種生長因子的有序可控釋放。
附圖說明
圖1為實施例1所述方法制備的a型明膠微凝膠顆粒的掃描電鏡照片。
圖2為實施例1所述方法制備的a型明膠微凝膠顆粒的激光粒度儀測試結果。
圖3為實施例2所述方法制備的由帶相反電荷的a型和b型明膠膠體顆粒組成的復合膠體凝膠的微觀結構的掃描電鏡照片。
圖4為實施例2所述方法制備的由帶相反電荷的a型和b型明膠膠體顆粒組成的復合膠體凝膠的自修復行為的流變學測試結果。
圖5為實施例5中所述方法制備的可注射膠體凝膠實現生物活性蛋白藥物的有序釋放。
圖6為實施例6所述方法制備的載骨形態發生蛋白-2(bmp-2)的自愈合膠體凝膠作為可注射型凝膠用于骨缺損的填充修復;其中,右圖①-④是動物實驗手術過程制造的大鼠膝關節骨缺損,及使用本發明所述凝膠進行填充修復的過程。
圖7為實施例6所述方法制備的載骨形態發生蛋白-2(bmp-2)的自愈合膠體凝膠作為骨填充物用于大鼠膝關節骨缺損的修復填充,植入后4周骨再生的組織切片圖。虛線區域為骨缺損的位置。a:空白對照組,即制造圓柱狀缺損后不做任何處理;b:膠體凝膠組,即制造缺損后使用實施例5所述膠體凝膠進行填充;c:載bmp-2膠體凝膠組,即制造缺損后使用載生長因子bmp-2的膠體凝膠進行填充修復。
圖8為實施例7所述的以明膠基膠體凝膠為3d打印墨水打印出的三維機構支架的照片;其中,a:打印出的三維機構支架整體圖,b和c為三維支架的顯微放大照片。
圖9為實施例7所述的包埋有細胞的明膠基膠體凝膠的激光共聚焦顯微圖片;其中,a:細胞分布在膠體凝膠中,b:細胞在微凝膠中的三維分布圖。
具體實施方式
下述非限制性實施例可以使本領域的普通技術人員更全面地理解本發明,但不以任何方式限制本發明。下述實施例中,如無特殊說明,所使用的實驗方法均為常規方法,所用材料、試劑等均可從生物或化學公司購買。
下面實施例中將膠體顆粒冷凍干燥后得各膠體顆粒的凍干粉末,其中所述冷凍干燥條件為:將膠體顆粒在-60℃、<300pa下冷凍干燥2-3天。
實施例1
以a型明膠為原料,使其在去離子水中加熱40℃溶解,配置濃度為5w/v%的明膠水溶液,調節明膠水溶液ph值為3,隨后向溶液中加入3倍溶液體積的丙酮,生成明膠微凝膠顆粒的分散液;分別向分散液中加入不同量的25wt%戊二醛水溶液,使明膠微凝膠顆粒交聯,加入戊二醛的量分別為每克明膠對應25wt%戊二醛66μl、132μl、264μl、538μl,交聯反應時間12hr,隨后加入甘氨酸中和未反應的醛基,離心清洗得到a型明膠微凝膠顆粒的分散液。
使用激光粒度儀對在使用不同交聯劑用量制備的a型明膠顆粒進行顆粒尺寸分析,結果如表1所示。
表1.a型明膠顆粒尺寸和顆粒表面zeta電勢隨著戊二醛加入量的變化
圖1為在上述方法中戊二醛加入量為264μl時的a型明膠微凝膠顆粒的掃描電鏡照片,可見顆粒尺寸分別較均勻,70%以上的顆粒尺寸在200-400nm范圍內,比使用激光粒度儀測試的顆粒尺寸小,這是因為冷凍干燥后明膠顆粒發生干燥收縮引起的。
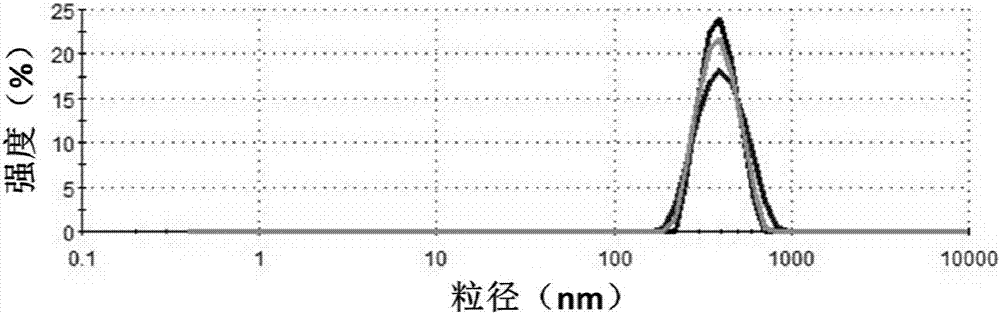
圖2為在上述方法中戊二醛加入量為264μl時的a型明膠微凝膠顆粒的激光粒度儀測試結果,可見這一制備參數得到的明膠膠體顆粒的平均粒徑為376.9±6.5nm,且粒徑分布窄。
實施例2
分別以a型明膠和b型明膠為原料,使其在去離子水中,在加熱40℃下溶解,配置得到濃度為5w/v%的a型明膠水溶液和濃度為5w/v%的b型明膠水溶液,調節兩種明膠水溶液ph值均為3,隨后向溶液中各加入3倍體積的丙酮,生成a型明膠和b型明膠微凝膠顆粒懸浮液;分別向懸浮液中加入25wt%戊二醛水溶液,使明膠微凝膠顆粒交聯,加入戊二醛的量為每g明膠對應25wt%戊二醛66μl,交聯反應時間12hr,隨后加入甘氨酸中和未反應的醛基,離心清洗分別得到a型明膠顆粒分散液和b型明膠顆粒分散液。利用激光粒度儀測得制備微凝膠顆粒尺寸和zeta電勢數據如表2所示。經冷凍干燥分別得到a型明膠顆粒的凍干粉末(標記為gela)和b型明膠顆粒的凍干粉末(標記為gelb)。
表2.不同類型明膠顆粒的性能參數
將gela和gelb分別分散在20mm的naoh堿性水溶液中,分別得到分散有帶正電荷的a型明膠微凝膠顆粒分散液和帶負電荷的b型明膠微凝膠顆粒的分散液,按照a型明膠顆粒和b型明膠顆粒的顆粒數量比為1:1將所述兩種明膠的分散液充分混合、攪拌,得分散有兩種不同微凝膠顆粒的分散液;向分散液中加入100mm的鹽酸調節ph值至7.0,攪拌混合,冷凍干燥,得到含有兩種不同膠體顆粒的凍干粉末,標記為gela+b。通過掃描電鏡觀察到膠體凝膠的微觀網絡結構如圖3所示,膠體凝膠具有多孔網絡結構,且凝膠網絡由明膠微球組裝堆積而成。
分別將gela、gelb、和gela+b膠體顆粒凍干粉末與不同體積的1mm的nacl鹽溶液共混,并快速攪拌混合均勻得到三種不同可注射型自愈合膠體凝膠,得到含不同微凝膠膠體顆粒體積分數的膠體凝膠。進一步通過流變儀對所得凝膠材料的彈性模量(表3)和剪切破壞后自愈合效率(表4)進行評價。
膠體凝膠的自修復行為是通過流變儀進行表征,具體測試方法如下。對膠體凝膠進行連續的流變測試:首先進行震蕩時間掃描,對樣品施加頻率為1hz和應變為0.5%的外力,測試樣品的彈性模量(g’)和粘性模量(g”),此時凝膠在低剪切力情況下表現出固體的剛性行為,因此彈性模量g’大于粘性模量g”且保持穩定。這一階段的g’值即為樣品的初始彈性模量。隨后逐漸增加施加的應變從0.1%至1000%,此過程中通過施加外力將樣品破壞,彈性模量g’逐漸降低,最終低于g”,即膠體體系從剛性固體向粘性流體發生轉變,結構被破壞。隨后立即取消外力作用,考察樣品彈性模量的恢復情況。將外力釋放后,樣品恢復的彈性模量與其初始彈性模量的百分比(%)定量考察凝膠的自修復效率。
表3和表4顯示,兩種帶相反電荷的膠體顆粒共混的膠體凝膠gela+b的彈性模量最高,剪切破壞后5分鐘內自愈合效率最高,彈性模量恢復率超過80%。并且這樣自修復行為可以反復發生:在對樣品施加多個循環的剪切破壞過程中,每次取消外力后,凝膠的彈性模量都會快速恢復,并恢復到初始彈性模量的80%以上(如圖4所示)。
表3.實施例2中制備的不同膠體凝膠含有不同體積分數的微凝膠顆粒所得到凝膠材料的彈性模量g'
表4.實施例2中制備的不同膠體凝膠不同體積分數的微凝膠顆粒所得的凝膠材料的自修復效率
*注:自修復效率是采用1000%的應變持續你剪切凝膠材料60s后,檢測應力釋放后5min內的彈性模量恢復的百分比(%)。
實施例3
以a型明膠為原料,在加熱40℃下溶解,配置得到濃度為5w/v%的a型明膠水溶液,調節ph值為11,隨后向溶液中各加入3.5倍體積的乙醇,生成a型明膠微凝膠顆粒懸浮液;向懸浮液中加入25wt%戊二醛水溶液,使明膠微凝膠顆粒交聯,加入戊二醛的量為每g明膠對應25wt%戊二醛66μl,交聯反應時間12hr,得到a型明膠微凝膠顆粒,顆粒尺寸和表面zeta點位參數如表5所示。
通過乳液法制備海藻酸微凝膠顆粒,具體制備方法如下:將1wt%的海藻酸鈉的水溶液加入氯化鈣水溶液中并持續高速攪拌(攪拌速度>5000rpm),即得到海藻酸鈣顆粒,顆粒尺寸和表面zeta點位參數如表5所示。將a型明膠和海藻酸鈣微凝膠顆粒分別分散在10mm的醋酸酸性水溶液中,分別得到帶正電荷的a型明膠微凝膠顆粒的分散液ⅰ、帶負電荷的海藻酸微凝膠顆粒的分散液ⅱ,將分散液ⅰ和分散液ⅱ充分混合、攪拌,得分散液iii,其中a型明膠和海藻酸微凝膠顆粒混合的顆粒數量比為2:1;向分散液iii中加入100mm的氫氧化鈉調節ph值至7.0,攪拌混合,冷凍干燥,得到混有兩相不同膠體顆粒的凍干粉末。將上述微凝膠顆粒凍干粉末與一定體積的1mm的nacl鹽溶液共混,并快速攪拌混合均勻得到自愈合膠體凝膠,其中微凝膠膠體顆粒體積分數占膠體凝膠體積的50vol%或100vol%。使用流變儀對膠體凝膠的力學參數進行評價,結果如表6所示,帶相反電荷的海藻酸鈣和a型明膠膠體顆粒共混得到的膠體凝膠的彈性模量隨著膠體顆粒體積分數的增加而增加,體積分數100vol%時,儲存(彈性)模量g’超過12kpa。剪切破壞后5分鐘內自愈合效率同樣隨著膠體顆粒體積分數的增加而增加,體積分數100vol%時,彈性模量g’自愈合效率超過80%。
將上述膠體凝膠利用成標準抗拉(gb/t1040-1992)和抗壓(gb/t1041-1992)測試的標準樣條,對凝膠剪切破壞自修復前后進行抗拉和抗壓測試,結果如表7所示。
表5.實施例3中制備的a型明膠和海藻酸鈣微凝膠的性能參數
表6.實施例3中制備的自愈合膠體凝膠在不同膠體體積分數情況下的力學強度(流變測試彈性模量g')和自愈合效率。
*注:自修復效率是采用1000%的應變持續你剪切凝膠材料60s后,檢測應力釋放后5min內的彈性模量恢復的百分比(%)。
表7.對實施例3中制備的自愈合膠體凝膠的剪切破壞前后凝膠自愈合行為的力學性能
表7中的自愈合前是指對凝膠剪切破壞之前;自愈合后是指對凝膠剪切破壞后愈合。
實施例4
以a型明膠為原料,在加熱40℃下溶解,配置得到濃度為10w/v%的a型明膠水溶液,調節ph值為11,隨后向溶液中各加入2倍體積的乙醇,生成a型明膠微凝膠顆粒懸浮液;向懸浮液中加入25wt%戊二醛水溶液,使明膠微凝膠顆粒交聯,加入戊二醛的量為每g明膠對應25wt%戊二醛264μl,交聯反應時間12hr,反復離心并在去離子水中重懸,得到a型明膠微凝膠顆粒,顆粒尺寸和表面zeta點位參數如表8所示。
將聚乙二醇(peg,分子量2kda)溶于去離子水配置濃度為5w/v%peg水溶液。將上述方法制備的a型明膠微凝膠顆粒分散得到的peg水溶液中,進一步將peg水溶液與a型明膠微凝膠分散液充分共混,攪拌,得分散液iii,其中a型明膠微凝膠顆粒與peg的質量比為1:2。隨后將分散液iii的ph值調節至7.0,然后冷凍干燥,得到a型明膠膠體顆粒和peg的復合凍干粉末。將上述凍干粉末與一定體積的10mm的nacl鹽溶液共混,并快速攪拌混合均勻得到自愈合膠體凝膠,其中明膠微凝膠顆粒體積分數占自愈合凝膠體積分數為100vol%。使用流變儀對膠體凝膠的力學參數進行評價,結果如表9所示,當膠體凝膠中a型明膠膠體顆粒體積分數為100vol%時,儲存(彈性)模量g’約19kpa。剪切破壞后5分鐘內自愈合效率在膠體顆粒體積分數為100vol%時,彈性模量g’自愈合效率約為83%。
表8.實施例4中制備的a型明膠微凝膠顆粒的性能參數
表9.實施例4中制備的a型明膠微凝膠顆粒和peg共混制備的自愈合凝膠的力學強度(流變測試彈性模量g')和自愈合效率。
*注:自修復效率是采用1000%的應變持續你剪切凝膠材料60s后,檢測應力釋放后5min內的彈性模量恢復的百分比(%)。
實施例5
以a型明膠為原料,通過實施例2所述反溶劑法制備a型明膠微凝膠顆粒,戊二醛交聯濃度為每g明膠使用25wt%戊二醛的量為66μl,制備得到帶正電荷的a型明膠微凝膠顆粒;以b型明膠為原料,通過實施例2所述的反溶劑法制備b型明膠微凝膠顆粒,其中戊二醛交聯濃度為每g明膠使用25wt%戊二醛的量為264μl,制備得到帶負電荷的b型明膠微凝膠顆粒,制備參數和所得微凝膠顆粒尺寸和zeta點位數據如表10。
表10.實施例5中制備的不同類型明膠微凝膠顆粒的性能參數
將a型明膠顆粒分散在含100ng/ml濃度的堿性成纖維生長因子(bfgf)的水溶液中,將b型明膠顆粒分散在含100ng/ml濃度的股形態發生蛋白-2(bmp-2)的水溶液中,分別得到載有bfgf的a型明膠顆粒和載有bmp-2的b型明膠微凝膠顆粒的分散液。將上述兩種明膠顆粒分散液按照顆粒數比1:1充分混合,并冷凍干燥,得到載有不同生長因子的兩種明膠顆粒凍干粉末。將上述微凝膠顆粒凍干粉末與一定體積的1mm的nacl鹽溶液共混,并快速攪拌混合均勻,得到載有不同生長因子的、可注射型自愈合膠體凝膠,其中微凝膠膠體顆粒體積分數占膠體凝膠體積的100vol%。兩種不同的生長因子從膠體凝膠載體材料中體外釋放動力學的釋放曲線如圖5所示,載有bfgf的a型明膠由于交聯度低降解速率較快,因此bfgf釋放速率較快,載有bmp-2的b型明膠由于交聯度高降解速率慢,因此bmp-2釋放速率較為緩慢;結果表明本發明所述的膠體凝膠可實現不同生長因子藥物的有序釋放。
實施例6動物實驗
分別以a型明膠或b型明膠為原料,使其在去離子水中加熱40℃溶解,配置濃度為5w/v%的a型明膠水溶液和b型明膠水溶液,調節明膠水溶液ph值為11,隨后向溶液中加入4倍體積的丙酮,生成明膠微凝膠顆粒的分散液;分別向分散液中加入25wt%戊二醛水溶液,使明膠微凝膠顆粒交聯,加入戊二醛的量為每g明膠對應25wt%戊二醛132μl,交聯反應時間12hr,隨后加入賴氨酸中和未反應的醛基,離心清洗分別得到a型明膠和b型明膠微凝膠顆粒的分散液。將a型明膠和b型明膠微凝膠顆粒分別分散在20mm的鹽酸水溶液中,分別得到分散有帶正電荷的a型明膠微凝膠顆粒分散液和帶負電荷的b型明膠微凝膠顆粒分散液,將兩者充分混合、攪拌,得分散有兩種不同微凝膠顆粒的分散液,其中a型明膠和b型明膠混合的顆粒數量比為1:1;向分散液中加入80mm的碳酸氫鈉調節ph值至7.0,攪拌混合,冷凍干燥,得到含有兩種不同膠體顆粒的凍干粉末。將上述膠體顆粒凍干粉末與一定體積的磷酸緩沖溶液pbs共混,并快速攪拌混合均勻得到可注射型自愈合膠體凝膠,凝膠中膠體顆粒占凝膠總體積的百分比為75vol%。
以大鼠膝關節5mm直徑骨缺損為動物實驗模型,通過手術將制備得到的所述可注射型自愈合膠體凝膠作為填充物,直接用于骨缺損的填充修復。動物實驗過程如圖6所示,通過動物實驗證明本專利所述可注射型膠體凝膠可作為組織器官修復填充材料用于組織器官的修復再生。動物實驗結果如圖7所示。空白對照組是制造直徑為5mm的圓柱狀缺損后不做任何處理,4周后的缺損部位組織切片圖,結果顯示:由于制造的缺損是非極限缺損,動物自身的骨修復能力可以實現一定程度的骨修復,組織切片圖顯示骨組織有一定程度的修復。膠體凝膠組,即為制造缺損后,使用膠體凝膠進行填充修復,由于凝膠存在是骨組織自身的修復受到限制,因此缺損中心部位可見大量的纖維組織長入,4周后仍未實現骨缺損的修復重建。載bmp-2膠體凝膠組,即制造缺損后使用載生長因子bmp-2的膠體凝膠進行填充修復,由于膠體凝膠可實現生長因子的局部緩釋,有骨誘導的作用,因此組織切片結果顯示4周后骨缺損部位完全實現了骨修復。
實施例7作為3d打印生物墨水的應用
以a型明膠為原料,使其在去離子水中加熱40℃溶解,配置濃度為5w/v%的明膠水溶液,調節明膠水溶液ph值為10,隨后向溶液中加入3.5倍體積的異丙醇,生成明膠微凝膠顆粒的分散液;向分散液中加入25wt%戊二醛水溶液,使明膠微凝膠顆粒交聯,加入戊二醛的量為每g明膠對應25wt%戊二醛132μl,交聯反應時間12hr,隨后加入甘氨酸中和未反應的醛基,離心清洗,得到表面zeta電勢為正的a型明膠微凝膠顆粒。同樣方法,以b型明膠為原料制備得到表面zeta電勢為負的b型明膠微凝膠顆粒。將a型明膠和b型明膠微凝膠顆粒分別分散在20mm的naoh水溶液中,分別得到分散有帶正電荷的a型明膠微凝膠顆粒和帶負電荷的b型明膠微凝膠顆粒的分散液,將兩者充分混合、攪拌,得分散有兩種不同微凝膠顆粒的分散液,其中a型明膠和b型明膠混合的顆粒數量比為1:1;向分散液中加入100mm的鹽酸調節ph值至7.0,攪拌混合,冷凍干燥,得到含有兩種不同明膠膠體顆粒的凍干粉末。將上述混合物凍干粉末與磷酸緩沖液pbs共混,并快速攪拌混合均勻得到可注射型自愈合膠體凝膠。其中膠體凝膠中明膠膠體顆粒占凝膠總體積的百分比為100w/v%。
以上述方法制備的膠體凝膠作為細胞三維包埋和培養的支架材料,制備載細胞3d打印“生物墨水”。具體實施步驟如下:
(i)細胞培養:以nih3t3(
(ii)載細胞膠體凝膠的制備:將分散有細胞的細胞懸液與上述膠體凝膠混合均勻,從而得到膠體顆粒體積分數為75%的載有活體細胞的復合膠體凝膠,凝膠中細胞濃度為5×105個/cm3。將上述制備的載細胞明膠基可注射凝膠使用擠注式生物3d打印機(沈陽尚賢organp1800
通過使用死活熒光染色(live/dead熒光染色)對凝膠材料的細胞毒性進行考察。為此,染色前用無菌pbs清洗30分鐘,在室溫下加入2mm鈣黃綠素(綠色熒光標記活細胞)和4mm乙錠同型二聚體(紅色熒光標記死細胞),并使用共聚焦激光掃描顯微鏡檢查。結果如圖9所示,nih/3t3成纖維細胞在明膠基膠體凝膠內部均勻分散,且熒光染色顯示包埋細胞的存活率>90%,證實使用本發明所述膠體凝膠作為細胞外基質進行生物3d打印能保持細胞的生物活性和正常功能。
- 還沒有人留言評論。精彩留言會獲得點贊!