一種重組豬流行性腹瀉病毒抗體的制備方法與流程
本發明涉及的是豬流行性腹瀉病毒(PEDV)抗體的基因工程制備,具體涉及一種重組豬流行性腹瀉病毒抗體的制備方法。
二、
背景技術:
抗體是機體天然的內源性蛋白質,毒性低,特異性高,可直接作用于靶點,在疾病治療中廣泛應用,成為臨床應用的一類重要的生物技術藥物。截至2010年,美國FDA已批準25種抗體用于疾病治療,超過240種抗體應用于臨床,治療的疾病包括自身免疫性疾病和炎癥、癌癥、器官移植、心血管疾病、傳染病及眼科疾病等。抗體藥物的臨床成功使用產生了巨大的商業利潤,2007年的銷售額超過270億美元,占20個最暢銷生物技術藥物中的8個,生物醫藥20%的份額。
豬流行性腹瀉(porcine epidemic diarrhea, PED)是一種由豬流行性腹瀉病毒(porcine epidemic diarrhea virus, PEDV)引起的高度傳染性腸道疾病。任何年齡的豬均可感染,對仔豬影響尤其嚴重,病死率非常高;對成年的懷孕母豬來說,感染后繁殖性能受到影響,如懷孕早期的母豬感染后會出現流產,受孕率降低;育肥豬感染后體重下降。目前,雖然商品化PEDV疫苗,PEDV與豬傳染性胃腸炎(TGEV)的二聯苗已普遍使用,但該病仍然很流行。2007年,泰國暴發了PED,大批的仔豬發生死亡,造成嚴重經濟損失。同時,PEDV作為冠狀病毒的一員,病毒基因組大,突變率高,弱毒疫苗回復突變的可能性大。亞單位疫苗的研制也沒有從根本上解決PEDV的感染問題,仔豬常常由于母源抗體低、消失或者沒有母乳而失去被動免疫;或者仔豬自身注射疫苗產生的抗體來不及起到保護作用,而傳統的PEDV治療方法又無法滿足人們對綠色食品需求。因此,研制一種有效防控豬流行性腹瀉的抗體藥物十分必要。
三、
技術實現要素:
本發明目的是提供了一種重組豬流行性腹瀉病毒抗體的制備方法,這種重組豬流行性腹瀉病毒抗體的制備方法用以解決傳統的鼠源PEDV抗體會產生免疫反應、制備周期長、抗體中和活性低的問題。
為了實現上述目的,本發明采用的具體技術方案如下:這種重組豬流行性腹瀉病毒抗體的制備方法:選取抗原抗體共表達的方式,將PEDV抗原基因S1和anti-PEDV ScFv基因共同表達在大腸桿菌周質腔內,利用流式細胞術進行三輪淘選;用大腸桿菌表達ScFv基因后純化PEDV抗體,用ELISA方法檢測PEDV ScFv抗體特異性,命名為PEDV-ScFv;具體通過抗PEDV ScFv文庫的構建、抗PEDV抗體的制備兩個步驟進行。
上述方案中抗PEDV ScFv文庫的構建的方法如下:
1. 動物免疫及血清抗體效價的檢測:
3-6日齡仔豬先以PEDV弱毒疫苗免疫,之后以中等毒力毒株攻毒,前后共3次;每次免疫或攻毒前1天及最后一次免疫1周后采血,間接ELISA檢測血清抗體效價;96孔酶標板包被重組PEDV的S1蛋白,一抗為待測血清,每板設空白對照、陰性對照和陽性對照各2孔,辣根過氧化物酶標記的兔抗豬IgG為二抗,TMB顯色,用酶標儀讀取各孔OD值;最后一次免疫1周后,選用抗體效價高的陽性血清,加入疊氮鈉至終濃度為0.2%,4 oC放置待用;
將抗體效價較高的三頭仔豬處死,取脾臟,將其置于300目尼龍網上研碎,取細胞懸液;脾細胞懸液加ACK lysing buffer,室溫放置5 min,2000 g離心10 min,收集白細胞沉淀;按106個細胞/ml的量加入Trizol,裂解細胞,提取總RNA;以提取的三頭豬脾臟的淋巴細胞混合后的總RNA為模板,Oligo(dT)-18為引物,參照M-MLV反轉錄酶說明書,進行cDNA第一條鏈合成,并用1 μl反轉錄產物進行1%瓊脂糖凝膠電泳檢查其質量;
根據GenBank上已發表的豬抗體重鏈VH、輕鏈VL可變區基因的兩端恒定區序列,分別利用引物設計軟件Primer 5.0分析設計引物,并在重鏈上下游分別加入Nhe I、Nde I酶切位點,輕鏈下游分別加入Bam HI、Not I酶切位點;以免疫后豬脾cDNA為模板,分別以VH上游引物、VH下游引物和VL上游引物、VL下游引物進行梯度PCR擴增;對VH和VL擴增產物進行膠回收,并與pMD18-T載體連接,轉化DH5α,并隨機挑取1個單菌落進行測序,確定獲得的基因序列為豬源抗體。
2. ScFv細菌展示抗體庫的構建:
以免疫后豬脾cDNA為模板,以VH上游引物、VH下游引物擴增重鏈可變區基因,其中VH的5’端引入NheI酶切位點,3’引入NdeI酶切位點,PCR產物利用瓊脂糖凝膠DNA回收試劑盒進行純化;取VH PCR純化產物與pMD18-T載體連接,轉化DH5α,并隨機挑取1個單菌落進行測序;進行Nhe I、Nde I雙酶切,37oC水浴3h,1%瓊脂糖凝膠電泳鑒定,并進行轉化構建VH抗體庫;次日,收集所有菌落并提取質粒,進行Bam HI、Not I雙酶切鑒定;然后用BamH I、Not I對VL PCR回收產物進行雙酶切;酶切后進行膠回收,連接并轉化DH5α,涂布平板,37oC過夜培養,收集菌落并提取質粒,即為PEDV-ScFv抗體庫;
取構建的PEDV-ScFv抗體庫進行酶切鑒定和PCR鑒定,分別用Nhe I、Nde I和Bam HI、Not I對抗體庫進行雙酶切;取PEDV-ScFv抗體庫質粒為模板,分別使用VH和VL的上下游引物對其進行PCR鑒定。
上述方案中抗PEDV抗體的制備方法如下:
1. 流式細胞術篩選大腸桿菌pBSD-PEDV ScFv展示文庫:
取上述收集的文庫所有菌落用LB液體培養基稀釋至OD600≈0.2,37 oC培養2h,使之OD600≈0.4,加入IPTG至終濃度為2.5 mmol/L,誘導4 h。在1.5 ml Eppendorf管中加入1.5 ml培養物,6000 rpm離心3 min,去掉上清;
菌體沉淀用350μl Sucrose /Tris solution重懸,Sucrose 的濃度為0.75mmol/L,Tris的濃度為0.1mol/L;加入35 μl濃度為10 mg/ml新鮮配制的溶菌酶母液;逐滴加入700 μl 1 mmol/L EDTA溶液,同時渦旋混勻;冰上孵育15 min;加入50 μl 0.5mol/L MgCl2溶液,并在冰上孵育10 min;4 oC,10000 rpm離心10 min;原生質球沉淀用1 ml PBS溶液重懸洗滌,6000 rpm離心3 min,去上清;原生質球沉淀用100 μl PBS重懸;
在100 μl PBS重懸的已誘導菌液中加入10 μl 質量體積比為1% BSA貯存液、1.5 μg FITC標記后的S1,冰上避光孵育1 h;8000 rpm,離心3 min,1 ml PBS重懸洗滌一次,沉淀用100 μl PBS重懸。設置陰性對照,將空白菌DH5α處理成為原生質球,空白菌DH5α 中不含pBSD-IBDV ScFv重組質粒,用標記后的VP2抗原孵育;
用流式細胞儀于488 nm波長激光下,檢測樣品及陰性對照的熒光強度,收集樣品中熒光強度高于陰性對照的部分;將分選出來的細菌進行質粒制備,電擊轉化至大腸桿菌DH5α,構建次級篩選庫,按上述的方法進行第二輪篩選,將每個峰值范圍內的細胞分選出來,制備質粒后轉化大腸桿菌DH5α,構建次級篩選庫,按上述的方法進行第三輪篩選后,挑取單菌落20個,擴培后逐個用流式細胞儀進行檢測,選出熒光信號比陰性對照強的克隆,進行測序并分析;
2. 抗PEDV ScFv抗體在大腸桿菌中的表達純化及活性:
將質粒測序后與網上的豬源抗體進行序列比對,利用引物設計軟件Primer Premier 5.0分析設計PCR引物P1、P2,選取兩個進行PCR擴增、純化、連接入pMD18-T載體,轉化到大腸桿菌DH5α感受態細胞,挑取陽性克隆,接種于LB液體培養基中過夜培養,提取質粒,PCR和酶切鑒定后送去測序;測序結果正確后,對質粒進行雙酶切,連入pET-27b載體,轉化入Rosetta中;
挑取含有表達載體pET-27b-ScFv的Rosetta單菌落,分別接種于含有100 μg/ml Amp+的LB液體培養基中,37 oC過夜培養;次日取上述過夜培養物以1%的比例分別接種于含100 μg/ml Amp+的LB液體培養基中,37 oC振蕩培養2h,加IPTG 37 oC繼續培養,誘導4h。取1ml培養物菌體;洗滌后加入預冷PBS重懸;加入5×SDS樣品緩沖液,煮沸5 min;取20μl樣品進行SDS-PAGE;電泳后,經考馬斯亮藍R-250染色,用甲醇-冰乙酸脫色液脫色,觀察結果;
挑取轉化重組質粒pET-27b-ScFv單個菌落接種于含有100 μg/ml Amp+的LB液體培養基中,培養過夜;取上述兩種過夜培養物以1%的比例接種于1L含有100 μg/ml Amp+的新鮮LB液體培養基中,37 oC振蕩培養至OD600值達到0.3時,加IPTG至終濃度0.25 mmol/L,37 oC繼續誘導培養4 h;取出培養物于4 oC以12000 r/min離心5 min,收集菌體;棄上清,每20 ml菌液沉淀加入1ml Binding buffer重懸菌體,加入溶菌酶至終濃度1mg/ml,在冰上高強度超聲破碎約40 min,每次10s,每次間隔10s;菌體經超聲波破碎后12000 rpm 4 oC離心30 min,分別收集包涵體;洗滌后分別用變性液溶解4 oC過夜;將溶解后蛋白加入到10倍體積的復性液中,4 oC復性24 h,pH調至7.4左右;在經pH 7.4的PBS 于4 oC透析3次,每次8 h;純化后的蛋白進行SDS-PAGE,并用紫外分光光度計檢測其濃度;將抗原蛋白以濃度梯度包被96孔板,于4 oC包被過夜。PBST洗96孔板3次,每次2 min,用5%脫脂奶粉37 oC封閉2h,分別加封閉液稀釋的濃度梯度為100 μg/mL, 10 μg/mL, 5 μg/mL, 1 μg/mL陰性對照不加抗體的S1蛋白,37 oC孵育2 h,PBST洗96孔板3次,再加入二抗HRP-goat anti-porcine IgG,37 oC溫育1 h,PBS洗96孔板4次后,加入TMB底物液,于37 oC避光顯色5 min,每孔加入50 μL終止液,用酶標儀于波長450 nm下檢測其OD值。
上述方案中S1擴增的引物:
上游引物5’- GGTCTCTAGGTGTTACTTTGCCATCATTTAA-3’(SEQ ID NO:1)
下游引物5’- ATGGATCCTTAAACGTCCGTGACACCTTCAA-3’(SEQ ID NO:2)。
上述方案中Binding buffer的組成為:8 mol/L Urea,0.1 mol/LNaH2PO4,0.01 mol/L Tris,,Binding buffer的 pH 8.0。
上述方案中變性液的組成為:8 mol/L尿素、0.1 mol/L Na2HPO4, 0.01 mol/L Tris-HCL, pH 8.0。
上述方案中復性液配方為還原型谷胱甘肽和氧化型谷胱甘肽至終濃度為2 mmol/L和0.2 mmol/L、精氨酸鹽酸鹽至終濃度0.5 mol/L、甘油至終濃度10%、Tris至終濃度0.4 mol/L,復性液pH調至7.4左右。
上述方案中終止液為2 mol/L的H2SO4。
有益效果:
1、本發明提供的豬源PEDV抗體不會產生免疫反應、針對性強、更容易篩選到中和活性高的抗體、制備周期短、速度快。
2、本發明以大腸桿菌展示的方式,通過流式細胞術三輪的篩選,得到了anti-PEDV的豬源抗體,具有中和PEDV能力,可作為PEDV的臨床治療性抗體。
3、本發明提供的PEDV抗體為豬源抗體,在對仔豬腹瀉治療過程中可避免由鼠源抗體引起的豬抗鼠抗體產生。
4、本發明制備方法簡單易行,適合擴大中試生產,市場前景廣闊。
四、附圖說明
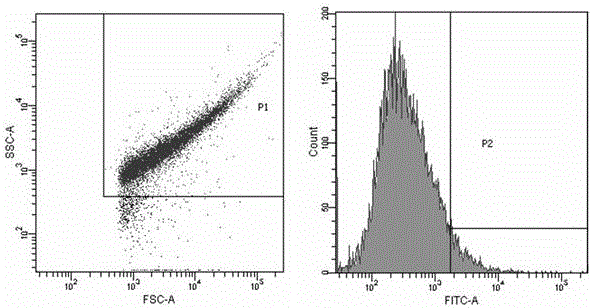
圖1是本發明中流式細胞術分選抗PEDV單鏈抗體的空白對照;
圖2是本發明中流式細胞術第一輪分選抗PEDV的單鏈抗體;
圖3是本發明中流式細胞術第二輪分選抗PEDV的單鏈抗體;
圖4是本發明中流式細胞術第三輪分選抗PEDV的單鏈抗體;
圖5是本發明中PEDV抗體的表達與純化;
圖6是本發明中PEDV抗體的親和性分析。
五、具體實施方式
下面對本發明做進一步的說明:
這種重組豬流行性腹瀉病毒抗體的制備方法:選取抗原抗體共表達的方式,將PEDV抗原基因S1和anti-PEDV ScFv基因共同表達在大腸桿菌周質腔內,利用流式細胞術進行三輪淘選。用大腸桿菌表達ScFv基因后純化PEDV抗體,用ELISA方法檢測PEDV ScFv抗體特異性,命名為PEDV-ScFv。
上述PEDV抗體的具體制備方法:
一、抗PEDV ScFv文庫的構建
1. 動物免疫及血清抗體效價的檢測
3-6日齡仔豬先以PEDV弱毒疫苗免疫,之后以中等毒力毒株攻毒,前后共3次。每次免疫或攻毒前1天及最后一次免疫1周后采血,間接ELISA檢測血清抗體效價。96孔酶標板包被重組PEDV的S1蛋白,一抗為待測血清,每板設空白對照、陰性對照和陽性對照各2孔,辣根過氧化物酶標記的兔抗豬IgG為二抗,TMB顯色,用酶標儀讀取各孔OD值。最后一次免疫1周后,選用抗體效價高的陽性血清,加入疊氮鈉至終濃度為0.2%,4 oC放置待用。將抗體效價較高的三頭仔豬處死,取脾臟,將其置于300目尼龍網上研碎,取細胞懸液。脾細胞懸液加ACK lysing buffer,室溫放置5 min,2000 g離心10 min,收集白細胞沉淀。按106個細胞/ml的量加入Trizol,裂解細胞,提取總RNA。以提取的三頭豬脾臟的淋巴細胞混合后的總RNA為模板,Oligo(dT)-18為引物,參照M-MLV反轉錄酶說明書,進行cDNA第一條鏈合成,并用1 μl反轉錄產物進行1%瓊脂糖凝膠電泳檢查其質量。根據GenBank上已發表的豬抗體重鏈(VH)、輕鏈(VL)可變區基因的兩端恒定區序列,分別利用引物設計軟件Primer 5.0分析設計引物,并在重鏈上下游分別加入Nhe I、Nde I酶切位點,輕鏈下游分別加入Bam HI、Not I酶切位點。以免疫后豬脾cDNA為模板,分別以VH上游引物、VH下游引物和VL上游引物、VL下游引物進行梯度PCR擴增。對VH和VL擴增產物進行膠回收,并與pMD18-T載體連接,轉化DH5α,并隨機挑取1個單菌落進行測序,確定獲得的基因序列為豬源抗體。
S1擴增的引物:
上游引物5’- GGTCTCTAGGTGTTACTTTGCCATCATTTAA-3’(SEQ ID NO:1)
下游引物5’- ATGGATCCTTAAACGTCCGTGACACCTTCAA-3’(SEQ ID NO:2)
2. ScFv細菌展示抗體庫的構建
以豬脾cDNA為模板,以VH上游引物、VH下游引物擴增重鏈可變區基因,其中VH的5’端引入NheI酶切位點,3’引入NdeI酶切位點,PCR產物利用瓊脂糖凝膠DNA回收試劑盒進行純化。取VH PCR純化產物與pMD18-T載體連接,轉化DH5α,并隨機挑取1個單菌落進行測序。進行Nhe I、Nde I雙酶切,37oC水浴3 h,1%瓊脂糖凝膠電泳鑒定,并進行轉化構建VH抗體庫。次日,收集所有菌落并提取質粒,進行Bam HI、Not I雙酶切鑒定。然后用BamH I、Not I對VL PCR回收產物進行雙酶切,酶切體系同上。酶切后進行膠回收,連接并轉化DH5α,涂布平板,37oC過夜培養,收集菌落并提取質粒,即為PEDV-ScFv抗體庫。取構建的PEDV-ScFv抗體庫進行酶切鑒定和PCR鑒定,分別用Nhe I、Nde I和Bam HI、Not I對抗體庫進行雙酶切。取PEDV-ScFv抗體庫質粒為模板,分別使用VH和VL的上下游引物對其進行PCR鑒定。
PEDV抗體的ScFV基因序列如序列表中的序列3表示。
二、抗PEDV抗體的制備
1. 流式細胞術篩選大腸桿菌(pBSD-PEDV ScFv)展示文庫
取上述收集的文庫所有菌落用LB液體培養基稀釋至OD600≈0.2,37 oC培養2h,使之OD600≈0.4,加入IPTG至終濃度為2.5 mmol/L,誘導4 h。在1.5 ml Eppendorf管中加入1.5 ml培養物,6000 rpm離心3 min,去掉上清。菌體沉淀用350 μl Sucrose (0.75mmol/L)/Tris (0.1mol/L) solution重懸;加入35 μl濃度為10 mg/ml新鮮配制的溶菌酶母液;逐滴加入700 μl 1 mmol/L EDTA溶液,同時渦旋混勻;冰上孵育15 min;加入50 μl 0.5mol/L MgCl2溶液,并在冰上孵育10 min;4 oC,10000 rpm離心10 min;原生質球沉淀用1 ml PBS溶液重懸洗滌,6000 rpm離心3 min,去上清;原生質球沉淀用100 μl PBS重懸。在100 μl PBS重懸的菌液(已誘導)中加入10 μl 1% (質量體積比) BSA貯存液、1.5 μg FITC標記后的S1,冰上避光孵育1 h;8000 rpm,離心3 min,1 ml PBS重懸洗滌一次,沉淀用100 μl PBS重懸。設置陰性對照,將空白菌DH5α (不含pBSD-IBDV ScFv重組質粒)處理成為原生質球,用標記后的VP2抗原孵育。用流式細胞儀于488 nm波長激光下,檢測樣品及陰性對照的熒光強度,收集樣品中熒光強度高于陰性對照的部分。將分選出來的細菌進行質粒制備,電擊轉化至大腸桿菌DH5α,構建次級篩選庫,按上述的方法進行第二輪篩選,將每個峰值范圍內的細胞分選出來,制備質粒后轉化大腸桿菌DH5α,構建次級篩選庫,按上述的方法進行第三輪篩選后,挑取單菌落20個,擴培后逐個用流式細胞儀進行檢測,選出熒光信號比陰性對照強的克隆,進行測序并分析。
2. 抗PEDV ScFv抗體在大腸桿菌中的表達純化及活性
將質粒測序后與網上的豬源抗體進行序列比對,利用引物設計軟件Primer Premier 5.0分析設計PCR引物P1、P2,選取兩個進行PCR擴增、純化、連接入pMD18-T載體,轉化到大腸桿菌DH5α感受態細胞,挑取陽性克隆,接種于LB液體培養基中過夜培養,提取質粒,PCR和酶切鑒定后送去測序。測序結果正確后,對質粒進行雙酶切,連入pET-27b載體,轉化入Rosetta中。挑取含有表達載體pET-27b-ScFv的Rosetta單菌落,分別接種于含有100 μg/ml Amp+的LB液體培養基中,37 oC過夜培養。次日取上述過夜培養物以1%的比例分別接種于含100 μg/ml Amp+的LB液體培養基中,37 oC振蕩培養2 h,加IPTG 37 oC繼續培養,誘導4 h。取1 ml培養物菌體。洗滌后加入預冷PBS重懸。加入5×SDS樣品緩沖液(含DTT),煮沸5 min。取20 μl樣品進行SDS-PAGE。電泳后,經考馬斯亮藍R-250染色,用甲醇-冰乙酸脫色液脫色,觀察結果。挑取轉化重組質粒pET-27b-ScFv單個菌落接種于含有100 μg/ml Amp+的LB液體培養基中,培養過夜。取上述兩種過夜培養物以1%的比例接種于1 L含有100 μg/ml Amp+的新鮮LB液體培養基中,37 oC振蕩培養至OD600值達到0.3時,加IPTG至終濃度0.25 mmol/L,37 oC繼續誘導培養4 h。取出培養物于4 oC以12000 r/min離心5 min,收集菌體。棄上清,每20 ml菌液沉淀加入1 ml Binding buffer (8 mol/L Urea, 0.1 mol/LNaH2PO4, 0.01 mol/L Tris, pH 8.0)重懸菌體,加入溶菌酶至終濃度1 mg/ml,在冰上高強度超聲破碎約40 min,每次10 s,每次間隔10 s。菌體經超聲波破碎后12000 rpm 4 oC離心30 min,分別收集包涵體。洗滌后分別用變性液(8 mol/L尿素、0.1 mol/L Na2HPO4, 0.01 mol/L Tris-HCL, pH 8.0)溶解4 oC過夜。將溶解后蛋白加入到10倍體積的復性液中,4 oC復性24 h,復性液配方為還原型谷胱甘肽和氧化型谷胱甘肽至終濃度為2 mmol/L和0.2 mmol/L、精氨酸鹽酸鹽至終濃度0.5 mol/L、甘油至終濃度10%、Tris至終濃度0.4 mol/L,pH調至7.4左右。在經PBS (pH 7.4) 4 oC透析3次,每次8 h。純化后的蛋白進行SDS-PAGE,并用紫外分光光度計檢測其濃度。將抗原蛋白以濃度梯度包被96孔板,于4 oC包被過夜。PBST洗96孔板3次,每次2 min,用5%脫脂奶粉37 oC封閉2 h,分別加封閉液稀釋的濃度梯度為100 μg/mL, 10 μg/mL, 5 μg/mL, 1 μg/mL的S1蛋白(陰性對照不加抗體),37 oC孵育2 h,PBST洗96孔板3次,再加入二抗HRP-goat anti-porcine IgG (H+L) (陽性對照孔加HRP-goat anti-mouse antibody購自R&D公司),37 oC溫育1 h,PBS洗96孔板4次后,加入TMB底物液,于37 oC避光顯色5 min,每孔加入50 μL終止液(2 mol/L的H2SO4),用酶標儀于波長450 nm下檢測其OD值。
實施例1:
首先選用中等毒力的毒株對仔豬進行攻毒,檢測仔豬的抗體效價,之后對提取的仔豬脾臟的RNA并反轉錄成cDNA,構建抗體庫。在制備抗原之前,對PEDV S基因進行了生物信息學分析,發現其糖基化位點較多,表達難度大,產量低,因而后期實驗選取了抗原抗體共表達的方式,利用流式細胞術進行了ScFv抗體庫三輪篩選。然后提取質粒,PCR擴增后、克隆到T載體上,送上海生工測序。采用Primer5.0和DNAMAN軟件進行序列分析,將質粒測序后與網上的豬源抗體進行序列比對,利用引物設計軟件Primer Premier 5.0分析設計PCR引物P1、P2,選取兩個進行PCR擴增、純化、連接入pMD18-T載體,轉化到大腸桿菌DH5α感受態細胞,挑取陽性克隆,接種于LB液體培養基中過夜培養,提取質粒,PCR和酶切鑒定后送去測序。測序結果正確后,對質粒進行雙酶切,之后連入表達載體,轉化入Rosetta中IPTG誘導表達。取1 ml培養物菌體,洗滌后加入預冷PBS重懸,加入SDS樣品緩沖液(含DTT),煮沸。取20 μl樣品進行SDS-PAGE。電泳后,經考馬斯亮藍R-250染色,用甲醇-冰乙酸脫色液脫色,可以看到ScFv在大腸桿菌中表達。挑取轉化陽性重組質粒pET-27b-ScFv單個菌落接種于含有Amp+的LB液體培養基中,經過連續培養過夜,加IPTG誘導,離心收集菌體。加入溶菌酶,在冰上高強度超聲破碎。菌體經超聲波破碎后離心,分別收集包涵體。洗滌后進行變性和復性,獲得純化的蛋白后進行SDS-PAGE,并用紫外分光光度計檢測其濃度,用ELISA檢測抗PEDV ScFv,證實PEDV ScFv具有特意中和病毒的能力。
序列表1
<110> 黑龍江八一農墾大學
<120> 一種重組豬流行性腹瀉病毒抗體的制備方法
<160> 3
<210> 1
<211> 31
<212> DNA
<213> 人工序列
<400> 1
GGTCTCTAGGTGTTACTTTGCCATCATTTAA 31
序列表2
<110> 黑龍江八一農墾大學
<120> 一種重組豬流行性腹瀉病毒抗體的制備方法
<160> 3
<210> 2
<211> 31
<212> DNA
<213> 人工序列
<400> 2
ATGGATCCTTAAACGTCCGTGACACCTTCAA 31
序列表3
<110> 黑龍江八一農墾大學
<120> 一種重組豬流行性腹瀉病毒抗體的制備方法
<160> 3
<210> 3
<211> 753
<212> DNA
<213> 人工序列
<400> 3
1 GAGGTGAAGCTGGTGGAGTCTGGAGGAGGCCTGGTGCAGCCTGGGGGGTCTCTG
55 AGACTCTCCTGTGTCGGCTCTGGATTCACCTTCAGTAGTTATGCAATGAGCTGG
109 GTCCGCCAGGCTCCAGGGAAGGGGCTGGAGTGGCTCGCATCTATTTATAGTAGT
163 GGTTGTAGCACCTACTACACAGACTCTGTGAAGGGCCGATTCACGTTCTCCATC
217 CACGACTCCCAGAACAAGGTGTATCTGCAAATCAACAGCCTCAGAACCGAAGAT
271 ACGGCCCGGTATTACTGTGCGATAGGCCCAGCGGTTGCTATAGCGGTTACTGTG
325 CAAGAGGCCGAATTCGGTGGCGGTGGCTCCGGCGGTGGTGGGTCGGGTGGCGGC
379 GGATCTGGTGGCGGTGGCTCGGGCGGTGGTGGGTCGGGTGGCGGCGGATCACTC
433 GAGGCCATCGTGCTGACCCAGACTCCAGCCTCCCTGGCTGCATCTCTAGGAGAC
487 ACGGTCTCCATCACTTGCCGGGCCAGTCAGAGTGTTAGGAGTTATTTAGCCTGG
541 TATCAACAACAACCAGGGAAGGCTCCGAAACTCGTGATCTATGCTACATCCAAT
595 TTAGAAAGTGGGGTCCCATCCCGCTTCAAGGGCAGTGGATCTGGCACCGATTTC
649 ACCCTCACCATCAGTGGCCTGCAGGCTGAAGATGTTGCAACTTATTACTGTTTG
703 CAGTGGAGCGGTGTATATGGTTTCGGCGCGGGGACCAAACTGGAGCTCAAA
序列表1
<110> 黑龍江八一農墾大學
<120> 一種重組豬流行性腹瀉病毒抗體的制備方法
<160> 3
<210> 1
<211> 31
<212> DNA
<213> 人工序列
<400> 1
GGTCTCTAGGTGTTACTTTGCCATCATTTAA 31
序列表2
<110> 黑龍江八一農墾大學
<120> 一種重組豬流行性腹瀉病毒抗體的制備方法
<160> 3
<210> 2
<211> 31
<212> DNA
<213> 人工序列
<400> 2
ATGGATCCTTAAACGTCCGTGACACCTTCAA 31
序列表3
<110> 黑龍江八一農墾大學
<120> 一種重組豬流行性腹瀉病毒抗體的制備方法
<160> 3
<210> 3
<211> 753
<212> DNA
<213> 人工序列
<400> 3
1 GAGGTGAAGCTGGTGGAGTCTGGAGGAGGCCTGGTGCAGCCTGGGGGGTCTCTG
55 AGACTCTCCTGTGTCGGCTCTGGATTCACCTTCAGTAGTTATGCAATGAGCTGG
109 GTCCGCCAGGCTCCAGGGAAGGGGCTGGAGTGGCTCGCATCTATTTATAGTAGT
163 GGTTGTAGCACCTACTACACAGACTCTGTGAAGGGCCGATTCACGTTCTCCATC
217 CACGACTCCCAGAACAAGGTGTATCTGCAAATCAACAGCCTCAGAACCGAAGAT
271 ACGGCCCGGTATTACTGTGCGATAGGCCCAGCGGTTGCTATAGCGGTTACTGTG
325 CAAGAGGCCGAATTCGGTGGCGGTGGCTCCGGCGGTGGTGGGTCGGGTGGCGGC
379 GGATCTGGTGGCGGTGGCTCGGGCGGTGGTGGGTCGGGTGGCGGCGGATCACTC
433 GAGGCCATCGTGCTGACCCAGACTCCAGCCTCCCTGGCTGCATCTCTAGGAGAC
487 ACGGTCTCCATCACTTGCCGGGCCAGTCAGAGTGTTAGGAGTTATTTAGCCTGG
541 TATCAACAACAACCAGGGAAGGCTCCGAAACTCGTGATCTATGCTACATCCAAT
595 TTAGAAAGTGGGGTCCCATCCCGCTTCAAGGGCAGTGGATCTGGCACCGATTTC
649 ACCCTCACCATCAGTGGCCTGCAGGCTGAAGATGTTGCAACTTATTACTGTTTG
703 CAGTGGAGCGGTGTATATGGTTTCGGCGCGGGGACCAAACTGGAGCTCAAA
- 還沒有人留言評論。精彩留言會獲得點贊!