一種具有快速穿過細胞膜特性的多重響應性高分子納米載體及其合成方法和應用與流程
本發明涉及聚合物反應領域,一種具有快速穿過細胞膜特性的多重響應性高分子納米載體及其合成方法和應用。
背景技術:
近年來,隨著納米技術與合成化學的飛速發展,納米載體在生物醫學領域中的應用研究受到越來越多的關注;其中,高分子基納米載體為生物醫學成像、診斷、以及藥物輸運提供了新的手段和思路。研究表明,納米至亞微米尺度的載體對組織粘膜有著較強的吸附和穿透,高分子基膠束、囊泡等納米結構可通過在腫瘤組織內的增強滲透和滯留(EPR)效應而“被動靶向”至腫瘤部位。
對于具有生物相容性的兩親性嵌段共聚物而言,其在水溶液中的濃度達到臨界膠束濃度(CMC)以上時能形成以親水嵌段為外殼、以疏水嵌段為內核的組裝體,這就賦予了疏水內核增溶憎水性染料分子或藥物分子的能力,從而實現對腫瘤部位的光學成像及藥物輸運。
藥物分子能夠順利實現跨膜輸送至細胞核是實施腫瘤治療的關鍵,然而,細胞膜的生物屏障作用會阻止很多高分子物質進入細胞內,從而很大程度上限制人工合成高分子作為藥物載體的可能性以及在后續治療上的應用。因此,如何便捷引導這類物質穿透細胞膜是一個迫切需要解決的問題。目前,有效介導大分子穿透細胞膜的方法之一即為細胞穿透肽(CPPs),CPPs能夠以非受體依賴和非經典內吞方式直接穿過細胞膜進入細胞,達到高效輸送藥物分子的目的。已知的部分CPPs要么具有固有的螺旋結構,要么能夠在細胞膜表面形成螺旋結構,加上疏水部分能形成剛性的兩親性結構,兩者的協同效應使CPPs能夠更加有效的與細胞膜磷脂層作用,從而促進細胞通透性。程建軍等報道了一種基于長疏水側鏈的聚精氨酸模塊,該聚合物具有穩定的螺旋結構,其細胞膜通透性與常規多肽相比有二個數量級的提高,并且具有極好的DNA與siRNA的輸運能力。
聚苯異腈(PPIs)是最早發現的具有穩定螺旋構象的高分子之一,其性質穩定、單體易得、聚合方法簡單、在溶液中和固態時均能很好的保持螺旋結構,因而是一種非常有意義的人工合成螺旋聚合物。日本Yashima教授等報道了在金屬催化劑催化下的活性聚合苯基異腈及其聚合物的組裝行為,這種聚苯異腈可以形成非常穩定的剛性螺旋構象,并能穩定的存在于溶液、本體、以及基材表面。
因此,本領域的技術人員致力于開發一種手性親水性苯異腈單體和刺激響應性苯異腈單體,采用含花菁結構的雙官能團引發劑,聚合苯異腈與丙交酯或ε-己內酯單體得到兩親性的嵌段聚合物,自組裝形成最外層為親水性左手螺旋的“洋蔥”結構納米載體。從而提供一種具有快速穿過細胞膜特性的多重響應性高分子納米載體,兼具化學-光熱協同治療的特性。
技術實現要素:
本發明的目的在于:提供一種具有快速穿過細胞膜特性的多重響應性高分子納米載體及其合成方法和應用。
為了實現上述發明目的,本發明采用的技術方案如下:
一種具有快速穿過細胞膜特性的多重響應性高分子納米載體,是由具有多重響應性的兩親性三嵌段共聚物組裝而成,其中,具有多重響應性的兩親性三嵌段共聚物的結構由如下通式表示:
R1為具有刺激響應性的基團,R2為手性PEG親水鏈;
x=20-50,y=20-50,z=30-80。
優選地,所述的納米載體呈“洋蔥”結構,由內向外依次為酸響應性PLLA內核、具有近紅外吸收特性的花菁分子、雙氧水響應性聚苯異腈中間層、左手螺旋親水聚苯異腈親水鏈。
優選地,一種具有快速穿過細胞膜特性的多重響應性高分子納米載體的合成方法,具體步驟如下:
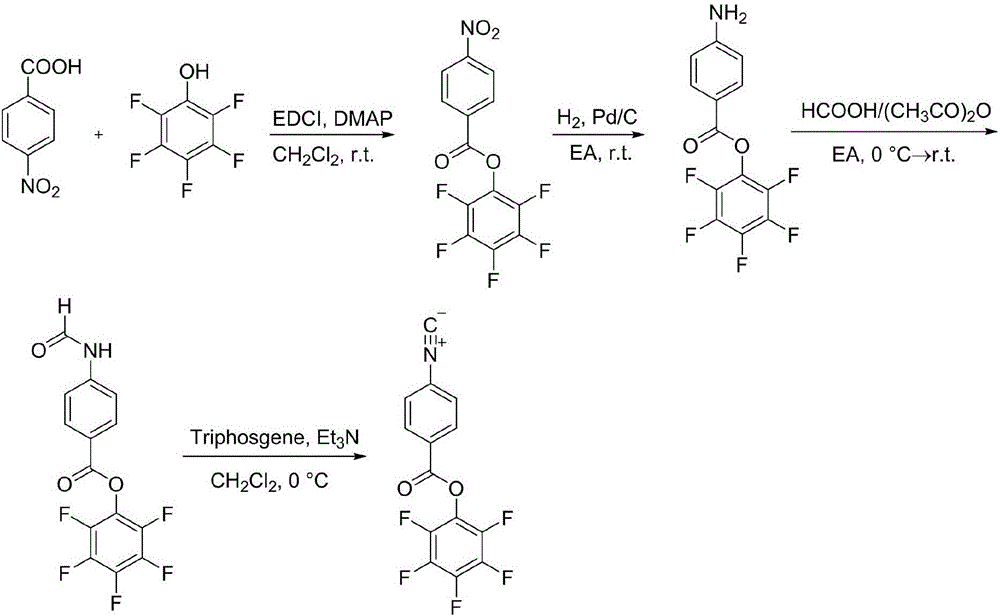
(1)五氟苯酚異腈的合成,按以下步驟操作:
a、對硝基苯甲酸和五氟苯酚反應,分離、洗滌并干燥后得到產物Ⅰ,其結構式為:
b、產物Ⅰ與氫氣反應,分離、洗滌并干燥后得到產物Ⅱ,其結構式為:
c、產物Ⅱ與甲酸/乙酸酐反應,分離、洗滌并干燥后得到產物Ⅲ,其結構式為:
d、產物Ⅲ與三光氣反應,分離、洗滌并干燥后得到五氟苯酚異腈,其結構式為:
(2)具有雙氧水響應的苯異腈的合成,按以下步驟操作:
五氟苯酚異腈與4-羥甲基苯硼酸頻哪醇酯反應,分離、洗滌并干燥后得到具有雙氧水響應的苯異腈,其結構式為:
(3)具有手性的親水苯異腈單體的合成,按以下步驟操作:
a、Cbz-丙氨酸與五乙二醇單甲醚反應,分離、洗滌并干燥后得到產物Ⅳ,其結構式為:
b、產物Ⅳ與氫氣反應,分離、洗滌并干燥后得到產物Ⅴ,其結構式為:
c、產物Ⅴ與五氟苯酚異腈反應,分離、洗滌并干燥后得到具有手性的親水苯異腈單體,其結構式為:
(4)具有多重響應性的兩親性三嵌段共聚物的合成,按以下步驟操作:
a、在聚合瓶中加入含花菁結構的雙官能團引發劑,羥基進行內酯類開環聚合,鈀引發具有雙氧水響應的苯異腈配位聚合,分離、洗滌并干燥后得到中間體Ⅰ,其結構式為:
其中R1為具有刺激響應性的基團;
b、將所述中間體Ⅰ與具有手性的親水苯異腈單體反應,分離、洗滌并干燥后得到具有多重響應性的兩親性三嵌段共聚物,其結構式為:
其中R1為具有刺激響應性的基團;R2為手性PEG親水鏈;
含花菁結構的雙官能團引發劑結構式為:
(5)具有快速穿過細胞膜特性的多重響應性高分子納米載體的合成
將具有多重響應性的兩親性三嵌段共聚物組裝得到“洋蔥”狀的具有快速穿過細胞膜特性的多重響應性高分子納米載體。
優選地,R1為雙氧水響應的苯硼酸頻那醇酯衍生物,其結構式如下:
R2為聚合度為n=3-6的手性PEG鏈,其結構式如下:
優選地,步驟(5)的具體過程如下:
將具有多重響應性的兩親性三嵌段共聚物溶于THF中,緩慢滴入到攪拌的去離子水中,滴完后,攪拌,透析得到“洋蔥”狀的具有快速穿過細胞膜特性的多重響應性高分子納米載體。
優選地,一種具有快速穿過細胞膜特性的多重響應性高分子納米載體的應用,能夠用于藥物負載,輸運和程序釋放。
優選地,將含有花菁結構的具有多重響應性的兩親性三嵌段共聚物和藥物分子共同組裝成“洋蔥”狀的具有快速穿過細胞膜特性的多重響應性高分子納米載體從而實現藥物負載,輸運和程序釋放的功能,同時兼具化學-光熱協同治療的特性。
優選地,所述的納米載體具有光熱效應的花菁結構,為多嵌段共聚物,具有多重刺激響應性,含有單一螺旋親水鏈,納米載體的最外層為左手螺旋親水聚苯異腈親水鏈,能更加快速、高效地進入細胞內部;由于其多重刺激響應性,在藥物負載、輸運到達特定部位后,可以程序釋放藥物,加上花菁的光熱轉換效應,能夠實現對癌細胞及腫瘤組織的化學-光熱協同治療效果。
本發明的多重響應性高分子納米載體可以用于疏水性染料分子和藥物分子的輸運,快速、高效地穿過細胞膜,程序控釋藥物,并兼具化學-光熱協同治療的特性。
(1)快速、高效穿過細胞膜
將本發明所合成的三嵌段目標聚合物與疏水性熒光分子尼羅紅(抗癌藥物模型分子)共組裝,形成含有熒光分子的疏水內核和具有親水性左手螺旋結構外殼的“洋蔥”結構納米載體。與細胞共培養,通過熒光共聚焦顯微鏡觀察納米載體進入細胞內的時間,發現在10-20分鐘左右就能觀察到納米載體內部由尼羅紅發出的紅色熒光,證明該納米載體已快速、高效的將藥物模型分子輸運至細胞內部。
(2)程序控釋藥物
將本發明所合成的三嵌段目標聚合物與疏水性熒光分子尼羅紅(抗癌藥物模型分子)共組裝,形成含有熒光分子的疏水內核和具有親水性左手螺旋結構外殼的“洋蔥”結構膠束。依次加入40mM的雙氧水和pH=5.5的酸,檢測熒光強度的變化,可以看到熒光強度逐步下降。加入雙氧水后,熒光分子逐步釋放,最后穩定在40%左右,繼續加入酸后,熒光分子進一步釋放。達到程序控釋的效果。
(3)化學-光熱協同治療
本發明所合成的三嵌段聚合物含有花菁(IR780)基團,具有近紅外光熱效應,可以吸收光能轉化為熱能釋放。用近紅外光(808nm;1W CM-2),分別照射含有納米載體和不含納米載體的PBS緩沖液,發現含有納米載體的溶液在很短的時間內溫度升高到接近于50℃,超過了絕大多數癌細胞的耐受溫度,而不含納米載體的PBS緩沖液的溫度由于光照只是小幅的增長。因此使用該納米載體負載藥物具有明顯的化學-光熱協同治療的特征。
本發明的有益效果在于:
1、納米載體的外層為具有螺旋結構的聚苯異腈親水鏈,在水中能保持很好的螺旋結構,模擬細胞穿膜肽,促進納米載體更快、更高效地進入細胞;
2、納米載體的外層螺旋結構為左手螺旋,與細胞膜相互作用更強;
3、可通過加入具有不同性質的異腈單體和內酯類單體,得到具有各種不同性質的聚合物,如:多重刺激響應性、兩親性、手性等;
4、納米載體的外層的親水鏈為PEG修飾,無毒,具有良好的生物相容性;
5、設計的聚合物自組裝形成“洋蔥”結構的納米載體后,可以負載藥物,且在體內可以逐步被降解,達到程序控釋藥物的目的;
6、含有的光熱效應的花菁(IR780)結構,可達到協同治療的效果;
7、聚合過程具有良好的自分類聚合能力,可均聚或“一鍋法”雜化共聚多種單體,催化活性高、性質穩定,得到的聚合物具有相應的刺激響應性;
8、聚合過程可控,得到的聚合物分子量均一,分子量分布窄。
附圖說明
圖1為本發明實施實例1中的五氟苯酚異腈單體的合成路線;
圖2為本發明實施實例1中的五氟苯酚異腈單體的1HNMR(CDCl3,600M Hz),相應的化學位移已在圖中標出;
圖3為本發明實施實例2中的具有雙氧水響應的苯異腈單體的合成路線;
圖4為本發明實施實例2中的具有雙氧水響應的苯異腈單體的1H NMR(CDCl3,600M Hz),相應的化學位移已在圖中標出;
圖5為本發明實施實例2中的具有雙氧水響應的苯異腈單體的13C NMR(CDCl3,600M Hz);
圖6為本發明實施實例3中的手性親水苯異腈單體的合成路線;
圖7為本發明實施實例3中的手性親水苯異腈單體合成過程中的每步1H NMR(CDCl3,600M Hz),相應的化學位移已在圖中標出;
圖8為本發明實施實例4中的三嵌段聚合物的合成路線;
圖9為本發明實施實例4中的三嵌段聚合物的凝膠滲透色譜(GPC)圖(Mn=30.1kDa,PDI=1.17);
圖10為本發明實施實例4中的三嵌段聚合物的1H NMR(CDCl3,600M Hz),相應的化學位移已在圖中標出;
圖11為本發明實施實例4中的三嵌段聚合物的圓二色譜(CD)圖,364nm處的摩爾CD值為-15.6(364nm處),表明該聚合物為單(左)手性;
圖12為本發明實施實例4中的三嵌段聚合物的原子力顯微鏡(AFM)圖,可以看到明顯的螺旋結構;
圖13為本發明實施實例5中的三嵌段聚合物組裝成膠束后的場發射透射電子顯微鏡(TEM)圖,顯示為球狀結構,粒徑為94nm;
圖14為本發明實施實例6中的細胞實驗圖,發現在10-20分鐘左右就能觀察到膠束內部由尼羅紅發出的紅色熒光,證明該納米載體已快速、高效的將藥物模型分子輸運至細胞內部;
圖15為本發明實施實實例7中的納米載體程序控釋熒光分子尼羅紅(藥物模型分子)熒光強度圖,發現隨著雙氧水和酸的加入,熒光強度逐漸減小,具有藥物緩釋的效果;
圖16為本發明實施實例7中的納米載體在加入的雙氧水、酸后,程序控釋熒光分子尼羅紅(藥物模型分子)的量與時間關系圖,在加入雙氧水后,熒光分子逐步釋放,最后穩定在40%左右,繼續加入酸后,熒光分子進一步釋放,達到程序控釋的效果;
圖17為本發明實施實例8中的納米載體的光熱效應圖,用近紅外光(808nm;1W CM-2),分別照射含有納米載體和不含納米載體的PBS緩沖液,發現含有納米載體的溶液在很短的時間內溫度升高到接近于50℃,超過了絕大多數癌細胞的耐受溫度,而不含納米載體的PBS緩沖液的溫度由于光照只是小幅的增長;因此使用該納米載體負載藥物具有明顯的化學-光熱協同治療的特征。
圖18為“洋蔥”結構的納米載體包裹藥物分子的示意圖,由內向外依次為酸響應性PLLA內核,具有近紅外吸收特性的花菁(IR780)分子,雙氧水響應性聚苯異腈中間層,單(左手)螺旋親水聚苯異腈親水鏈,其中疏水內核與中間層包裹了抗癌藥物小分子。
具體實施方式
實施實例1:五氟苯酚異腈單體的合成
對硝基苯甲酸(1.1eq)、五氟苯酚(1eq)、EDCI(1.2eq)、DMAP(0.5eq)加入雙口瓶中,二氯甲烷為溶劑,室溫反應,TLC跟蹤反應結束后,用水洗3次,飽和碳酸氫鈉溶液洗3次,飽和氯化鈉溶液洗3次,收集有機相,加無水硫酸鈉干燥3h,抽濾除去無水硫酸鈉,旋蒸除去溶劑,過硅膠柱提純(洗脫劑為石油醚:乙酸乙酯=1:1),收集產物,除去溶劑,真空干燥至恒重。過硅膠柱(DCM:PE=1:1),收集產物,旋干后真空干燥至恒重,得到產物Ⅰ,結構式為:
產物Ⅰ、Pd/C按質量比1:0.1的比例加入雙口瓶中,加入乙酸乙酯(EA),先置換氮氣,然后置換為氫氣,常溫反應,TLC跟蹤反應至完全,抽濾除去Pd/C,旋蒸除去溶劑,真空干燥至恒重。得產物Ⅱ,結構式為:
產物Ⅱ(1eq)用乙酸乙酯(EA)溶解,加入雙口瓶中,抽真空-充氮氣重復3-5次,甲酸(12.5eq)、乙酸酐(2.5eq)按體積比2:1混合攪拌2h后,冰浴、氮氣氛圍下,逐滴滴入到反應液中,滴加完畢后轉移至室溫反應,TLC跟蹤反應結束后,用水洗3次,飽和碳酸氫鈉溶液洗3次,飽和氯化鈉溶液洗3次,收集有機相,加無水硫酸鈉干燥3h,抽濾除去無水硫酸鈉,旋蒸除去溶劑,過硅膠柱提純(洗脫劑為石油醚:乙酸乙酯=1:1),收集產物,除去溶劑,真空干燥至恒重。得到產物Ⅲ,結構式為:
產物Ⅲ用二氯甲烷溶解,加入雙口瓶中,抽真空-充氮氣重復3-5次,冰浴條件下加入三乙胺,攪拌15分鐘,稱量好的三光氣用二氯甲烷溶解,冰浴、氮氣氛圍下,逐滴滴入到反應液中,TLC跟蹤反應結束后,用水洗3次,飽和碳酸氫鈉溶液洗3次,飽和氯化鈉溶液洗3次,收集有機相,加無水硫酸鈉干燥3h,抽濾除去無水硫酸鈉,旋蒸除去溶劑,過硅膠柱提純(洗脫劑為石油醚:乙酸乙酯=5:1),收集產物,除去溶劑,真空干燥至恒重。分離、洗滌并干燥后得到單體Ⅰ,結構式為:
五氟苯酚異腈單體的合成路線如圖1所示。
實施實例2:具有雙氧水響應的苯異腈的合成
五氟苯酚異腈(1eq),4-羥甲基苯硼酸頻哪醇酯(1.1eq),DMAP(1.2eq),無水THF,加入兩口燒瓶中,抽真空-充氮氣,重復3次,氮氣氛圍下,30℃攪拌反應,TLC跟蹤反應結束后旋干,過硅膠柱(DCM:PE=9:1),收集產物,旋干后真空干燥至恒重,冷凍保存,具有雙氧水響應的苯異腈合成路線如圖3所示。
實施例3:手性親水苯異腈單體的合成
Cbz-丙氨酸,五乙二醇單甲醚,EDCI,DMAP按摩爾比1:1:1.1:0.2,加入兩口瓶中,以二氯甲烷為溶劑,常溫反應過夜。TLC顯示反應完全后,用水洗3次,飽和碳酸氫鈉溶液洗3次,飽和氯化鈉溶液洗3次,收集有機相,加無水硫酸鈉干燥3h,抽濾除去無水硫酸鈉,旋蒸除去溶劑,過硅膠柱提純(洗脫劑為石油醚:乙酸乙酯=1:1),收集產物,除去溶劑,真空干燥。得產物Ⅳ,結構式為:
產物Ⅳ、Pd/C按質量比1:0.1的比例加入雙口瓶中,加入THF,先置換氮氣,然后置換為氫氣,常溫反應,TLC跟蹤反應至完全,抽濾除去Pd/C,旋蒸除去溶劑,過硅膠柱提純(洗脫劑為二氯甲烷:甲醇=15:1),收集產物,除去溶劑,真空干燥。得產物Ⅴ,結構式為:
產物Ⅴ,五氟苯酚異腈按摩爾比1.1eq:1eq,加入雙口瓶中,置換氮氣3-5次,加入三乙胺4eq,THF,室溫反應。TLC跟蹤反應至完全,取下反應冷卻至室溫,用水洗3次,飽和碳酸氫鈉溶液洗3次,飽和氯化鈉溶液洗3次,收集有機相,加無水硫酸鈉干燥3h,抽濾除去無水硫酸鈉,旋蒸除去溶劑,過硅膠柱提純(洗脫劑為乙酸乙酯:石油醚=2:1),收集產物,除去溶劑,真空干燥。得產物手性親水苯異腈單體,結構式為:
手性親水苯異腈單體的合成路線如圖6所示。
實施實例4:三嵌段聚合物的合成
在聚合瓶中加入含花菁結構的雙官能團引發劑(IR780):雙氧水響應性苯異腈:L-LA:TBD=1:20:30:5,抽真空-充氮氣,重復3-5次,氮氣氛圍下加入無水甲苯,80攝氏度反應,反應過夜,至分子量不再增加,用甲醇沉淀3-5次,干燥得到兩嵌段聚合物中間體Ⅰ,結構式為:
在上述反應完全后,將手性親水苯異腈單體(50eq)加入聚合瓶中,80攝氏度反應,反應過夜,至分子量不再增加,用甲醇沉淀3-5次,真空干燥至恒重,得到三嵌段目標聚合物,結構式為:
合成路線如圖8所示。
實施實例5:“洋蔥”結構納米載體的合成
取實施實例4中的三嵌段聚合物5mg溶于1mlTHF中,緩慢滴入到劇烈攪拌的去離子水中(轉速:1400-1600rpm,1h滴完)。聚合物滴完后,保持高速(轉速為1400-1600rpm)攪拌25-35min,之后低速(轉速為300-500rpm)攪拌1.8-2.5h,轉移到透析袋中用去離子水透析8-12h(間隔2h換一次去離子水),得到“洋蔥”結構的納米載體。
實施實例6:納米載體快速、高效穿過細胞膜的特性
將本發明所合成的三嵌段目標聚合物與疏水性熒光分子尼羅紅(抗癌藥物模型分子)共組裝,(組裝方法如實施例5所示),形成含有熒光分子的疏水內核和具有親水性左手螺旋結構外殼的“洋蔥”結構膠束。與細胞共培養,通過熒光共聚焦顯微鏡觀察納米載體進入細胞內的時間,發現在10-20分鐘左右就能觀察到膠束內部由尼羅紅發出的紅色熒光,證明該納米載體已快速、高效的將藥物模型分子輸運至細胞內部。
實施實例7:納米載體程序控釋藥物的特性
將本發明所合成的三嵌段目標聚合物與疏水性熒光分子尼羅紅(抗癌藥物模型分子)共組裝,(組裝方法如實施例5所示),形成含有熒光分子的疏水內核和具有親水性左手螺旋結構外殼的“洋蔥”結構膠束。依次加入40mM的雙氧水和pH=5.5的酸,檢測熒光強度的變化,可以看到熒光強度逐步下降。加入雙氧水后,熒光分子逐步釋放,最后穩定在40%左右,繼續加入酸后,熒光分子進一步釋放。達到程序控釋的效果。
實施實例8:納米載體的化學-光熱協同治療特性
本發明所合成的三嵌段聚合物含有花菁(IR780)基團,具有近紅外光熱效應,可以吸收光能轉化為熱能釋放。用近紅外光(808nm;1W CM-2),分別照射含有納米載體和不含納米載體的PBS緩沖液,發現含有納米載體的溶液在很短的時間內溫度升高到接近于50℃,超過了絕大多數癌細胞的耐受溫度,而不含納米載體的PBS緩沖液的溫度由于光照只是小幅的增長。因此使用該納米載體負載藥物具有明顯的化學-光熱協同治療的特征。
以上詳細描述了本發明的較佳具體實施例。應當理解,本領域的普通技術無需創造性勞動就可以根據本發明的構思作出諸多修改和變化。因此,凡本技術領域中技術人員依本發明的構思在現有技術的基礎上通過邏輯分析、推理或者有限的實驗可以得到的技術方案,皆應在本發明的保護范圍內。
-
 0訪客 來自[中國] 2023年07月16日 11:23很好的專利,不知如何聯系。
0訪客 來自[中國] 2023年07月16日 11:23很好的專利,不知如何聯系。