通過改造糖多孢紅霉菌SACE_3980基因提高紅霉素產量的方法與流程
本發明涉及基因工程技術領域,具體涉及一種通過改造糖多孢紅霉菌SACE_3980基因提高紅霉素產量的方法。
背景技術:
紅霉素是由糖多孢紅霉菌次級代謝產生,屬于典型的聚酮類抗生素,其組分包括紅霉素A(Er-A)、紅霉素B(Er-B)、紅霉素C(Er-C)、紅霉素D(Er-D)、紅霉素E(Er-E)和紅霉素F(Er-F)等。該類抗生素有廣譜抗菌作用,其抗菌譜與青霉素相似,對革蘭陽性菌有較強的抑制作用。紅霉素各組分中臨床上廣泛應用的是紅霉素A,它的抑菌活性最高,而紅霉素系列化學衍生物(克拉霉素、阿奇霉素、羅紅霉素、泰利霉素等)也被廣泛用來治療感染性疾病,紅霉素及其衍生物每年的銷售額達數百億美元。
紅霉素在醫藥領域具有重要作用,但其產率仍有待提高。傳統優化發酵條件提高紅霉素A產量的方法耗時且不經濟,不適合廣泛應用。而通過基因工程的方法,在糖多孢紅霉菌染色體中增加合成基因的拷貝數,或通過基因敲除的方法改造調控基因來獲得紅霉素高產菌株,有著很好的前景。
2003年Rodriguez等報道紅霉素高產主要是由于其調控基因,而不是合成基因,更使我們將研究重點轉向調節基因。2005年,Ramos等以序列相似性、結構和功能為標準將原核生物轉錄調控子分成LysR、AraC/XylS、TetR、LuxR、LacI、ArsR、IcIR、MerR、AsnC、MarR、NtrC(EBP)、OmpR、DeoR、Cold shock、GntR和Crp共16個家族。其中TetR家族調控基因在DNA結合結構域上有高度的保守性,廣泛參與調控多藥抗性、抗生素合成、滲透性應激反應等生物活動。近年來報道了多種參與抗生素或鏈霉菌形態分化的TetR家族轉錄調控子,比如SCO1712,SAV151,SAV576,jadY,atrA等,暗示著TetR家族調控基因在鏈霉菌次級代謝及抗生素生物合成中的重要性。糖多孢紅霉菌全基因組中有101個TetR家族基因,然而關于糖多孢紅霉菌次級代謝TetR家族調控基因研究依然很少,報道的僅有參與調控糖多孢紅霉菌形態分化的調控基因SACE_7040、SACE_0012和調控紅霉素合成代謝基因SACE_5599、SACE_3986,SACE_3446,SACE_7301等,且對于其調節紅霉素產量的精確機制闡明的還未清楚。
技術實現要素:
本發明目的就是通過缺失糖多孢紅霉菌中負調控基因SACE_3980,通過改造糖多孢紅霉菌SACE_3980基因提高紅霉素產量方法。
本發明是通過以下技術方案實現的:
一種通過改造糖多孢紅霉菌SACE_3980基因提高紅霉素產量方法,其特征在于:通過基因工程途徑使糖多孢紅霉菌中SACE_3980基因失活,獲得糖多孢紅霉菌紅霉素高產工程菌株,用所述的菌株發酵生產紅霉素。
所述的一種通過改造糖多孢紅霉菌SACE_3980基因提高紅霉素產量方法,其特征在于所述的SACE_3980基因產物可以負向調控紅霉素生物合成。
SACE_3980基因在工業菌株中的應用,其特征在于:在工業高產菌株中缺失TetR家族轉錄基因SACE_3980,獲得高產突變株,可用于紅霉素生產。
本發明的優點是:
本發明研究中篩選到了紅霉素生物合成負調控子SACE_3980,通過基因工程途徑缺失糖多孢紅霉菌染色體上SACE_3980基因拷貝,能夠獲得紅霉素高產菌株,為工業生產提高紅霉素發酵產量提供技術支持。
糖多孢紅霉菌A226中敲除SACE_3980基因時紅霉素產量提高了29.3%,而在ΔSACE_3980缺失突變株中回補SACE_3980基因,紅霉素產量得到恢復,表明SACE_3980是一個參與紅霉素生物合成的負調控因子。利用工業高產菌株WB作為出發菌株,在其染色體上缺失SACE_3980基因,使紅霉素產量提高15.8%,說明缺失SACE_3980基因提高紅霉素產量的技術在工業高產菌株中同樣適用。
附圖說明
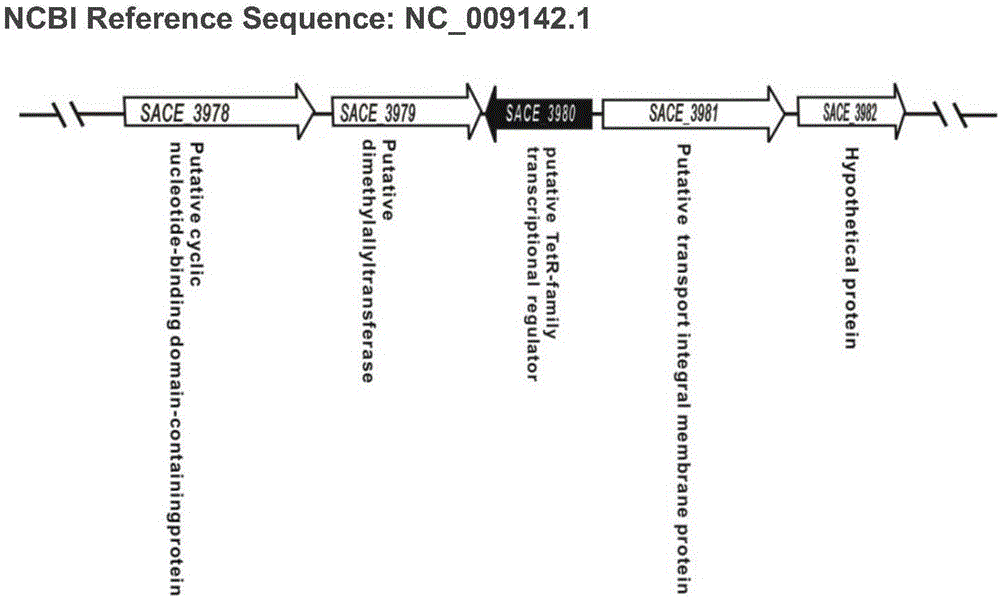
圖1:SACE_3980基因及周邊鄰近基因在染色體上的位置信息;
圖2:本發明的染色體片段同源重組技術示意圖及缺失突變株的PCR鑒定,
(A)ΔSACE_3980突變體構建示意圖,
(B)ΔSACE_3980突變體的PCR鑒定:SACE_3980基因(639bp)被tsr抗性基因(1360bp)替換后長度變為1727bp;M,5000bp DNA Marker;
圖3:出發菌株A226及缺失突變株ΔSACE_3980的抑菌分析及紅霉素A每日產量分析,
(A)A226出發菌株和ΔSACE_3980突變株發酵液的抑菌分析,
(B)出發菌株A226和缺失突變株ΔSACE_3980六天紅霉素A產物的HPLC分析;
圖4:SACE_3980基因回復、過表達菌株的構建及紅霉素A產量分析,
(A)A226/pIB139-3980回補、過表達菌株的PCR鑒定:PCR產物為apr抗性基因(776bp);M,5000bp DNA Marker,
(B)出發菌株A226、缺失突變株ΔSACE_3980、缺失回補菌株及回補空載對照菌株、過表達菌A226/pIB139-3980及過表達空載對照菌株紅霉素A的HPLC分析;
圖5:SACE_3980基因對菌株形態分化的影響及ΔSACE_3980突變株生物量的測定,
(A)ΔSACE_3980突變株和野生型A226菌株的孢子生長情況,其中1:A226菌株,2:ΔSACE_3980突變株,3:回復菌株ΔSACE_3980/pIB139-3980,4:過表達菌株A226/pIB139-3980,
(B)ΔSACE_3980突變株和野生型A226菌株菌絲體的生物量測定。
圖6:紅霉素工業高產菌株WB/SACE_3980缺失突變株的構建及紅霉素A產量分析,
(A)WB/ΔSACE_3980突變體的PCR鑒定:SACE_3980基因(639bp)被tsr抗性基因(1360bp)替換后長度變為1727bp;M,5000bp DNA Marker,
(B)高產菌株WB及缺失突變株WB/ΔSACE_3980紅霉素A產量的HPLC分析。
具體實施方式
實施例1
1.1菌株、質粒與生長條件
試驗中使用到的菌株和質粒見表1。大腸桿菌在37℃的液體LB培養基或在添加1.25%瓊脂的固體LB平板上培養。紅霉素產生菌糖多孢紅霉菌及其工程菌株在30℃胰蛋白胨大豆肉湯(TSB)培養基或在含有2.2%瓊脂的R3M平板上培養。
1.2材料、DNA操作與測序
PEG3350、溶菌酶、TES、酪蛋氨基酸、硫鏈絲菌肽、安普霉素從Sigma公司購買。TSB、酵母提取物、蛋白胨購買于Oxoid公司。甘氨酸、瓊脂粉、氯化鈉和其它生物學試劑都購于試劑公司。大腸桿菌和糖多孢紅霉菌的一般操作技術按照標準操作。引物的合成和DNA測序由生工生物工程(上海)股份有限公司完成。
表1研究中所用的菌種和質粒
表2本發明構建合成的引物
1.3 SACE_3980基因缺失突變體的構建
試驗中合成的引物序列見表2。pUCTSR質粒是在pUC18的BamH I和Sma I酶切位點之間插入1360bp的硫鏈絲菌肽抗性基因(tsr)。為了敲除糖多孢紅霉菌中的SACE_3980基因,分別用3980-P1/3980-P2和3980-P3/3980-P4為引物、糖多孢紅霉菌A226基因組為模板,PCR擴增SACE_3980基因的上、下游各約1.5kb的同源片段。
分別將上述兩個3980-U和3980-D上下游片段分別連接到pUCTSR的tsr抗性基因序列兩側,完成構建質粒pUCTSRΔ3980;以3980-P1和3980-P4為引物、pUCTSRΔ3980質粒為模板,PCR擴增3980U-tsr-D大片段,利用染色體片段同源重組技術將3980U-tsr-D大片段轉化糖多孢紅霉菌原生質體中,根據硫鏈絲菌肽抗性篩選陽性突變株,獲得SACE_3980基因被tsr替換的基因工程菌株。以3980-P5和3980-P6作為鑒定引物,以質粒pUCTSRΔ3980為陽性模板,A226基因組為陰性模板進行PCR鑒定,陽性缺失突變體命名為ΔSACE_3980(見圖3A)。
1.4 SACE_3980基因回復菌株的構建
利用設計的引物3980-P7和3980-P8擴增出SACE_3980基因,并電泳回收,使用NdeI和Xba I內切酶分別對回收到的SACE_3980基因片段與pIB139進行雙酶切并回收,通過T4DNA連接酶將SACE_3980基因片段連接到pIB139上,成功獲得整合型質粒pIB139-3980。然后通過PEG介導的原生質體轉化方法將pIB139-3980導入ΔSACE_3980原生質體中。通過安普霉素初步篩選,以安普霉素抗性基因(apr)為對象進行PCR鑒定,獲得的回復菌株命名為ΔSACE_3980/pIB139-3980。
1.5出發菌株A226中過表達SACE_3980基因
pIB139-3980通過PEG介導的原生質體轉化技術導入糖多孢紅霉菌A226原生質體中,以安普霉素抗性基因(apr)為對象進行PCR鑒定,獲得陽性菌株命名為A226/pIB139-3980。
1.6糖多孢紅霉菌發酵產物HPLC檢測
接種糖多孢紅霉菌于TSB培養基,在30℃振蕩培養48小時后,轉接至R5液體培養基,30℃振蕩培養144小時,然后利用有機溶劑對發酵液進行萃取,使用水浴鍋蒸干后,加入1mL甲醇溶解并使用0.22μm有機濾膜處理,后上機檢測樣品中的紅霉素A含量。
1.7糖多孢紅霉菌菌絲體生物量檢測
以相同的接種量分別將ΔSACE_3980突變株與A226接種于30mL的液體TSB中,30℃搖床培養48小時后,轉接到R5培養基中30℃轉速220rpm搖床培養144小時,期間設置不同時間段取樣,用無水乙醇清洗后烘干稱量菌體干重,每次重復取樣兩次,并取得平均值,測量結束后根據實驗數據繪制菌體生物量曲線。
1.8紅霉素工業高產菌株WB/ΔSACE_3980菌株的構建及HPLC檢測
在紅霉素工業高產菌株WB中缺失SACE_3980,驗證正確菌株命名為WB/ΔSACE_3980。并將WB高產菌株與缺失突變株WB/ΔSACE_3980的發酵產物進行HPLC檢測。突變株構建過程和HPLC檢測參考上述1.3和1.6方法。
結果分析:
2.1缺失突變株ΔSACE_3980較出發菌株A226紅霉素產量提高。
SACE_3980與臨近基因在糖多孢紅霉菌染色體上的位置見圖1。SACE_3980基因缺失突變株A226/ΔSACE_3980構建過程見圖2A。SACE_3980基因缺失突變體在含有30μg ml-1硫鏈絲菌肽的R3M平板上篩選并通過PCR證實(見圖2B)。
ΔSACE_3980在R5液體培養基中發酵6天(144h),離心收集發酵上清液;點樣于含枯草芽孢桿菌菌液的LB平板表面,37℃培養12小時后觀察平板上抑菌圈大小,結果顯示:ΔSACE_3980的發酵液抑菌圈較A226明顯偏大(見圖3A),初步推斷SACE_3980基因可能是負調節于紅霉素的產量。
將發酵液萃取后,經HPLC檢測每日紅霉素A產量,發現第六天ΔSACE_3980較出發菌株A226的產量提高了28.3%(見圖3B),HPLC結果再次表明SACE_3980是參與紅霉素生物合成的負向調控子。
2.2 SACE_3980基因回復與過表達。
為了驗證突變體ΔSACE_3980中紅霉素產量的提高是因為SACE_3980基因缺失引起的,將SACE_3980基因表達載體pIB139-3980和pIB139載體(作為對照),分別導入ΔSACE_3980突變株和出發菌株A226的原生質體中,獲得回復菌株及空載ΔSACE_3980/pIB139-3980、ΔSACE_3980/pIB139,過表達菌株及空載A226/pIB139-3980、A226/pIB139,PCR鑒定證實(見圖4A)。后將A226及ΔSACE_3980系列突變株進行搖瓶發酵,HPLC檢測結果顯示:ΔSACE_3980的紅霉素A產量較A226升高29.3%;回復菌株ΔSACE_3980/pIB139-3980的紅霉素A產量較A226基本恢復;A226/pIB139-3980的紅霉素A產量相比于A226降低約20%(見圖4B);HPLC檢測結果進一步表明SACE_3980基因能夠負調紅霉素A的生物合成。
2.3缺失SACE_3980基因對菌體生長及孢子形態分化的影響。
測定發酵6天的ΔSACE_3980突變株與A226菌株的菌體干重,繪制相應變化曲線,結果顯示ΔSACE_3980較A226的生物量差異不大(見圖5A),暗示著SACE_3980基因的缺失并未影響菌體的初級代謝。
為了確定SACE_3980基因是否調控菌體的孢子形成,將突變株ΔSACE_3980、回復菌株ΔSACE_3980/pIB139-3980、過表達菌株A226/pIB139-3980以及野生型對照菌株A226同時涂于R3M平板上,30℃培養72小時,觀察菌株孢子生長情況。結果顯示相比于A226,ΔSACE_3980突變體的孢子形態無明顯差異(圖5B),說明SACE_3980基因的缺失不影響孢子的形成。
2.4改造的工業高產菌株WB/ΔSACE_3980使紅霉素產量提高。
首先進行WB/ΔSACE_3980突變株的構建,構建過程參照圖2A,PCR鑒定見圖6A。后將WB/ΔSACE_3980突變株及工業高產菌株WB涂板活化,然后分別接入工業種子培養基的搖瓶中,30℃轉速220rpm下培養2天后,轉接工業發酵培養基中,繼續培養6天。發酵結束后萃取濃縮經HPLC分析,相比較出發菌株WB,WB/ΔSACE_3980的紅霉素產量分別提高了15.8%(見圖6B)。這說明高產菌株WB中SACE_3980基因同樣參與調節紅霉素的產量。
CCCAAGCTTGCGGTGTTCATCAGCGCGAT
GCTCTAGAGCTCGACGAACAGCCGGATG
CGGGGTACCAGATCACCACCGTCCTGCG
CCGGAATTCAGCCTCAACGTGCGGTTCA
GCATGCCACAAAGGCTAACTCGGT
AAGTCAGCACAGGCGTCCTCAGT
GGAATTCCATATGATGGCGGTCATGAGCGAGCC
GCTCTAGATCAGCCGCAGCAGGCGGCC
GGAGTGCATATGGTGCAATACGAATGGCGAAAAG
CTCAAAGCTTCAGCCAATCGACTGGCGAGCG
- 還沒有人留言評論。精彩留言會獲得點贊!