一種海洋源鈣螯合肽及其制備方法與流程
本發明涉及一種鈣螯合肽,更具體地涉及了一種海洋源鈣螯合肽及其制備方法,屬于生物技術領域。
背景技術:
目前,鈣缺失是全球性的營養問題,缺鈣造成機體的各種疾病,使人處于亞健康狀態。近幾年來,隨著補鈣試劑迅猛發展,使得國民補鈣意識也在不斷增加。雖然這些補鈣劑能在一定程度上緩解鈣缺失的壓力,但卻也沒有從根本上改善國民缺鈣的狀況,其主要原因是在于鈣的生物利用度較低。我國的膳食組成是植物性食物,而植物中的草酸、磷酸和植酸等成分容易在腸道中鈣離子結合形成難溶性的草酸鹽、磷酸鹽和植酸鹽,降低了機體內鈣的生物利用度。因此,除了開發補鈣產品外,提高鈣的生物利用度也是解決鈣缺失的關鍵方法之一。隨著科學研究的深入,發現多肽-鈣螯合物具有獨特的螯合體制與轉運機制,更易被人體吸收轉運,肽鈣螯合物結構穩定。機體對肽鈣螯合物的吸收是通過肽的吸收通道,從而可以避免與其他被吸收的金屬離子的拮抗競爭,提高鈣離子的吸收率,提高其生物利用度。由此可見,多肽-金屬螯合物的吸收率高,穩定性好,是理想的保健品添加物。
隨著海洋源活性物質的研究與產品開發的興起,微藻生物被聯合國糧農組織確定為21世紀綠色健康食品,微藻不僅營養成分豐富,而且有優良的醫療保健作用。裂殖壺菌作為優質餌料的微藻源,本身就含有較高的蛋白質,且富含能與鈣離子結合的氨基酸殘基,因此,從裂殖壺菌粕中提取出蛋白做為原料開發鈣螯合肽,能夠為鈣制劑提供一種有效的載體,既增加了裂殖壺菌蛋白產品的附加值,又能為補鈣制品提供了新的思路;
因此,如何獲得具有鈣螯合活性的肽,就成為制備新型微量金屬元素補充劑亟需的研究方向。
技術實現要素:
本發明的目的在于提供了一種利用堿性蛋白酶和復合風味蛋白酶分步酶解裂殖壺菌粕蛋白制備的金屬螯合肽,使鈣螯合活性得以高效地實現。
為實現上述目的,本發明采用如下技術方案:
一種金屬螯合肽,所述肽的氨基酸序列為:SSV。
所述金屬為Ca。
一種金屬螯合肽的制備方法,以裂殖壺菌粕蛋白為原料,采用堿性蛋白酶和復合風味蛋白酶對其進行分步酶解,分離純化、冷凍干燥得到金屬螯合肽。
所述的第一步酶解條件為:最適酶為堿性蛋白酶,時間為8 h,pH為9,酶底比為10%,底物濃度為1%。所述的第二步酶解條件為:最適酶為復合風味蛋白酶,酶底比為10%,溫度為40 ℃,pH為6,時間為3 h50 min。
所述分離純化的具體步驟為:酶解產物首先利用Sephadex G-25凝膠過濾色譜進行分離,洗脫液為去離子水,流速為0.3 mL/min,洗脫峰在214 nm下進行測定;收集具有最高金屬螯合活性的峰,利用RP-HPLC-C18反相高效液相色譜再進行進一步分離,反相HPLC的分離條件是用體積比為0-40%乙腈溶液作為洗脫液梯度洗脫,流速為2 mL/min,收集洗脫峰,得到所述的金屬螯合肽。
本發明立足于多肽具備與金屬離子螯合的作用位點,能夠與其形成穩定的化合物,且多肽-金屬螯合物具有獨特的螯合體制和轉運機制,易被吸收轉運、又能補充氨基酸和金屬的理論基礎,以來自于海洋源的裂殖壺菌粕蛋白為原材料,經過堿性蛋白酶和復合風味蛋白酶分步酶解進行優化,以制備具有高鈣螯合活性的肽,而使金屬螯合活性得以高效地實現。本發明為裂殖壺菌粕蛋白的應用提供了一條嶄新的思路。
附圖說明
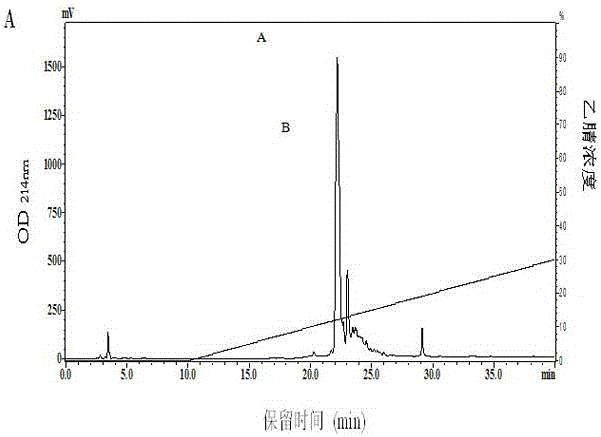
圖1純化裂殖壺菌粕蛋白源金屬螯合肽的RP-HPLC-C18色譜圖;其中SPH-2A為該特異性金屬螯合肽的色譜峰。
具體實施方式
實施例1
采用的儀器、檢測手段如下:
本技術所采用的裂殖壺菌粕,由福建省水產研究所提供,酶購自諾維信生物技術有限公司(中國·天津)。首先進行裂殖壺菌粕蛋白的提取,使用中藥粉碎機處理裂殖壺菌粕,過60目篩,獲得實驗用原料。采用堿提酸沉的方法提取裂殖壺菌粕中的蛋白質。配制濃度為0.39mol/L的NaOH溶液,按料液比1:100(w/v)在90℃下提取30min。將所獲得的樣液在4℃下以10000r/min的轉速離心20min,取上清棄沉淀。再用6mol/L HCl調節上清液中的pH值,調節pH值至3.0,對蛋白質進行酸沉。靜置30min后,在4℃下以10000r/min的轉速離心20min。最終取沉淀棄上清,冷凍干燥,然后再進一步對其酶解。
酶解工藝采用單因素實驗,第一步酶解實驗分別對五個酶解因素進行考察,分別為最適酶(中性蛋白酶、堿性蛋白酶、木瓜蛋白酶、胰蛋白酶),時間(0.0h、0.5h、1.0h、1.5h、2.0h、2.5h、3.0h、3.5h、4.0h、6.0h、8.0h、10.0h、12.0h),pH(7.0、8.0、9.0、10.0、11.0、12.0,酶底比(2%、4%、6%、8%、10%、12%,w/w),底物濃度(1%、3%、5%、7%、9%,w/v)。在第一步酶解的基礎上,第二步酶解實驗分別對五個酶解因素進行考察,最適酶(復合風味蛋白酶、中性蛋白酶、木瓜蛋白酶、胰蛋白酶),時間(0h、0.5h、1h、2h、3h、4h、6h、8h),酶底比(4%、6%、8%、10%、12%,w/w),pH(5.0、6.0、7.0、8.0、9.0),溫度(40℃、50℃、60℃、70℃、80℃)。稱取一定質量裂殖壺菌蛋白溶解于蒸餾水中,然后用2mol/L NaOH將其pH調節至最適pH。先將該溶液水浴加熱到需要溫度,接著再按不同的酶底比加入相應量的酶,按照預定的反應時間開始反應。接著再在沸水浴中滅酶10分鐘,冷卻后再10000rpm離心10分鐘。上清液收集后,分別對金屬鈣螯合活性進行測定,以確定最佳酶解條件。得到第二步酶解中具有最大金屬螯合活性的酶解液的酶解條件是:酶底比10%、溫度40℃、pH6、時間3h50min。
本發明的制備金屬螯合肽的鈣螯合活性測定方法,采用鄰-甲酚酞比色法,測定金屬螯合肽對鈣離子的螯合作用。將1 mL 5 mmol/L的CaCl2和2 mL 0.2 mol/L的磷酸鹽緩沖液(pH 8.0)加入具塞試管中,再加入1 mL清蛋白肽溶液,置于恒溫加熱水浴搖床中37℃溫育2h,取出后10000 r/min常溫離心10 min。取1 mL上清液,加入鄰-甲酚酞顯色液5 mL,搖勻。放置10 min后于分光光度計570 nm處測定吸光值,將數值代入標準曲線中計算出可溶性鈣結合量。
標準曲線的制作:分別取標準Ca工作液(10 ug/ mL)0,0.2,0.4,0.6,0.8, 1.0 mL于10 mL試管中,分別加去離子水1.0,0.8,0.6,0.4,0.2,0 mL,加入鄰-甲酚酞顯色液5 mL,搖勻,放置10 min后于分光光度計570 nm處測定吸光值。以可溶性鈣含量(ug/mL)為橫坐標,吸光值為縱坐標做圖,得標準曲線公式為:y = 0.0992x - 0.0887,R2 = 0.9988。
應用Sephadex G-25分子篩、RP-HPLC反相高效液相色譜等分離純化手段,實現顯著活性的裂殖壺菌粕蛋白金屬螯合肽的高效分離純化。
稱取1.0克裂殖壺菌粕蛋白溶解于100ml 蒸餾水中→用2mol/L NaOH調節pH至9.0→加堿性蛋白酶→立即置于50℃的水浴搖床中反應8h→沸水浴滅酶10min→立即冷卻→10000r/min離心10min,取上清→粗酶解液→用2mol/L NaOH調節pH至6.0→加復合風味蛋白酶→立即置于40℃的水浴搖床中反應3h50min→沸水浴滅酶10min→立即冷卻→10000r/min離心10min,取上清備用。
將上清液用Sepadex G-25凝膠過濾色譜(長100 cm,外徑2.0 cm)進行分離,獲得最好的金屬鈣螯合活性的樣品利用RP-HPLC-C18反相高效液相色譜再進行進一步的分離純化。洗脫液自含100%去離子水(v/v)的混合液開始,至40%乙腈和60%水(v/v)的混合液結束,流速為2 ml/min進行梯度洗脫,收集洗脫峰,得到本發明的高純度的特異性金屬鈣螯合肽,如圖1所示。SPH-1A峰為該特異性金屬螯合肽的色譜峰。
純化得到的特異性金屬螯合肽具有很高的金屬鈣螯合活性,由表1可以看出,與酶解液相比,SPH-2A的金屬螯合力有了很大提高。
表1 純化的特異性金屬螯合肽的金屬螯合力
對純化的特異性金屬螯合肽利用ESI質譜儀((WATERS MALDI SYNAPT Q-TOF MS, Waters Co., U.S.A)測定特異性金屬螯合肽的氨基酸序列。所述金屬螯合肽的氨基酸序列為:SSV。
以上所述僅為本發明的較佳實施例,凡依本發明申請專利范圍所做的均等變化與修飾,皆應屬本發明的涵蓋范圍。
SEQUENCE LISTING
<110> 福州大學
<120> 一種海洋源鈣螯合肽及其制備方法
<130> 1
<160> 1
<170> PatentIn version 3.3
<210> 1
<211> 3
<212> PRT
<213> 人工序列
<400> 1
Ser Ser Val
1
- 還沒有人留言評論。精彩留言會獲得點贊!