一種用于核酸純化或片段篩選的試劑盒及其使用方法與流程
本發明屬于生物技術領域,尤其涉及一種用于核酸純化或片段篩選的試劑盒及其使用方法。
背景技術:
高通量測序技術,即下一代測序技術(next generation sequencing)能一次對幾十萬到幾百萬條DNA分子進行序列測定及量化,為基礎生物醫學研究和臨床檢測提供了一個強大的工具,并推動基因組學的科學研究和臨床轉化,奠定了其在精準醫學的基石地位。而一個待檢樣品在走上高通量DNA測序機器測序前還需要做大量的工作,其中的關鍵步驟就是文庫構建。文庫構建包括核酸片段化、修復反應、加A反應、連接反應、片段篩選與純化、PCR擴增、PCR產物純化、文庫質檢等過程,這些過程需要做大量的核酸純化及片段篩選的工作。
目前核酸純化及片段篩選的方法有膠回收法、離心柱法等。膠回收法是根據凝膠電泳中不同片段大小的核酸在凝膠上的泳動距離不同而通過對含特定大小核酸片段的凝膠切割下來,再將切割下來的凝膠中的核酸分離純化出來,達到核酸片段選擇純化的目的。離心柱法是利用硅膠膜配合特定的溶液環境來吸附核酸片段而達到核酸片段選擇純化的目的。但這些方法存在操作繁瑣,耗時,或需要凝膠電泳或需要離心,無法實現高通量、自動化操作。膠回收法首先需要制備凝膠、電泳、切膠、回收等過程需要消耗大量的時間、花費不少人力操作成本。離心柱法一般需要吸附、洗滌、洗脫等步驟,其間需要大量的離心操作步驟,每次離心5min左右,而離心機的通量有限,限制了操作的簡便性,當然少量樣品以上兩種方法可以是種選擇,但當需要實現批量操作的時候,以上方法無法滿足。
技術實現要素:
一方面,本發明的目的在于克服現有技術存在的不足之處而提供了一種用于核酸純化或片段篩選的試劑盒,本發明的試劑盒用磁珠法進行核酸純化與片段篩選操作,不受通量限制,可以實現高通量,同時本發明基于磁珠的磁性特性,可配合自動化操作儀器進行自動化操作。
本發明采用的技術方案為:一種用于核酸純化或片段篩選的試劑盒,包括磁珠溶液、洗滌試劑和洗脫試劑;其中,所述磁珠溶液包含濃度為1~100ng/μL的氧化硅羧基磁珠、0.1~100mol/L的氯化鈉、體積百分比濃度為1%~50%的聚乙二醇和緩沖液。
作為對上述技術方案的進一步改進,所述緩沖液為pH為5.5~6.5的1~100mol/L三羥基甲烷-鹽酸。所述PH優選為6.0。
作為對上述技術方案的進一步改進,所述聚乙二醇的分子量為5000~10000道爾頓,優選為8000道爾頓。PEG最早應用于提純免疫球蛋白(IgG)和沉淀一些細菌病毒,近年來逐漸應用于核酸和酶的分離純化,特別是用PEG分離質粒DNA,已相當普遍。用PEG8000代替乙醇沉淀DNA,可以在500ul DNA液中加入200ul 20%PEG8000(含1.2mol/LNaCl),冰浴20min。該操作的優點在于:操作條件溫和,不易引起生物大分子的變性。同時具有極高的沉淀效能,少量的PEG可以沉淀相當多的生物大分子。
作為對上述技術方案的進一步改進,所述氧化硅羧基磁珠的濃度為5~50ng/μL,所述氯化鈉的濃度為0.5~10mol/L,所述聚乙二醇的體積百分比濃度為2%~30%。各組分在以上濃度范圍內時,試劑盒的使用效果更佳,對鹽、引物、引物二聚體、dNTPs、小片段的DNA分子等去除效率更高,對目標片段的回收率更高。
作為對上述技術方案的進一步改進,所述洗滌試劑包含體積百分比濃度為1%~85%的乙醇,1~100mmol/L氯化鈉,0.1~10mmol/L乙二胺四乙酸(EDTA),pH為7.5~8.5的0.1~10mmol/L三羥基甲烷-鹽酸。三羥基甲烷-鹽酸的pH優選為8.0。
作為對上述技術方案的進一步改進,所述洗脫試劑含有pH為8.0~9.0的0.1~10mmol/L三羥基甲烷-鹽酸。三羥基甲烷-鹽酸的pH優選為8.5。
另一方面,本發明還提供了使用以上所述的試劑盒進行核酸純化的方法,其包括以下步驟:
1)向盛有待純化核酸樣品的反應管中加入所述磁珠溶液,混勻,室溫下靜置3~10min;
2)將所述反應管置于磁力架,靜置2~5min,待溶液澄清后,吸走上清液;
3)向所述反應管中加入所述洗滌試劑,室溫靜置20~60s,吸走上清液;此步驟至少進行一次;
4)保持所述反應管置于磁力架上狀態,室溫開蓋晾干2~5min;
5)將所述反應管從磁力架上取下來,加入洗脫試劑,混勻,室溫靜置2~6min;
6)將所述反應管重新放置在磁力架上,室溫靜置1~3min,上清液即純化后的DNA產物。
作為對上述技術方案的進一步改進,所述步驟1)中,磁珠溶液的加入體積為待純化核酸樣品體積的0.5~2倍,優選為1.8倍。
又一方面,本發明還提供了使用以上所述的試劑盒進行片段篩選的方法,其包括以下步驟:
1')將第一輪磁珠溶液加入盛有待篩選核酸樣品的反應管中,混勻,室溫下靜置3~10min;
2')將所述反應管放置在磁力架上,靜置2~5min,待溶液澄清后將上清液轉移置新的反應管;
3')向上述裝有上清液的反應管加入第二輪磁珠溶液,室溫靜置3~10min,置于磁力架上,靜置2~5min,待溶液澄清后吸走上清液;所述第一輪磁珠溶液與第二輪磁珠溶液的總和即為所述磁珠溶液;
4')向反應管中加入洗滌試劑,室溫靜置20~60s,吸走上清液;此步驟至少進行一次;
5')保持反應管置于磁力架上狀態,室溫開蓋晾干2~5min;
6')將反應管從磁力架上取下來,加入洗脫試劑,混勻,室溫靜置2~6min;
7')將反應管重新放置在磁力架上,室溫靜置1~3min,上清液即篩選的核酸片段。
作為對上述技術方案的進一步改進,所述第一輪磁珠溶液的加入量為待篩選核酸樣品體積的0.4~0.8倍,所述第二輪磁珠溶液的加入量為待篩選核酸樣品體積的0.1~0.3倍,所述篩選的核酸片段的平均長度為250~700bp。
作為對上述技術方案的進一步改進,所述第一輪磁珠溶液的加入量、第二輪磁珠溶液的加入量與對應的篩選的核酸片段的平均長度如下表所示:
表中”ד表示待篩選核酸樣品的體積。
相對于現有技術,本發明的有益效果為:
1)實現高通量:本發明用磁珠法進行核酸純化與片段篩選操作,不受通量限制,可以實現高通量。
2)實現自動化:本發明基于磁珠的磁性特性,可配合自動化操作儀器進先自動化操作。
3)實現核酸純化:本發明中的吸附試劑在特定的溶液環境下(高鹽低PH)對核酸樣品中的大片段DNA的結合效率優于小片段DNA,基于這一特性,可通過調節吸附試劑的加入比例,選擇性地去除鹽、引物、引物二聚體、dNTPs、小片段的DNA分子等。
4)實現片段篩選:本發明中的吸附試劑加入待純化的核酸樣品的比例越小,對于中小DNA片段的吸附能力越小,通過配合操作流程,兩次加入不同比例的吸附試劑,可實現一定長度范圍的核酸片段篩選。
附圖說明
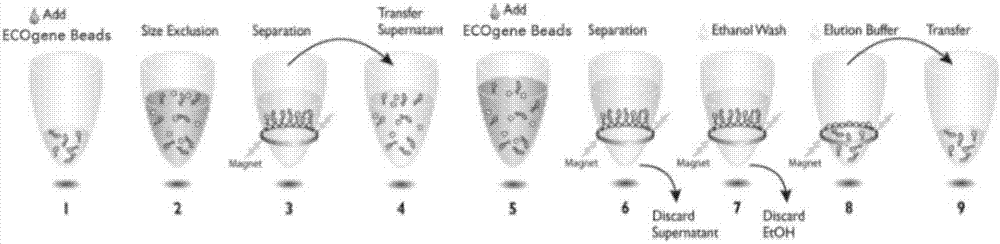
圖1為核酸純化方法的流程示意圖;
圖2為片段篩選方法的流程示意圖;
圖3顯示了不同的磁珠溶液的加入比例對核酸樣品的純化效果的影響;
圖4顯示了分別使用AMPureXP磁珠和本發明的試劑盒進行核酸純化的結果;
圖5顯示了使用本發明的試劑盒進行3個不同批次的試驗所得的核酸純化結果;
圖6顯示了不同條件下的磁珠片段篩選結果。
具體實施方式
二代測序如火如荼,但文庫制備仍然繁瑣,核酸純化與片段篩選作為文庫構建的一個關鍵步驟,其操作是否簡便快捷,可否實現自動化是個需解決的問題。
磁珠法可克服以上所述缺點,磁珠法是采用超順磁性納米磁珠在兩種不同的溶液環境中特異吸附和解吸附核酸的特性,配合磁力分離裝置,針對性地設計試劑系統和核酸片段選擇性純化流程,從而達到快速實現核酸樣品純化及片段篩選的目的。磁珠法核酸純化過程安全無毒、操作簡便,可對核酸片段進行選擇性純化,且基于磁性特質可實現自動化、高通量。
本發明的實施例提供了一種用于核酸純化或片段篩選的試劑盒,其包括磁珠溶液、洗滌試劑和洗脫試劑;其中,所述磁珠溶液包含濃度為1~100ng/μL的氧化硅羧基磁珠、0.1~100mol/L的氯化鈉、體積百分比濃度為1%~50%的聚乙二醇和緩沖液。
本發明試劑盒中的磁珠溶液(即吸附試劑)在特定的溶液環境下(高鹽低PH)對核酸樣品中的大片段DNA的結合效率優于小片段DNA,基于這一特性,可通過調節吸附試劑的加入比例,吸附試劑加入待純化的核酸樣品的比例越小,對于中小DNA片段的吸附能力越小,通過配合特殊設計的操作流程,可實現核酸純化與片段篩選的目的。
進一步地,所述緩沖液為pH為5.5~6.5的1~100mol/L三羥基甲烷-鹽酸。所述PH優選為6.0。
進一步地,所述聚乙二醇的分子量為5000~10000道爾頓,優選為8000道爾頓。
進一步地,所述氧化硅羧基磁珠的濃度為30~70ng/μL,所述氯化鈉的濃度為30~70mol/L,所述聚乙二醇的體積百分比濃度為15%~35%。當各組分的濃度在上述數值范圍之內時,試劑盒的使用效果更佳。
所述洗滌試劑用于清洗掉非目的片段,為了實現更佳的洗滌效果,進一步地,所述洗滌試劑包含體積百分比濃度為1%~85%的乙醇,1~100mmol/L氯化鈉,0.1~10mmol/L乙二胺四乙酸(EDTA),pH為7.5~8.5的0.1~10mmol/L三羥基甲烷-鹽酸。三羥基甲烷-鹽酸的pH優選為8.0。
所述洗脫試劑用于將磁珠上的目的片段清洗下來,為了實現更佳的洗脫效果,進一步地,所述洗脫試劑含有pH為8.0~9.0的0.1~10mmol/L三羥基甲烷-鹽酸。三羥基甲烷-鹽酸的pH優選為8.5。
在一個優選的實施例中,一種核酸純化或片段篩選試劑盒,包括磁珠溶液(即吸附試劑)、洗滌試劑、洗脫試劑;其中,
所述磁珠溶液包含濃度為1~100ng/μL的氧化硅羧基磁珠、濃度為0.1~100mol/L的氯化鈉,體積百分比濃度為1%~50%的PEG8000,1~100mol/L的三羥基甲烷-鹽酸(Tris-HCL pH=6.0)。
所述洗滌試劑含有體積百分比濃度為1%~85%的乙醇,1~100mmol/L氯化鈉,0.1~10mmol/L乙二胺四乙酸(EDTA),0.1~10mmol/L三羥基甲烷-鹽酸(Tris-HCL pH=8.0),現配現用。
所述洗脫試劑含有0.1~10mmol/L三羥基甲烷-鹽酸(Tris-HCL pH=8.5)。
本發明的實施例還提供了使用以上所述的試劑盒進行核酸純化的方法,該方法的流程示意圖如圖1所示,該方法具體包括以下步驟:
1)向盛有待純化核酸樣品的反應管中加入所述磁珠溶液,混勻,室溫下靜置3~10min;
2)將所述反應管置于磁力架,靜置2~5min,待溶液澄清后,吸走上清液;
3)向所述反應管中加入所述洗滌試劑,室溫靜置20~60s,吸走上清液;此步驟至少進行一次;
4)保持所述反應管置于磁力架上狀態,室溫開蓋晾干2~5min;
5)將所述反應管從磁力架上取下來,加入洗脫試劑,混勻,室溫靜置2~6min;
6)將所述反應管重新放置在磁力架上,室溫靜置1~3min,上清液即純化后的DNA產物。
磁珠溶液的加入比例對核酸的純化有較大影響,可通過調節磁珠溶液的加入比例,來提高核酸純化效果,對于本發明的磁珠溶液來說,磁珠溶液加入待純化的核酸樣品的比例越小,對于中小DNA片段的吸附能力越小,進一步地,所述步驟1)中,磁珠溶液的加入體積為待純化核酸樣品體積的0.5~2倍,優選為1.8倍。當磁珠溶液的加入體積為待純化核酸樣品體積的1.8倍時,相比于其他的用量純化效果更好,此時核酸純化效率可穩定地達到80%以上。
本發明的實施例還提供了使用以上所述的試劑盒進行片段篩選的方法,該方法的流程示意圖如圖2所示,該方法具體包括以下步驟:
1')將第一輪磁珠溶液加入盛有待篩選核酸樣品的反應管中,混勻,室溫下靜置3~10min;
2')將所述反應管放置在磁力架上,靜置2~5min,待溶液澄清后將上清液轉移置新的反應管;
3')向上述裝有上清液的反應管加入第二輪磁珠溶液,室溫靜置3~10min,置于磁力架上,靜置2~5min,待溶液澄清后吸走上清液;所述第一輪磁珠溶液與第二輪磁珠溶液的總和即為所述磁珠溶液;
4')向反應管中加入洗滌試劑,室溫靜置20~60s,吸走上清液;此步驟至少進行一次;
5')保持反應管置于磁力架上狀態,室溫開蓋晾干2~5min;
6')將反應管從磁力架上取下來,加入洗脫試劑,混勻,室溫靜置2~6min;
7')將反應管重新放置在磁力架上,室溫靜置1~3min,上清液即篩選的核酸片段。
進一步地,所述第一輪磁珠溶液的加入量為待篩選核酸樣品體積的0.4~0.8倍,所述第二輪磁珠溶液的加入量為待篩選核酸樣品體積的0.1~0.3倍,所述篩選的核酸片段的平均長度為250~700bp。
為更好的說明本發明的目的、技術方案和優點,下面將結合具體實施例對本發明作進一步說明。
實施例1
核酸純化或片段篩選試劑盒
一種核酸純化或片段篩選試劑盒,包括磁珠溶液(即吸附試劑)、洗滌試劑、洗脫試劑;其中,
所述磁珠溶液包含濃度為10ng/μL的氧化硅羧基磁珠、濃度為2.5mol/L的氯化鈉,體積百分比濃度為12%的PEG8000,1mol/L的三羥基甲烷-鹽酸(Tris-HCL pH=6.0),2℃-8℃儲存。
所述洗滌試劑含有體積百分比濃度為70%的乙醇,100mmol/L氯化鈉,10mmol/L乙二胺四乙酸(EDTA),10mmol/L三羥基甲烷-鹽酸(Tris-HCLpH=8.0),現配現用,室溫儲存。
所述洗脫試劑含有10mmol/L三羥基甲烷-鹽酸(Tris-HCL pH=8.5),室溫儲存。
核酸純化方法
使用本實施例的試劑盒進行核酸純化的方法,其包括以下步驟:
(1)使用前,將磁珠溶液從2-8℃冰箱中取出,室溫下震蕩混勻,平衡30min。
(2)根據純化目的往待純化核酸樣品加入0.5~2×已混勻的磁珠,×表示待純化核酸樣品的體積,若加入磁珠的比例為1.8X,待純化核酸樣品體積為100μL,則加入磁珠的比例為1.8×100μL,即180μL。
(3)用移液器反復吹打10次使磁珠溶液和待純化樣本充分混勻,室溫下靜置5min。
(4)將反應管置于磁力架,靜置2min,待溶液澄清后,吸走上清。
(5)向反應管中加入洗滌試劑200μL,室溫靜置30s,吸走上清。
注意不可將反應管從磁力分離架上拿下或將磁珠吹散。
(6)重復步驟5。
(7)保持反應管置于磁力架上狀態,室溫開蓋晾干2min。
(8)將反應管從磁力架上取下來,加入50μL洗脫試劑,移液器反復吹打10次混勻,室溫靜置3min。
(9)將反應管重新放置在磁力架上,室溫靜置1min,上清液即純化后的DNA產物。
(10)將該上清液轉入新的反應管或者反應板中,供下一步反應或檢測使用。
核酸片段篩選方法
使用本實施例的試劑盒進行核酸片段篩選的方法,其包括以下步驟:
(1)向盛有待篩選核酸樣品的反應管中加入第一輪磁珠溶液,將充分震蕩混勻平衡后的磁珠溶液加入待篩選的核酸片段樣品。
(2)用移液器反復吹打10次,將磁珠溶液和待篩選的核酸樣本充分混勻,室溫靜置5min。
(3)將反應管放置在磁力架上,靜置2min,待溶液澄清后將上清轉移置新的反應管。
(4)向上述裝有上清液的反應管加入第二輪磁珠溶液,室溫靜置5min;
(5)置于磁力架,靜置2min,待溶液澄清后吸走上清。
(6)向反應管中加入洗滌試劑200μL,室溫靜置30s,吸走上清。
(7)重復步驟(6)。
(8)保持反應管置于磁力架上狀態,室溫開蓋晾干2min。
(9)將反應管從磁力架上取下來,加入50μL洗脫試劑,移液器反復吹打10次混勻,室溫靜置3min。
(10)將反應管重新放置在磁力架上,室溫靜置1min,上清液即純化后的DNA產物。
(11)將該上清液轉入新的反應管或者反應板中,供下一步反應或檢測使用。
所述第一輪磁珠溶液與第二輪磁珠溶液的總和即為所述磁珠溶液;所述第一輪磁珠溶液的加入量為待篩選核酸樣品體積的0.4~0.8倍,所述第二輪磁珠溶液的加入量為待篩選核酸樣品體積的0.1~0.3倍,所述篩選的核酸片段的平均長度為250~700bp。
實施例2
核酸純化或片段篩選試劑盒
一種核酸純化或片段篩選試劑盒,包括磁珠溶液(即吸附試劑)、洗滌試劑、洗脫試劑;其中,
所述磁珠溶液包含濃度為1ng/μL的氧化硅羧基磁珠、濃度為0.1mol/L的氯化鈉,體積百分比濃度為10%的PEG8000,10mol/L的三羥基甲烷-鹽酸(Tris-HCL pH=6.0),2℃-8℃儲存。
所述洗滌試劑含有體積百分比濃度為1%的乙醇,1mmol/L氯化鈉,0.5mmol/L乙二胺四乙酸(EDTA),0.5mmol/L三羥基甲烷-鹽酸(Tris-HCLpH=8.0),現配現用,室溫儲存。
所述洗脫試劑含有0.1mmol/L三羥基甲烷-鹽酸(Tris-HCL pH=8.5),室溫儲存。
核酸純化方法和核酸片段篩選方法同實施例1。
實施例3
核酸純化或片段篩選試劑盒
一種核酸純化或片段篩選試劑盒,包括磁珠溶液(即吸附試劑)、洗滌試劑、洗脫試劑;其中,
所述磁珠溶液包含濃度為100ng/μL的氧化硅羧基磁珠、濃度為100mol/L的氯化鈉,體積百分比濃度為50%的PEG8000,100mol/L的三羥基甲烷-鹽酸(Tris-HCL pH=6.0),2℃-8℃儲存。
所述洗滌試劑含有體積百分比濃度為85%的乙醇,100mmol/L氯化鈉,10mmol/L乙二胺四乙酸(EDTA),10mmol/L三羥基甲烷-鹽酸(Tris-HCLpH=8.0),現配現用,室溫儲存。
所述洗脫試劑含有10mmol/L三羥基甲烷-鹽酸(Tris-HCL pH=8.5),室溫儲存。
核酸純化方法和核酸片段篩選方法同實施例1。
實施例4
核酸純化或片段篩選試劑盒
一種核酸純化或片段篩選試劑盒,包括磁珠溶液(即吸附試劑)、洗滌試劑、洗脫試劑;其中,
所述磁珠溶液包含濃度為10ng/μL的氧化硅羧基磁珠、濃度為10mol/L的氯化鈉,體積百分比濃度為1%的PEG8000,1mol/L的三羥基甲烷-鹽酸(Tris-HCLpH=6.0),2℃-8℃儲存。
所述洗滌試劑含有體積百分比濃度為20%的乙醇,30mmol/L氯化鈉,5mmol/L乙二胺四乙酸(EDTA),5mmol/L三羥基甲烷-鹽酸(Tris-HCL pH=8.0),現配現用,室溫儲存。
所述洗脫試劑含有5mmol/L三羥基甲烷-鹽酸(Tris-HCL pH=8.5),室溫儲存。
核酸純化方法和核酸片段篩選方法同實施例1。
實施例5
核酸純化或片段篩選試劑盒
一種核酸純化或片段篩選試劑盒,包括磁珠溶液(即吸附試劑)、洗滌試劑、洗脫試劑;其中,
所述磁珠溶液包含濃度為30ng/μL的氧化硅羧基磁珠、濃度為30mol/L的氯化鈉,體積百分比濃度為15%的PEG8000,15mol/L的三羥基甲烷-鹽酸(Tris-HCL pH=6.0),2℃-8℃儲存。
所述洗滌試劑含有體積百分比濃度為50%的乙醇,60mmol/L氯化鈉,7mmol/L乙二胺四乙酸(EDTA),7mmol/L三羥基甲烷-鹽酸(Tris-HCL pH=8.0),現配現用,室溫儲存。
所述洗脫試劑含有7mmol/L三羥基甲烷-鹽酸(Tris-HCL pH=8.5),室溫儲存。
核酸純化方法和核酸片段篩選方法同實施例1。
實施例6
核酸純化或片段篩選試劑盒
一種核酸純化或片段篩選試劑盒,包括磁珠溶液(即吸附試劑)、洗滌試劑、洗脫試劑;其中,
所述磁珠溶液包含濃度為70ng/μL的氧化硅羧基磁珠、濃度為70mol/L的氯化鈉,體積百分比濃度為35%的PEG8000,50mol/L的三羥基甲烷-鹽酸(Tris-HCL pH=6.0),2℃-8℃儲存。
所述洗滌試劑含有體積百分比濃度為70%的乙醇,80mmol/L氯化鈉,8mmol/L乙二胺四乙酸(EDTA),9mmol/L三羥基甲烷-鹽酸(Tris-HCL pH=8.0),現配現用,室溫儲存。
所述洗脫試劑含有9mmol/L三羥基甲烷-鹽酸(Tris-HCL pH=8.5),室溫儲存。
核酸純化方法和核酸片段篩選方法同實施例1。
實施例7
以實施例1的核酸純化或片段篩選試劑盒為例,當利用此試劑盒處理待純化的核酸樣品時,對不同的磁珠溶液的加入比例對核酸樣品的純化效果影響進行測試分析,結果如圖3所示。從圖中可知,磁珠溶液加入待純化的核酸樣品的比例越小,對于中小DNA片段的吸附能力越小,因此可通過配合特殊設計的操作流程,可實現核酸純化與片段篩選的目的。
實施例8
以實施例1的核酸純化或片段篩選試劑盒為例,與進口品牌磁珠比較,在進行核酸純化時,使用相對于待純化核酸樣品體積1.8倍的磁珠溶液體積進行純化,純化效率達80%以上。與同類型產品AMPureXP磁珠(操作步驟與實施例1的核酸純化步驟相同)比較,純化效率更高。批次間穩定性良好,CV值<8%,結果如圖4、圖5所示,其中,橫坐標的AMPureXP代表使用AMPureXP磁珠進行核酸純化的結果,ECOgene B1、ECOgene B2、ECOgene B3分別代表使用本發明的試劑盒進行3個不同批次的試驗所得的核酸純化結果。
實施例9
以實施例1的核酸純化或片段篩選試劑盒為例,在利用該試劑盒進行片段篩選時,設置六組不同的第一輪磁珠溶液的加入量和第二輪磁珠溶液的加入量(具體詳見表1),篩選后得到的片段結果如圖6所示。
表1
表中”ד表示待篩選核酸樣品的體積,如篩選的目的片段平均長度為320bp,樣品DNA體積為100μL,則第一輪磁珠溶液使用體積為0.7×100μL=70μL;第二輪磁珠溶液使用體積為0.20×100μL=20μL。圖6為2100檢測模擬電泳圖,其中,1~6分別代表表1中的第一組~第六組,7代表采用只加入一輪磁珠溶液進行核酸片段篩選的結果,從圖6可知,采用加入兩輪磁珠溶液的方式,可實現更精準的核酸片段篩選,通過選擇不同的第一輪磁珠溶液的加入量和第二輪磁珠溶液的加入量,可實現不同大小的核酸片段篩選。
最后所應當說明的是,以上實施例僅用以說明本發明的技術方案而非對本發明保護范圍的限制,盡管參照較佳實施例對本發明作了詳細說明,本領域的普通技術人員應當理解,可以對本發明的技術方案進行修改或者等同替換,而不脫離本發明技術方案的實質和范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!