一種稠合的苯并咪唑雜氮環丁酮衍生物的制備方法及其在抗腫瘤藥物中的應用與流程
本申請涉及藥物領域,尤其是一類稠合的苯并咪唑雜氮環丁酮衍生物及其在抗腫瘤藥物中的應用。
背景技術:
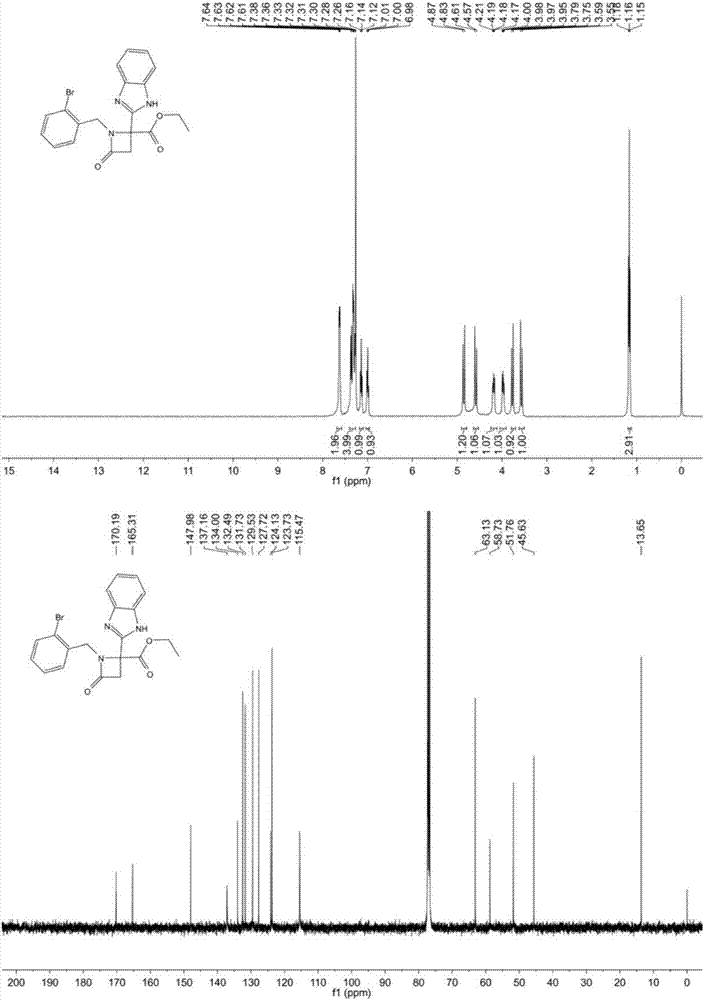
:苯并咪唑類化合物具有廣泛的生物活性,在抗腫瘤、消炎等疾病方面有所應用,另外還可以作為有機反應的重要中間體。在倡導綠色化學的今天,如何使苯并咪唑類化合物的合成進一步綠色化,仍然是一個重要的課題。雜氮環丁酮類化合物也同樣作為重要的藥物基團,在很多的藥物中都有所體現。首個也是唯一一個選擇性膽固醇吸收抑制劑依折麥布(ezetimibe),是降脂藥物近15年來的一大創新,該藥物就是雜氮環丁酮類化合物。雖然,雜氮環丁酮結構有很多的研究已經開展,但是苯并咪唑和雜氮環丁酮結構共同組合的新結構化合物還未有報道,急需人們關注和研究。技術實現要素:本發明的目的在于提供一類稠合的苯并咪唑雜氮環丁酮衍生物的制備方法及其在抗腫瘤藥物中的應用。本申請合成出稠合的苯并咪唑雜氮環丁酮衍生物,并對其進行了體外腫瘤細胞抑制活性的測試,結果顯示這類化合物對人類肺癌、膠質瘤、肝癌、乳腺癌、結腸癌和前列腺癌有一定的抑制作用(10mm生長抑制率可達到53%),具有抗腫瘤活性,可用作制備抗腫瘤藥物。本發明的目的是通過以下技術方案實現的:一種稠合的苯并咪唑雜氮環丁酮衍生物,其特征在于:衍生物的結構通式如下:其中所述的r1為烷基、芳基和雜芳基,r2為氫原子、鹵素、甲基。而且,所述化合物為乙基2-(1h-苯并咪唑-2-基)-1-(2-溴芐基)-4-氧代氮雜環丁烷-2-羧酸乙酯。而且,所述化合物為乙基2-(1h-苯并咪唑-2-基)-1-芐基-4-氧代氮雜環丁烷-2-羧酸乙酯。而且,所述化合物為乙基2-(1h-苯并咪唑-2-基)-1-(3-氟芐基)-4-氧代氮雜環丁烷-2-羧酸乙酯。而且,所述化合物為乙基2-(1h-苯并咪唑-2-基)-1-(4-甲氧基芐基)-4-氧代氮雜環丁烷-2-羧酸乙酯。而且,所述化合物為乙基2-(1h-苯并咪唑-2-基)-1-(4-甲氧基苯基)-4-氧代氮雜環丁烷-2-羧酸乙酯。而且,所述化合物為乙基2-(1h-苯并咪唑-2-基)-4-氧代-1-苯基氮雜環丁烷-2-羧酸乙酯。而且,所述化合物為乙基2-(1h-苯并咪唑-2-基)-1-(3-氯苯基)-4-氧代氮雜環丁烷-2-羧酸乙酯。而且,所述化合物為乙基2-(1h-苯并咪唑-2-基)-1-(4-氯苯基)-4-氧代氮雜環丁烷-2-羧酸乙酯。所述的稠合的苯并咪唑雜氮環丁酮衍生物,其特征在于:合成路線如下其中r1為烷基、芳基和雜芳基,r2為氫原子、鹵素、甲基。而且,稠合苯并咪唑雜氮環丁酮衍生物在制備抗腫瘤藥物中的應用。所述化合物可用作制備治療人類肺癌、膠質瘤、肝癌、乳腺癌、結腸癌和前列腺癌的抗腫瘤藥物。本發明的優點和積極效果:(1)本發明以乙醛酸乙酯為其中一種原料,經過ugi反應和堿性條件下的關環得到雜氮環丁酮結構,然后在酸性條件下得到苯并咪唑環,首次合成出了具有抗腫瘤活性的稠合苯并咪唑雜氮環丁酮衍生物,并對其進行了體外腫瘤細胞抑制活性的測試,結果顯示這類化合物對人類肺癌、膠質瘤、肝癌、乳腺癌、結腸癌和前列腺癌有一定的抑制作用(10mm生長抑制率可達到53%),具有抗腫瘤活性,可用作制備抗腫瘤藥物。(2)本發明合成路線具有操作工藝簡單、合成路線短,成本低等優點。(3)本發明所述的化合物具有抑制或殺滅人肺癌、膠質瘤、肝癌、乳腺癌、結腸癌和前列腺癌細胞,可以用作制備治療相關的抗腫瘤藥物。附圖說明圖1為結構通式,其中所述的r1為烷基、芳基和雜芳基,r2為氫原子、鹵素、甲基。圖2為乙基2-(1h-苯并咪唑-2-基)-1-(2-溴芐基)-4-氧代氮雜環丁烷-2-羧酸乙酯的核磁譜圖。圖3為乙基2-(1h-苯并咪唑-2-基)-1-芐基-4-氧代氮雜環丁烷-2-羧酸乙酯的核磁譜圖。圖4為乙基2-(1h-苯并咪唑-2-基)-1-(3-氟芐基)-4-氧代氮雜環丁烷-2-羧酸乙酯的核磁譜圖。圖5為乙基2-(1h-苯并咪唑-2-基)-1-(4-甲氧基芐基)-4-氧代氮雜環丁烷-2-羧酸乙酯的核磁譜圖。圖6為乙基2-(1h-苯并咪唑-2-基)-1-(4-甲氧基苯基)-4-氧代氮雜環丁烷-2-羧酸乙酯的核磁譜圖。圖7為乙基2-(1h-苯并咪唑-2-基)-4-氧代-1-苯基氮雜環丁烷-2-羧酸乙酯的核磁譜圖。圖8為乙基2-(1h-苯并咪唑-2-基)-1-(3-氯苯基)-4-氧代氮雜環丁烷-2-羧酸乙酯的核磁譜圖。圖9為乙基2-(1h-苯并咪唑-2-基)-1-(4-氯苯基)-4-氧代氮雜環丁烷-2-羧酸乙酯的核磁譜圖。具體實施方式為了理解本發明,下面結合實施例子對本發明作進一步說明:下述實施例子是說明性的,不是限定性的,不能以下述實施例來限定本發明的保護范圍。本發明所述的稠合苯并咪唑雜氮環丁酮衍生物的結構通式如下:其中r1為烷基、芳基和雜芳基,r2為氫原子、鹵素、甲基。所述的稠合的苯并咪唑雜氮環丁酮衍生物具體合成路線如下:下面通過實施例子具體說明合成過程。實施例1其中r1為烷基,r2為氫原子,即乙基2-(1h-苯并咪唑-2-基)-1-(2-溴芐基)-4-氧代氮雜環丁烷-2-羧酸乙酯的合成,具體步驟如下:在10毫升大小的微波爐反應管中,先將乙醛酸乙酯(1.5毫摩爾)和2-溴芐胺(1.0毫摩爾)溶解在2.0毫升的甲醇溶液中,然后再將溴乙酸(1.0毫摩爾)和異氰化合物(1.0毫摩爾)依次加入該溶液中,反應液常溫下攪拌一晚上,然后使用薄層色譜檢測異氰化合物,如果沒有剩余的異氰原料,溶液使用氮氣吹干,然后再用5.0毫升的二甲基甲酰胺(dmf)溶解,再加入二異丙胺(dipa)(2.0毫摩爾),在微波爐中90oc反應10分鐘。該溶液使用乙酸乙酯(15毫升)稀釋,然后用飽和食鹽水洗滌3次,每次20毫升。有機相使用硫酸鎂干燥后,采用真空泵旋干得到固體。把該固體溶解在10%tfa/dce(5毫升),然后再微波120oc反應10分鐘。該反應混合物使用乙酸乙酯(15毫升)稀釋后,用飽和碳酸鈉溶液和氯化鈉溶液洗滌洗滌3次,每次20毫升。有機項使用硫酸鎂干燥后,采用硅膠柱進行分離,得到目標化合物乙基2-(1h-苯并咪唑-2-基)-1-(2-溴芐基)-4-氧代氮雜環丁烷-2-羧酸乙酯,產率47%。1hnmr(400mhz,cdcl3)δ7.62(dd,j=5.9,3.1hz,2h),7.40–7.27(m,4h),7.14(t,j=7.4hz,1h),7.00(t,j=7.5hz,1h),4.85(d,j=15.2hz,1h),4.59(d,j=15.2hz,1h),4.18(dt,j=14.3,7.2hz,1h),4.04–3.91(m,1h),3.77(d,j=14.4hz,1h),3.57(d,j=14.4hz,1h),1.16(t,j=7.1hz,3h).13cnmr(100mhz,cdcl3)δ170.19,165.31,147.98,137.16,134.00,132.49,131.73,129.53,127.72,124.13,123.73,115.47,63.13,58.73,51.76,45.63,13.65.lc/mscalculatedforc20h18brn3o3[m+h]+,428;found428。實施例2其中r1為烷基,r2為氫原子,即乙基2-(1h-苯并咪唑-2-基)-1-芐基-4-氧代氮雜環丁烷-2-羧酸乙酯的合成,具體步驟如下:在10毫升大小的微波爐反應管中,先將乙醛酸乙酯(1.5毫摩爾)和芐胺(1.0毫摩爾)溶解在2.0毫升的甲醇溶液中,然后再將溴乙酸(1.0毫摩爾)和異氰化合物(1.0毫摩爾)依次加入該溶液中,反應液常溫下攪拌一晚上,然后使用薄層色譜檢測異氰化合物,如果沒有剩余的異氰原料,溶液使用氮氣吹干,然后再用5.0毫升的二甲基甲酰胺(dmf)溶解,再加入二異丙胺(dipa)(2.0毫摩爾),在微波爐中90oc反應10分鐘。該溶液使用乙酸乙酯(15毫升)稀釋,然后用飽和食鹽水洗滌3次,每次20毫升。有機相使用硫酸鎂干燥后,采用真空泵旋干得到固體。把該固體溶解在10%tfa/dce(5毫升),然后再微波120oc反應10分鐘。該反應混合物使用乙酸乙酯(15毫升)稀釋后,用飽和碳酸鈉溶液和氯化鈉溶液洗滌洗滌3次,每次20毫升。有機項使用硫酸鎂干燥后,采用硅膠柱進行分離,得到目標化合物乙基2-(1h-苯并咪唑-2-基)-1-芐基-4-氧代氮雜環丁烷-2-羧酸乙酯,產率45%。1hnmr(400mhz,cdcl3)δ9.10(s,2h),7.64(dd,j=6.1,3.1hz,2h),7.34(dd,j=6.1,3.1hz,2h),7.15–6.97(m,5h),4.67(d,j=15.2hz,1h),4.46(d,j=15.2hz,1h),4.03(dddd,j=25.0,10.7,7.2,3.6hz,2h),3.59-3.77(m,2h),1.14(t,j=7.1hz,3h).13cnmr(100mhz,cdcl3)δ168.19,147.76,134.65,134.10,128.81,128.46,127.83,124.96,115.06,63.44,58.6550.66,46.14,13.61.lc/mscalculatedforc20h19n3o3[m+h]+,350;found350。實施例3其中r1為烷基,r2為氫原子,即乙基2-(1h-苯并咪唑-2-基)-1-(3-氟芐基)-4-氧代氮雜環丁烷-2-羧酸乙酯的合成,具體步驟如下:在10毫升大小的微波爐反應管中,先將乙醛酸乙酯(1.5毫摩爾)和3-氟芐胺(1.0毫摩爾)溶解在2.0毫升的甲醇溶液中,然后再將溴乙酸(1.0毫摩爾)和異氰化合物(1.0毫摩爾)依次加入該溶液中,反應液常溫下攪拌一晚上,然后使用薄層色譜檢測異氰化合物,如果沒有剩余的異氰原料,溶液使用氮氣吹干,然后再用5.0毫升的二甲基甲酰胺(dmf)溶解,再加入二異丙胺(dipa)(2.0毫摩爾),在微波爐中90oc反應10分鐘。該溶液使用乙酸乙酯(15毫升)稀釋,然后用飽和食鹽水洗滌3次,每次20毫升。有機相使用硫酸鎂干燥后,采用真空泵旋干得到固體。把該固體溶解在10%tfa/dce(5毫升),然后再微波120oc反應10分鐘。該反應混合物使用乙酸乙酯(15毫升)稀釋后,用飽和碳酸鈉溶液和氯化鈉溶液洗滌洗滌3次,每次20毫升。有機項使用硫酸鎂干燥后,采用硅膠柱進行分離,得到目標化合物乙基2-(1h-苯并咪唑-2-基)-1-(3-氟芐基)-4-氧代氮雜環丁烷-2-羧酸乙酯,產率46%。1hnmr(400mhz,cdcl3)δ7.62(dd,j=6.0,3.1hz,2h),7.33(dd,j=6.1,3.1hz,3h),7.11(dd,j=13.8,7.8hz,1h),7.00–6.78(m,3h),4.71(d,j=15.3hz,1h),4.37(d,j=15.3hz,1h),4.19(tt,j=14.0,7.0hz,1h),4.11–3.99(m,1h),3.74(d,j=14.4hz,1h),3.60(d,j=14.5hz,1h),1.20(t,j=7.1hz,3h).13cnmr(100mhz,cdcl3)δ169.87,165.52,163.95,161.49,147.98,137.01,130.05,124.56,123.98,116.00,115.79,115.46,114.90,114.69,63.25,58.79,51.15,45.59,13.71.lc/mscalculatedforc20h18fn3o3[m+h]+,368;found368。實施例4其中r1為烷基,r2為氫原子,即乙基2-(1h-苯并咪唑-2-基)-1-(4-甲氧基芐基)-4-氧代氮雜環丁烷-2-羧酸乙酯的合成,具體步驟如下:在10毫升大小的微波爐反應管中,先將乙醛酸乙酯(1.5毫摩爾)和3-氟芐胺(1.0毫摩爾)溶解在2.0毫升的甲醇溶液中,然后再將溴乙酸(1.0毫摩爾)和異氰化合物(1.0毫摩爾)依次加入該溶液中,反應液常溫下攪拌一晚上,然后使用薄層色譜檢測異氰化合物,如果沒有剩余的異氰原料,溶液使用氮氣吹干,然后再用5.0毫升的二甲基甲酰胺(dmf)溶解,再加入二異丙胺(dipa)(2.0毫摩爾),在微波爐中90oc反應10分鐘。該溶液使用乙酸乙酯(15毫升)稀釋,然后用飽和食鹽水洗滌3次,每次20毫升。有機相使用硫酸鎂干燥后,采用真空泵旋干得到固體。把該固體溶解在10%tfa/dce(5毫升),然后再微波120oc反應10分鐘。該反應混合物使用乙酸乙酯(15毫升)稀釋后,用飽和碳酸鈉溶液和氯化鈉溶液洗滌洗滌3次,每次20毫升。有機項使用硫酸鎂干燥后,采用硅膠柱進行分離,得到目標化合物乙基2-(1h-苯并咪唑-2-基)-1-(4-甲氧基芐基)-4-氧代氮雜環丁烷-2-羧酸乙酯,產率49%。1hnmr(400mhz,cdcl3)δ7.57(dd,j=6.1,3.2hz,2h),7.31(dd,j=6.1,3.2hz,2h),7.03(d,j=8.6hz,2h),6.64(d,j=8.6hz,2h),4.51(q,j=14.8hz,2h),4.30–4.18(m,1h),4.14–4.07(m,1h),3.74(d,j=14.5hz,1h),3.66(s,3h),3.59(d,j=14.5hz,1h),1.26(d,j=2.2hz,3h).13cnmr(100mhz,cdcl3)δ169.79,165.59,159.37,148.37,136.94,130.53,126.18,123.79,115.36,113.94,63.13,58.68,55.2,50.67,45.43,13.86.lc/mscalculatedforc21h21n3o4[m+h]+,380;found380。實施例5其中r1為芳基,r2為氫原子,即乙基2-(1h-苯并咪唑-2-基)-1-(4-甲氧基苯基)-4-氧代氮雜環丁烷-2-羧酸乙酯的合成,具體步驟如下:在10毫升大小的微波爐反應管中,先將乙醛酸乙酯(1.5毫摩爾)和3-氟芐胺(1.0毫摩爾)溶解在2.0毫升的甲醇溶液中,然后再將溴乙酸(1.0毫摩爾)和異氰化合物(1.0毫摩爾)依次加入該溶液中,反應液常溫下攪拌一晚上,然后使用薄層色譜檢測異氰化合物,如果沒有剩余的異氰原料,溶液使用氮氣吹干,然后再用5.0毫升的二甲基甲酰胺(dmf)溶解,再加入二異丙胺(dipa)(2.0毫摩爾),在微波爐中90oc反應10分鐘。該溶液使用乙酸乙酯(15毫升)稀釋,然后用飽和食鹽水洗滌3次,每次20毫升。有機相使用硫酸鎂干燥后,采用真空泵旋干得到固體。把該固體溶解在10%tfa/dce(5毫升),然后再微波120oc反應10分鐘。該反應混合物使用乙酸乙酯(15毫升)稀釋后,用飽和碳酸鈉溶液和氯化鈉溶液洗滌洗滌3次,每次20毫升。有機項使用硫酸鎂干燥后,采用硅膠柱進行分離,得到目標化合物乙基2-(1h-苯并咪唑-2-基)-1-(4-甲氧基苯基)-4-氧代氮雜環丁烷-2-羧酸乙酯,產率44%。1hnmr(400mhz,cdcl3)δ7.67(dd,j=6.0,3.2hz,2h),7.33(dd,j=6.1,3.1hz,2h),7.16(d,j=9.0hz,2h),6.76(d,j=9.0hz,2h),4.49–4.31(m,2h),3.80–3.66(m,5h),1.26(s,3h).13cnmr(100mhz,cdcl3)δ170.39,162.15,156.87,148.23,130.12,123.95,119.04,115.63,114.47,63.60,58.63,55.44,52.15,13.94.lc/mscalculatedforc20h19n3o4[m+h]+,366;found366。實施例6其中r1為芳基,r2為氫原子,即乙基2-(1h-苯并咪唑-2-基)-4-氧代-1-苯基氮雜環丁烷-2-羧酸乙酯的合成,具體步驟如下:在10毫升大小的微波爐反應管中,先將乙醛酸乙酯(1.5毫摩爾)和苯胺(1.0毫摩爾)溶解在2.0毫升的甲醇溶液中,然后再將溴乙酸(1.0毫摩爾)和異氰化合物(1.0毫摩爾)依次加入該溶液中,反應液常溫下攪拌一晚上,然后使用薄層色譜檢測異氰化合物,如果沒有剩余的異氰原料,溶液使用氮氣吹干,然后再用5.0毫升的二甲基甲酰胺(dmf)溶解,再加入二異丙胺(dipa)(2.0毫摩爾),在微波爐中90oc反應10分鐘。該溶液使用乙酸乙酯(15毫升)稀釋,然后用飽和食鹽水洗滌3次,每次20毫升。有機相使用硫酸鎂干燥后,采用真空泵旋干得到固體。把該固體溶解在10%tfa/dce(5毫升),然后再微波120oc反應10分鐘。該反應混合物使用乙酸乙酯(15毫升)稀釋后,用飽和碳酸鈉溶液和氯化鈉溶液洗滌洗滌3次,每次20毫升。有機項使用硫酸鎂干燥后,采用硅膠柱進行分離,得到目標化合物乙基2-(1h-苯并咪唑-2-基)-4-氧代-1-苯基氮雜環丁烷-2-羧酸乙酯,產率42%。1hnmr(400mhz,cdcl3)δ7.66(dt,j=6.6,3.3hz,2h),7.37–7.30(m,2h),7.25–7.18(m,4h),7.06(ddd,j=8.6,5.2,3.4hz,1h),4.48–4.31(m,2h),3.73(dd,j=30.9,14.7hz,4h),1.22(d,j=7.1hz,3h).13cnmr(100mhz,cdcl3)δ170.32,162.37,148.11,136.80,129.19,124.78,123.88,116.91,115.65,63.62,58.29,52.29,13.88.lc/mscalculatedforc19h17n3o3[m+h]+,336;found336。實施例7其中r1為芳基,r2為氫原子,即乙基2-(1h-苯并咪唑-2-基)-1-(3-氯苯基)-4-氧代氮雜環丁烷-2-羧酸乙酯的合成,具體步驟如下:在10毫升大小的微波爐反應管中,先將乙醛酸乙酯(1.5毫摩爾)和3-氯苯胺(1.0毫摩爾)溶解在2.0毫升的甲醇溶液中,然后再將溴乙酸(1.0毫摩爾)和異氰化合物(1.0毫摩爾)依次加入該溶液中,反應液常溫下攪拌一晚上,然后使用薄層色譜檢測異氰化合物,如果沒有剩余的異氰原料,溶液使用氮氣吹干,然后再用5.0毫升的二甲基甲酰胺(dmf)溶解,再加入二異丙胺(dipa)(2.0毫摩爾),在微波爐中90oc反應10分鐘。該溶液使用乙酸乙酯(15毫升)稀釋,然后用飽和食鹽水洗滌3次,每次20毫升。有機相使用硫酸鎂干燥后,采用真空泵旋干得到固體。把該固體溶解在10%tfa/dce(5毫升),然后再微波120oc反應10分鐘。該反應混合物使用乙酸乙酯(15毫升)稀釋后,用飽和碳酸鈉溶液和氯化鈉溶液洗滌洗滌3次,每次20毫升。有機項使用硫酸鎂干燥后,采用硅膠柱進行分離,得到目標化合物乙基2-(1h-苯并咪唑-2-基)-1-(3-氯苯基)-4-氧代氮雜環丁烷-2-羧酸乙酯,產率45%。1hnmr(400mhz,cdcl3)δ7.66(dd,j=6.1,3.2hz,2h),7.41(t,j=1.8hz,1h),7.32(dd,j=6.1,3.2hz,2h),7.13(t,j=8.1hz,1h),7.01(dd,j=21.7,8.4hz,2h),4.41(tdd,j=10.7,7.1,3.6hz,2h),3.72(dd,j=34.0,14.8hz,2h),1.25(s,3h).13cnmr(100mhz,cdcl3)δ170.21,162.32,137.78,134.94,130.13,124.82,123.70,117.50,114.66,63.70,52.56,13.90.lc/mscalculatedforc19h16cln3o3[m+h]+,370;found370。實施例8其中r1為芳基,r2為氫原子,即乙基2-(1h-苯并咪唑-2-基)-1-(4-氯苯基)-4-氧代氮雜環丁烷-2-羧酸乙酯的合成,具體步驟如下:在10毫升大小的微波爐反應管中,先將乙醛酸乙酯(1.5毫摩爾)和4-氯苯胺(1.0毫摩爾)溶解在2.0毫升的甲醇溶液中,然后再將溴乙酸(1.0毫摩爾)和異氰化合物(1.0毫摩爾)依次加入該溶液中,反應液常溫下攪拌一晚上,然后使用薄層色譜檢測異氰化合物,如果沒有剩余的異氰原料,溶液使用氮氣吹干,然后再用5.0毫升的二甲基甲酰胺(dmf)溶解,再加入二異丙胺(dipa)(2.0毫摩爾),在微波爐中90oc反應10分鐘。該溶液使用乙酸乙酯(15毫升)稀釋,然后用飽和食鹽水洗滌3次,每次20毫升。有機相使用硫酸鎂干燥后,采用真空泵旋干得到固體。把該固體溶解在10%tfa/dce(5毫升),然后再微波120oc反應10分鐘。該反應混合物使用乙酸乙酯(15毫升)稀釋后,用飽和碳酸鈉溶液和氯化鈉溶液洗滌洗滌3次,每次20毫升。有機項使用硫酸鎂干燥后,采用硅膠柱進行分離,得到目標化合物乙基2-(1h-苯并咪唑-2-基)-1-(4-氯苯基)-4-氧代氮雜環丁烷-2-羧酸乙酯,產率45%。1hnmr(400mhz,cdcl3)δ11.01(s,1h),7.64(dd,j=5.8,3.1hz,2h),7.34(dd,j=6.0,3.0hz,2h),7.23–7.03(m,4h),4.48–4.25(m,2h),3.76(q,j=15.1hz,2h),1.21(t,j=7.1hz,3h).13cnmr(100mhz,cdcl3)δ168.69,162.20,147.32,135.78,135.12,130.05,129.24,124.74,118.12,115.40,63.92,58.69,52.27,13.85.lc/mscalculatedforc19h16cln3o3[m+h]+,370;found370。實施例9抗腫瘤活性測試的具體步驟:本發明抗腫瘤測試所用的細胞為a549,ln229,mda-mb-453,sw620和du145。細胞使用的培養液為含的青霉素一鏈霉素溶液的胎牛血清的dmem細胞培養液,培養條件為37℃、含5%co2的恒溫培養箱。具體步驟:(1)用血球計數板對細胞進行計數后,用dmemlowglucose培養液將其稀釋至5×104個/ml;(2)在96孔板的每個孔里加入100ml細胞懸液吹打混勻,培養箱37℃溫育24h;(3)將所要測試化合物稀釋至種濃度為10mm,按照該濃度依次加藥,培養箱37℃溫育48h;(4)加入濃度為5mg/ml的mtt,培養箱37℃溫育4h;(5)加dmso將細胞溶解,酶標儀測490nm和630nm下的od值;(6)處理數據,根據od值計算抑制率。表1新型稠合苯并咪唑雜氮環丁酮衍生物抗腫瘤活性結果。序號化合物a549ln229mda-mb-453sw620du1451乙基2-(1h-苯并咪唑-2-基)-1-(2-溴芐基)-4-氧代氮雜環丁烷-2-羧酸乙酯6391518192乙基2-(1h-苯并咪唑-2-基)-1-芐基-4-氧代氮雜環丁烷-2-羧酸乙酯2234247323乙基2-(1h-苯并咪唑-2-基)-1-(3-氟芐基)-4-氧代氮雜環丁烷-2-羧酸乙酯1038131244乙基2-(1h-苯并咪唑-2-基)-1-(4-甲氧基芐基)-4-氧代氮雜環丁烷-2-羧酸乙酯243462245乙基2-(1h-苯并咪唑-2-基)-1-(4-甲氧基苯基)-4-氧代氮雜環丁烷-2-羧酸乙酯32531514156乙基2-(1h-苯并咪唑-2-基)-4-氧代-1-苯基氮雜環丁烷-2-羧酸乙酯3843911187乙基2-(1h-苯并咪唑-2-基)-1-(3-氯苯基)-4-氧代氮雜環丁烷-2-羧酸乙酯36379548乙基2-(1h-苯并咪唑-2-基)-1-(4-氯苯基)-4-氧代氮雜環丁烷-2-羧酸乙酯630262315由測試結果可以看出,本發明所述的新型稠合苯并咪唑雜氮環丁酮衍生物可以抑制或殺滅瘤細胞,具有抗腫瘤活性,可以在治療人肺癌、膠質瘤、肝癌、乳腺癌、結腸癌和前列腺癌的抗腫瘤藥物。當前第1頁12
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1
- 苯并二氮雜*衍生物的2-萘磺酸鹽及晶型和它們的制備方法與制造工藝
- 一種二氰基甲烯基苯并四氫呋喃衍生物及其制備方法與制造工藝
- 苯并吲唑類衍生物及其制備方法、應用與制造工藝
- 一種二苯并環庚烷衍生物的制備方法與制造工藝
- Atropurpuran的苯并咪唑基和嗎啉基衍生物組合物用于防治胰腺纖維化的制造方法與工藝
- 一種苯并咪唑衍生物鎘配合物及其制備方法和應用
- 一種咪唑并吡啶巰乙酸類衍生物及其制備方法與應用
- Artalbic acid的O?(苯并咪唑基)乙基與O?(二羥乙胺基)乙基衍生物的組合物在抗病毒 ...的制作方法
- 阿掏比克酸苯并咪唑基與二羥乙胺基衍生物的組合物用于制備抗骨質疏松藥物的制作方法
- 阿掏比克酸苯并咪唑基與二羥乙胺基衍生物的組合物用于制備防治胰腺纖維化藥物的制作方法