一種植物乳桿菌高產胞外多糖的方法與流程
本發明屬于乳酸菌胞外多糖領域,具體涉及一種植物乳桿菌高產胞外多糖的方法。
背景技術:
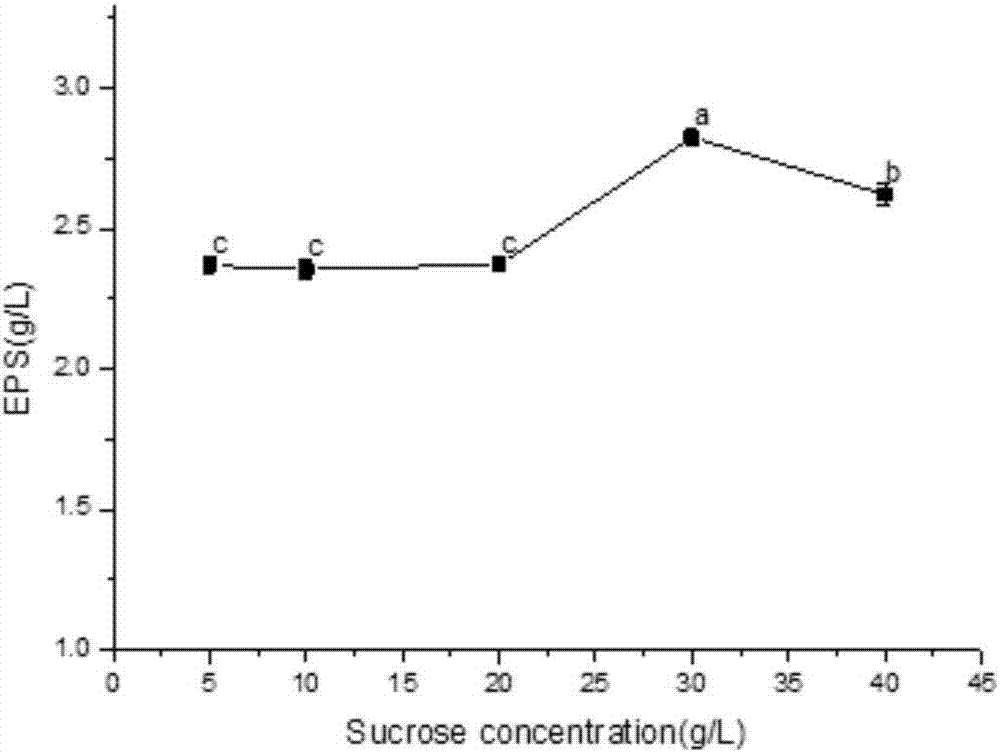
:細菌胞外多糖(exopolysaccharides,eps)是一類微生物利用培養基中的碳源經過一系列磷酸化、脂質化、連接、聚合及運輸到胞外即可附著在細胞壁上亦可直接滲入到培養中,由寡糖經脂質載體聚合而成的大分子多糖,其中由一種寡糖形成的多糖為同型多糖,否則為異型多糖,經過提取純化并凍干后的多糖呈白色。胞外多糖的生理生化功能主要體現在食品加工中,比如可以作為穩定的增稠劑、乳化劑、脫水收縮劑,相對化學添加劑而言,胞外多糖的天然無毒性將更有市場價值。不同的乳酸菌所產生的eps結構不同,即寡糖組成和比例不同,同時,同種菌株在不同的碳源存在條件下也將生成不同結構的eps。因此可選擇合適的碳源、發酵條件、菌株等來獲得高產eps菌株。此外,胞外多糖在聚合運輸到胞外后,可作為物理保護屏障起到保護菌體免受外界毒害、抵御外界不良信息的作用,還可協助細胞與細胞間的識別、便于在特殊環境中附著在固體表面,比如在營養相對較缺乏的環境中,固定在營養較豐富的表面上,待營養物耗盡便從表面解離。eps作為次級代謝物可保護細菌免受干燥、捕食,并具有一定耐毒性。細菌eps的大量分泌使得液體培養基變粘稠,可作為良好的增稠劑、乳化劑。除此之外,乳酸菌eps對人體的免疫系統也有一定調節作用,如增強巨噬細胞的活性,這為食品工業、化學工業和醫藥行業帶來研究價值。膳食纖維的攝入可以降低代謝綜合征的生理危險因素,例如高血脂和低度炎癥狀態。膳食纖維通常是來源于植物,然而微生物胞外多糖(eps)具有可潛在地發揮類似生理效應的結構。多項實驗表明eps可抑制血壓升高,降低血清膽固醇總水平,降低動物體內血糖水平,并能夠在動物腸粘膜中誘導免疫應答反應調節免疫能力,這表明可以使用微生物eps來控制代謝綜合征中發生的異常,并且eps的研究可為降脂藥物或保健品的開發提供理論指導。然而目前微生物胞外多糖的產量依然較低,想要投入大規模的生產還需要進一步的提高菌種生產能力,并且eps結構和特性隨菌株和發酵條件的改變而不同,比如碳源、發酵時間和培養基組成的差異,eps產量和性能也將有所不同。進一步提高微生物eps產量,并開拓其生理生化特性,將是胞外多糖研究領域的突破點。技術實現要素:為了克服現有技術的缺點與不足,本發明的目的在于提供一種植物乳桿菌高產胞外多糖的方法。目前在乳酸菌產eps的研究領域中主要集中在eps的提取純化及其結構鑒定方面,本發明提供一種經過優化實驗后的植物乳桿菌高產胞外多糖的發酵條件,以及所提取的eps具有高效降膽固醇的功能,開拓了eps降低膽固醇的潛力。利用本發明中的植物乳桿菌高產胞外多糖的發酵條件后,eps具有很明顯的降膽固醇能力的提升。本發明的另一目的在于提供通過上述制備方法制備得到的植物乳桿菌胞外多糖。本發明的再一目的在于提供上述植物乳桿菌胞外多糖的應用。本發明的目的通過下述技術方案實現:一種植物乳桿菌高產胞外多糖的方法,包括如下步驟:(1)植物乳桿菌la-10(lactobacillusplantarum,以下簡稱la-10)在改良mrs液體培養基中靜置發酵,其接種量為3%~5%(v/v),得菌體發酵液;所述的靜置發酵的條件為25℃~31℃靜置發酵30h~40h;所述的改良mrs液體培養基:大豆蛋白胨10.0g/l、牛肉膏10.0g/l、酵母膏5.0g/l、蔗糖30~40g/l、k2hpo4為2.0g/l、乙酸鈉5.0g/l、檸檬酸三銨2.0g/l、mgso4·7h2o為0.58g/l、mnso4·4h2o為0.25g/l、吐溫-80為1.0ml/l,ph6.2~6.4,滅菌,備用;(2)將步驟(1)得到的菌體發酵液離心,取上清液;加入三氯乙酸(tca)除蛋白,4℃條件下靜置,離心取上清液;95%乙醇沉淀多糖,離心棄上清液,沉淀透析后得到粗多糖,測定提取量并凍干成粉末狀,即植物乳桿菌胞外多糖。步驟(1)中所述的接種量優選為4~5%;最優選為4%;步驟(1)中所述的靜置發酵的條件優選為30~31℃靜置發酵30~35h;最優選為30℃靜置發酵30h。步驟(1)中所述的改良mrs液體培養基優選為:大豆蛋白胨10.0g/l、牛肉膏10.0g/l、酵母膏5.0g/l、蔗糖30~34g/l、k2hpo4為2.0g/l、乙酸鈉5.0g/l、檸檬酸三銨2.0g/l、mgso4·7h2o為0.58g/l、mnso4·4h2o為0.25g/l、吐溫-80為1.0ml/l,ph6.2~6.4,滅菌,備用;最優選的,步驟(1)中所述的改良mrs液體培養基為:大豆蛋白胨10.0g/l、牛肉膏10.0g/l、酵母膏5.0g/l、蔗糖30g/l、k2hpo4為2.0g/l、乙酸鈉5.0g/l、檸檬酸三銨2.0g/l、mgso4·7h2o為0.58g/l、mnso4·4h2o為0.25g/l、吐溫-80為1.0ml/l,ph6.2~6.4,滅菌,備用;所述的滅菌優選為121℃滅菌30分鐘。步驟(2)中所述的離心的條件均優選為4℃、8000r/min離心15min。步驟(2)中所述的透析所用的透析袋的孔徑大小為3500da。步驟(2)中所述的測定提取量為2.67~3.18g/l。一種植物乳桿菌胞外多糖,通過上述制備方法制備得到。所述的植物乳桿菌胞外多糖在制備降脂藥物或保健品中的應用。將植物乳桿菌胞外多糖加入至1g/l的膽固醇標準液中,其中,植物乳桿菌胞外多糖的終濃度為0.8~1.6g/l,于恒溫條件下30~37℃振蕩吸附15~25h,實現膽固醇的高效吸附。優選的,所述的植物乳桿菌胞外多糖的終濃度為0.8g/l。優選的,所述的振蕩吸附的條件為于恒溫條件下30℃振蕩吸附15h。本發明所使用的菌株是廣東省微生態制劑工程技術研究中心篩選得到的具有一定降膽固醇能力的植物乳桿菌la-10(lactobacillusplantarum,以下簡稱la-10),目前保存于華南農業大學微生態制劑工程技術研究中心。菌株la-10在改良mrs液體培養基中靜置發酵,在接種量分別為2%、3%、4%、5%、6%時,接種量為4%的菌體發酵液經過提取純化并使用苯酚-硫酸法檢測的eps提取量最高(圖1)。菌株la-10分別在蔗糖含量為5g/l、10g/l、20g/l、30g/l、40g/l的改良mrs液體培養基中靜置發酵,當培養基中的蔗糖含量為30g/l時的菌體發酵液經過提取純化并使用苯酚-硫酸法檢測的eps提取量最高(圖2)。菌株la-10在改良mrs液體培養基中靜置發酵,其發酵溫度分別為20℃、25℃、30℃、37℃、42℃,當發酵溫度為30℃時,菌體發酵液經過提取純化并使用苯酚-硫酸法檢測的eps提取量最高(圖3)。菌株la-10在改良mrs液體培養基中分別靜置發酵15h、25h、30h、35h、40h,其中30h的菌體發酵液經過提取純化并使用苯酚-硫酸法檢測的eps提取量最高(圖4)。上述菌株胞外多糖發酵的改良mrs液體培養基組成為:大豆蛋白胨10.0g/l、牛肉膏10.0g/l、酵母膏5.0g/l、蔗糖30g/l、k2hpo42.0g/l、乙酸鈉5.0g/l、檸檬酸三銨2.0g/l、mgso4·7h2o0.58g/l、mnso4·4h2o0.25g/l、吐溫-801.0ml/l,ph6.2~6.4,121℃滅菌30分鐘后使用。上述植物乳桿菌eps提取方法:菌體發酵液經4℃、8000r/min離心15min,取上清液并棄去菌體沉淀;上清液加入三氯乙酸(tca)至終質量分數為4%,4℃條件下靜置過夜,以去除蛋白;4℃、8000r/min離心15min取上清液;上清液中加入3倍體積的95%乙醇,于4℃條件下靜置過夜,沉淀粗多糖;4℃、8000r/min離心15min,棄上清,將沉淀溶于滅菌的ddh2o中;經三級水透析(透析袋孔徑大小為3500da)16h,其間每8h換水一次,再用超純水透析8h,其間每4h換水一次,收集透析后的多糖溶液,吸取少量稀釋數倍,根據葡萄糖標準曲線并利用苯酚-硫酸法測定eps含量;加入3倍體積的95%乙醇沉淀剩余eps,凍干收集多糖粉末。葡萄糖標準曲線繪制:精密量取標準葡萄糖溶液(0.6mg/ml)1ml、2ml、4ml、6ml、10ml,分別置于50ml容量瓶中,加水定容,搖勻;精密量取上述各容量瓶中的溶液2ml,分別加入6%的苯酚溶液1ml,95%的硫酸溶液6ml,用取樣器混勻;40℃水浴30min,取出并冷卻至室溫;分光光度計測定吸光值od490;以葡萄糖濃度為橫坐標,吸光度為縱坐標,制作線性回歸方程,葡萄糖標準曲線見圖5。上述la-10的eps定量方法(苯酚-硫酸法):將待測溶液稀釋數倍后,并吸取2ml于50ml離心管中,量取3份;分別加入6%的苯酚溶液1ml,95%的硫酸溶液6ml,搖勻;40℃水浴30min,取出并冷卻至室溫;分光光度計測定吸光值od490;根據標準曲線計算多糖含量。除此之外,本發明中的la-10所產的eps具有高效降膽固醇的功能,經過體外優化實驗,可達到40%的膽固醇清除率,優化前和優化后的eps降膽固醇能力差異見圖6。上述優化前的原始mrs液體培養基:細菌學蛋白胨10.0g/l,牛肉膏10.0g/l,酵母粉5g/l,磷酸氫二鉀2.0g/l,檸檬酸氫二銨2.0g/l,葡萄糖20.0g/l,吐溫-801.0ml/l,乙酸鈉5.0g/l,硫酸鎂0.58g/l,硫酸錳0.25g/l、ph6.5。la-10分別以最適發酵條件在原始mrs液體培養基中發酵,其發酵液經過提取純化后得到的eps降膽固醇率為17.12%±2.9%,在改良mrs液體培養基中發酵,其發酵液經過提取純化后得到的eps降膽固醇率為40.60%±3.2%。la-10在本發明中的最適碳源含量、發酵時間、發酵溫度、接種量以及培養基組成的發酵條件下經過提取純化后的eps不僅產量得到了提高,其降膽固醇性能亦有所提高。分別準確稱取從la-10的發酵液中提取得到的胞外多糖粉末(0.1g/l、0.4g/l、0.8g/l、1.2g/l、1.6g/l)置于50ml離心管中,加入10ml膽固醇標準液(1mg/ml),以不加入胞外多糖為對照。于恒溫條件下37℃振蕩吸附12h,10000rpm離心6分鐘,取上清液,鄰苯二甲醛法測上清液膽固醇含量,其最佳eps質量濃度為0.8g/l,膽固醇吸附率高達43.79%±1.36%(圖7)。分別準確稱取相應適量的從la-10的發酵液中提取得到的胞外多糖粉末置于50ml離心管中,加入10ml膽固醇標準液,以不加入胞外多糖為對照。于恒溫條件下37℃振蕩吸附一定的時間(5h、10h、15h、20h、25h),10000rpm離心6分鐘,取上清液,鄰苯二甲醛法測上清液膽固醇含量,并利用上述公式計算出la-10胞外多糖的膽固醇吸附率,其最佳吸附時間為15h,膽固醇吸附率是43.85%±1.32%(圖8)。分別準確稱取相應適量的從la-10的發酵液中提取得到的胞外多糖粉末置于50ml離心管中,加入10ml膽固醇標準液,以不加入胞外多糖為對照。于恒溫條件下(15℃、25℃、30℃、37℃、42℃)振蕩吸附數小時,12000rpm離心2分鐘,取上清液,鄰苯二甲醛法測上清液膽固醇含量,并利用上述公式計算出la-10胞外多糖的膽固醇吸附率。最佳吸附溫度為30℃,其膽固醇清除率為33.78%±0.4%(圖9)。膽固醇標準曲線繪制,見圖10。表1標準曲線加樣體系配置混合體系時,濃硫酸緩慢加入,并用取樣器充分混勻,室溫靜置10min,分光光度計測od550。上述上清液中膽固醇定量方法(領苯二甲醛法):將待測溶液稀釋數倍后,并吸取400μl于15ml離心管中,量取3份;分別加入領苯二甲醛試劑2ml,95%的硫酸溶液1ml,用取樣器混合均勻;室溫靜置10min;分光光度計測定吸光值od550;根據標準曲線計算膽固醇含量,并根據公式計算出膽固醇清除率。除此之外,本發明中的植物乳桿菌la-10胞外多糖降膽固醇功能還體現在:根據上述高產胞外多糖的發酵方法,吸取能提取出10mg胞外多糖的菌體發酵液約3.4ml,熱水煮沸15分鐘以滅活菌體,離心取已滅活菌體于滅菌離心管中,另取3.4ml渾濁發酵液于滅菌離心管中并熱水煮沸15分鐘以滅活菌體,再取另一干凈離心管中加入10mgeps固體粉末,分別加入10ml含有1%膽固醇溶解液(10mg/ml)的改良mrs液體培養基,30℃靜置12h,進行降膽固醇能力比較,分別以不加菌體和加入3.4ml新鮮配置的改良mrs液體培養基為對照,根據標準曲線,計算出膽固醇含量,并參照上述公式分別計算出eps、滅活菌體與菌液的降膽固醇率。上述菌液中膽固醇含量測定方法:10000rpm,6min離心取上清樣液0.5ml,加入無水乙醇3.0ml;加入50%koh2.0ml,振蕩器混合均勻;60℃水浴15min;冷卻后加入正己烷5.0ml,混合均勻,加入一級水3.0ml,混合均勻,室溫靜置15min;待溶液分層,取正己烷層(最上層)溶液400μl沸水浴蒸干;加入領苯二甲醛溶液2.0ml,95%的硫酸溶液1.0ml,用取樣器混合均勻;室溫靜置10min,分光光度計測定吸光值(od550);根據標準曲線計算膽固醇含量,比較菌體、eps與菌液的降膽固醇能力。結果表明:eps降膽固醇率高達59%,熱滅活的菌體和發酵菌液降膽固醇率分別是6.45%、9.99%(圖11)。熱滅活的菌體和發酵菌液對培養基中的膽固醇都有一定的清除作用,發酵菌液相比滅活菌體吸附率較高,說明菌液中的化學物質或菌體分泌的代謝產物有降膽固醇能力,比如某些有機酸、膠狀胞外多糖等,植物乳桿菌eps分泌到胞外呈粘液狀或膠狀,其凍干粉末狀見圖12。本發明不僅提供了一種植物乳桿菌高產胞外多糖的發酵條件和提取純化方法,還通過實驗發現提取獲得的eps具有高效的膽固醇清除功能,為現代降脂藥物和保健品的開發提供新思路。本發明進一步研究了eps不同狀態的降膽固醇功能,為eps開拓不同的市場應用提供指導。本發明相對于現有技術,具有如下的優點及效果:本發明所使用的菌株具有高效產胞外多糖的特點,并且該菌株在本發明中的發酵條件下所產生的eps具有高效降膽固醇的功能,具體體現在:1)通過單因素優化實驗獲得菌株最佳產胞外多糖的發酵條件,其產量可高達2.67~3.18g/l;2)通過優化前與優化后的eps降膽固醇能力比較,eps降膽固醇能力得到了明顯提升;3)通過單因素體外定性實驗,其eps具有高效的膽固醇清除能力,最高可達59%;4)通過實驗發現分泌到胞外的未經過提取純化的eps依然具有一定的膽固醇清除能力。使用本發明中的發酵條件和制備方法可提高微生物eps產量,并且獲得的eps有高效降膽固醇能力,具有廣闊的降脂藥物和保健品的開發應用。附圖說明圖1是植物乳桿菌la-10高產eps最適接種量測定結果。圖2是植物乳桿菌la-10高產eps最適蔗糖含量測定結果。圖3是植物乳桿菌la-10高產eps最適發酵溫度測定結果。圖4是植物乳桿菌la-10高產eps最適發酵時間測定結果。圖5是葡萄糖標準曲線。圖6是發酵優化前和優化后的eps降膽固醇能力差異。圖7是eps降膽固醇最適質量濃度測定結果。圖8是eps降膽固醇最適吸附時間測定結果。圖9是eps降膽固醇最適吸附溫度測定結果。圖10是膽固醇標準曲線。圖11是菌液、滅活菌體及eps降膽固醇能力比較測定結果。圖12是植物乳桿菌la-10提取純化凍干后的eps固體粉末。具體實施方式下面結合實施例及附圖對本發明作進一步詳細的描述,但本發明的實施方式不限于此。實施例1植物乳桿菌la-10胞外多糖的發酵及提取純化植物乳桿菌la-10按4%體積分數的接種量接種于改良mrs液體培養基中,30℃的發酵溫度,靜置培養30小時,其中改良mrs液體培養基中的蔗糖含量為30g/l。表2各單因素的最高提取量單因素eps(g/l)接種量3.1756±0.02b蔗糖含量2.8255±0.03a發酵溫度2.9417±0.09a發酵時間2.6694±0.001a改良mrs液體培養基組成:大豆蛋白胨10.0g/l、牛肉膏10.0g/l、酵母膏5.0g/l、蔗糖30g/l、k2po4為2.0g/l、乙酸鈉5.0g/l、檸檬酸三銨2.0g/l、mgso4·7h2o為0.58g/l、mnso4·4h2o為0.25g/l、吐溫-80為1.0ml/l,ph6.2~6.4。eps提取方法為:(1)4℃、8000r/min離心15min,取上清液并棄去菌體沉淀。(2)上清液加入三氯乙酸(tca)至終質量分數為4%,4℃條件下靜置過夜,以去除蛋白。(3)4℃、8000r/min離心15min取上清液。(4)上清液中加入3倍體積的95%乙醇,于4℃條件下靜置過夜,沉淀粗多糖。(5)4℃、8000r/min離心15min,棄上清,將沉淀溶于滅菌的ddh2o中。(6)經三級水透析(透析袋孔徑大小為3500da)16h,其間每8h換水一次,再用超純水透析8h,其間每4h換水一次,收集透析后的多糖溶液,吸取少量稀釋數倍,苯酚-硫酸法測定eps含量為2.664g/l。(7)加入3倍體積的95%乙醇溶液,于4℃條件下靜置過夜,收集多糖并凍干。葡萄糖標準曲線繪制:精密量取標準葡萄糖溶液(0.6mg/ml)1ml、2ml、4ml、6ml、10ml,分別置于50ml容量瓶中,加水定容,搖勻;精密量取上述各容量瓶中的溶液2ml,分別加入6%的苯酚溶液1ml,95%的硫酸溶液6ml,用取樣器混勻;40℃水浴30min,取出并冷卻至室溫;分光光度計測定吸光值od490;以葡萄糖濃度為橫坐標,吸光度為縱坐標,制作線性回歸方程,葡萄糖標準曲線見圖5。苯酚-硫酸法:吸取上清液300μl,稀釋30倍后,并吸取2ml于50ml離心管中,量取3份;分別加入6%的苯酚溶液1ml,95%的硫酸溶液6ml,搖勻;40℃水浴30min,取出并冷卻至室溫;分光光度計測定吸光值od490;根據標準曲線計算多糖含量。實施例2植物乳桿菌la-10胞外多糖的降膽固醇定性方法收集接種量為4%、蔗糖含量為30g/l、發酵時間為30h、發酵溫度為30℃時,la-10在改良mrs液體培養基中經過靜置培養后提取純化并凍干的eps粉末。稱取eps固體粉末0.8g/l于15ml干凈離心管中,并加入10ml膽固醇標準液(1mg/ml),以不加入胞外多糖為對照。于恒溫條件下30℃振蕩吸附15h,10000rpm離心6分鐘,取上清液,鄰苯二甲醛法測上清液膽固醇含量,并利用上述公式計算出la-10胞外多糖的膽固醇吸附率為41.45%±1.3%。領苯二甲醛法:吸取500μl上清液,將待測溶液稀釋5倍后,并吸取400μl于15ml離心管中,量取3份;分別加入領苯二甲醛試劑2ml,95%的硫酸溶液1ml,用取樣器混合均勻;室溫靜置10min;分光光度計測定吸光值od550;根據膽固醇標準曲線計算膽固醇含量,并根據公式計算出膽固醇清除率。膽固醇標準曲線繪制,見表1和圖10。實施例3植物乳桿菌la-10液體靜置發酵產eps植物乳桿菌la-10按5%體積分數的接種量接種于改良mrs液體培養基中,31℃的發酵溫度,靜置培養35小時,其中改良mrs液體培養基中的蔗糖含量為34g/l。mrs液體培養基組成:大豆蛋白胨10.0g/l、牛肉膏10.0g/l、酵母膏5.0g/l、蔗糖34g/l、k2po4為2.0g/l、乙酸鈉5.0g/l、檸檬酸三銨2.0g/l、mgso4·7h2o為0.58g/l、mnso4·4h2o為0.25g/l、吐溫-80為1.0ml/l,ph6.2~6.4。eps提取方法為:(1)4℃、8000r/min離心15min,取上清液并棄去菌體沉淀。(2)上清液加入三氯乙酸(tca)至終質量分數為5%,4℃條件下靜置過夜,以去除蛋白。(3)4℃、8000r/min離心10min取上清液。(4)上清液中加入4倍體積的95%乙醇,于4℃條件下靜置過夜,沉淀粗多糖。(5)4℃、8000r/min離心10min,棄上清,將沉淀溶于滅菌的ddh2o中。(6)經三級水透析(透析袋孔徑大小為3500da)16h,其間每8h換水一次,再用超純水透析8h,其間每4h換水一次,收集透析后的多糖溶液,吸取少量稀釋數倍,苯酚-硫酸法測定eps含量為2.955±0.039g/l。(7)加入3倍體積的95%乙醇溶液,于4℃條件下靜置過夜,收集多糖并凍干。葡萄糖標準曲線繪制:精密量取標準葡萄糖溶液(0.6mg/ml)1ml、2ml、4ml、6ml、10ml,分別置于50ml容量瓶中,加水定容,搖勻;精密量取上述各容量瓶中的溶液2ml,分別加入6%的苯酚溶液1ml,95%的硫酸溶液6ml,用取樣器混勻;40℃水浴30min,取出并冷卻至室溫;分光光度計測定吸光值od490;以葡萄糖濃度為橫坐標,吸光度為縱坐標,制作線性回歸方程,葡萄糖標準曲線見圖5。苯酚-硫酸法:吸取上清液300μl,稀釋30倍后,并吸取2ml于50ml離心管中,量取3份;分別加入6%的苯酚溶液1ml,95%的硫酸溶液6ml,搖勻;40℃水浴30min,取出并冷卻至室溫;分光光度計測定吸光值od490;根據標準曲線計算多糖含量。上述實施例為本發明較佳的實施方式,但本發明的實施方式并不受上述實施例的限制,其他的任何未背離本發明的精神實質與原理下所作的改變、修飾、替代、組合、簡化,均應為等效的置換方式,都包含在本發明的保護范圍之內。當前第1頁12
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1