用于靶向連接蛋白半通道的組合物和方法與流程
本申請是要求2013年8月21日提交的美國臨時專利申請序列號61/868,112的優先權的國際申請,所述臨時申請整體以引用方式并入本文。
背景技術:
骨組織是乳腺癌和前列腺癌轉移的優選位點。骨轉移出現在高達75%的晚期癌患者中。目前,還無法治愈轉移性乳腺癌,也無用于治療骨轉移的副作用極低的可靠干預藥物。
骨關節炎(OA)是一種影響著大約20%的美國成年人的普遍性疾病。該疾病導致關節(包括關節軟骨和軟骨下骨)的退化。OA的病理特征在于關節軟骨的喪失,從而導致關節空間變窄、關節摩擦增加和可能的結構重塑。當前的治療包括鍛煉、生活方式改變和止痛劑。如果癥狀變嚴重,則通常施行關節置換術。迄今為止,尚無可用于治療OA的特定藥物干預措施。
連接蛋白半通道在細胞和組織功能中發揮著重要作用,并且已知連接蛋白半通道的功能異常會導致各種病理病癥。因此,仍需要用于治療與半通道活性相關的病理病癥(例如炎癥、骨關節炎或骨轉移)的另外療法以及用于確定此類療法的方法。
技術實現要素:
本發明人已發現:轉移靶標的細胞中打開的半通道對癌生長、遷移和轉移具有抑制作用。某些實施方案提供用來鑒定調節半通道的打開以治療癌轉移的化合物的工具和/或方法。在某些方面,可將藥物用于抑制或緩解癌癥向骨、腦或肝的轉移。在某些方面,半通道可在骨、腦或肝細胞中表達。在又一個方面,半通道可以是骨細胞半通道、肝細胞半通道或星形膠質細胞半通道。在某些方面,半通道可以是連接蛋白Cx43、Cx32、Cx46、Cx37、Cx40、Cx50、Cx59、Cx62、Cx26、Cx31、Cx30.3、Cx31.1、Cx30、Cx25、Cx45、Cx47、Cx30.2、Cx36、Cx31.9、Cx39、Cx40.1、Cx23或Cx29半通道。在某一方面,半通道是Cx43或Cx 32半通道。例如,骨細胞中連接蛋白43(Cx43)半通道的打開對向骨骼的轉移具有抑制作用,并可抑制骨轉移。
半通道打開可通過使用比如熒光黃(Lucifer yellow)、溴化乙錠、Alexa 350、Alexa 485、Alexa 594染料等熒光染料進行的染料攝取測定法進行檢測。半通道打開的特異性可通過使用抑制半通道打開并因此抑制靶向試劑活性的連接蛋白特異性抗體進行驗證。因此,所述工具和/或方法可用于篩選、測試和鑒定打開半通道并抑制轉移的試劑。
某些實施方案涉及鑒定打開半通道的化合物的方法。其它實施方案涉及正調節半通道的打開以抑制或緩解骨轉移的方法。
本發明提供抗半通道的抗體,編碼此類抗體和治療性蛋白的核酸,制備抗半通道單克隆抗體和其它治療性蛋白的方法,以及用于治療諸如轉移癌的疾病的方法。在某些方面,該抗體結合具有FLSRPTEKTI(SEQ ID NO:13)、KRDPCPHQVD(SEQ ID NO:14)或LSAVYTCKR(SEQ ID NO:15)的氨基酸序列的表位。在一個特定的方面,抗體結合具有FLSRPTEKTI(SEQ ID NO:13)的氨基酸序列的表位。
在一個實施方案中,本發明提供特異性結合到半通道的分離抗體,該抗體包含具有SEQ ID NO:2的氨基酸序列的重鏈和具有SEQ ID NO:4的氨基酸序列的輕鏈。
在某些方面,第一重鏈區包含具有SEQ ID NO:2的殘基13至37的氨基酸序列的氨基酸序列;第二重鏈區具有對應于SEQ ID NO:2的殘基46至66的氨基酸序列;并且第三重鏈區包含具有SEQ ID NO:2的殘基97至116的氨基酸序列的氨基酸序列。
在另一方面,第一輕鏈區包含具有SEQ ID NO:4的殘基9至40的氨基酸序列的氨基酸序列;第二輕鏈區具有對應于SEQ ID NO:4的殘基49至58的氨基酸序列;并且第三輕鏈區包含具有SEQ ID NO:4的殘基64至108的氨基酸序列的氨基酸序列。
在一個實施方案中,本發明提供特異性結合到半通道和間隙連接部的分離抗體,該抗體包含具有SEQ ID NO:6的氨基酸序列的重鏈和具有SEQ ID NO:8的氨基酸序列的輕鏈。
在某些方面,第一重鏈區包含具有SEQ ID NO:6的殘基13至37的氨基酸序列的氨基酸序列;第二重鏈區具有對應于SEQ ID NO:6的殘基46至66的氨基酸序列;并且第三重鏈區包含具有SEQ ID NO:6的殘基97至116的氨基酸序列的氨基酸序列。
在另一方面,第一輕鏈區包含具有SEQ ID NO:8的殘基9至42的氨基酸序列的氨基酸序列;第二輕鏈區具有對應于SEQ ID NO:8的殘基51至60的氨基酸序列;并且第三輕鏈區包含具有SEQ ID NO:8的殘基66至125的氨基酸序列的氨基酸序列。
在一個實施方案中,本發明提供特異性結合到間隙連接部的分離抗體,該抗體包含具有SEQ ID NO:10的氨基酸序列的重鏈和具有SEQ ID NO:12的氨基酸序列的輕鏈。
在某些方面,第一重鏈區包含具有SEQ ID NO:10的殘基10至34的氨基酸序列的氨基酸序列;第二重鏈區具有對應于SEQ ID NO:10的殘基43至59的氨基酸序列;并且第三重鏈區包含具有SEQ ID NO:10的殘基94至109的氨基酸序列的氨基酸序列。
在另一方面,第一輕鏈區包含具有SEQ ID NO:12的殘基9至40的氨基酸序列的氨基酸序列;第二輕鏈區具有對應于SEQ ID NO:12的殘基49至58的氨基酸序列;并且第三輕鏈區包含具有SEQ ID NO:12的殘基64至108的氨基酸序列的氨基酸序列。
在某些方面,抗體包括全長抗體、抗體片段、單鏈抗體、雙特異性抗體、微抗體、域抗體、合成抗體和抗體融合體及其片段。
又一個實施方案提供包含如本文所述的抗體與藥學上可接受的載體的藥物組合物。還提供了用作治療劑以用于治療癌癥和抑制癌轉移的本發明的抗體或藥物組合物。
又一個實施方案提供治療或預防癌轉移的方法。治療方法可包括向對其有需要的受試者施用有效量的本文所述的分離抗體。還提供了如本文所述的抗體在制造用于治療或預防癌轉移的藥劑中的用途。
某些方面涉及使用抗體、化合物或試劑抑制軟骨細胞中的炎癥反應的體外方法。在某些方面,方法涉及通過以下方面來確定對軟骨細胞中Cx43半通道打開的抑制的作用:(i)使用熒光黃或Alexa染料通過染料攝取測定法測定半通道打開,(ii)評估IL-1β對半通道打開的抑制作用,(iii)通過流體流動剪切應力形式的機械負荷測試試劑對半通道打開的抑制作用。
某些方面涉及通過以下方面來確定抗體、化合物或試劑對抑制IL-1β和機械負荷所誘發的炎性反應的作用的方法:(i)測定對IL-1β誘導的核因子-кB(NF-кB)活化的抑制,(ii)測定對體流動剪切應力誘導的NF-кB活化的抑制。
其它方面涉及使用單克隆抗體、化合物或試劑治療OA或確定OA的體內方法,該方法包括:(i)將抗體、化合物或試劑注射進入膝蓋骨腔中,(ii)評估對IL-1β誘導的NF-кB活化的抑制,(iii)通過X射線、組織學分析和身體運動評估OA發展。
如本文所用,術語“抗原”是能夠被抗體或T細胞受體結合的分子。在某些實施方案中,對抗體之外的結合部分進行工程改造以特異性結合到抗原,例如適配子、高親合性多聚體(avimer)等。
術語“抗體”或“免疫球蛋白”用于包括完整的抗體及其結合片段/區段。通常,片段與得到所述片段的完整抗體競爭與抗原的特異性結合。片段包括單獨的重鏈、輕鏈、Fab、Fab'、F(ab')2、Fabc和Fv。片段/區段通過重組DNA技術或通過酶促方式或化學方式分離完整的免疫球蛋白而產生。術語“抗體”還包括與其它蛋白化學綴合或表達為融合蛋白的一條或多條免疫球蛋白鏈。術語“抗體”還包括雙特異性抗體。雙特異性或雙功能抗體是具有兩個不同的重/輕鏈對和兩個不同的結合位點的人工雜交抗體。雙特異性抗體可通過多種方法產生,包括融合雜交瘤或連接Fab'片段。參見例如Songsivilai和Lachmann,Clin Exp Immunol 79:315-21,1990;Kostelny等,J.Immunol.148:1547–53,1992。
術語“分離的”可以指基本不含其來源中的細胞物質、細菌物質、病毒物質或培養基(當通過重組DNA技術產生時)或者化學前體或其它化學品(當化學合成時)的核酸或多肽。另外,分離的化合物是指可作為分離的化合物施用給受試者的化合物;換言之,如果該化合物吸附到柱上或包埋在瓊脂糖凝膠中則不會被簡單地認為是“分離的”。另外,“分離的核酸片段”或“分離的肽”是不天然作為片段形式存在的和/或通常不處于功能狀態的核酸或蛋白片段。
本發明的部分(諸如多肽、肽、抗原或免疫原)可以綴合或者共價或非共價連接至其它部分(諸如佐劑、蛋白、肽、支持物、熒光部分或標記)。廣義地使用術語“綴合”或“免疫綴合”定義一個部分與另一試劑的可操作連接,無意單獨指任何類型的可操作連接,尤其不限于化學“綴合”。
術語“提供”使用其普通含義,指“提供或配備來使用”。在一些實施方案中,通過施用蛋白來直接提供所述蛋白,而在其它實施方案中,通過施用編碼蛋白的核酸來有效地提供所述蛋白。在某些方面,本發明設想的組合物包括核酸、抗原、肽和/或表位的各種組合。
短語與靶標“特異性結合”或“具有特異性免疫反應性”是指在存在其它生物分子的異質群體的情況下決定分子的存在性的結合反應。因此,在指定的免疫測定條件下,指定的分子優先結合到特定的靶標,而不會大量結合到樣品中存在的其它生物分子。抗體與靶標在此類條件下的特異性結合需要針對與靶標的特異性來選擇抗體。多種免疫測定法可用于選擇與特定的蛋白具有特異性免疫反應性的抗體。例如,通常使用固相ELISA免疫測定法來選擇與蛋白具有特異性免疫反應性的單克隆抗體。有關可用于測定特定免疫反應性的免疫測定法和條件的描述,參見例如Harlow和Lane,Antibodies:A Laboratory Manual,Cold Spring Harbor Press,1988。
在本申請中討論了本發明的其它實施方案。相對于本發明的一個方面討論的任何實施方案適用于本發明的其它方面,反之亦然。本文所述的每個實施方案應被理解為適用于本發明所有方面的本發明的實施方案。據設想,本文所討論的任何實施方案可相對于本發明的任何方法或組合物進行實施,反之亦然。此外,本發明的組合物和試劑盒可用于實現本發明的方法。
詞語“一個”與術語“包括”在權利要求書和/或說明書中結合使用時可意指“一個”,但是也與“一個或多個”、“至少一個”和“一個或多于一個”的含義一致。
在本申請中,術語“約”用于表示數值包括測定該數值所用裝置或方法的誤差的標準差。
除非明確地僅指出某些可選方式或可選方式之間互相排斥,否則權利要求中使用術語“或”意指“和/或”,但本公開也支持僅指某些可選方式和“和/或”的定義。
如本說明書和權利要求書中所用,詞語“包含”(以及任何形式的包含)、“具有”(以及任何形式的具有)、“包括”(以及任何形式的包括)或“含有”(以及任何形式的含有)是包含性質的或者開放式的,且不排除另外的未陳述的要素或方法步驟。
通過以下詳細描述,本發明的其它目標、特征和優點將變得顯而易見。然而,應當理解的是,該詳細描述和具體實例雖然指明了本發明的特定實施方案,但是僅以舉例說明的方式給出,因為通過該詳細描述,在本發明的精神和范圍內的各種變化和修改對本領域的技術人員而言將變得顯而易見。
附圖說明
以下附圖構成本說明書的一部分,并包括在內以進一步闡明本發明的某些方面。通過結合這里所展示的說明書實施方案的詳細描述來參考這些附圖中的一個或多個可以更好地理解本發明。
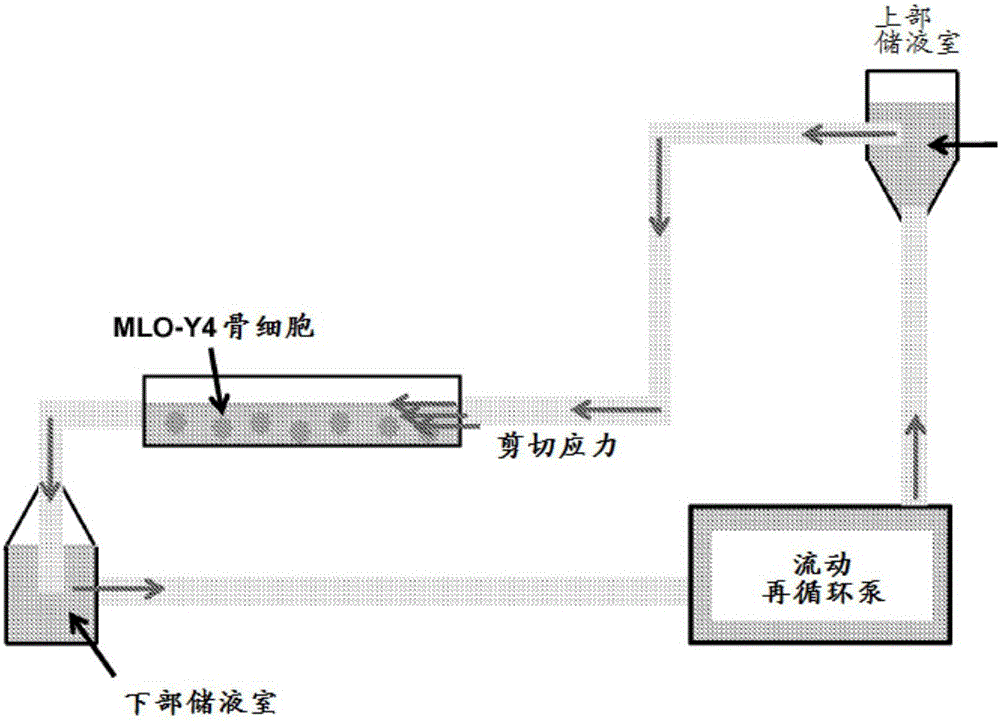
圖1示出了流體流動回路設備的一個實施方案。
圖2示出了在不存在或存在1μg/ml Cx43(E2)抗體的情況下用20μM AD處理MLO-Y4骨細胞30分鐘的結果。進行了溴化乙錠染料攝取試驗,并與未處理的基礎攝取水平相比進行了定量。在鈣條件下進行了研究。將低鈣條件用作對照(打開半通道)。還示出了用AD或AD和Cx43(E2)抗體處理MLO-A5成骨細胞的結果。
圖3示出了模型系統,其用于研究骨細胞Cx43半通道在調節AD對癌細胞遷移的作用中的角色。骨細胞中的Cx43半通道通過AD或FFSS打開。AD處理或FFSS處理的CM中釋放的因子減少癌細胞遷移。用對照CM處理的癌細胞表現出正常的遷移。
圖4A和4B示出了使用軟瓊脂糖非貼壁依賴性生長測定法進行的研究,該測定法不同于貼壁依賴性生長。只有癌細胞才能在軟瓊脂上生長,并且其在這種基質上的生長表明癌細胞增殖的程度。來自骨細胞的CM-AD減少MDA-MB-231集落形成。
圖5A和5B示出了使用傷口愈合遷移測定法進行的研究的結果。來自骨細胞的CM-AD抑制了MDA-MB-231細胞遷移。
圖6示出了另一傷口愈合遷移測定的結果。AD對MDA-MB-231細胞的遷移無直接作用。
圖7A和7B示出了得自transwell遷移測定的結果。(B)點表示遷移到插件的相對端并且已被染色的細胞。較小的點是所述細胞遷移通過的孔。在該測定中,將蛋白A用于從CM移除E2Ab,并且這導致遷移效應與添加E2Ab之前相同。
圖8示出了得自另一transwell遷移測定的結果。MDA-MB-231遷移不受來自MLO-A5成骨細胞的CM-AD的影響。
圖9示出了得自另一transwell遷移測定的結果。MDA-MB-231遷移通過來自機械負荷所刺激的骨細胞的CM而減少。
圖10A和10B示出了得自注射到Cx43條件性敲除(cKO)小鼠的Py8119乳腺癌細胞的結果。Py8199腫瘤生長和轉移在Cx43cKO小鼠中增加。(B)腫瘤擴散到Cx43cKO小鼠中的其它組織。
圖11示出了得自注射到Cx43cKO小鼠中的Py8119的結果。Py8119腫瘤生長在Cx43cKO小鼠中增加。
圖12示出了通過三種mAb對Cx43進行免疫標記。將骨細胞MLO-Y4細胞在-20℃下用70%乙醇固定20分鐘,阻斷過夜,用mAb在室溫在上文所示的濃度下溫育3h。將山羊抗小鼠FITC二抗用于評估三種mAb的活性。作為細胞標記物的WGA以紅色進行標記。
圖13顯示了通過在pH 7.4下經過Cx43 E2柱而親和純化的雜交瘤上清液。對每種單克隆抗體以1:100稀釋進行了western印跡。多克隆Cx43Ab稀釋度為1:300。
圖14顯示了M1阻斷半通道,但不阻斷間隙連接部;M2阻斷間隙連接部,但不阻斷半通道;而M3則阻斷兩者。(A)將MLO-Y4細胞用含有低Ca2+和Mg2+的培養基溫育,這種條件誘導Cx43半通道的打開。在存在EtBr具有或不具有mAb的情況下進行了20分鐘的染料攝取測定。(B)將用Cx43轉染的HeLa細胞用mAb溫育3h,將信號細胞與AlexaFluor 488一起顯微注射以評價針對間隙連接部測定的染料轉移程度。
圖15示出了降落染料轉移(parachuting dye transfer)測定,顯示了M2和M7但非M1阻斷間隙連接通道。將用Cx43轉染的Hela細胞用于降落染料轉移實驗。將供體細胞用5μM可滲透到間隙連接部的鈣黃綠素紅-橙-AM(790Da)和5μM不可滲透到間隙連接部的俄勒岡綠488BAPTA-2-AM(1752Da)在37℃溫育40分鐘。將供體細胞用胰蛋白酶處理,并將分離的預加載細胞在未標記的受體細胞頂部以1:4的供體與受體比率分層(“降落”)。使細胞貼壁90分鐘。在熒光顯微鏡下檢查細胞。
圖16.顯示了通過M1和M7但非M2阻斷了機械負荷所誘導的半通道打開。將MLO-Y4細胞用或不用mAb預處理20分鐘。使細胞接受8達因/cm2的流體流動剪切應力10分鐘,并用100μM EtBr進行5分鐘的染料攝取。對細胞進行漂洗、固定,并在熒光顯微鏡下獲取圖像。
圖17.顯示了在小鼠體內骨細胞中M1阻斷了機械負荷所誘導的半通道打開。將小鼠IgG或Cx43(M1)mAb(25mg/kg)并在2小時后將伊文思藍(Evans blue)染料注射到WT和Cx43cKO小鼠中。染料注射后30分鐘,對左(L)脛骨施加一次10分鐘的機械負荷。對小鼠實施安樂死,并灌注50ml PBS。分離脛骨,固定,制作骨組織切片。條,40mm。箭頭指示染料攝取。
圖18.顯示了Cx43在軟骨細胞表面上的表達。(A)Cx43在原代軟骨細胞表面上的表達。(B)流體流動剪切(16達因/cm2)(FSS)打開了半通道,而這種打開被Cx43特異性抗體明顯阻斷。FSS與所有其它條件相比,***,P<0.001。
具體實施方式
各種細胞能夠通過由連接蛋白形成的半通道和間隙連接部與彼此以及與胞外環境通訊。連接蛋白在整個體內遍在表達。六個連接蛋白構成一個半通道,而2個半通道構成1個間隙連接通道。間隙連接部是一簇通道,它們位于相鄰細胞之間的質膜中并介導細胞間通訊。半通道是來自間隙連接通道的單獨實體。半通道允許分子在細胞內隔室與細胞外環境之間交換。
骨細胞表達稱為連接蛋白(Cx)43半通道的半通道。這些骨細胞半通道通常是關閉的,并可在暴露于機械刺激時打開,這導致各種因子釋放到骨微環境中。半通道打開所釋放的因子可介導其它過程,這些過程可減少腫瘤細胞遷移和骨轉移。
某些實施方案涉及鑒定調節連接蛋白的打開的試劑的方法。在某些方面,該方法鑒定正調節連接蛋白半通道的打開的化合物或藥物。其它實施方案涉及通過向患有癌癥的患者施用打開半通道的化合物而治療癌癥的方法。在某些方面,患者具有原發性腫瘤。在某些方面,打開Cx43半通道的化合物可用于抑制或減少向骨骼的轉移。
當癌癥從其起源的身體部分(例如,乳腺或前列腺)擴散到其它身體部分(例如,肝或骨)時即發生癌轉移,并確立繼發性腫瘤。骨骼是癌轉移最常見的部位之一。轉移到骨骼的癌癥包括但不限于乳腺癌、前列腺癌、肺癌和皮膚癌(例如,黑素瘤)。在高達75%的晚期乳腺癌和前列腺癌患者中可以確定骨轉移。骨轉移(mets)與許多嚴重的臨床和生活質量后果相關,諸如但不限于難治性疼痛、病理性骨折、脊髓和神經壓迫、骨髓浸潤和運動性受損。在許多情況下,癌癥的全身性存在也可使癌癥無法治愈。
正常的骨骼由三大細胞類型構成:形成骨骼的成骨細胞,再吸收骨骼的破骨細胞,和骨細胞。骨細胞占骨骼細胞的大約95%,并通過協調溶骨和成骨活動而維持骨重建過程。當癌細胞侵襲骨骼時,許多正常的骨骼功能受到影響。癌細胞與局部微環境相互作用,以經由骨骼破壞和血管形成而促進癌細胞存活。
已證實,骨細胞中的Cx43半通道通過用阿侖膦酸鹽(AD)處理而打開,阿侖膦酸鹽是一種有效且常用的雙膦酸鹽藥物。雙膦酸鹽是一類已知用于治療許多骨病(包括骨轉移)的藥物。Powles等已顯示施用雙膦酸鹽與乳腺癌患者中的骨轉移發生率降低和死亡率降低相關。AD已與減少的腫瘤生長以及降低的骨破壞和疼痛相關。AD抑制破骨細胞活性并誘導骨細胞中Cx43半通道的打開(Plotkin等,2002)。然而,AD施用伴隨著多種嚴重的副作用。
I.與作為骨轉移抑制劑的候選藥物篩選相關的方法
A.體外測定
某些實施方案涉及使用染料攝取測定法在體外檢測半通道的打開。在某些方面,染料是熒光示蹤劑染料(例如,溴化乙錠或熒光黃)。
在檢測半通道打開的體外測定法的一個實例中,可以使用流體流動回路設備(FFLA)(平行板流動小室)或其改進形式。FFLA設備的一個實例在圖1中示意性示出。FFLA模擬骨骼中的動態流體微環境以產生流體流動剪切應力(FFSS)。將細胞在平行板流動小室中培養,從而將細胞暴露于穩態層流流體流動。
骨細胞感測骨細胞骨陷窩/骨小管網絡中FFSS所產生的機械應變。已有人提出,骨骼流體流動受血管外壓力以及骨細胞施加的循環機械負荷驅動,并且峰值生理負荷為8至30達因/cm2。在某些方面,FFSS水平在之前測量骨骼內的流體流動的研究所報道的生理值范圍內。流體剪切應力幅度可通過調整流動回路的柱高而改變。
用于評估半通道功能的測定可使用足夠小以穿過半通道的孔的熒光示蹤劑分子。如果半通道關閉,則分子無法通過。如果半通道打開,則染料可從中通過并導致細胞產生熒光,從而允許對熒光進行定量。當溴化乙錠連接到DNA時,其變得發出熒光。熒光黃在位于細胞內后產生熒光。
染料轉移方法可包括將細胞暴露于胞外熒光滲透性示蹤劑。胞外滲透性示蹤劑是保持在細胞外部的分子,除非一些條件增加了細胞膜的滲透性才會進入分子內部。在某些方面,示蹤劑的質量低于1、2或3kDa。在其它方面,示蹤劑將具有凈電荷。此類滲透性示蹤劑包括但不限于陰離子染料熒光黃(LY;凈電荷=-1)和陽離子探針溴化乙錠(Etd;凈電荷=+1)、碘化丙啶(PI;凈電荷=+2)。EtBr的熒光在結合到DNA時增強,從而增加對比對并使得可以更容易地進行鑒定。在某些方面,在不同的時期或在施加刺激以打開半通道后移除胞外染料,并對每個細胞保持的熒光強度定量。在某些方面,在快照圖片中對熒光強度定量。
圖2示出了得自體外染料轉移測定的一個實例的結果。將MLO-Y4骨細胞在不存在或存在1μg/ml Cx43(E2)抗體的情況下用20μM AD處理30分鐘。進行了溴化乙錠染料攝取測定,并與未處理的基礎攝取水平相比進行了定量。測定在存在鈣的情況下進行。將低鈣條件用作對照(打開半通道)。此外,將MLO-A5成骨細胞用AD處理或將AD+Cx43(E2)抗體用作陰性對照–AD不打開成骨細胞中的Cx43半通道,并且由AD誘導的骨細胞半通道的打開被Cx43(E2)抗體阻斷。
在體外測定的某些方面用于鑒定半通道的正調節物的材料包括:
半通道表達細胞或細胞系。可使用本領域已知的方法和/或表達載體獲得、分離或工程改造表達各種連接蛋白半通道的細胞或細胞系。
骨細胞:從動物(包括小鼠、大鼠、兔、雞)分離的原代骨細胞等或骨細胞系,包括但不限于MLO-Y4細胞及其它細胞。
癌細胞:乳腺癌細胞系,包括ER、PR、HER和TP53陽性/陰性細胞(例如MD-MBA-231、MCF7、T47D或ZR751)。MDA-MB-231是乳腺導管癌。從C57Bl/6MMTV-PyMT雌性(小鼠乳腺腫瘤病毒啟動子驅動的多瘤居中T轉基因)小鼠中產生的自發性乳腺腫瘤建立了Py8119乳腺腫瘤細胞系。癌基因(多瘤居中T轉基因)的表達受小鼠乳腺腫瘤病毒啟動子的驅動。
前列腺癌細胞系:包括雄性激素受體和5α-還原酶陽性/陰性和雄性激素敏感/非敏感細胞系(例如,LNCaP-Rf、BM18、pRNA-1-1/ras、RC58T/hTERT、PPC-1等)。
成骨細胞:將MLO-A5成骨細胞用作對照,因為它們表達連接蛋白43,但它們似乎在由阿侖膦酸鹽刺激時不打開。
待測試的“試劑”包括化合物、肽、蛋白、反義寡聚物和/或微RNA。
示蹤劑分子包括但不限于熒光黃、溴化乙錠、伊文思藍、Alexa350、Alexa488和Alexa594。
Cx43(E2):Cx43(E2)抗體為Cx43半通道特異性的。Cx43E2結合Cx43半通道的第2個胞外環,并防止半通道打開。
確定試劑是否打開半通道的方法包括以下步驟中的一個或多個:
(a)分離、獲得或產生連接蛋白表達細胞或細胞系。例如,從顱骨分離原代骨細胞。可使用本領域已知的其它方法分離其它細胞類型。在某些方面,從動物(例如,16天胚胎雞顱骨或新生小鼠)分離顱骨骨細胞。將動物斷頭處死,解剖顱骨,快速浸入70%酒精中。然后將顱骨放入αMEM中,用PBS洗滌多次。將清洗后的骨骼置入新鮮的αMEM中。將骨骼剁碎,切成1.5mm大小的片。可將骨片用膠原酶處理以移除軟組織和類骨質,然后使用EDTA脫鈣。最后,通過用膠原酶處理并用力攪拌而將骨細胞從骨碎片中釋放出來。
(b)從長骨分離原代骨細胞。可從2-3周大的小鼠或大鼠分離長骨骨細胞。例如,向小鼠給予超劑量的麻醉,使頸椎脫位,斷頭處死,并浸入70%乙醇中。分離關節末端仍然完整的股骨和脛骨。將腿快速浸入70%酒精中然后置入αMEM中。將αMEM中的腿用PBS洗滌。移除大部分肌肉,并與肌腱/韌帶脫離。將清洗后的骨骼置入新鮮的αMEM中。清洗所有骨骼后,將每塊骨骼的兩端用手術刀切掉,然后立即使用PBS沖洗出骨髓。將骨骼切成1.5至2mm長,并用膠原酶處理。在一個實例中,將骨片用膠原酶相繼處理9次,以移除所有組織和類骨質,然后使用EDTA脫鈣。
(c)培養細胞或細胞系。例如,將原代和/或骨細胞系在膠原包被的板上培養,然后浸入含有滲透性示蹤劑的記錄培養基(不含HCO3的HEPES緩沖α-MEM培養基)浴中。
(d)施用測試試劑。將培養的細胞置于與測試試劑接觸所需的時長。
(e)測定滲透性示蹤劑攝取。通過檢測細胞內的示蹤劑的量測定滲透性示蹤劑攝取。在某些方面,使用延時記錄。可在不同的細胞中在所關注的區域記錄熒光,其中顯微鏡上的eclipse濾光片基于所用的示蹤劑或其它探針的熒光波長。在某些方面,通過快速冷卻的數碼相機每2分鐘獲取一次圖像,并通過ImageJ軟件進行圖像處理。收集到的數據可示為初始熒光和所關注時間的熒光與基礎熒光相比的倍數差異。
對于快照圖片,可將細胞暴露于滲透性示蹤劑5-10分鐘,用PBS漂洗多次,然后用甲醛固定。在某些方面,用顯微鏡獲取熒光場的至少三個顯微相片。通過ImageJ軟件進行圖像分析。測量隨機細胞的像素密度的平均值。
在某些方面,確認連接蛋白半通道的打開。可例如通過將骨細胞與Cx43(E2)抗體(特異性抑制Cx43半通道的多克隆抗體)與測試試劑一起溫育而進行確認。如果試劑打開Cx43半通道,則該通道打開將被Cx43(E2)抗體阻斷。為了控制Cx43半通道的打開,將骨細胞用流體流動剪切應力和/或AD處理,兩者已知均可打開骨細胞中的半通道。
在一個特定的實例中,將MLO-Y4骨細胞在不存在或存在1μg/ml Cx43(E2)抗體的情況下用20μM AD處理30分鐘。進行了溴化乙錠染料攝取試驗,并與未處理的基礎攝取水平相比進行了定量。測定在存在鈣的情況下進行。低鈣條件可用作對照(打開半通道)。AD誘導的骨細胞半通道的打開被Cx43(E2)抗體阻斷。
骨細胞Cx43半通道的打開介導對癌細胞遷移的負面效應。骨細胞中的Cx43半通道通過施用AD或FFSS而打開。打開的半通道使得各種因子可以釋放到產生條件培養基(CM)的培養基中。AD或FFSS處理的CM中釋放的因子減少癌細胞遷移,如通過軟瓊脂和傷口愈合測定法所確定。軟瓊脂測定法的實例在圖3中示意性地示出。如圖4中所示,用對照CM處理的癌細胞表現出正常的遷移。軟瓊脂測定法是非貼壁依賴性生長測定法,與貼壁依賴性生長相對。只有癌細胞才能在軟瓊脂上生長,并且其在這種基質上的生長表明癌細胞增殖的程度。
在某些方面,所述方法包括將原代骨細胞或骨細胞系用測試試劑在α-MEM中溫育各種時間段,并在各個時間點收集上清液(條件培養基)。在某些方面,將乳腺癌或前列腺癌細胞用CM溫育,并測定癌細胞增殖、遷移和侵襲。
可使用WST-1(水溶性四唑鎓鹽)測定法、使用臺盼藍的活細胞計數法、BrdU DNA結合和細胞增殖測定法測定癌細胞生長和活力。對于WST-1測定法,通過Synergy HT多模式酶標儀(Biotek)以450nm的發射波長測量細胞增殖。
細胞遷移測定通常在24孔組織培養板(BD Biosciences)中的transwell膜過濾器插件中進行。transwell膜過濾器插件可以為例如6.5-mm直徑、8-μm孔徑和10-nm厚的聚碳酸酯膜。
侵襲測定在BD Biocoat低生長因子基質膠侵襲小室(BD Biosciences)中進行。收獲癌細胞系并與或不與測試試劑一起重懸在得自骨細胞的CM中。將癌細胞懸液添加到插件的上側。將細胞在37℃溫育各種時間段。移除未穿過過濾器遷移的細胞,并將穿過插件遷移的細胞固定且用Hema 3Stat Pack(Fisher Scientific)染色。在光學顯微鏡下對每個插件5個視野中的遷移細胞數計數。
在某些方面,當在得自用AD或FFSS處理以刺激Cx43半通道打開的骨細胞的CM中溫育時,乳腺癌遷移減少。當骨細胞Cx43半通道被E2抗體阻斷時,對癌細胞遷移的這種抑制作用減弱。當用從成骨細胞收集的CM溫育時或直接用AD處理時,未見癌細胞遷移的這種降低。Cx43半通道的打開防止乳腺癌細胞生長和遷移。
B.體內測定
其它實施方案涉及體內檢測連接蛋白半通道的打開。用來發現可用于治療癌癥向骨骼轉移的試劑的體內測定法的一個實例包括確定候選試劑對骨細胞中Cx43半通道的作用以及對體內癌向骨轉移的作用。在某些方面,通過以下方式測定骨細胞中的Cx43調節:將候選試劑注射到長骨中并使用熒光示蹤劑染料(例如,鈣黃綠素或伊文思藍)原位檢測骨細胞中半通道的打開。
體內測定化合物對骨組織的骨細胞中半通道打開的作用。分析骨細胞中的半通道的體內測定法的一個實例使用3-4個月大的小鼠或大鼠。對動物稱重。將測試試劑通過腹膜內(IP)注射而引入動物體內。2-4小時后,將熒光示蹤劑染料(即,伊文思藍、Alexa 594)注射到動物的側尾靜脈中或進行腹膜內注射。注意:可注射動物體重的最多1%(體積)。在某些方面,在尾靜脈注射之前給動物保暖以擴張尾靜脈。2-4小時后,將動物處死,解剖不含肌肉組織的脛骨和股骨,用PBS洗滌數次。將骨骼固定在多聚甲醛中,在14%EDTA溶液中在4℃脫鈣兩周或在室溫在恒定攪拌下脫鈣3-5天。將骨骼在PBS中洗滌,浸泡在30%的蔗糖的PBS溶液中過夜,然后包埋在OCT化合物中。通常根據需要調整骨骼在模具中的位置。使用低溫恒溫器切割五微米厚的冷凍切片,將切片在PBS中漂洗,然后使用50%的甘油的PBS溶液固定。在熒光顯微鏡下檢查骨切片,并使用Image J對骨中骨細胞攝取示蹤劑染料的程度定量。
骨細胞中Cx43半通道的打開可通過對脛骨施加機械負荷以打開骨細胞中的Cx43半通道而確認。這可用作體內骨細胞中半通道打開的陽性對照。對于陰性對照,使用骨細胞中Cx43存在缺陷的小鼠。這種小鼠通過將10-kb DMP-1 Cre與Cx43 flox小鼠雜交而產生。
使用脛骨內注射骨轉移模型和/或心內注射癌轉移測定法測定測試試劑對體內對骨轉移的作用。
脛骨內注射骨轉移模型。該方法包括將1個月大的正常或免疫低下小鼠用異氟烷麻醉。向小鼠給予鹽酸丁丙諾啡(0.3mg/ml)作為止痛劑。使用表達熒光或化學發光標記物的癌細胞進行脛骨內注射(例如,對于正常小鼠為表達Luc-GFP的Py8119細胞,或對于免疫低下小鼠為表達Luc-GFP的MD-MBA-231)。通過由配有30號針的Hamilton注射器預先產生的孔,將癌細胞接種到右脛骨的骨髓區中。將PBS注入左脛骨作為對照。將測試試劑或鹽水經腹膜內施用,每周兩次,持續5周。從腫瘤細胞接種后3天開始,每周通過生物發光成像或熒光來監測脛骨內腫瘤生長。在足夠的生物發光成像后的研究終止時,獲取X射線圖像以測試骨質量并觀察標記的轉移癌細胞集落,且通過熒光顯微鏡計數。
心內注射骨轉移模型。將兩個月大的正常或免疫低下小鼠通過異氟烷麻醉,并且還給予鹽酸丁丙諾啡(0.3mg/ml)作為止痛劑。將表達熒光或化學發光標記物的癌細胞(例如,對于正常小鼠為表達Luc-GFP的Py8119細胞,或對于免疫低下小鼠為Luc-GFP-MD-MBA-231)注射到小鼠的左心室中。程序包括:將針保持向操作者成一角度且向右,將其插入第二肋間隙,距離胸骨左側約3mm。推進約5mm并輕輕轉動針頭,直到觀察到鮮紅動脈血的脈動流進入針座。在30秒中注射細胞懸液。取出針,在注射部位使用酒精棉施壓30秒。將小鼠置于溫暖的表面上,直到其完全從麻醉中恢復。從腫瘤細胞接種后3天每周在心內注射后進行生物發光或熒光成像以驗證腫瘤細胞的分布。在足夠的生物發光成像后的研究終止時,獲取X射線圖像以評估骨質量并觀察標記的轉移癌細胞集落,且通過熒光顯微鏡計數。
Cx43條件性敲除(cKO)小鼠。由于純合Cx43整體敲除是致命的,并且還由于本發明人想要研究在骨細胞中表達的Cx43的作用,因此產生了骨細胞特異性Cx43敲除小鼠。將floxed Cx43基因純合的小鼠與Cx43整體雜合小鼠雜交有利于骨細胞中Cx43的完全缺失。然后將Cx43fl/-小鼠(50%的子代)與表達由人類DMP-1啟動子驅動的Cre重組酶的小鼠雜交。這產生了為Cx43fl/-、DMP1 Cre+或Cx43 fl/-、DMP1 Cre-的小鼠(小百分比的為Cx43fl/fl或Cx43-/-)。通過免疫組織化學確認了Cx43缺陷骨細胞。
研究可包括4組小鼠:用阿侖膦酸鹽(AD)處理的WT,用阿侖膦酸鹽處理的KO,無AD的WT,和無阿侖膦酸鹽的KO。將AD以150μg/kg體重施用給小鼠。對于AD處理,預期骨轉移在KO中與WT小鼠相比將會增加。而在無AD的情況下,骨轉移在WT與敲除小鼠之間應相似。
II.治療與連接蛋白半通道相關的病癥的方法
在某些實施方案中,可將連接蛋白半通道的調節劑用于治療與連接蛋白半通道相關的障礙,包括炎性障礙,諸如骨關節炎(OA)和脊椎損傷。本文所述的方法和組合物還可用于治療傷口,諸如角膜和皮膚傷口。
A.骨關節炎(OA)
骨關節炎是一種影響著大約20%的美國成年人的普遍性疾病。該疾病導致關節(包括關節軟骨和軟骨下骨)的退化。OA的病理特征在于關節軟骨的喪失,從而導致關節空間變窄、關節摩擦增加和可能的結構重塑。當前的治療包括鍛煉、生活方式改變和止痛劑。如果癥狀變嚴重,則通常施行關節置換術。迄今為止,尚無可用于治療OA的特定藥物干預措施。
軟骨細胞表達連接蛋白(Cx)43半通道,并且這些通道介導小分子(低于1kDa)在細胞內/外之間的傳遞。在正常條件下,軟骨細胞中的Cx43半通道保持關閉;然而,這些通道在炎癥條件下打開并釋放諸如促炎性因子的小分子。機械負荷和白介素-β1誘導軟骨細胞中Cx43半通道的打開,促進炎性反應,釋放諸如前列腺素E2(PGE2)和ATP的促炎性因子。
抑制軟骨細胞中Cx43半通道的打開(例如,通過化學試劑等)可抑制骨關節炎的炎癥和發展。軟骨細胞中的半通道打開可使用本文所述的方法進行檢測。Cx43半通道釋放的促炎性因子(PGE2和ATP)使用ELISA測定法測量。阻斷半通道打開的藥劑可用作炎性疾病諸如OA的治療劑。
升高的白介素1β(IL-1β)是OA的誘導劑。不正常的關節負荷已知也會增加OA的風險。IL-1β的暴露導致軟骨細胞釋放前列腺素和NO。釋放的PGE2通過抑制蛋白聚糖的合成并誘導膠原的降解而發揮分解代謝作用。已證實,機械負荷打開Cx43半通道。Cx43充當PGE2釋放進骨細胞的入口。Cx43在軟骨細胞的表面上(參見18)以及在關節軟骨中表達。IL-1β和機械負荷導致軟骨細胞中Cx43半通道的打開(圖18),而這種打開受半通道特異性Cx43抗體抑制。當半通道被Cx43(E2)抗體阻斷時,由IL-1β誘發的炎性反應受到抑制。
基于以上證據,軟骨細胞中的Cx43半通道被IL-1β或機械負荷打開,并且半通道釋放的PGE2導致OA的發展。軟骨細胞中Cx43半通道的特異性阻斷可用于治療性策略以治療由升高的IL-1β或創傷(不正常的負荷)導致的OA。
用于評價Cx43通道活性的體外細胞模型。從小鼠腿骨關節分離原代軟骨細胞。可檢測藥劑對軟骨細胞中Cx43半通道打開和間隙連接部偶合的作用,并對時間和劑量依賴性作用進行評價。例如,使用熒光黃或Alexa染料通過染料攝取測定法來評估半通道打開。通過使用ELISA測定法來檢測PGE2和ATP的釋放而測量下游效應。
對于脊柱損傷,局部炎癥和腫脹通常由局部損傷、創傷或感染導致,而這些事件也可以是全身炎癥的致因。炎癥的特征通常在于增加的發紅、腫脹、體溫、疼痛,以及在受累區域中的一些功能喪失。在某些方面,抑制半通道打開的藥劑可用于緩解與中樞神經系統炎癥和/或脊髓損傷相關的炎癥。
傷口愈合代表了另一個重要的健康問題,并且采用復雜的生物過程而不論原因如何。一般來講,在相關炎性反應過程中,傷口由浸潤細胞和體液清洗。該初始炎癥階段之后是增生階段,其中不同的細胞類型提供傷口愈合或被適當的細胞(諸如成纖維細胞、角質形成細胞以及許多其它細胞)填入所必需的因子和組織環境。隨著上皮細胞逐漸填入傷口,諸如血管生成和傷口收縮的另外事件也在發生。該階段往往持續約7-10天,具體取決于傷口的嚴重性和炎癥階段的效率。諸如更大的年齡、免疫缺陷以及壓力等情況和其它環節因素可影響傷口愈合。傷口的長期暴露導致增加的感染可能性、不良炎癥作用以及結疤和可能的慢性傷口。一般來講,傷口愈合過程以成熟和重塑階段而結束。膠原得以更換、重塑和交聯,從而增加新產生的組織的強度,并且非必需血管、細胞和組織從傷口部位緩慢移除。隨著身體傾向于最終愈合階段,該最終階段可持續數年。
傷口的治療通常涉及應用抗生素以及防護外部環境的藥劑,諸如繃帶、縫線、第二皮膚、密封劑或其它霜劑和藥膏。另外,許多化合物也可用于在傷口愈合的早期治療炎癥,通常與甾體類抗炎化合物或藥物相結合。本文所述的或通過本文所述的方法鑒定的藥劑可用于調節與傷口愈合相關的炎癥過程。
III.抗體
本發明的某些方面涉及正或負調節半通道功能的抗體。鑒定和分離單克隆抗體的實例在下文描述。
如本文所用的術語“CDR”是指抗體可變結構域的互補決定區。CDR中所包括的殘基的系統性鑒定已由Kabat等(1991,Sequences of Proteins of Immunological Interest,第5版,United States Public Health Service,National Institutes of Health,Bethesda)開發。可變輕鏈(VL)CDR在本文定義為包括位置27-32(CDR1)、50-56(CDR2)和91-97(CDR3)處的殘基。可變重鏈(VH)CDR在本文定義為包括位置27-33(CDR1)、52-56(CDR2)和95-102(CDR3)處的殘基。
如本領域的技術人員將認識到,本文所公開的CDR還可以包括變體。一般來講,各個變體CDR之間的氨基酸同一性為至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%。因此,“變體CDR”是與本發明的親本CDR具有指定的同一性的CDR并且共有生物功能,包括但不限于至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的親本CDR的特異性和/活性。
盡管要預先確定用于引入氨基酸序列變異的位點或區域,但是突變本身不需要預先確定。例如,為了優化突變在給定位點的性能,可以在靶密碼子或靶區域處實施隨機誘變,并針對所需活性的最佳組合,篩選表達的抗原結合蛋白CDR變體。在具有已知序列的DNA中的預定位點處產生置換突變的技術是熟知的,例如,M13引物誘變和PCR誘變。使用如本文所述的抗原結合蛋白活性測定法進行突變體的篩選。
氨基酸置換一般是單個殘基;插入通常將在約一個(1)至約二十個(20)氨基酸殘基的級別上,但也可以容許明顯更大的插入。缺失的范圍為約一個(1)至約二十個(20)氨基酸殘基,但在一些情況下缺失可以大得多。
置換、缺失、插入或其任意組合可以用來獲得最終的衍生物或變體。一般來講,在少許氨基酸上進行這些改變,以便使分子的改變(特別是抗原結合蛋白的免疫原性和特異性)最小化。然而,在某些情況下可以容許較大的改變。
如本文所用的“Fab”或“Fab區域”意指包含VH、CH1、VL和CL免疫球蛋白結構域的多肽。Fab可以指分離情況下的這種區域,或在全長抗體、抗體片段或Fab融合蛋白或如本文概述的任何其它抗體實施方案的情境下的這種區域。
如本文所用的“Fv”或“Fv片段”或“Fv區域”意指包含單一抗體的VL和VH結構域的多肽。
如本文所用的“骨架”意指抗體可變結構域的不包括定義為CDR的那些區域的區域。每個抗體可變結構域骨架可以進一步再劃分成由CDR分隔的連續區域(FR1、FR2、FR3和FR4)。
如本文所用,術語抗體的“抗原結合部分”(或簡稱為“抗體部分”)是指保留與抗原(例如,半通道)特異性結合的能力的一種或多種抗體片段。已證實,抗體的抗原結合功能可以由全長抗體的片段執行。術語抗體的“抗原結合部分”所涵蓋的結合片段的實例包括,(i)Fab片段,一種由VL/VK、VH、CL和CH1結構域組成的單價片段;(ii)F(ab')2片段,一種包含由二硫鍵在鉸鏈區連接的兩個Fab片段的二價片段;(iii)實質上是帶有部分鉸鏈區的Fab的Fab'片段(參見FUNDAMENTAL IMMUNOLOGY(Paul編著,第3版,1993);(iv)由VH和CH1結構域組成的Fd片段;(v)由抗體單臂的VL和VH結構域組成的Fv片段;(vi)由VH結構域組成的dAb片段(Ward等(1989)Nature 341:544-546);(vii)分離的互補決定區(CDR);和(viii)納米抗體,一種含有單個可變結構域和兩個恒定域的重鏈可變區。
術語“特異性結合”(“或免疫特異性結合”)無意表示抗體專有地結合其預期靶標。相反,如果抗體與其預期靶標的親和力比其與非靶標分子的親和力高大約5倍,則抗體“特異性結合”。適宜地,不存在與不希望的物質的明顯的交叉反應或交叉結合。抗體與靶標分子的親和力將比其與非靶標分子的親和力高至少約5倍,諸如10倍,諸如25倍,尤其是50倍,特別是100倍或更高。在一些實施方案中,抗體或其它結合劑與抗原之間的特異性結合意指至少106M-1的結合親和力。抗體可例如以至少約107M-1,諸如介于約108M-1至約109M-1、約109M-1至約1010M-1或約1010M-1至約1011M-1的親和力進行結合。抗體可例如以50nM或更小、10nM或更小、1nM或更小、100pM或更小或更優選地10pM或更小的EC50進行結合。
小鼠mAb純化方案。蛋白G而非蛋白A是選擇用來純化小鼠IgG的柱,因為小鼠IgG1與蛋白G的結合好得多。15天后收集無胎牛血清的得自雜交瘤培養物的上清液以便產生IgG。
在實驗中,使用了GammaBind PlusTM瓊脂糖快速流動柱。對柱子進行清洗,然后用結合緩沖液平衡。這些步驟的每一個使用約30ml緩沖溶液。然后將具有結合緩沖液的稀釋雜交瘤上清液上樣到柱子中。收集1.5ml級分(洗脫液)。將150μl 1M Tris緩沖液(pH 8)用于中和pH。將柱子用結合緩沖液(30-50ml)再平衡。最后,添加20μl疊氮化鈉以便儲存。柱結合能力為18mg/ml小鼠IgG。使用1ml/min的流量。將50mM磷酸鈉緩沖鹽水(pH 7)用作結合緩沖液,并將0.1M甘氨酸(pH 2.7)用作洗脫緩沖液。將上清液與結合緩沖液按1:1混合。
在某些實施方案中,將小鼠單克隆抗體(M1)用于研究形成間隙連接部或/和半通道的連接蛋白Cx43的功能,其中單克隆抗體的重鏈具有SEQ ID NO:2所示的氨基酸序列,而單克隆抗體M1的輕鏈具有SEQ ID NO:4所示的氨基酸序列。
在某些實施方案中,將小鼠單克隆抗體(M2)用于研究形成間隙連接部或/和半通道的連接蛋白Cx43的功能,其中單克隆抗體的重鏈具有SEQ ID NO:6所示的氨基酸序列,而單克隆抗體的輕鏈具有SEQ ID NO:8所示的氨基酸序列。
在某些實施方案中,將小鼠單克隆抗體(M7)用于研究形成間隙連接部或/和半通道的連接蛋白Cx43的功能,其中單克隆抗體的重鏈具有SEQ ID NO:10所示的氨基酸序列,而單克隆抗體的輕鏈具有SEQ ID NO:12所示的氨基酸序列。
免疫印跡。將MLO-Y4細胞以3x105個接種到60mm平皿中維持48h。在裂解緩沖液(5mM Tris,5mM EDTA,5mM EGTA+蛋白酶抑制劑,20μl/ml苯甲基磺酰氟(PMSF),20μl/ml N-乙基馬來酰亞胺,10μl/ml NaVO4和10μl/ml亮肽素)中收集小鼠心臟組織,勻化并以100,000xg在4℃下離心30分鐘然后重懸在裂解緩沖液中。將粗制膜蛋白通過10%SDS-聚丙烯酰胺凝膠電泳分離,轉移到硝酸纖維素膜,用識別Cx43的C端的抗Cx43CT(1:300稀釋)或識別Cx43的第二胞外環的抗Cx43 E2(1:500稀釋)或抗Cx43的第二胞外環的單克隆抗體(1:100稀釋)印跡。通過Odyssey紅外檢測系統(LI-COR,Lincoln,NE,USA)檢測二抗即紅外800抗兔IgG(1:15000)(LI-COR,Lincoln,NE,USA)的熒光。
免疫熒光:將MLO-Y4細胞在膠原包被的蓋玻片上培養。將細胞用PBS漂洗2次,并用70%冷乙醇在-20℃溫育20分鐘。使用PFA破壞表位,該表位富含賴氨酸,因此不予推薦。然后,將細胞用PBS漂洗兩次以便移除乙醇。之后,將細胞用阻斷溶液(2%山羊血清、2%魚皮明膠和1%牛血清白蛋白的PBS溶液)阻斷過夜。然后,將細胞用PBS中不同濃度的單克隆抗體標記,再用FITC綴合的山羊抗小鼠抗體和WGA-alexa594(Invitrogen)(分別在阻斷溶液中以1:400和1:1500稀釋)標記。通過Olympus BH-2熒光顯微鏡觀察細胞,并通過NIH Image J軟件對圖像進行離線處理。
半通道活性的染料攝取。使用快照照片評價了染料攝取測量結果。將MLO-Y4細胞鋪板到膠原包被的35mm平皿上,并用以下記錄培養基溫育:不含HCO3–的鹽水培養基,用10mM以下HEPES鹽組合物緩沖(單位mM):154NaCl、5.4KCl、1.8CaCl2、1.0MgCl2、5葡萄糖。向具有低濃度二價陽離子的培養基(低[X2])添加0.5mM EGTA但不添加CaCl2和MgCl2。記錄培養基或低[X2]含有50μM EtBr用于快照記錄。將細胞暴露于100μM EtBr 5分鐘,然后用PBS漂洗3次,再用2%甲酰胺固定。在具有若丹明濾光片的倒置顯微鏡(Carl Zeiss)中,通過10倍干物鏡獲取熒光場的至少3張顯微照片。通過image J軟件離線分析圖像。測量30個隨機細胞的像素密度的平均值。
間隙連接部的染料偶合測定。將MLO-Y4細胞鋪板到膠原包被的35mm平皿上,并用記錄培養基(不含HCO3–的αMEM培養基,用10mM HEPES緩沖)溫育。在37℃下通過alexafluor 350(Invitrogen,Eugene,Oregon,USA)(10mM的PBS溶液)使用均得自Eppendorf(Eppendorf)的顯微操縱器InjectMan NI 2和Femtojet進行細胞的顯微注射。在alexafluor 350注射后2分鐘測量染料轉移。對發生染料轉移的細胞數計數,從而記錄染料偶合指數。在配備氙弧燈照明和Nikon eclipse(Nikon,Japan)(激發波長330-380nm,發射波長高于420nm)的倒置顯微鏡下觀察染料偶合。
間隙連接部的細胞降落染料轉移測定。使MLO-Y4細胞在12孔板中生長到匯合。將供體細胞用5μM鈣黃綠素紅-橙-AM(790Da)和5μM俄勒岡綠488BAPTA-2-AM(1752Da)在37℃溫育40分鐘。間隙連接部分子間通訊可通過用可滲透間隙連接部的示蹤劑染料鈣黃綠素紅-橙和不可滲透間隙連接通道的俄勒岡綠488BAPTA-2同時標記細胞而跟蹤。通過胰蛋白酶消化從板移除預加載的供體細胞。使預加載的細胞在以1:4供體與受體比率培養的未標記受體細胞的頂部分層(“降落”)。使細胞貼壁1小時的時間段,然后小心洗滌3次,在新鮮的2%PFA中在室溫下固定10分鐘,然后再漂洗3次。通過熒光顯微鏡檢查細胞。對于鈣黃綠素紅-橙轉移,調整閾值以清楚區分染料轉移邊界。染料轉移陽性標準是檢測鈣黃綠素紅-橙/俄勒岡綠488BAPTA-2,其中接觸的細胞呈鈣黃綠素紅-橙陽性和俄勒岡綠488BAPTA-2陰性。染料轉移幾乎不可檢測(<1%)。在我們發現俄勒岡綠488BAPTA-2綠陽性細胞的地方獲取圖像。
流體流動剪切應力打開半通道。通過限定厚度的墊圈隔開的平行板流動小室以重力驅動的流體流使用蠕動泵形成流體流。墊圈厚度決定通道高度,將其與流量一起調整以產生16達因/cm2的應力水平。循環培養基為10mM HEPES緩沖的α-MEM。
將所提供的實施例以及附圖包括在內以闡述本發明的優選實施方案。本領域的技術人員應當認識到,實施例或附圖中所公開的技術代表了本發明人發現的在本發明的實踐中能很好發揮作用的技術,并因此可被視為構成本發明的優選實踐模式。然而,根據本公開,本領域的技術人員還將認識到,在不脫離本發明的精神和范圍的情況下,可以對所公開的具體實施方案進行多種修改,并仍得到相同或相似的結果。
IV.藥物組合物
某些方面包括組合物,例如藥物組合物,其包含與藥學上可接受的載體一起配制的單克隆抗體或其抗原結合部分中的一種或組合。此類組合物可包含本文所述的(例如,兩種或更多種不同的)抗體或免疫綴合物中的一種或組合。例如,本發明的藥物組合物可包含結合到靶抗原上的不同表位或具有互補活性的抗體的組合。
本發明的藥物組合物還可以作為聯合療法而施用,即,與其它藥劑聯合。例如,聯合療法可包括與至少一種其它抗癌劑聯合的抗半通道抗體。
如本文所用,“藥學上可接受的載體”包括生理上相容的任何和所有溶劑、分散介質、包衣料、抗細菌劑及抗真菌劑、等滲劑和吸收延遲劑等。優選地,載體適于靜脈內、肌內、皮下或腸胃外施用(例如,通過注射或輸注)。取決于施用途徑,可將活性化合物(即,抗體或免疫綴合物)用材料包衣以避免化合物受到可使化合物失活的酸和其它自然條件的作用。
可用于本發明的藥物組合物的合適的水性和非水性載體的實例包括水、乙醇、多元醇(諸如甘油、丙二醇、聚乙二醇等)及其合適的混合物,植物油,諸如橄欖油,和注射用有機酯,諸如油酸乙酯。可例如通過使用包衣材料(諸如卵磷脂)、通過維持所需的粒度(就分散體而言)以及通過使用表面活性劑而維持適當的流動性。
藥學上可接受的載體包括無菌水溶液或分散體以及用于臨時制備無菌注射溶液或分散體的無菌粉末。將這種介質和試劑用于藥學活性物質是本領域已知的。除非任何常規的介質或試劑與活性化合物不相容,否則均設想了其在本發明的藥物組合物中的用途。補充性活性化合物也可摻入組合物中。
治療性組合物通常必須為無菌的且在制造和儲存條件下穩定。組合物可配制成溶液、微乳液、脂質體或其它適于高藥物濃度的有序結構。載體可以是包含例如水、乙醇、多元醇(例如甘油、丙二醇和液體聚乙二醇等)及其合適的混合物的溶劑或分散介質。可例如通過使用包衣料(諸如卵磷脂)、通過維持所需的粒度(就分散體而言)以及通過使用表面活性劑而維持適當的流動性。在許多情況下,將優選的是,在組合物中包含等滲劑,例如糖、多元醇(諸如甘露糖醇、山梨糖醇)或氯化鈉。注射用組合物的延遲吸收可通過在組合物中包含延遲吸收的試劑例如單硬脂酸鹽和明膠而實現。
無菌注射用溶液可通過以下方式制備:將活性化合物按所需的量與上文列舉的成分中的一種或組合一起摻入合適的溶劑中,然后進行除菌微濾。一般來講,分散體通過以下方式制備:將活性化合物摻入無菌媒介物中,該媒介物含有基礎分散介質和來自上文列舉的那些成分的所需其它成分。就用于制備無菌注射用溶液的無菌粉末而言,優選的制備方式是真空干燥和冷凍干燥(凍干),其從之前無菌過濾的溶液產生活性成分與任何另外的所需成分的粉末。
可與載體材料結合以產生單劑量形式的活性成分的量將根據進行治療的受試者和特定的施用模式而變化。可與載體材料結合以產生單劑量形式的活性成分的量一般將為產生治療效果的組合物的量。一般來講,在100%之中,該量將為約0.01%至約99%的活性成分,優選約0.1%至約70%,最優選約1%至約30%的活性成分與藥學上可接受的載體結合。
對劑量方案進行調整以提供最佳的所需反應(例如,治療反應)。例如,可以施用單次大劑量,可隨著時間施用多個分劑量,或成比例降低或增加劑量,如治療情形的緊急性所指示。尤其有利的是,以劑量單位形式配制腸胃外組合物,以便于施用和實現劑量均勻性。如本文所用的劑量單位形式是指適合用作待治療的受試者的單一劑量的物理分散單元;每個單元包含預定量的經計算可產生所需治療效果的活性化合物連同所需的藥物載體。本發明的劑量單位形式規格受控于并直接取決于(a)活性化合物的獨特特性和要實現的特定治療效果,以及(b)配混這種用于治療個體敏感性的活性化合物領域中固有的限制。
對于抗體的施用,劑量在從約0.0001至100mg/kg、更通常0.01至5mg/kg宿主體重的范圍內。例如,劑量可以為0.3mg/kg體重、1mg/kg體重、3mg/kg體重、5mg/kg體重或10mg/kg體重或在1-10mg/kg的范圍內。示例性治療方案采用每周施用一次、每兩周施用一次、每三周施用一次、每四周施用一次、一個月施用一次、每3個月施用一次或每3至6個月施用一次。本發明的抗半通道抗體的優選劑量方案包括經由靜脈內施用1mg/kg體重或3mg/kg體重,其中抗體使用以下給藥計劃給予:(i)每四周一次持續六個劑量,然后每三個月一次;(ii)每三周一次;(iii)每三周一次3mg/kg體重,然后1mg/kg體重。
在一些方法中,同時施用具有不同結合特異性的兩種或更多種單克隆抗體,在這種情況下,所施用的每種抗體的劑量落在指定的范圍內。抗體通常多次施用。單個劑量之間的間隔可例如為每周、每個月、每三個月或每年。間隔也可以是不規則的,如通過測量患者體內針對靶抗原的抗體的血液水平所指明。在一些方法中,調整劑量以實現約1-1000μg/ml的血漿抗體濃度并在一些方法中實現約25-300μg/ml的血漿抗體濃度。
本發明的藥物組合物中的活性成分的實際劑量水平可以改變,以便獲得這樣的活性成分量,其對于特定患者、組合物和施用模式而言達到所需的治療反應,而對患者無毒。所選的劑量水平將取決于多種藥代動力學因素,包括所采用的本發明的特定組合物的活性,施用途徑,施用時間,所采用的特定化合物的排泄率,治療持續時間,與所采用的特定組合物組合使用的其它藥物、化合物和/或材料,所治療的患者的年齡、性別、體重、狀況、一般健康和先前醫療史,以及醫學領域中熟知的類似因素。
“治療有效劑量”的抗半通道抗體導致疾病癥狀的嚴重性減輕、無疾病癥狀期的頻率和持續時間增加或預防因疾病困擾所導致的損傷或殘疾。治療有效量的治療化合物或抗體可減少受試者體內的腫瘤轉移或以其它方式緩解癥狀。本領域的普通技術人員將能夠基于諸如受試者的大小、受試者癥狀的嚴重性和所選的特定組合物或施用途徑等因素來確定這種量。
本發明的組合物可使用本領域已知的多種方法中的一種或多種通過一種或多種施用途徑進行施用。如技術人員將會認識到,施用途徑和/或模式將根據所需的結果而變化。本發明的抗體的優選施用途徑包括靜脈內、肌內、真皮內、腹膜內、皮下或其它腸胃外施用途徑,例如通過注射或輸注。如本文所用的短語“腸胃外施用”意指腸道和局部施用之外的施用模式(通常通過注射施用)并包括但不限于靜脈內、肌內、動脈內、腹膜內、經氣管、皮下、表皮下、關節內注射和輸注。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 一種腫瘤靶向絲膠蛋白膠束及其制備方法和應用與流程
- 一種靶向缺血心肌的VEGF重組蛋白的制作方法與工藝
- 一種胰島靶向蛋白及其真核表達方法與流程
- 一種基于Ion Torrent測序平臺的靶向葉綠體測序方法與流程
- 用于癌癥靶向治療的包含基于重組血紅蛋白蛋白質或亞基的治療劑的藥物組合物的制作方法與工藝
- 基于STAT3蛋白靶點的靶向抗癌藥物的發明的制作方法與工藝
- 靶向泛素化降解PLK1和BRD4蛋白的化合物及其應用的制造方法與工藝
- 抗HBV復制的靶向融合蛋白及其構建方法與流程
- 靶向于鈣粘著蛋白?11的EC1結構域的人源化抗體及相關組合物和方法與流程
- 用于刺激靶向熱休克蛋白以及促進蛋白質修復的脈沖電磁和超聲療法的制造方法與工藝