一種復合關節柄及其制備方法與流程
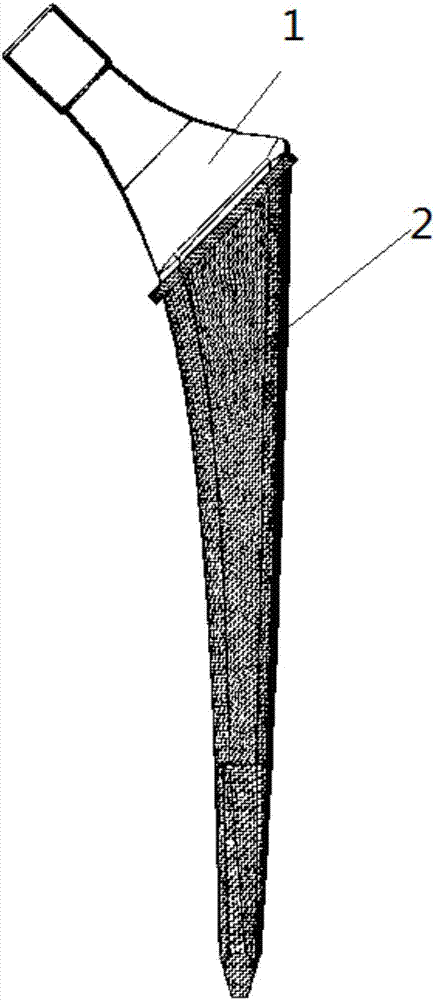
本發明涉及復合關節柄及其制備方法。
背景技術:
人工關節置換術是在關節成形術的基礎和理念上發展起來的一門新技術。最早人體應用人工關節是gluck于1891年首先報告的,自1938年willess首次將人工全髖關節置換術應用到臨床后,該術式在臨床得到廣泛應用。但是直到20世紀60年代chamley通過大量臨床實踐和基礎研究,確立了人工關節假體設計中的低摩擦原理,選擇了金屬一高密度聚乙烯組合來替代金屬一金屬組合和現代骨水泥技術,才使得人工關節置換術的臨床效果出現較大的進步。歷經一個多世紀的發展,已經成為治療髖部關節疾病的標準手術之一,在緩解疼痛、改善關節功能、恢復髖關節穩定和肢體功能等方面,已為學界和患者廣泛認同,并迅速推廣。隨著臨床深入研究,新材料、新技術不斷涌現,不斷推動人工關節的發展。
用來制作人工股骨柄假體是種類繁多的各種合金,主要有不銹鋼、鈦基合金和鈷基合金等。20世紀70年代以來,鈦合金有了很大發展。鈦合金表面易氧化生成致密的二氧化鈦膜,耐腐蝕性好,優于鈷合金;而且密度低,約為鈷合金的一半;彈性模量與人皮質骨的彈性模量接近,生物相容性好,生物界面結合牢固,是較理想的置入材料。但其耐磨性差,不宜用于球頭的制造,只適用于關節柄假體的制造。是目前作為假體柄最廣泛使用的材料。
harris[1]長期隨訪顯示,骨水泥假體術后8年的松動率為0.58%;12~15年后14%的患者出現ⅲ度骨水泥松動(界面出現連續的透亮線),11%的假體出現移位;20年后,22%的假體發生松動,其中8%的假體需要翻修;25年的隨訪則有15%的假體因為無菌性松動需要翻修。
假體松動仍是目前困擾關節置換手術的最重要因素,也是影響關節假體使用壽命的主要原因。早期將假體松動歸因于由應力遮擋引起骨質重新塑型,近年來由于生物學固定型假體的廣泛應用,假體翻修術中病理和尸體病理的取得, 對假體的松動原因認識著重于假體微動和磨屑誘導的骨溶解方面。后期研究表明假體微動原因與假體及周圍骨溶解關系密切,無機假體對有機骨骼的反復擠壓應力是骨溶解發生的關鍵誘因,這也就說明了在沒有反復劇烈應力的肩關節假體及肱骨小頭假體治療失敗率低的原因。這種影響主要是由于人工假體與本體骨沒能完全融合,在人工假體與本體骨的結合界面上,負重應力使人工假體對本體骨產生高頻度的反復擠壓,從而一則導致人工假體的磨損,二則造成假體微動,使本體骨產生骨溶解現象。而因為反復微動導致的摩擦碎屑顆粒和離解產生的微小顆粒物質所致的生物學反應是啟動因素,這些物質可趨化并激活機體內單核一巨噬細胞,使其大量增值并分泌多種與骨吸收有關的細胞因子,直接或經激活破骨細胞間接誘發骨溶解,最終使固定良好的假體發生松動,這就是促使我們來解決假體植入機體后發生假體微動的問題。
20世紀90年代以來所采用的第三代骨水泥技術,包括髓腔栓、骨水泥槍、髓腔沖洗、壓力固定以及假體柄的中心化,減少骨水泥中的氣泡含量等。這些方法極大地克服了原有缺點,增加了骨水泥承受的應力,加強了界面的結合強度,從而降低了松動發生率。非骨水泥假體在固定方面的重要改進是使骨長到燒結孔或假體的粗糙表面。這種方法一度比骨水泥假體的應用更為廣泛,在股骨上端非骨水泥固定假體獲得了與采用新骨水泥固定假體相似的臨床效果,但有跡象證明這仍然會產生更多的骨溶解。而本體骨的骨溶解可能會造成假體的無菌性松動。因此,如何使人工假體與本體骨能完全融合,從而消除由于負重應力使人工假體對本體骨產生高頻度的反復擠壓所導致的人工假體磨損和由于假體微動使本體骨產生的骨吸收現象,是材料、工藝學與臨床醫學要共同解決的難題。
技術實現要素:
本發明針對上述產品存在的問題,提出一種復合關節柄及其制備方法。
本發明的技術方案是:一種復合關節柄,包括金屬關節柄本體,在所述的金屬關節柄本體與本體骨相聯接的部位包覆了一層高分子復合人工仿生骨材料。
本發明在金屬關節柄本體與本體骨相聯接的部位包覆了一層高分子復合人工仿生骨材料克服目前人工關節柄的不足。
進一步的,上述的復合關節柄中:所述的金屬關節柄本體中與本體骨相聯接的部位的金屬材料中設置一些蜂窩狀孔洞,在所述的蜂窩狀孔洞中也充盈高分子復合人工仿生骨材料。
進一步的,上述的復合關節柄中:所述的高分子復合人工仿生骨材料包括以下組份:
質量百分比為20%-80%高分子材料;
質量百分比為5%-60%非可降解或可部份降解的無機物;
質量百分比為5%-40%可降解的無機物;
所述的高分子材料為具有優良的電絕緣性、生物惰性和對化學藥品的穩定性,且其沒有生物毒性的高分子化合物;所述非可降解或可部份降解的無機物為具有骨細胞誘導或傳導功能的無機材料;可降解的無機物為植入人體后可以在生物環境下降解并被生物細胞所吸收且具有骨細胞誘導功能的無機材料。
進一步的,上述的復合關節柄中:所述的高分子復合人工仿生骨材料包括以下組份:
質量百分比為60%-80%的高分子復合材料;
質量百分比為10%-30%的非可降解或可部份降解的無機物;
質量百分比為5%-10%的可降解的無機物。
進一步的,上述的復合關節柄中:所述的高分子復合人工仿生骨材料包括以下組份:
質量百分比為25-50%的高分子復合材料;
質量百分比為25-50%的非可降解或可部份降解的無機物;
質量百分比為20-30%的可降解的無機物。
進一步的,上述的復合關節柄中:所述的高分子復合人工仿生骨材料包括以下組份:
質量百分比為20-50%的高分子復合材料;
質量百分比為25-50%的非可降解或可部份降解的無機物;
質量百分比為15-40%的可降解的無機物。
進一步的,上述的復合關節柄中:所述的高分子復合材料為聚醚醚酮、液晶高分子聚合物或改性氟塑料中的一種。
進一步的,上述的復合關節柄中:所述的高分子復合材料中還包括最多占制備中間骨質層材料總質量60%的增強纖維。
進一步的,上述的復合關節柄中:所述的增強纖維為碳纖維或玻璃纖維。
進一步的,上述的復合關節柄中:所述的生物陶瓷為羥基磷灰石或磷酸三鈣。
進一步的,上述的復合關節柄中:所述的可降解且具有骨細胞誘導功能的無機材料為鎂或者鎂合金。
本發明還提供一種復合關節柄的制備方法,包括以下步驟:
步驟1、按要求加工好金屬關節柄本體;
步驟2、將制作高分子復合人工仿生骨材料的原料粉末充分混合;
步驟3、采用注塑或熱壓成型工藝將充分混合后的復合人工仿生骨材料復合到金屬關節柄本體上。
以下將結合附圖和實施例,對本發明進行較為詳細的說明。
附圖說明
附圖1是本發明的復合關節柄示意圖。
附圖2是本發明的復合關節柄分解圖。
附圖3是本發明的復合關節柄剖視圖。
附圖4是本發明的復合關節柄局部剖視圖。
具體實施方式
如圖1、2、3、4所示,一種復合關節柄,包括金屬關節柄本體1,在金屬關節柄本體1與本體骨相聯接的部位12包覆了一層高分子復合人工仿生骨材料2,不與本體骨相聯接的部位11外部光滑。金屬關節柄本體1中與本體骨相聯接的部位12的金屬材料中設置一些蜂窩狀孔洞121,在蜂窩狀孔洞121中也充盈高分子復合人工仿生骨材料2。
當本實施例的復合關節柄植入本體骨后,人體骨細胞可逐步在包覆在金屬外層的人工仿生骨材料中生長,最終與本體骨完全融為一體;同時,該層人工仿生骨材料的彈性模量等于或小于本體骨,且韌性好、疲勞強度高,故可以吸收負重應力對本體骨產生的應力遮擋,從而消除人工假體的磨損和由于假體微動而產生關節柄松動。
按照表1的成分,先按要求加工好金屬關節柄本體1,然后按照表1的成分表,可以生成不同的骨特性的高分子復合人工仿生骨粉末料,將這些粉末料充分混合后采用注塑或熱壓成型復合到金屬關節柄上。
下表中具有36種不同特性的復合人工仿生骨成分,按照要求可以生成不同特性的復合人工仿生骨,其中,“其它”一欄一般只占總量的5-10%的質量,是指除生物陶瓷和鎂及鎂合金以外的其它骨傳導和骨誘導功能的生物陶瓷和可降解且具有骨細胞誘導功能的無機材料,本領域的技術人員根據醫生要求可以配制出符合醫生要求的與不同人體個體配合最佳的復合關節柄。
表1成份列表
- 還沒有人留言評論。精彩留言會獲得點贊!