一種基于環糊精及卵磷脂為載體的番荔素納米粒及其制備方法和應用與流程
本發明涉及藥物制劑領域,具體涉及一種用環糊精以及卵磷脂為載體制備的番荔素納米粒、其制備方法及應用。
背景技術:
番荔素包括番荔素內酯(簡稱ACGs)及其單體bullatacin、squamostatin、annosquacin等。番荔素是從番荔枝科植物種子中提取的一系列含有35或37個碳的長鏈脂肪酸,并含有0到3個四氫呋喃(THF)環類似的結構。番荔枝總內酯和單體大多數展示出來很強的抗腫瘤活性,其中活性最好的單體bullatacin對肺癌A549細胞、人肝癌HepG2細胞、人宮頸癌HeLa細胞、人乳腺癌MCF-7細胞、人結腸癌Lovo細胞、肉瘤S180細胞等具有顯著療效。同時,ACGs對多藥耐藥的腫瘤細胞株也有較好活性。
ACGs水溶性差,小于1ug/mL,難于給藥,導致體內研究大大受限。已有的體內研究多采用懸浮灌胃,或者分散在植物油中口服給藥,由于生物利用度低導致其療效難以最大程度發揮。并且ACGs毒副作用大,治療窗口窄,對大鼠的肝和腎有一定毒性。
納米粒是將藥物通過不同的方法制備成納米大小的顆粒,包括膠束、聚合物納米粒、納米混懸劑等。由于具有較大的表面積,藥物溶出速度和程度均較高,納米粒已成為解決難溶性藥物的給藥問題的主要方法之一。同時,藥物多包封在納米粒內部,進入體內之后可以在一定時間內與外界環境隔離,從而在一定程度上保護不穩定的藥物,延緩代謝。如果納米粒的粒徑較小(如300nm以內),還可由于EPR(enhanced permeation and retention)效應而被動靶向腫瘤。因此,納米給藥系統是解決難溶性藥物,尤其是難溶性抗腫瘤藥物的臨床應用的有效手段。
技術實現要素:
為實現上述目的,本發明提供一種制備方法簡便、穩定性高,能同時實現番荔素靜脈注射和口服給藥,并增強抗癌療效的納米粒。
一種基于環糊精及卵磷脂為載體的番荔素納米粒,由番荔素、環糊精和磷脂組成,其質量比為1∶0.02~20∶0.02~20。
在本發明的一個優選的實施方案中,所述番荔素選自番荔素內酯、bullatacin、squamostatin或annosquacin中的一種或者兩種及以上的組合。
在本發明的一個優選的實施方案中,番荔素、環糊精和磷脂的質量比為4∶2∶1。
在本發明的一個優選的實施方案中,所述納米粒的平均粒徑為10-1000nm,優選平均粒徑為20-200nm;所述納米粒包括但不限于納米混懸劑、納米晶、納米粒、納米聚集體等。
在本發明的一個優選的實施方案中,所述納米粒可制成口服制劑或靜脈給藥制劑。
在本發明的一個優選的實施方案中,所述環糊精選自α-環糊精、β-環糊精或γ-環糊精中的一種或者兩種及以上的組合。
在本發明的另一個優選的實施方案中,所述環糊精選自羥丙基-β-環糊精。
在本發明的另一個優選的實施方案中,所述環糊精選自PEG修飾的α-、β-或γ-環糊精,其中PEG的分子量范圍是200-10000,優選分子量范圍是400-5000,更優選分子量范圍是600-2000。
在本發明的另一個優選的實施方案中,所述卵磷脂選自大豆卵磷脂,蛋黃卵磷脂中的一種或兩種的組合,其中優選大豆卵磷脂。
在本發明的另一個優選的實施方案中,為進一步改善載藥納米粒的性質,還可以加入有其他藥劑上可以接受的各種輔料作為非必需的輔助穩定劑,這些輔料包括但不限于PCL-PEG、ChoI-PEG、聚乙烯醇等。
另一方面,本發明提供了一種基于環糊精及卵磷脂為載體的番荔素納米粒的制備方法,所述方法為溶劑沉淀法或反溶劑法,包括攪拌注入或者超聲注入或者二者結合來制備。
在本發明的一個優選的實施方案中,所述方法具體步驟包括:
(1)將卵磷脂溶于能與水互溶的有機溶劑中,攪拌條件下將所述含有卵磷脂的溶液加入到含有環糊精的水溶液中,減壓旋蒸法除去有機溶劑;
(2)將番荔素溶于能與水互溶的有機溶劑中,攪拌條件下,將所述含有番荔素的溶液加入到上一步的溶液中,減壓旋蒸除去有機溶劑,即得所述的納米粒。
在本發明的一個更優選的實施方案中,所述能與水互溶的有機溶劑選自DMSO、DMF、甲醇、乙醇、丙醇、乙腈、異丙醇、PEG400、PEG600中的一種或兩種及以上的混合體系;或者以上溶劑與乙酸乙酯、二氯甲烷、三氯甲烷等與水不相混溶的有機溶劑的混合體系,只要混合體系能和水混溶同時能很好地溶解藥物和輔料即可。
在本發明的另一個更優選的實施方案中,所述方法中番荔素在有機溶劑中的濃度為0.001%~20%(w/v),載體的濃度為0.001%~50%(w/v)。
在本發明的另一個更優選的實施方案中,步驟(2)中有機溶劑與水相的體積比為1∶2~100(v/v)。
在本發明的另一個更優選的實施方案中,步驟(1)和(2)中的攪拌條件為攪拌溫度20-60℃;攪拌速度100~1000rpm;攪拌時間1~60min,優選的攪拌條件為25℃,500rpm,攪拌20min。
在本發明的另一個更優選的實施方案中,還包括步驟(3)還可以通過冷凍干燥進一步固化。所用凍干保護劑可以是海藻糖、麥芽糖、半乳糖、乳糖、β-環糊精、羥丙基-β-環糊精中的一種或兩種及兩種以上的組合中的一種或兩種及以上的組合,優選乳糖為凍干保護劑;凍干保護劑的用量為0.1%-5%(g/100mL),凍干保護劑的用量優選為0.5-2.5%。
另一方面,本發明提供了提供一種番荔素納米粒在制備用于治療肝癌的注射劑中的應用。
在本發明的一個優選的實施方案中,所述的注射劑選自注射液或無菌凍干粉針。
在本發明的一個優選的實施方案中,所述納米粒注射劑的水相分散介質可用高濃度的氯化鈉或葡萄糖水溶液調成0.9%氯化鈉或者5%葡萄糖生理等滲體系,適應臨床應用。
在本發明的另一個優選的實施方案中,所述納米粒無菌凍干粉針可加入適量的無菌藥用0.9%氯化鈉或者5%葡萄糖水溶液稀釋,重建成供靜脈給藥用的分散體系,適應臨床使用。
本發明的納米粒的優點在于:
(1)處方簡單,所用的載體對人體無毒副作用,并且經濟易得;
(2)載藥量可高達50%以上,平均粒徑小,具有較高的藥物傳輸效率,同時易實現對腫瘤的被動靶向;
(3)體外釋放沒有突釋;
(4)在人工胃腸液和血漿當中均穩定,既可以口服給藥,也可以靜脈注射。
本發明的納米粒經體外細胞毒實驗表明,與番荔素DMSO溶液相比,表現出更顯著的腫瘤細胞抑制率。
本發明的納米粒經荷瘤小鼠藥效實驗證明,與市售喜樹堿注射液(陽性藥)相比,具體更顯著的抗腫瘤藥效,在腫瘤治療方面,是一種非常有前景的藥物遞送系統。
本發明的納米粒工藝簡單,輔料經濟安全易得,有廣闊的產業化前景。
附圖說明
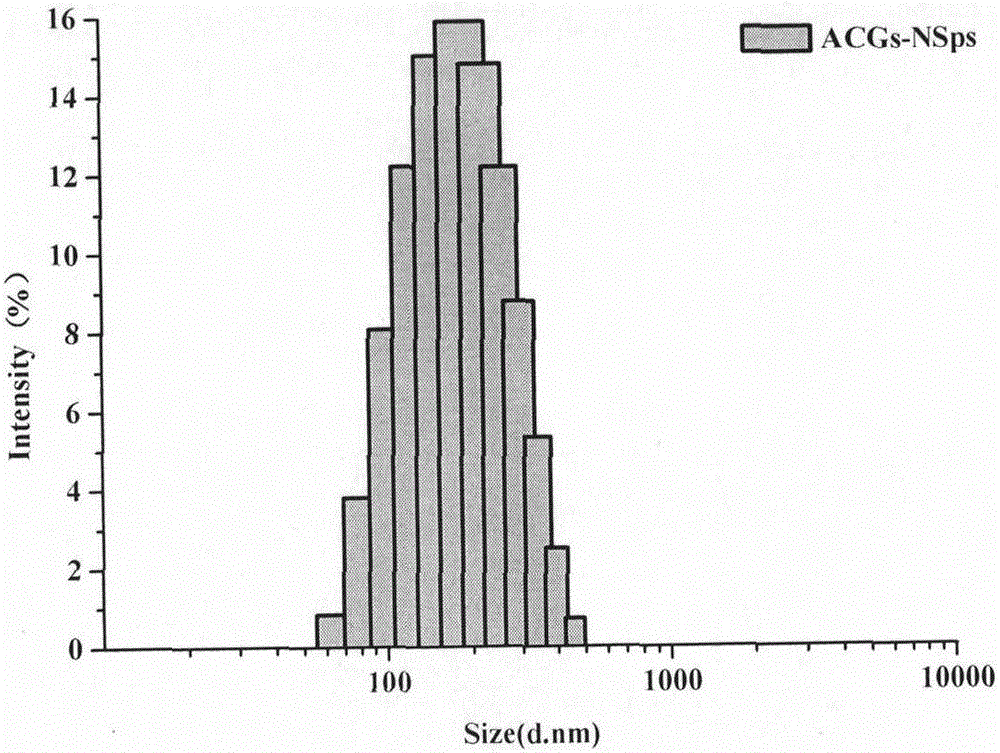
圖1為實施例1中ACGs納米粒的平均粒徑分布圖。
圖2為實施例1中透射電鏡照片(×19000)。
圖3為實施例1中ACGs納米粒在人工胃腸液中的穩定性考察(n=3)。
圖4為實施例1中ACGs納米粒在血漿中的穩定性考察(n=3)。
圖5為實施例1中ACGs納米粒的溶血考察(n=3)。
圖6為實施例1中ACGs納米粒在PBS中的體外釋放曲線(n=3)。
圖7為實施例1中ACGs納米粒對HepG2、Hela細胞毒考察(n=6)。
圖8為實施例1中荷瘤小鼠體重隨時間變化曲線(n=10)。
圖9為實施例1中荷瘤小鼠腫瘤體積隨時間變化曲線(n=10)。
具體實施方式
通過以下實施方式進一步詳細說明本發明的技術方案。需要指出的是,以下說明僅僅是對本發明要求保護的技術方案的舉例說明,并非對這些技術方案的任何限制。本發明的保護范圍以所附權利要求書記載的內容為準。
實施例1
稱取大豆卵磷脂2mg溶于0.2mL甲醇中,25℃,500rpm攪拌條件下緩慢注入到含有4mg羥丙基-β-環糊精的4mL水溶液中,繼續攪拌10分鐘后,旋蒸除去甲醇。隨后將8mgACGs溶于0.4mL甲醇中,常溫,500rpm攪拌條件下注入到上述獲得的溶液中,隨后旋蒸除去甲醇,即得ACGs納米粒。平均粒徑為144.4nm(圖1),多分散性指數(PDI)為0.08,電位值-22.9mV。
實施例2
制備2mg/mL濃度的ACGs混懸劑,吸取6μL滴到300目的銅網上,空氣中自然晾干,后用0.1%醋酸鈾染色10min,透射電鏡下觀察粒子的形態(圖2)。
實施例3 ACGs納米粒在人工胃腸液中的穩定性考察
人工胃液的配置:取濃度為1mol/L的稀鹽酸16.4mL,加800mL蒸餾水,10g胃蛋白酶,混勻,加水稀釋至1000mL。
人工腸液的配置:6.8g磷酸二氫鉀,加水500mL,用0.1mol/L氫氧化鈉調pH6.8,另取胰蛋白酶10g,加水溶解,兩液混合后加水稀釋至1000mL。
取0.5mL過膜后的配置好的人工胃腸液,與ACGs納米粒等體積混合,一定時間點測其粒徑的變化。
結果:在人工胃腸液中,ACGs納米粒在12h之內粒徑變化幾乎不大(圖3),說明ACGs納米粒在人工胃腸液中基本穩定,能夠口服給藥。
實施例4 ACGs納米粒在血漿中的穩定性考察
ACGs納米粒與大鼠血漿混合后(1∶4,v/v),在特定的時間點測其粒徑的變化。
結果:ACGs納米粒與血漿孵育后,6h之內并未發現沉淀或者粒徑變化(圖4),說明ACGs納米粒在血漿中基本穩定。
實施例5 ACGs納米粒的溶血考察
大鼠眼眶取血后,于5000rpm離心10min,收集沉淀。隨后用0.9%的NaCl溶于洗滌幾遍,直至上清無明顯紅色。隨后血細胞沉淀用0.9%的NaCl的溶液稀釋至4%紅細胞懸浮液(v/v)。取此懸浮液0.5mL與0.5mL的已調等滲的納米粒混合,37℃孵育4h后,5000rpm離心10min,取上清于酶標儀540nm處測吸光值。同時將4%的紅細胞懸浮液與0.9%的NaCl混合作為陰性對照,4%的紅細胞懸浮液與去離子水混合作為陽性對照。
溶血率(%)=(OD樣品-A陰性對照)/(A陽性對照-A陰性對照)×100
結果:ACGs溶液劑溶血明顯(圖5),0.25mg/mL時溶血率20%,2mg/mL時溶血率將近95%。而相比之下,ACGs納米粒的溶血率大大降低,2mg/mL的ACGs納米粒溶血率不足10%,體內靜脈給藥時所需的濃度完全不溶血,滿足靜脈注射的條件。
實施例6 ACGs納米粒的體外釋放實驗
方案:取制備好的ACGs納米粒4mL(1mg/mL,平行三份),于即用型透析袋(MWCO=20000,Spectra/Por,USA)中,分別置于1L釋放介質PBS中,37℃下100rpm攪拌,定時從透析袋內吸取50μL釋放內液,加950μL甲醇溶解納米粒和未釋放的藥物,HPLC測定ACGs的含量,計算累積釋放率。
結果:ACGs納米粒能夠緩慢釋放72h(圖6),整個過程無明顯突釋,釋放行為接近一級釋放。
實施例7 ACGs納米粒對HepG2、Hela的體外細胞毒考察
方案:用含10%胎牛血清的1640培養液將HepG2、Hela細胞配成單細胞懸液,以每孔5×103個細胞左右接種到96孔板。5%CO2、37℃細胞培養24h后,吸去培養液,用不含胎牛血清的培養基稀釋ACGs納米粒至不同濃度梯度,加入200uL繼續培養(同時以不含胎牛血清的培養基作為空白對照),每個濃度6個復孔。孵育48h后,吸去樣品溶液,每孔加MTT溶液(5mg·mL-1,PBS配制)20μL;繼續孵育4h后,終止孵育,吸去孔內培養上清液,每孔加200μL DMSO,振蕩20min,使結晶物充分溶解。選擇570nm波長,在酶聯免疫熒光儀檢測OD值。
細胞抑制率(%)=(空白對照組OD-實驗組OD)/空白對照組OD×100%。
結果:與番荔素DMSO溶液相比,納米粒混懸劑對HepG2、Hela均具有更強的抑制作用(圖7),尤其是對于Hela細胞(IC50值0.018μg/mL vs.0.241μg/mL,p<0.01)。孵育48h后,ACGs溶液和納米粒的IC50值如下表:
(mean±SD,n=10,**p<0.01vs.ACGs溶液劑)
實施例8 ACGs納米粒在H22荷瘤小鼠的抗腫瘤藥效研究
給藥方案:將篩選出來的荷瘤小鼠隨機分為7組,每組10只,除正常飲食外,尾靜脈注射ACGs納米粒(100,200,400ug/kg),灌胃給予ACGs納米粒(400ug/kg)和ACGs油溶液(4mg/kg),同時設立陽性藥對照組(尾靜脈注射給予市售HCPT注射液5mg/kg),生理鹽水陰性對照組。隔天給藥,實驗7天。
考察指標:每日上午9點至10點,用電子秤稱量小鼠體重;用游標卡尺測量腫瘤體積。實驗結束后,脫頸椎處死小鼠,完整剝離腋下腫瘤組織稱重,計算抑瘤率。
抑瘤率(%)=(1-治療組平均瘤重/生理鹽水組平均瘤重)×100%。
結果:納米粒組的小鼠體重變化并未明顯降低,中劑量和低劑量甚至還有升高趨勢(圖8),表明該治療組對小鼠沒有顯著毒性。ACGs納米粒靜脈注射時表現出卓越的抗腫瘤治療,400ug/kg尾靜脈給藥的腫瘤抑制率較HCPT市售注射劑5mg/kg(70.31%vs.35.28%,p<0.01)有顯著性增強。ACGs納米粒呈現出劑量依賴性,中劑量(200ug/kg,iv)和低劑量(100ug/kg,iv)抑瘤率相比于高劑量抑瘤率低(分別為56.39%和47.52%),但都比陽性藥的抑瘤率高。口服給藥時,ACGs納米粒僅用ACGs油溶液十分之一的劑量就能達到近乎相同的腫瘤抑制率(47.94%vs.49.74%,p>0.05)。
表明采用羥丙基-β-環糊精與大豆卵磷脂為載體制備的ACGs納米粒是一種非常有前景的藥物遞送系統。ACGs納米粒,ACGs油溶液及陽性藥對H22荷瘤小鼠的抑瘤率如下表:
(mean±SD,n=10,#p<0.05vs.空白對照,##p<0.01vs.空白對照,*p<0.05vs.HCPT注射液,&p<0.05vs.ACGs油溶液).
以上所述僅為本發明的優選實施方式,應當指出,對于本技術領域的普通技術人員來說,在不脫離本發明原料的前提下,還可以做出若干改進和潤飾,這些改進和潤飾也應視為本發明的保護范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!