新型調節劑及使用方法與流程
交叉參考的專利申請
本專利申請根據35U.S.C.119(e)要求于2010年9月3日提交的系列號為No.61/380,181的美國臨時專利申請的權益,將該專利申請以引用的方式全文并入本文。
技術領域
本申請案整體涉及組合物及其用于治療或改善過度增殖障礙、它們的擴張、再發、復發或轉移的方法。在一個廣泛的方面,本發明涉及CD46調節劑(包括CD46拮抗劑和融合構建體)用于治療或預防贅生性障礙的用途。在特別優選的實施例中,本發明提供抗CD46抗體用于對惡性腫瘤進行免疫治療的用途,包括降低腫瘤起始細胞(tumor initiating cell)出現率。
背景技術:
干細胞和祖細胞分化及細胞增殖為一致發揮作用以支持器官發生期間的組織生長以及所有活生物體壽命期間大部分組織的細胞替換及修復的正常進程。分化和增殖決定通常受多種因素和信號控制,這些因素和信號達成平衡以維持細胞命運決定和組織架構。作為細胞對調節細胞分裂和組織成熟的微環境暗示作出響應的結果,正常組織架構得以維持。因此,細胞增殖和分化通常僅為替換受損或死亡細胞或為生長所需要而進行。遺憾的是,細胞增殖和/或分化的破壞可由多種因素引起,包括例如多種信號傳導化學物質不足或過多、存在微環境改變、基因突變或它們的某種組合。當正常細胞增殖和/或分化受到擾亂或某種破壞時,其可引起多種疾病或障礙,包括癌癥。
常規的癌癥治療包括化學療法、放射療法、手術、免疫療法(例如生物響應修飾劑、疫苗或靶向治療劑)或它們的組合。遺憾的是,太多癌癥對這類常規治療無響應或響應極小,從而留給患者極少的選擇。例如,一些患者亞群表現出使他們無響應的基因突變(例如KRAS),盡管某些療法具有普遍有效性。此外,取決于癌癥的類型,一些可用的治療(如手術)可能并非可行的備選方案。當試圖護理先前已進行治療而隨后復發的患者時,當前的護理標準治療劑所固有的局限性尤為明顯。在這類情形中,失敗的治療方案和所導致的患者惡化可造成難治性腫瘤,其通常自身表現為更具侵襲性的疾病,最終證明不能治愈。盡管多年來癌癥的診斷和治療已有很大改進,但由于現有療法無法預防復發、腫瘤再發和轉移,許多實體瘤的總存活率仍基本保持不變。因此,開發更多靶向的且有效的療法仍是一個挑戰。
一個有前景的研究領域涉及使用靶向治療劑來追逐似乎造成許多癌癥的致瘤“種子”細胞。為此,現已知大部分實體組織含有組織固有的成人干細胞群體,其產生占該組織的大部分的分化細胞類型。在這些組織中產生的腫瘤類似地由也從干細胞產生、但其總體增殖和組織化明顯不同的異源細胞群體組成。雖然日益認識到大多數腫瘤細胞具有有限的增殖能力,但少數癌細胞群體(通常稱為癌癥干細胞或CSc)具有專有的廣泛自我更新能力,由此能使它們具有腫瘤重新起始能力。更具體地講,癌癥干細胞假說認為,每一腫瘤中存在獨特的細胞子集(即CSC)(約0.1-10%),其能夠無限自我更新并產生由于它們分化為腫瘤祖細胞且隨后分化為最終分化的腫瘤細胞而復制能力逐漸受限的腫瘤細胞。
近年來,已變得更加明顯的是,這些CSC(也稱為腫瘤永續細胞(tumor perpetuating cell)或TPC)可能對傳統的化學治療劑或放射具有更大的抗性,因而在護理標準臨床療法后繼續存在,隨后刺激復發性腫瘤、繼發性腫瘤和轉移瘤的生長。此外,越來越多的證據表明,調節器官發生和/或正常組織固有干細胞自我更新的途徑在CSC中失調或改變,從而導致自我更新癌細胞不斷擴張和腫瘤形成。一般參見Al-Hajj等人,2004,PMID:15378087;和Dalerba等人,2007,PMID:17548814;將這些參考文獻的每一者以引用的方式全文并入本文。因此,傳統的以及較新的靶向治療方法的有效性顯然受抗性癌細胞的存在和/或出現所限制,這類抗性癌細胞即使面對這些各式各樣的治療方法仍能夠延續癌癥。Huff等人,European Journal of Cancer(《歐洲癌癥雜志》)42:1293-1297(2006)以及Zhou等人,Nature Reviews Drug Discovery(《自然評論:藥物發現》)8:806-823(2009),將這些參考文獻每一者以引用的方式全文并入本文。這些觀察結果由當患有實體腫瘤時傳統減積劑(debulking agent)一直無法實質上提高患者存活率以及對腫瘤如何生長、復發和轉移的了解逐漸深入得到證實。因此,治療贅生性障礙的最新策略已認識到消除、消耗、沉默腫瘤永續細胞或促進其分化以降低腫瘤再發、轉移或患者復發的可能性的重要性。
開發這類策略的努力已整合了涉及非傳統異種移植(NTX)模型的最新工作,在所述模型中將原發性人實體腫瘤樣本專門植入免疫功能降低的小鼠中并進行繼代。這類技術證實存在具有產生異源腫瘤并無限刺激其生長的獨特能力的細胞亞群。如先前所假設,在NTX模型中進行的工作已證實,所鑒別的腫瘤細胞CSC亞群表現出對諸如化學療法和放射治療的減積方案具有更大的抗性,這潛在地解釋臨床響應率與總存活率之間的不一致。此外,在CSC研究中使用NTX模型已引起了藥物發現及候選藥物臨床前評價的根本變化,這個變化可產生對腫瘤再發和轉移具有重大影響從而改善患者存活率的CSC靶向療法。雖然已取得了進展,但與處理原發性和/或異種移植腫瘤組織相關的固有技術困難以及表征CSC特征及分化潛力的實驗平臺的缺乏構成重大的挑戰。因此,仍十分需要選擇性地靶向癌癥干細胞并開發可用于治療、預防和/或管理過度增殖障礙的診斷性、預防性或治療性化合物或方法。
技術實現要素:
這些及其他目標由本發明提供,本發明在廣泛意義上涉及可用于治療CD46相關障礙(例如過度增殖障礙或贅生性障礙)的方法、化合物、組合物和制品。為此,本發明提供有效靶向癌癥干細胞且可用于治療患有各種惡性腫瘤的患者的新型CD46調節劑。在某些實施例中,所公開的CD46調節劑可包含任何識別CD46多肽、其配體或其基因、與它們競爭、對它們進行激動、拮抗、與它們相互作用、與它們結合或與它們締合,并調節、調整、改動、改變或改善CD46蛋白對一個或多個生理學途徑的影響的化合物。在本發明的所選的實施例中,CD46調節劑可包含CD46自身或其片段,所述CD46自身或其片段呈分離形式或與其他部分融合或締合(例如Fc-CD46、PEG-CD46或與靶向部分締合的CD46)。在其他所選的實施例中,CD46調節劑可包含CD46拮抗劑,出于本申請案的目的,CD46拮抗劑應視為意指任何識別CD46、與其競爭、與其相互作用、與其結合或與其締合,并中和、消除、減少、敏化、重新程序化贅生性細胞(包括腫瘤起始細胞)、抑制或控制所述細胞生長的構建體或化合物。在優選的實施例中,本發明的CD46調節劑包含抗CD46抗體或其片段或衍生物,意外地發現其可沉默、中和、減少、降低、消耗、緩和、減弱、重新程序化、消除腫瘤起始細胞或者抑制其繁殖、維持、擴張、增殖贅生性細胞或以別的方式促進贅生性細胞存活、再發、再生和/或轉移的能力。
在一個實施例中,CD46調節劑可包含人源化抗體,其中所述抗體包含SEQ ID NO:199中所示的重鏈可變區氨基酸序列和SEQ ID NO:201中所示的輕鏈可變區氨基酸序列。在其他優選的實施例中,本發明將為包含hSC1.N71抗體和可藥用載體的組合物的形式。在另一個優選的實施例中,CD46調節劑可包含人源化抗體,其中所述抗體包含SEQ ID NO:203中所示的重鏈可變區氨基酸序列和SEQ ID NO:205中所示的輕鏈可變區氨基酸序列。在其他優選的實施例中,本發明將為包含hSC1.N149抗體和可藥用載體的組合物的形式。
在某些其他實施例中,本發明將包含在施用給受試者后降低腫瘤起始細胞出現率的CD46調節劑。優選地,出現率的降低將使用體外或體內有限稀釋分析來測定。在特別優選的實施例中,該分析可用體外有限稀釋分析來進行,其包括將活人腫瘤細胞移植進免疫功能降低的小鼠中。或者,有限稀釋分析可使用體外限制稀釋分析來進行,其包括將活人腫瘤細胞限制稀釋沉積于體外集落支持條件中。在任一種情況下,出現率降低的分析、計算或定量將優選包括使用泊松分布統計來提供精確計算。應當理解,雖然這類定量方法是優選的,但諸如流式細胞術或免疫組織化學之類的其他勞動密集度較小的方法也可用于提供所需的值,因此將它們明確地設想為處于本發明的范圍內。在這類情況下,出現率的降低可使用流式細胞檢測分析或對已知用于富集腫瘤起始細胞的腫瘤細胞表面標記物的免疫組織化學檢測來測定。
因此,在本發明的另一個優選的實施例中,包含治療CD46相關障礙的方法,該方法包括向有需要的受試者施用治療有效量的CD46調節劑,由此降低腫瘤起始細胞的出現率。此外,腫瘤起始細胞出現率的降低將優選使用體外或體內有限稀釋分析來測定。
就此而言,應當理解本發明至少部分基于如下發現:CD46多肽與涉及多種瘤形成(neoplasia)的病因的腫瘤永續細胞(即癌癥干細胞)締合。更具體地講,本專利申請意外地證明,施用多種例示性CD46調節劑可減少、抑制或消除腫瘤起始細胞的致瘤信號傳導(即降低腫瘤起始細胞出現率)。這種信號傳導減少,無論是通過減少或消除或重新程序化或沉默腫瘤起始細胞還是通過修飾腫瘤細胞形態(例如,誘導的分化、小生境破壞)實現,均繼而通過抑制致瘤、腫瘤維持、擴張和/或轉移和再發而更有效地治療CD46相關障礙。在其他實施例中,所公開的調節劑可干擾、抑制或以其他方式延緩CD46介導的可刺激腫瘤生長的信號傳導。另外,如下文更詳細論述的,CD46多肽密切涉及補體途徑。使用本文所述的新型CD46調節劑干預該途徑,可通過不止一種機制(即腫瘤起始細胞減少和補體破壞)進一步改善所述障礙以提供附加效應或協同增強效應。
因此,本發明的另一個優選的實施例包括治療有需要的受試者中的CD46介導的障礙的方法,所述方法包括向該受試者施用CD46調節劑的步驟。在尤其優選的實施例中,CD46調節劑將與抗癌劑締合(例如綴合)。此外,受試者腫瘤組織與正常的相鄰組織相比較,無論是表現出CD46水平升高還是CD46水平降低或受到抑制,都可實現這種破壞和附帶有益效果。
還應當理解,可以對本發明的CD46調節劑進行加工和選擇以與CD46分子的單種同種型(isoform)或所選的一些同種型(即剪接變體)反應,或者相反,可包括泛CD46調節劑,所述泛CD46調節劑可與CD46同種型中的一些或全部反應或締合。更具體地講,如本文所公開的以及下面實例中所述的,可生成優選的調節劑如抗體并對其進行選擇,使得它們可與單種剪接變體展現的結構域(例如,在特定的外顯子接合點處)反應,或與多種或全部CD46同種型中保守的結構域(例如外顯子1-6)反應。這對于本發明是重要的,因為如以下實例5中所示,某些剪接變體已被發現優選在TIC上表達,且可充當可提供致瘤細胞出現率的選擇性降低和/或癌癥干細胞群體的消耗的治療標靶。
因此,在一個所選的實施例中,本發明包括泛CD46調節劑。在其他所選的實施例中,本發明包括可免疫特異性地與一種或多種剪接變體締合的CD46調節劑。優選的是,所述剪接變體可選自CD46D、CD46F和CD46J。因此,在另外其他實施例中,本發明包括治療有需要的受試者的方法,該方法包括施用治療有效量的泛CD46調節劑。再其他的實施例包括治療有需要的受試者的方法,該方法包括施用治療有效量的可與一或多種剪接變體免疫特異性締合的CD46調節劑。
本發明的其他方面利用到所公開的調節劑潛在破壞多個致癌存活途徑而同時沉默腫瘤起始細胞的能力。這類多活性CD46調節劑(例如CD46拮抗劑)當與護理標準抗癌劑或減積劑組合使用時可證明尤其有效。另外,根據本發明教導,可組合使用兩種或更多種CD46拮抗劑(例如特異性結合CD46上的兩個分立表位的抗體)。此外,如下文相當詳細論述的,本發明的CD46調節劑可在綴合或未綴合狀態下且任選作為致敏劑與多種化學或生物學抗癌劑組合使用。
因此,本發明的另一優選的實施例包括敏化受試者的腫瘤以用抗癌劑進行治療的方法,該方法包括向該受試者施用CD46調節劑的步驟。在本發明的一個特別優選的方面,CD46調節劑將特異性地引起腫瘤起始細胞出現率降低,如使用體外或體內有限稀釋分析所測定的。
類似地,因為本發明的化合物可通過多種生理學機制發揮治療有益效果,所以本發明還涉及所選的經特定加工以利用某些細胞過程的效應劑或調節劑。例如,在某些實施例中,可對優選的調節劑進行工程改造以與腫瘤起始細胞表面上或附近的CD46締合并刺激受試者的免疫應答。在其它實施例中,調節劑可包含針對這樣的表位的抗體,該表位可中和CD46活性并增加腫瘤微環境中可影響信號傳導的CD46底物的濃度。在另外其他實施例中,所公開的調節劑可通過消耗或消除CD46相關細胞而起作用。因此,重要的是認識到,本發明并不限于任何特定作用模式,而是涵蓋任何能實現所需結果的方法或CD46調節劑。
在該框架內,所公開的實施例的優選實施例是涉及治療患有贅生性障礙的受試者的方法,該方法包括施用治療有效量的至少一種中和性CD46調節劑的步驟。
其他實施例涉及治療患有CD46相關障礙的受試者的方法,該方法包括施用治療有效量的至少一種消耗性CD46調節劑的步驟。
在又另一個實施例中,本發明提供維持療法的方法,其中在設計用于移除至少一部分腫瘤塊的初始程序(例如化療、放療或手術)后施用所公開的效應劑一段時間。這類治療方案可施用數周的時間、數月的時間或甚至數年的時間,其中CD46調節劑可預防性地起作用以抑制轉移和/或腫瘤再發。在另外其他實施例中,所公開的調節劑可與已知的減積方案配合施用以預防或延緩轉移。
除上述治療性用途外,還應當理解本發明的調節劑可用于診斷CD46相關障礙,尤其是過度增殖障礙。因此,一個優選的實施例包括診斷有需要的受試者中的過度增殖障礙的方法,該方法包括如下步驟:
a.從所述受試者獲得組織樣品;
b.使該組織樣品與至少一種CD46調節劑接觸;以及
c.檢測或定量與樣品締合的CD46調節劑。
結合本申請案可容易領悟這類方法,且容易使用諸如自動讀板儀、專用報告系統等之類的一般可用的商業技術來進行這類方法。在其他優選的實施例中,該檢測或定量步驟將包括腫瘤起始細胞出現率的降低以及對其的檢測。此外,有限稀釋分析可如先前上文所提及進行,且將優選使用泊松分布統計來提供關于出現率降低的精確計算。
類似地,本發明還提供可用于診斷和監測諸如癌癥之類的CD46相關障礙的試劑盒。為此,本發明優選提供可用于診斷或治療CD46相關障礙的制品,該制品包括含有CD46調節劑的容器和關于使用所述CD46調節劑治療或診斷該CD46相關障礙的說明書。
本發明的其他優選的實施例也利用所公開的調節劑的性質,作為可用于通過諸如熒光激活細胞分選(FACS)或激光介導的分區(laser mediated sectioning)之類的方法對腫瘤起始細胞的群體或亞群進行鑒別、分離、分區或富集的手段。
因此,本發明的另一個優選的實施例涉及對腫瘤起始細胞群體進行鑒別、分離、分區或富集的方法,該方法包括使所述腫瘤起始細胞與CD46調節劑接觸的步驟。
上文為概述,因此必然簡化、概括和省略細節;因此,本領域技術人員應了解,該概述僅是示例性的而并非意圖以任何方式限制。本文所述的方法、組合物和/或裝置和/或其他主體的其他方面、特征和優點將在本文所述的教導中變得顯而易見。提供該概述來以簡化形式介紹下文在“具體實施方式”中進一步描述的一系列概念。該概述既無意于確定要求保護的主題的關鍵特征或基本特征,也無意于用于輔助判定要求保護的主題的范圍。
附圖說明
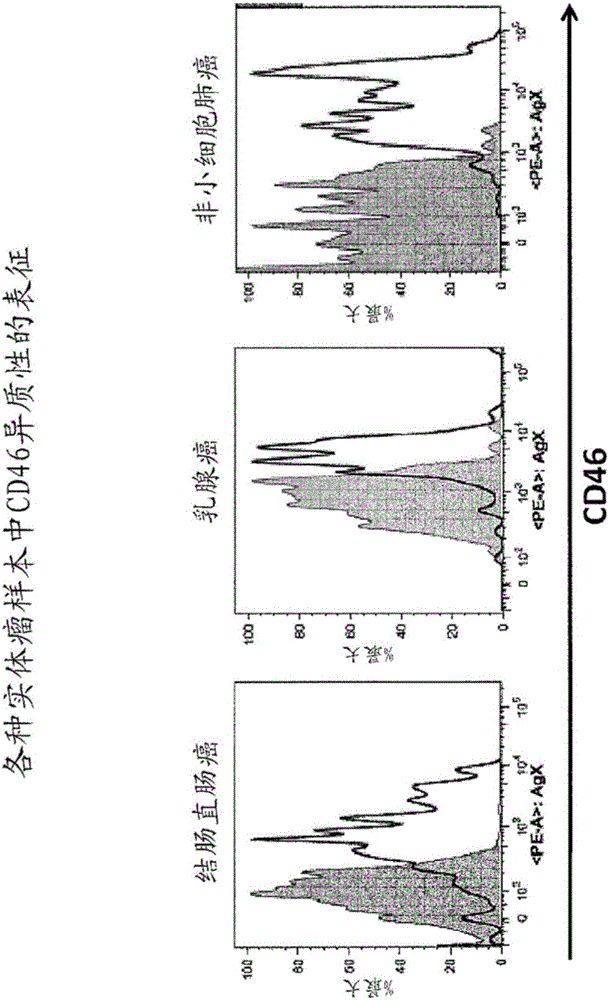
圖1A和1B分別繪出了來自直腸結腸癌患者、乳腺癌患者或非小細胞肺癌患者的實體瘤樣本上的CD46表達的流式細胞術數據(圖1A)和來自結腸直腸癌細胞、胰腺癌細胞、乳腺癌細胞、非小細胞肺癌細胞、骨髓癌細胞、卵巢癌細胞和頭頸部癌細胞的源于患者的非傳統異種移植腫瘤樣本上的CD46表達的流式細胞術數據(圖1B)。
圖2提供了散點圖,示出了使用細胞表面標記CD46、上皮表面抗原(ESA)、CD66c和CD324對腫瘤起始細胞的流式細胞術富集;
圖3A-C示出了流式細胞術和熒光激活細胞分選(FACS)數據,通過在非傳統異種移植模型中進行系列繼代證明了CD46hi細胞的腫瘤永續能力;
圖4A-C圖示了伊立替康對CD46hi腫瘤永續細胞在結腸直腸癌中的出現率的影響;
圖5A-C示出了結腸直腸癌腫瘤永續細胞、腫瘤祖細胞和非致瘤細胞中的CD46剪接變體同種型表達;
圖6示出了定量實時PCR數據,其說明了本體結腸直腸腫瘤細胞群體中的CD46外顯子用法;
圖7A-C是分別顯示結腸直腸正常相鄰細胞和腫瘤細胞中的CD46蛋白的表達(圖7A)、神經內分泌亞型和非神經內分泌亞型的胰腺正常相鄰細胞和腫瘤細胞中的CD46蛋白的表達(圖7B)以及卵巢正常相鄰細胞和腫瘤細胞中的CD46蛋白的表達(圖7C);
圖8A-C是示出了含有外顯子10的CD46剪接變體分別在如下細胞中的表達的示意圖:結腸直腸正常相鄰細胞和腫瘤細胞(圖8A)、神經內分泌亞型和非神經內分泌亞型的胰腺正常相鄰細胞和腫瘤細胞(圖8B)以及卵巢正常相鄰細胞和腫瘤細胞(圖8C);
圖9A和9B示意圖說明了CD46抗體內化進K562細胞中(圖9A)并通過能夠內化與皂草素毒素綴合的抗小鼠二抗的小鼠單克隆抗CD46抗體殺滅K562細胞(圖9B);
圖10A-R提供了十八種分立的抗CD46抗體的重鏈和輕鏈可變區的核酸和氨基酸序列,所述抗CD46抗體如本文實例中所描述進行分離和克隆;
圖11A和11B是表格形式的圖示,分別示出了如本文實例中描述分離和克隆的十八種分立CD46調節劑的遺傳排列方式及如Chothia等人定義的重鏈和輕鏈CDR序列;
圖12A和12B圖示了ELISA數據,顯示了抗CD46抗體SC1.N122和SC1.N29與CD46的各區域的結合(圖12A)以及抗CD46抗體SC1.N29與各CD46外顯子的結合(圖12B);
圖13A和13B分別示出了hSC1.N71的重鏈可變區的核酸和氨基酸序列(SEQ ID NO:198和SEQ ID NO:199)和輕鏈可變區的核酸和氨基酸序列(SEQ ID NO:200和SEQ ID NO:201)(圖13A)以及hSC1.N149的重鏈可變區的核酸和氨基酸序列(SEQ ID NO:202和SEQ ID NO:203)和輕鏈可變區的核酸和氨基酸序列(SEQ ID NO:204和SEQ ID NO:205),其中如Kabat等人定義的CDR序列標有下劃線;
圖14以表格形式提供了十二種分立CD46調節劑的免疫化學特性;
圖15A-15C示出了鼠抗體SC1.N71(圖15A)和人源化抗體衍生物hSC1.N71(圖15B)對四個不同濃度的抗原的親和力測量結果,并提供了表格形式的總結,包括測量值(圖15C);
圖16A和16B分別示出了使用所公開的調節劑產生的標準曲線和在從健康受試者和患有各種瘤形成的患者獲得的樣品中測量并從標準曲線外推得到的可溶性CD46的血漿濃度;
圖17是描繪所公開的CD46調節劑充當靶向劑的能力的圖示,其通過使用與皂草素綴合的鏈霉親和素介導細胞死亡。
圖18A和18B示出了所公開的CD46調節劑與細胞表面上表達的CD46締合的能力(圖18A)以及介導CD46hi細胞的細胞死亡的能力,同時慢病毒誘導的CD46-/lo相對免疫(圖18B);
圖19A和19B顯示本發明的CD46調節劑可介導鏈霉親和素-ZAP綴合物的受體依賴的攝入和內化,其中在不存在調節劑時觀察到相對低的殺滅(圖19A),并且顯示所公開的調節劑有效介導在不同腫瘤類型中的殺滅(圖19B);以及
圖20A和20B示出了CD46調節劑使癌癥干細胞化學致敏的能力,其中圖20A示出了所公開的調節劑與對照相比的效果,圖20B證明與單獨的化學療法相比CD46調節劑可延緩腫瘤再發以及延長無進展生存期。
具體實施方式
I.引言
在廣泛意義上,本發明的實施例涉及新型CD46調節劑及其在治療、管理、改善過度增殖障礙(包括癌癥)或預防過度增殖障礙(包括癌癥)的發生中的用途。不希望受任何特定理論的束縛,已發現所公開的調節劑可有效減少或延緩腫瘤生長以及消除或中和致瘤細胞以及改變這類細胞對抗癌劑的敏感性。另外,還令人驚奇地發現,所選的腫瘤永續細胞(TPC)與稱為CD46的蛋白質之間還存在迄今未知的表型關聯。就這一點而言,已經發現,當與正常組織比較時以及當與一起構成實體瘤的大部分的腫瘤祖細胞(TProg)和非致瘤(NTG)細胞比較時,所選的TPC(即癌癥干細胞或CSc)可表達升高水平的CD46,包括特異性剪接變體。因而,在所選的實施例中,CD46包含腫瘤相關標記物(或抗原)且已發現可提供這樣的物質,該物質能有效用于檢測、敏化和/或抑制TPC以及由與所選的細胞的表面相關的或腫瘤微環境中的該蛋白質水平升高所引起的相關瘤形成。更具體地講,甚至更出人意料地,鑒于CD46被明顯分泌(至少在一定程度上),已進一步發現CD46調節劑(包括Fc-CD46構建體和免疫反應性拮抗劑(如該蛋白質的抗體))可用于在患者中消耗、敏化、消除、減少、重新程序化這些腫瘤永續細胞、促進其分化或以別的方式阻止或限制其擴散和/或繼續刺激腫瘤生長或再發的能力。
在優選的實施例中,本發明的CD46調節劑將包含核苷酸、寡核苷酸、多核苷酸、肽或多肽。如上文提及和下文更詳細論述的,本文公開的所選的實施例將包含CD46的綴合或非綴合形式的抗體。CD46調節劑的其他實施例將優選包含CD46或其形式、變體、衍生物或片段,包括例如CD46融合構建體(如CD46-Fc、CD46-靶向部分等)或CD46-綴合物(如CD46-PEG、CD46-細胞毒性劑等)。在另外其他實施例中,調節劑可在遺傳水平上起作用且可包含如反義構建體、siRNA、miRNA等之類的化合物。上述CD46調節劑可通過競爭機理、激動或拮抗所選的途徑或者消除或消耗特定細胞(包括非TPC支持細胞)來削弱腫瘤永續細胞的生長、增殖或存活和/或相關瘤形成,這例如取決于CD46的形式或者給藥形式(dosing)及遞送方法。
根據這些發現,本領域的技術人員將理解,本發明特別優選的實施例很大程度上涉及CD46調節劑及它們在降低腫瘤起始細胞出現率中的用途。如本文中將充分論述的,與本發明相容的CD46調節劑廣泛包括任何與CD46締合、結合、復合或以別的方式反應或競爭且任選地導致腫瘤永續細胞出現率降低的化合物。本文所公開的例示性調節劑包含核苷酸、寡核苷酸、多核苷酸、肽或多肽。在某些優選的實施例中,所選的調節劑將包含CD46的抗體或其免疫反應性片段或衍生物。這種抗體可以是本質上是拮抗性的或激動性的。在其他優選的實施例中,與本發明相容的效應劑將包含CD46構建體,該構建體包含CD46本身或其反應性片段。應了解,這類CD46構建體可包含融合蛋白且可包括來自其他多肽(例如免疫球蛋白、釘肽(stapled peptide)或生物應答修飾劑)的反應性結構域。在另外其他的優選方面,CD46效應劑或調節劑將包含在基因組水平上發揮所需效應的核酸組件。與本發明教導相容的另外其他調節劑將在下文詳細論述。
在一個相關方面,下文的論述是關于CD46調節劑、CD46拮抗劑和抗CD46抗體。雖然下文提供每個術語的更詳細定義,但應當理解,這些術語對于本公開的目的在很大程度上是可互換的,而不應當狹義地解釋,除非上下文中指明。例如,如果對CD46拮抗劑表達一種看法,則其也適用于本發明的那些恰巧是拮抗性的抗體。相似地,術語CD46調節劑明確包括所公開的CD46拮抗劑和抗CD46抗體,且對后者的提及也適用于調節劑,除非上下文排除這個適用。
II.CD46
CD46也稱為膜輔因子蛋白或MCP。它是廣泛表達的I型跨膜蛋白,但由于選擇性外顯子剪接和糖基化而具有多種同種型。最近Karosi等人,Laryngoscope(《喉鏡》)118:1669-1676(2008年9月)報道檢測了該分子的十四種同種型,將該文獻以引用的方式全文并入本文。從位于染色體1q32的單個基因轉錄出mRNA并經歷廣泛的選擇性剪接而產生編碼多種蛋白質同種型的多個轉錄物。構成該基因的14個外顯子中,看起來外顯子1-6是所有CD46蛋白同種型中保守的,而外顯子7至9編碼以不同程度被利用的富含絲氨酸-蘇氨酸-脯氨酸(“STP”)的區域,從而引起這些蛋白質同種型中的主要超可變性。外顯子11和12編碼CD46的跨膜區,而外顯子13和14編碼該蛋白質的胞質內尾部。最長的mRNA轉錄物即變體A(NM_002389)含有來自該基因全部十四個外顯子的序列。據信外顯子7、8、9和13的可變剪接產生CD46的十四種同種型中的大多數,其中主要觀察到的66和56kDa的蛋白質同種型因選擇性包括或不包括外顯子8而形成。選擇性地包括/不包括外顯子13可導致該分子的胞質內尾部的編碼序列的改變,這提示這些改變會影響該蛋白質的亞細胞運輸、穩定性以及信號傳導性質。
如Karosi等人中所述,CD46mRNA同種型D包含CD46基因的外顯子1-6、8-12和14(等同于序列NM_153826,其編碼蛋白質NP_722548),同種型F包含外顯子1-6、9-12和14(等同于序列NM_172353,其編碼NP_758863),同種型J包含外顯子1-6、8、10-12和14(等同于序列NM_172356,其編碼NP_758866)。更具體地講,CD46分子包含四個N末端短共有重復序列(SCR)模塊(“Sushi”結構域:4個半胱氨酸,呈1-3,2-4鍵拓撲結構),其中這些SCR結構域由該基因的前六個外顯子編碼。SCR2、3和4模塊具有C3b/C4b結合和調節活性(下文中論述),而SCR1模塊和SCR4末端序列對于補體調節功能不是必需的。由選擇性利用的外顯子7-9以及外顯子10編碼的近膜的細胞外序列被大量糖基化,主要通過O-連接碳水化合物糖基化。
為了本公開的目的,術語“CD46”應視為意指上文剛說明的任何蛋白質,包括任何剪接變體或其免疫反應性片段以及任何編碼這類蛋白質、剪接變體或片段的核酸序列,除非上下文另外指出。因而,如本文中所論述的,“CD46標記物”應廣泛地包括任何構成或編碼CD46的可檢測的蛋白質、肽或核酸序列。在優選的實施例中,CD46標記物將包含全長糖蛋白(變體a)或其剪接變體或免疫反應性片段。甚至更優選地,CD46蛋白標記物將存在于所選的致瘤細胞群體的細胞表面。在其他優選的實施例中,CD46標記物將包含編碼全長CD46、其剪接變體或片段的核酸序列(如DNA或mRNa)。
就上述變體而言,還應當理解,可以對本發明的CD46調節劑進行加工和選擇以與CD46分子的單種同種型(即剪接變體)或所選的一些同種型反應,或者相反,可包括泛CD46調節劑,所述泛CD46調節劑可與CD46同種型中的一些或全部反應或締合。更具體地講,如本文所公開的以及下面實例中所述的,可生成所公開的調節劑如抗體并對其進行選擇,使得它們與單種剪接變體展現的結構域(例如,在特定的外顯子接合點處)反應或與多種或全部CD46同種型中保守的結構域(例如外顯子1-6)反應。這對于本發明是重要的,因為如以下實例5中所示,某些剪接變體已被發現優選在TIC上表達,且可充當可提供致瘤細胞出現率的選擇性降低和/或癌癥干細胞群體的消耗的治療標靶。
在任何情況下,已將多種生物學功能歸因于CD46,其中許多涉及免疫系統的調節。CD46的一個主要免疫調節功能涉及調節補體以保護宿主細胞免受作為高等真核生物先天性免疫應答的一部分的補體蛋白的損害。具體地講,CD46是因子I所介導的補體蛋白C3b和C4b的蛋白水解切割的輔因子。已證實其可活化C3轉化酶(將C3b切割成無活性片段的分子),從而防止不當的補體活化。除了其在先天性免疫中的作用外,CD46還調節獲得性免疫應答。通過CD46進行的信號傳導會引起T細胞的增殖,以及向特定類別的調節性T細胞(稱為Tr1)的分化,以產生大量的IL-10(一種抗炎細胞因子)為特征。此外,由于精子表達高水平的CD46,已提出CD46參與繁殖,也許是參與精子與卵母細胞的融合。CD46還似乎在胎盤中高度表達,且可起到保護胎兒免受母體的免疫排斥的作用。
還進一步證實CD46在大多數正常人細胞上遍在表達,紅細胞例外。例如,有報道稱在上皮細胞中強表達,在淋巴細胞和內皮細胞中適度表達,在其他細胞如破骨細胞、骨細胞、間質細胞和肌肉細胞中弱表達。由于其普遍表達,多種人病原體已進化出策略來利用CD46作為受體或共受體用于與細胞結合作為感染的前體。這些病原體包括人皰疹病毒6、麻疹病毒、腺病毒的一些血清型和來自奈瑟氏菌屬(Neisseria)家族的共生菌的致病種。某些逆轉錄病毒據信可通過在其表面上帶有CD46模擬物來規避補體介導的免疫(Stoiber等人,Molecular Immunology(《分子免疫學》)2005;Saifuddin等人,J Gen Virol(《普通病毒學雜志》),1997)。
還已將CD46與多種疾病相關聯,包括自體免疫障礙如多發性硬化癥(MS)。MS是一種慢性炎性疾病,其中自體免疫應答攻擊隔離神經元軸突的髓鞘蛋白,導致髓鞘脫失和隨后這些細胞傳導受損,結果是神經紊亂和缺陷。MS會導致腦和脊髓的白質的結疤(硬化)。它是一種復雜的疾病,病因錯綜復雜,由免疫、遺傳和環境因素構成,盡管已探索了數種機理,但對MS發病機制的理解還遠未完成。由于CD46在調節T細胞免疫和炎癥中的作用,因此據信其參與MS發病機制。更具體地講,最近的數據已證實,CD46在多發性硬化癥中欠缺或受損,在這些患者中IL-10的產生受到嚴重削弱。這個L-10的產生的缺少可能參與在多發性硬化癥患者中觀察到的炎癥(A.L.Astier,Immunology(《免疫學》),2008年6月;124(2):149–154,將其以引用的方式并入本文)。在一些情形中,有可能是自身反應性抗CD46抗體在損害該分子的正常功能。在這些抗體充當調節劑(如本發明描述的那些調節劑)的意義上,它們在本發明的范圍內并因此可以使用。
CD46除了存在于正常細胞上以外,其在某些癌癥中的表達水平可能升高。例如,已報道在如下癌癥中CD46表達升高:乳腺癌(Thorsteinsson等人,APMIS 106:869-78(1998);Hofman等人,Breast Cancer Res.Treat.(《乳腺的研究和治療》)32:213-9(1994));結腸/結腸直腸癌(Andrew等人,Cancer Res.(《癌癥研究》)50:5225-30(1990);Koretz等人,Br.J.Cancer(《英國癌癥雜志》)68:926-31(1993);Juhl等人,J.Surg.Oncol.(《外科腫瘤學雜志》)64:222-30(1997);Bjorge等人,Cancer Immunol.Immunother.(《癌癥免疫學及免疫療法》)42:185-92(1996));肺癌(Varsano等人,Clin.Exp.Immunol.(《臨床和實驗免疫學》)113:173-82(1998);Varsano等人,Am.J.Respir.Cell.Mol.Bioi.(《美國呼吸系統細胞和分子生物學雜志》)19:522-9(1998));卵巢癌(Bjorge等人,Int.J.Cancer(《國際癌癥雜志》)70:14-25(1997));腎癌(Blok等人,Lab.Invest.(《實驗室研究》)80:335-44(2000);Gorter等人,Lab.Invest.(《實驗室研究》)74:1039-49(1996));胰腺癌(Juhl等人,J.Surg.Oncol.(《外科腫瘤學雜志》)64:222-30(1997));和前列腺癌(Jarvis等人,J.Allergy Clin.Immunol(《過敏癥與臨床免疫學雜志》)99(NO.I,PART 2):S215(1997);Liu,Cancer Res.(《癌癥研究》)60:3429-3434(2000));還可參見PCT WO 02/18948;PCT WO 01/88537。
自從對該蛋白首次描述時,就已生產了CD46的多種抗體。這些抗體包括:E4.3(CD46-SCR1),Sparrow等人,Hum Immunol(《人類免疫學》)1983 7:1;M177(CD46-SCR2),Seya等人,J Immunol(《免疫學雜志》)1990 145:238;J4/48(CD46-SCR1),Pesando等人,J Immunol(《免疫學雜志》)1986 137:3689;GB24(CD46-SCR3/4),Hsi等人,Am J Reprod Immunol Microbiol(《美國生殖免疫學和微生物學雜志》)1988 18:21;H316(CD46-SCR1),Stern等人,J Immunol(《免疫學雜志》)1986 137:1604;MH61(CD46-SCR3),Okabe等人,Fertil Steril(《生育與不育》)1990 54:1121;TRA-2-10(CD46-SCR1),Cho等人,Clin Exp Immunol(《臨床和實驗免疫學》)1991 83:257;MCI20.6(CD46-SCR1),Naniche等人,J Virol(《病毒學雜志》)1993 67:6025;158.2A5,Vilella等人;197.2B1,Vilella等人;和MPA7,美國專利No.7,744,878,將上述參考文獻每一者以引用方式并入本文。一般參見Loveland等人,Prot Rev,網址為:http://prow.nci.nih.gov/guide/2027814670_g.htm。對于上述列表中的許多抗體,提供了反應性短共同重復結構域(SCR)。
III.腫瘤起始細胞
與現有技術的任何教導形成對比的是,本發明提供尤其可用于靶向腫瘤起始細胞以及特別是腫瘤永續細胞,從而有利于治療、管理或預防贅生性障礙的CD46調節劑。更具體而言,如先前所指出,已意外地發現,特定腫瘤細胞亞群表達CD46且很可能修改對癌癥干細胞自我更新及細胞存活很重要的形態發生素信號傳導的局部協調(localized coordination)。因此,在優選的實施例中,根據本發明的教導CD46的調節劑可用于降低腫瘤起始細胞出現率,從而有利于治療或管理過度增殖性疾病。
如本文中所使用,術語腫瘤起始細胞(TIC)涵蓋腫瘤永續細胞(TPC;即癌癥干細胞或CSC)與高度增殖性腫瘤祖細胞(稱為TProg)二者,其通常一起構成本體腫瘤或腫塊的獨特亞群(即0.1-40%)。出于本發明的目的,術語腫瘤永續細胞和癌癥干細胞是等同的且可在本文中互換使用。另一方面,TPC與TProg不同,因為其可完全重演存在于腫瘤內的腫瘤細胞的組成,且如通過連續移植(經由小鼠繼代兩次或兩次以上)低數目的分離細胞所證實的,具有無限制自我更新能力。如下文將更詳細論述的,使用適當細胞表面標記物的熒光活化細胞分選(FACS)為一種分離高度富集細胞亞群(>99.5%純度)的可靠方法,其至少部分歸因于其區分單細胞與細胞團(即成對細胞等)的能力。使用這類技術已證實,當將低細胞數目的高度純化TProg細胞移植進免疫功能降低小鼠中時,其可刺激初次移植物中腫瘤生長。然而,不同于經純化的TPC亞群,TProg產生的腫瘤并不完全反映親本腫瘤的表型細胞異質性且在重新起始后續移植物中的連續致瘤方面明確無效。相比的下,TPC亞群完全重構親本腫瘤的細胞異質性且當連續分離和移植時可有效起始腫瘤。因此,本領域技術人員會認識到,盡管TPC與TProg二者均可在初次移植物中產生腫瘤,但二者之間的明確差異在于TPC具有在以低細胞數目連續移植后持久刺激異源腫瘤生長的獨特能力。表征TPC的其他常見方法涉及形態、細胞表面標記物的檢查、轉錄譜和藥物反應,不過標記物表達可隨培養條件和體外細胞系繼代而變。
因此,出于本發明的目的,像支持正常組織中的細胞層次的正常干細胞一樣,腫瘤永續細胞優選由其無限自我更新而同時維持多譜系分化潛能的能力來限定。因此,腫瘤永續細胞能夠產生致瘤子代(即腫瘤起始細胞:TPC和TProg)和非致瘤(NGT)子代二者。如本文所使用,非致瘤細胞(NGT)是指由腫瘤起始細胞產生、但自身不能自我更新或產生構成腫瘤的腫瘤細胞異質譜系的腫瘤細胞。在實驗上,NTG細胞不能在小鼠中可再現地形成腫瘤,即使是在以過量細胞數目移植時也不能。
如所指出,TProg由于其有限的在小鼠中產生腫瘤的能力而被歸類為腫瘤起始細胞(或TIc)。TProg為TPC的子代且通常能夠進行有限次數的非自我更新細胞分裂。此外,TProg細胞可進一步分裂成早期腫瘤祖細胞(ETP)和晚期腫瘤祖細胞(LTP),其每一者均可由表型(例如細胞表面標記物)和重演腫瘤細胞架構的不同能力來區分。盡管存在這類技術性差異,但ETP和LTP二者在功能上也與TPC不同,因為它們當以低細胞數目移植時其一般不太能夠連續重構腫瘤,且它們通常不反映親本腫瘤的異質性。雖然存在上述區別,但也已證實各種TProg群體在極少數情況下可獲得通常歸于干細胞的自我更新能力且自身變成TPC(或CSC)。在任何情況下,兩種類型的腫瘤起始細胞均很可能在單個患者的典型腫瘤塊中呈現,且用如本文所公開的調節劑進行治療。也就是說,不管在腫瘤中所呈現的特定實施例或混合體(mix)如何,所公開的組合物一般可有效降低這類CD46陽性腫瘤起始細胞的出現率或改變其化學敏感性。
在本發明的上下文中,與構成腫瘤本體的TProg(ETP和LTP二者)、NTG細胞和浸潤腫瘤的非TPC來源細胞(例如成纖維細胞/基質細胞、內皮細胞和造血細胞)相比,TPC更具致瘤性,相對更靜止且通常更具化學抗性。鑒于常規療法和方案在很大程度上已被設計成既使腫瘤減積又攻擊快速增殖的細胞,TPC很可能比增殖較快的TProg和其他本體腫瘤細胞群體對常規療法和方案更具抗性。此外,TPC常常表達使其對常規療法具有相對化學抗性的其他特征,例如多重抗藥性轉運蛋白的表達增加、DNA修復機制增強和抗凋亡蛋白增強。這些性質(每一者均有助于TPC的耐藥性)構成標準腫瘤學治療方案無法確保大部分晚期瘤形成患者長期受益的關鍵原因;即無法充分地靶向以及去除那些刺激持續腫瘤生長和再發的細胞(即TPC或CSc)。
不同于許多上述現有技術的治療方案,不管所選的調節劑的形式或特異性標靶(例如遺傳物質、CD46或CD46配體)如何,本發明的新型組合物優選在施用給受試者后都降低腫瘤起始細胞的出現率。如上文所述,腫瘤起始細胞出現率的降低可因如下原因而發生:a)消除、消耗、敏化、沉默或抑制腫瘤起始細胞;b)控制腫瘤起始細胞的生長、擴張或再發;c)中斷腫瘤起始細胞的起始、繁殖、維持或增殖;或d)以其他方式阻礙致瘤細胞的存活、再生和/或轉移。在一些實施例中,腫瘤起始細胞出現率的降低因一個或多個生理學途徑的變化而發生。途徑的變化,無論是通過減少或消除腫瘤起始細胞還是通過修改其潛力(例如誘導的分化、小生境破壞)或以其他方式干擾其對腫瘤環境或其他細胞發揮影響的能力來實現的,均繼而使得可以通過抑制致瘤、腫瘤維持和/或轉移和再發而更有效地治療CD46相關障礙。
可用于評估這種腫瘤起始細胞出現率降低的方法包括體外或體內有限稀釋分析,優選隨后使用泊松分布統計進行計算,或評估預定的明確事件(例如能否在體內產生腫瘤)的出現率。雖然這種有限稀釋分析是計算腫瘤起始細胞出現率降低的優選方法,但其他要求較低的方法盡管精確度略小也可用于有效測定所需值,且完全與本文教導相符。因此,如本領域技術人員將理解的,通過熟知的流式細胞計數手段或免疫組織化學手段測定出現率值的降低也是可能的。對于所有上述方法,參見例如Dylla等人,2008,PMCID:PMC2413402&Hoey等人,2009,PMID:19664991;將上述參考文獻每一者以引用方式全文并入本文。
關于有限稀釋分析,腫瘤起始細胞出現率的體外計算可通過將分級分離或未分級分離的人腫瘤細胞(例如分別來自經處理和未經處理的腫瘤)沉積進能促進集落形成的體外生長條件中來完成。以此方式,集落形成細胞可通過對集落進行簡單計數和表征來計算,或通過由例如將人類腫瘤細胞的連續稀釋物沉積于板中并在平板接種后至少10天評定各孔是集落形成陽性還是陰性所組成的分析來計算。體內有限稀釋實驗或分析(一般而言其測定腫瘤起始細胞出現率的能力更精確)涵蓋例如將來自未經處理的對照或經處理的條件的人腫瘤細胞的連續稀釋物移植于免疫功能降低小鼠中,隨后在移植后至少60天評定各小鼠是腫瘤形成陽性還是陰性。通過體外或體內有限稀釋分析推導細胞出現率值,優選是通過將泊松分布統計應用于陽性和陰性事件的已知出現率,從而得出滿足陽性事件(在這個情況下分別為集落或腫瘤形成)定義的事件的出現率來進行。
關于與本發明相容的可用于計算腫瘤起始細胞出現率的其他方法,最常見方法包括可定量流式細胞計數技術和免疫組織化學染色程序。盡管不如上文剛剛描述的有限稀釋分析技術精確,但這些程序的勞動密集度小得多且可在相對短的時間范圍內提供合理的值。因此,應當理解,技術人員可使用利用一或多種抗體或試劑的流式細胞術細胞表面標記物譜測定,從而測量多種樣品的TIC水平,所述抗體或試劑可結合本領域公認的已知用于富集腫瘤起始細胞的細胞表面蛋白(例如下文實例1中所述的潛在相容的標記物)。在又一個相容的方法中,本領域技術人員可通過免疫組織化學計算原位(例如組織切片中)TIC出現率,其中所述免疫組織化學使用一種或多種能夠結合據信可區分這些細胞的細胞表面蛋白的抗體或試劑。
使用任一上文提及的方法于是有可能對根據本文教導由所公開的CD46調節劑提供的TIC(或其中的TPC)出現率的降低進行定量。在一些情況下,本發明的化合物可使TIC出現率降低(通過上文所述的多種機制,包括消除、誘導的分化、小生境破壞、沉默等)10%、15%、20%、25%、30%或甚至35%。在其他實施例中,TIC出現率的降低可為約40%、45%、50%、55%、60%或65%。在某些實施例中,所公開的化合物可使TIC的出現率降低70%、75%、80%、85%、90%或甚至95%。當然,應當理解TIC出現率的任何降低很可能會導致瘤形成(neoplasia)的致瘤性、持續性、再發性和侵襲性相應降低。
IV.CD46調節劑
在任何情況下,本發明涉及CD46調節劑(包括CD46拮抗劑)用于診斷、治療和/或預防多種CD46相關惡性腫瘤中的任一者的用途。所公開的調節劑可單獨使用或與多種抗癌化合物(例如化學治療劑或免疫治療劑或生物響應修飾劑)結合使用。在其他所選的實施例中,可將兩種或更多種分立的CD46調節劑組合使用以提供增強的抗贅生性作用或可用于制造多特異性構建體。
在某些實施例中,本發明的CD46調節劑將包含核苷酸、寡核苷酸、多核苷酸、肽或多肽。甚至更優選地,調節劑將包含可溶性CD46(sCD46)或其形式、變體、衍生物或片段,包括例如CD46融合構建體(如CD46-Fc、CD46靶向部分等)或CD46-綴合物(如CD46-PEG、CD46-細胞毒性劑、CD46-brm等)。還應當理解,在其他實施例中,CD46調節劑包含抗體(如抗CD46單克隆抗體)或其免疫反應性片段或衍生物。在尤其優選的實施例中,本發明的調節劑將包含中和抗體或其衍生物或片段。在其他實施例中,CD46調節劑可包含內化抗體。在另外其他實施例中,CD46調節劑可包含消耗性抗體。此外,與上述融合構建體一樣,這些抗體調節劑可與所選的細胞毒性劑、聚合物、生物響應修飾劑(BRM)或其類似物綴合、鍵聯或以其他方式締合以,提供具有各種(以及任選多種)作用機制的定向免疫療法。在另外其他實施例中,調節劑可在遺傳水平上起作用且可包含如反義構建體、siRNA、微RNA等諸如此類的化合物。
還應當理解,所公開的CD46調節劑可通過多種機制消耗或消除或抑制腫瘤細胞(尤其是TPC)的生長、繁殖或存活和/或相關瘤形成,包括激動或拮抗所選的途徑或消除特定細胞,這取決于例如CD46調節劑的形式、任何相關的有效負載或劑量和遞送方法。因此,雖然本文所公開的優選的實施例涉及消耗、抑制或沉默特定腫瘤細胞亞群(例如腫瘤永續細胞),但必須強調這類實施例僅為示例性的而不在任何意義上具有限制性。相反,如隨附權利要求書中所述的,本發明廣義地涉及CD46調節劑及其用于治療、管理或預防多種CD46介導的過度增殖性障礙的用途,不管任何具體機制或靶標腫瘤細胞群體。
在相同意義上,本發明所公開的實施例可包含一種或多種CD46拮抗劑。為此,應當理解,本發明的CD46拮抗劑可包含能識別CD46蛋白或其片段、與它們反應、與它們結合、與它們組合、與它們競爭、與它們締合或以其他方式與它們相互作用,且消除、沉默、減少腫瘤起始細胞或其他贅生性細胞(包括本體腫瘤或NTG細胞)、抑制、阻礙、制止或控制它們的生長的任何配體、多肽、肽、融合蛋白、抗體或其免疫活性片段或衍生物。在所選的實施例中,CD46調節劑包含CD46拮抗劑。
如本文中所使用的,拮抗劑是指這樣的分子,其能夠中和、阻斷、抑制、去除、降低或干擾特定或指定蛋白質的活性,包括受體與配體的結合或酶與底物的相互作用。更一般而言,本發明的拮抗劑可包含抗體及其抗原結合片段或衍生物、蛋白質、肽、糖蛋白、糖肽、糖脂、多糖、寡糖、核酸、反義構建體、siRNA、miRNA、生物有機分子、肽模擬物、藥劑以及它們的代謝物、轉錄和翻譯控制序列等等。拮抗劑也可包括小分子抑制劑、融合蛋白、受體分子及衍生物(它們特異性結合至蛋白質,從而隔離其與其底物標靶的結合)、蛋白質的拮抗性變體、針對蛋白質的反義分子、RNA適體以及針對蛋白質的核糖酶。
在本文所用且應用于兩個或更多個分子或化合物的術語“識別”或“特異性識別”應認為意指分子的共價或非共價反應、結合、特異性結合、組合、締合、相互作用、連接、鍵聯、聯合、聚結、合并或接合,從而一個分子對另一個分子施加影響。
此外,如本文實例中所證明的,人CD46的一些調節劑可在某些情況下與來自非人物種(如鼠類)的CD46發生交叉反應。在其他情況下,例示性的調節劑可對人CD46的一種或多種同種型具有特異性且不會表現出與來自其他物種的CD46直向同源物的交叉反應性。
在任何情況下,本領域的技術人員將理解,所公開的調節劑可以綴合或未綴合的形式使用。也就是說,調節劑可與藥物活性化合物、生物響應修飾劑、細胞毒性劑或細胞生長抑制劑、診斷部分或生物相容修飾劑締合或與它們綴合(例如以共價或非共價形式)。就此而言,應當理解這類綴合物可包含肽、多肽、蛋白質、融合蛋白、核酸分子、小分子、模擬劑、合成藥物、無機分子、有機分子和放射性同位素。此外,如上文所指出的,所選的綴合物可以各種摩爾比共價或非共價鍵聯至CD46調節劑,這至少部分取決于用來實現綴合的方法。
V.抗體
a.概述
如先前所提及的,本發明的尤其優選的實施例包括抗體形式的CD46調節劑。本文中的術語“抗體”以最廣泛意義使用且具體涵蓋合成抗體、單克隆抗體、寡克隆或多克隆抗體(polyclonal antibody)、多克隆抗體(multiclonal antibody)、重組產生的抗體、胞內抗體、多特異性抗體、雙特異性抗體、單價抗體、多價抗體、人抗體、人源化抗體、嵌合抗體、靈長源化抗體、Fab片段、F(ab')片段、單鏈FvFc(scFvFc)、單鏈Fv(scFv)、抗獨特型(抗-Id)抗體和任何其他免疫活性抗體片段,只要它們表現出所需生物活性(即CD46締合或結合)即可。在更廣泛意義上,本發明的抗體包括免疫球蛋白分子和免疫球蛋白分子的免疫活性片段,即含有抗原結合位點的分子,其中這些片段可與或不與另一免疫球蛋白結構域(包括但不限于Fc區或其片段)融合。此外,如本文更詳細地敘述的,術語“抗體”具體包括如下文所述的Fc變體,包括全長抗體和包含Fc區的變體Fc融合物或其片段,任選包含至少一個氨基酸殘基修飾且與免疫球蛋白的免疫活性片段融合。
如下文將更詳細論述的,通用術語“抗體”或“免疫球蛋白”包含五種不同類別的抗體,它們可以生物化學方法進行區分,且根據它們的重鏈恒定域的氨基酸序列可容易歸類為適當類別。出于歷史原因,完整抗體的主要類別稱為IgA、IgD、IgE、IgG和IgM。在人中,根據結構和某些生化性質,IgG類別和IgA類別可進一步分為公認的亞類(同種型),即IgG1、IgG2、IgG3、IgG4、IgA1和IgA2。應當理解,人中的IgG同種型按照其在血清中的豐度順序來命名,其中IgG1最豐富。
雖然所有五種類別的抗體(即IgA、IgD、IgE、IgG和IgM)和所有同種型(即IgG1、IgG2、IgG3、IgG4、IgA1和IgA2)以及其變異形式均在本發明的范圍內,但將僅出于示例的目的相當詳細地論述包含IgG類免疫球蛋白的優選實施例。然而應當理解,該公開內容僅說明例示性組合物和實施本發明的方法,而不以任何方式限制本發明或隨附權利要求書的范圍。
就此而言,人IgG免疫球蛋白包含兩條分子量為大約23,000道爾頓的相同多肽輕鏈和兩條分子量為53,000-70,000(取決于同種型)的相同重鏈。對應于不同類別抗體的重鏈恒定域分別由相應小寫希臘字母α、δ、ε、γ及μ表示。來自任何脊椎動物物種的抗體的輕鏈可根據其恒定域的氨基酸序列而歸屬于被稱為κ和λ的兩種明顯不同類型之一。本領域技術人員應當理解,不同類別免疫球蛋白的亞基結構和三維構型是眾所周知的。
該四條鏈以Y構型通過二硫鍵接合,其中輕鏈括住重鏈,重鏈在Y的開口開始且貫穿可變區到達Y的兩個末端。每條輕鏈通過一個共價二硫鍵鍵與重鏈連接,而鉸鏈區中的兩個二硫鍵接合重鏈。各個重鏈和輕鏈也具有規則間隔的鏈內二硫橋,其數目可根據IgG的同種型而變。
每條重鏈在一端具有可變域(VH),隨后是多個恒定域。每條輕鏈在一端具有可變域(VL)且在其另一端具有恒定域;輕鏈恒定域與重鏈的第一恒定域對齊,且輕鏈可變域與重鏈可變域對齊。就此而言,應當理解,輕鏈部分的可變域(VL)和重鏈部分的可變域(VH)二者決定抗原識別和特異性。相反,輕鏈恒定域(CL)和重鏈恒定域(CH1、CH2或CH3)賦予并調節重要的生物學性質,如分泌、經胎盤運動性(transplacental mobility)、循環半衰期、補體結合等等。按照慣例,恒定區結構域的編號隨著其逐漸遠離抗體的抗原結合位點或氨基末端而增加。因此,抗體的氨基末端或N端構成可變區,羧基末端或C端構成恒定區。因此,CH3域和CL域實際上分別包含重鏈和輕鏈的羧基末端。
術語“可變”是指這樣的事實:在各種免疫球蛋白當中,可變域的某些部分在序列上相差很大,并且這些熱點(hot spot)在很大程度上限定了特定抗體的結合和特異性特征。這些高變位點自身表現于分別在輕鏈和重鏈可變域二者中的三個稱為互補決定區(CDR)的區段中。在CDR旁側的可變域的更高保守性部分稱為構架區(FR)。更具體地講,在天然存在的單體IgG抗體中,抗體每個臂上存在的六個CDR為短的非鄰接氨基酸序列,這些氨基酸在抗體在含水環境中呈現其三維構型時經專門定位而形成抗原結合位點。
構成重鏈和輕鏈可變域的其余部分的構架區在氨基酸序列方面顯示較小的分子間可變性。相反,構架區主要采取β片層(β-sheet)構象,且CDR形成連接β片層結構并在一些情況下構成β片層結構的一部分的環(loop)。因此,這些構架區起到形成可使六個CDR通過鏈間非共價相互作用以正確取向進行定位的骨架(scaffold)的作用。由經定位的CDR形成的抗原結合位點限定與免疫反應性抗原(即CD46)上的表位互補的表面。這個互補表面能促進抗體與免疫反應性抗原表位的非共價結合。應當理解,CDR的位置可容易由本領域普通技術人員鑒別。
如下文更詳細論述的,重鏈和輕鏈可變區的全部或部分可使用標準的重組和表達技術進行重組或工程改造以提供有效的抗體。也就是說,來自第一抗體的重鏈或輕鏈可變區(或其任何部分)可與來自第二抗體的重鏈或輕鏈可變區的任何選定部分混合和匹配。例如,在一個實施例中,包含第一抗體的三個輕鏈CDR的整個輕鏈可變區可與包含第二抗體的三個重鏈CDR的整個重鏈可變區配對以提供有效抗體(operative antibody)。此外,在其他實施例中,可將來源于各種抗體的單獨重鏈和輕鏈CDR混合和匹配以提供具有優化的特征的所需抗體。因此,例示性抗體可包含來自第一抗體的三個輕鏈CDR、來源于第二抗體的兩個重鏈CDR和來自第三抗體的第三重鏈CDR。
更具體地講,在本發明的內容中,應當理解可根據本發明教導將圖11B中所公開的重鏈和輕鏈CDR中的任一者以這個方式重新排列以提供優化的抗CD46(如抗CD46)抗體。
在任何情況下,互補決定區殘基編號可定義為Kabat等人(1991,NIH出版號91-3242,弗吉尼亞州斯普林菲爾德的美國國家技術信息服務局(National Technical Information Service,Springfield,Va.))的那些編號,具體而言,輕鏈可變域中為殘基24-34(CDR1)、50-56(CDR2)和89-97(CDR3),重鏈可變域中為31-35(CDR1)、50-65(CDR2)和95-102(CDR3)。注意,各CDR在抗體之間差別很大(且根據定義不會表現出與Kabat共有序列具有同源性)。構架殘基的最大比對通常需要在編號系統中插入間隔殘基才能用于Fv區。另外,任何給定的Kabat位點編號處的某些單獨殘基的種類(identity)可因物種間或等位基因分歧而在抗體鏈之間有差異。另參見Chothia等人,J.Mol.Biol.(《分子生物學雜志》)196:901-917(1987)以及MacCallum等人,J.Mol.Biol.(《分子生物學雜志》)262:732-745(1996),其中定義包括彼此比較時氨基酸殘基的重疊或子集。上述參考文獻中的每一者以引用的方式全文并入本文中,并且示出涵蓋上面所引用的參考文獻每一者所定義的CDR的氨基酸殘基以供比較。
CDR定義
1殘基編號是按照Kabat等人(出處同上)的命名法
2殘基編號是按照Chothia等人(出處同上)的命名法
3殘基編號是按照MacCallum等人(出處同上)的命名法
出于便利的目的,圖11B中所示的CDR是使用Chothia等人的命名法定義,但根據本申請案的內容,本領域技術人員可容易鑒別和計算每一各別重鏈和輕鏈序列的由Kabat等人或MacCallum等人所定義的CDR。就此而言,將Kabat等人所定義的CDR用于實例16中所述的人源化分析,在描繪人源化抗體序列的圖13A和13B中加下劃線表示。因此,將包含由所有這類命名法定義的CDR的抗體明確地包括在本發明的范圍內。更廣泛而言,術語“可變區CDR氨基酸殘基”包括用上述任何基于序列或結構的方法所鑒別的CDR中的氨基酸。
如本文所用的,術語“可變區構架(FR)氨基酸殘基”是指Ig鏈的構架區中的那些氨基酸。如本文所用的,術語“構架區”或“FR區”包括作為可變區的一部分、但非CDR(如使用CDR的Kabat定義)的一部分的氨基酸殘基。因此,可變區構架為長度在約100-120個氨基酸之間的非鄰接序列,但僅包括CDR外的那些氨基酸。
對于重鏈可變區的特定實例和對于Kabat等人所定義的CDR,構架區1對應于可變區中包涵氨基酸1-30的結構域;構架區2對應于可變區中包涵氨基酸36-49的結構域;構架區3對應于可變區中包涵氨基酸66-94的結構域,而構架區4對應于可變區中自氨基酸103至可變區末端的結構域。輕鏈構架區類似地由各輕鏈可變區CDR分隔。類似地,使用Chothia等人或McCallum等人的CDR定義,構架區邊界由上文所述的各自CDR末端分隔。
銘記上述結構考慮因素,本領域技術人員應當理解,本發明的抗體可包含多種功能實施例中的任一者。就此而言,相容性抗體可包含任何在受試者中提供所需生理學響應的免疫反應性抗體(該術語在本文中進行了定義)。雖然所公開抗體中的任一者可結合本發明教導來使用,但本發明的某些實施例將包含嵌合抗體、人源化抗體或人單克隆抗體或其免疫反應性片段。另外其他實施例可例如包含同源或異源多聚構建體、Fc變體和綴合的或經糖基化改變的抗體。此外,應當理解,這類構型并不互相排斥,且相容的獨立抗體可包含本文所公開的一個或多個功能方面。例如,相容的抗體可包含具有人源化可變區的單鏈雙體抗體(diabody)或具有能改變糖基化模式以調節血清半衰期的Fc修飾的完全人全長IgG3抗體。其他例示性實施例對本領域技術人員是顯而易見的且可容易辨別出其在本發明的范圍內。
b.抗體產生
眾所周知,可對包括兔、小鼠、大鼠等在內的各種宿主動物進行接種并用于提供根據本文教導的抗體。取決于接種的物種,本領域已知的可用于增強免疫應答的佐劑包括(但不限于)弗氏佐劑(完全和不完全弗氏佐劑)、礦物凝膠(如氫氧化鋁)、表面活性物質(如溶血卵磷脂)、普洛尼克多元醇(pluronic polyol)、聚陰離子、肽、油乳液、鑰孔戚血藍素、二硝基酚以及潛在可用的人佐劑如BCG(卡介苗(bacille Calmette-Guerin))和短棒狀桿菌(corynebacterium parvum)。這類佐劑可通過將抗原隔離于局部沉積物中來防止該抗原快速分散,或它們可含有能刺激宿主分泌對巨噬細胞和免疫系統的其他組分具有趨化性的因子的物質。優選地,若施用多肽,則免疫接種時間表將涉及分兩次或更多次施用多肽,為期數周。
在用CD46免疫原(包括所選的剪接變體和/或肽)免疫動物后,可用本領域已知的技術從該動物獲得抗體和/或產抗體細胞。在一些實施例中,通過將動物放血或處死來獲得含有多克隆抗CD46抗體的血清。血清可以以獲自動物的形式用于研究目的,或在備選方案中,可將抗CD46抗體部分或完全純化以提供免疫球蛋白級分或均質抗體制劑。
c.單克隆抗體
雖然多克隆抗體可結合本發明的某些方面來使用,但優選的實施例包括使用CD46反應性單克隆抗體。如本文中所用的,術語“單克隆抗體”或“mAb”是指從實質上均質的抗體群體獲得的抗體,即構成該群體的各個抗體除可能少量存在的可能突變(如天然存在的突變)外均相同。因此,修飾語“單克隆”表示抗體不是分立的抗體的混合物的這種特征,且可以用在任何類型的抗體上。在某些實施例中,這類單克隆抗體包括包含與CD46結合或締合的多肽序列的抗體,其中該結合CD46的多肽序列是通過包括從多條多肽序列中選擇單一標靶結合多肽序列的方法來獲得。
在優選的實施例中,產生抗體的細胞系從分離自經免疫的動物的細胞制備。免疫后,將動物處死并通過本領域熟知的手段使淋巴結和/或脾B細胞永生化。使細胞永生化的方法包括但不限于用致癌基因轉染細胞、用致癌病毒感染細胞并在可選擇永生化細胞的條件下培養細胞、使細胞經受致癌或突變化合物、使細胞與永生化細胞(如骨髓瘤細胞)融合以及使腫瘤抑制基因失活。若采用與骨髓瘤細胞融合,則骨髓瘤細胞優選不分泌免疫球蛋白多肽(非分泌性細胞系)。永生化細胞用CD46或其免疫反應性部分進行篩選。在一個優選的實施例中,使用酶聯免疫測定法(ELISA)或放射免疫測定法來進行初始篩選。
更一般地說,可使用本領域已知的多種技術來制備符合本發明的分立的單克隆抗體,包括雜交瘤、重組技術、噬菌體展示技術、酵母文庫、轉基因動物(例如或HuMAb)或它們的一些組合。例如,單克隆抗體可使用諸如上文概述的以及在Harlow等人,Antibodies:A Laboratory Manual(《抗體:實驗室手冊》),(冷泉港實驗室出版社(Cold Spring Harbor Laboratory Press),第二版,1988年);Hammerling等人,載于:Monoclonal Antibodies and T-Cell Hybridomas(《單克隆抗體和T細胞雜交瘤》)563-681(紐約愛思唯爾出版社(Elsevier,N.Y.),1981)中更詳細教導的雜交瘤技術來產生。使用所公開的方案,優選通過多次皮下或腹膜內注射相關抗原和佐劑而在哺乳動物中產生抗體。如先前所論述的,這個免疫通常會引起免疫應答,免疫應答包括由活化的脾細胞或淋巴細胞產生抗原反應性抗體(若免疫的動物為轉基因動物,則其可為完全人抗體)。雖然可從動物血清收獲所得抗體以提供多克隆制劑,但一般更希望從脾、淋巴結或外周血液分離獨立淋巴細胞以提供單克隆抗體的均質制劑。最通常,從脾獲得淋巴細胞并使其永生化以提供雜交瘤。
例如,如上文所述,選擇方法可為從多個克隆(例如雜交瘤克隆、噬菌體克隆或重組DNA克隆的庫)中選擇獨特的克隆。應當理解,可進一步改變所選的CD46結合序列,例如以改善對標靶的親和力、使標靶結合序列人源化、改善其在細胞培養物中的產生、降低其體內免疫原性、產生多特異性抗體等,并且包含改變的標靶結合序列的抗體也為本發明的單克隆抗體。與通常包括針對不同決定簇(表位)的分立抗體的多克隆抗體制劑相反,單克隆抗體制劑的每種單克隆抗體是針對抗原上的單一決定簇。除其特異性外,單克隆抗體制劑的有利之處在于其通常未受到可能具有交叉反應性的其他免疫球蛋白污染。
d.嵌合抗體
在另一實施例中,本發明的抗體可包含嵌合抗體,該嵌合抗體來源于共價接合的來自至少兩種不同物種或類型的抗體的蛋白質區段。應當理解,如本文所用的,術語“嵌合抗體”涉及其中重鏈和/或輕鏈的一部分與來源于特定物種或屬于特定抗體類別或亞類的抗體中的相應序列一致或同源,而所述鏈的其余部分與來源于另一物種或屬于另一抗體類別或亞類的抗體中的相應序列一致或同源的構建體,以及這類抗體的片段,只要其表現出所需生物活性即可(美國專利No.4,816,567;Morrison等人,Proc.Natl.Acad.Sci.USA(《美國科學院院刊》),81:6851-6855(1984))。在一個例示性實施例中,根據本文教導的嵌合抗體可包含鼠VH和VL氨基酸序列以及來源于人來源的恒定區。在其他相容的實施例中,本發明的嵌合抗體可包含如下文所述的CDR移植抗體或人源化抗體。
一般來講,制備嵌合抗體的目的在于產生其中來自預定受試物種的氨基酸的數目最大化的嵌合體。一個例子為CDR移植抗體,其中該抗體包含一個或多個來自特定物種或屬于特定抗體類別或亞類的互補決定區(CDR),而該抗體鏈的其余部分與來源于另一物種或屬于另一抗體類別或亞類的抗體中相應序列一致或同源。為在人類中使用,通常將來自嚙齒動物抗體的可變區或所選的CDR移植到人抗體中,替換人抗體的天然存在的可變區或CDR。通常這些構建體的優點在于提供全強度調節劑功能(例如CDC、ADCC等),而同時減少受試者對抗體的非所需免疫應答。
e.人源化抗體
與CDR移植抗體類似的是人源化抗體。一般來講,人源化抗體由最初在非人動物中產生的單克隆抗體制備。本文所用的非人(例如鼠類)抗體的人源化形式為含有極少的來源于非人免疫球蛋白的序列的嵌合抗體。在一個實施例中,人源化抗體為其中來自接受者的某個CDR的殘基被具有所需特異性、親和力和/或能力的非人物種(供體抗體)(例如小鼠、大鼠、兔或非人靈長類動物)的某個CDR的殘基代替的人免疫球蛋白(接受者抗體)。
在所選的實施例中,接受者抗體可包含共有序列。為產生共有人構架,可將來自若干人重鏈或輕鏈氨基酸序列的構架進行比對以鑒別共有氨基酸序列。此外,在許多情況下,人免疫球蛋白的可變域中的一個或多個構架殘基被來自供體抗體的相應非人殘基代替。這些構架置換通過本領域熟知的方法來鑒別,例如通過將CDR與構架殘基的相互作用建模以鑒別對抗原結合重要的構架殘基以及進行序列比較以鑒別特定位置處的不尋常構架殘基來進行鑒別。這類置換有助于維持移植的CDR的適當三維構型且通常相比于無構架置換的類似構建體可改善親和力(infinity)。此外,人源化抗體可包含未存在于接受者抗體或供體抗體中的殘基。可用熟知的技術作出這些修飾以進一步改進抗體性能。
CDR移植和人源化抗體例如描述于美國專利No.6,180,370、No.5,693,762、No.5,693,761、No.5,585,089和No.5,530,101中。一般而言,人源化抗體將實質上包含全部至少一個且通常兩個可變域,其中全部或實質上全部CDR均對應于非人免疫球蛋白的CDR,并且全部或實質上全部構架區為人免疫球蛋白序列的構架區。人源化抗體任選還將包含免疫球蛋白恒定區(Fc)(通常為人免疫球蛋白的恒定區)的至少一部分。更多細節參見例如:Jones等人,Nature(《自然》)321:522-525(1986);Riechmann等人,Nature(《自然》)332:323-329(1988);和Presta,Curr.Op.Struct.Biol.(《結構生物學新見》)2:593-596(1992)。還可參見例如:Vaswani和Hamilton,Ann.Allergy,Asthma&Immunol.(《過敏、哮喘及免疫學年鑒》)1:105-115(1998);Harris,Biochem.Soc.Transactions(《生化學會會刊》)23:1035-1038(1995);Hurle和Gross,Curr.Op.Biotech.(《生物技術新見》)5:428-433(1994);和美國專利No.6,982,321和No.7,087,409。又一方法稱為人化工程改造(humaneering),在例如U.S.2005/0008625中描述。出于本專利申請的目的,術語“人源化抗體”將視為明確包括無構架置換或構架置換極少的CDR移植抗體(即包含一個或多個移植的非人CDR的人抗體)。
另外,非人抗CD46抗體也可通過利用WO 98/52976和WO 00/34317中所公開的方法使人T細胞表位特定缺失或去免疫(deimmunization)來修飾。簡而言之,可分析抗體的重鏈和輕鏈可變區尋找能結合II型MHC的肽;這些肽代表潛在的T細胞表位(如WO 98/52976和WO 00/34317中所定義)。為檢測潛在的T細胞表位,可應用稱為肽穿線(peptide threading)的計算機建模方法,并且另外可如WO 98/52976和WO 00/34317中所述搜索人II型MHC結合肽的數據庫尋找VH序列和VL序列中存在的基序。這些基序可結合18種主要II型MHC DR同種異型(allotype)中的任一者,因而構成潛在的T細胞表位。檢測到的潛在T細胞表位可通過取代可變區中的少數氨基酸殘基或通過單一氨基酸置換來消除。盡可能作出保守置換。通常,但不唯獨地,可使用對人種系抗體序列中的位置而言常見的氨基酸。在鑒別去免疫變化后,可通過誘變或其他合成方法(例如從頭合成、盒置換(cassette replacement)等)來構建編碼VH和VL的核酸。可任選將經誘變的可變序列與人恒定區融合。
在所選的實施例中,至少60%、65%、70%、75%或80%的人源化抗體可變區殘基將對應于親本構架區(FR)和CDR序列的殘基。在其他實施例中,至少85%或90%的人源化抗體殘基將對應于親本構架區(FR)和CDR序列的殘基。在另一優選的實施例中,大于95%的人源化抗體殘基將對應于親本構架區(FR)及CDR序列的殘基。
人源化抗體可使用本文所述的常見分子生物學和生物分子工程改造技術來制造。這些方法包括分離、操縱和表達編碼來自重鏈或輕鏈中至少一者的免疫球蛋白Fv可變區的全部或一部分的核酸序列。這類核酸的來源是本領域技術人員所熟知的,例如可獲自如上文所述產生針對預定標靶的抗體或免疫反應性片段的雜交瘤、真核細胞或噬菌體、獲自種系免疫球蛋白基因或獲自合成的構建體。然后可將編碼人源化抗體的重組DNA克隆進適當表達載體中。
人種系序列例如公開于如下文獻中:Tomlinson,I.A.等人,(1992)J.Mol.Biol.(《分子生物學雜志》)227:776-798;Cook,G.P.等人,(1995)Immunol.Today(《當代免疫》)16:237-242;Chothia,D.等人,(1992)J.Mol.Bio.(《分子生物學雜志》)227:799-817;和Tomlinson等人,(1995)EMBO J(《歐洲分子生物學學會雜志》)14:4628-4638。V BASE目錄提供人免疫球蛋白可變區序列的詳盡目錄(參見Retter等人,(2005)Nuc Acid Res(《核酸研究》)33:671-674)。這些序列可用作人序列的來源,例如用于構架區和CDR。如本文中所述,也可使用共有人構架區,例如如美國專利No.6,300,064中所述。
f.人抗體
除上述抗體外,本領域技術人員應當理解,本發明的抗體可包含完全人抗體。出于本申請案的目的,術語“人抗體”包含具有對應于由人產生的抗體的氨基酸序列的氨基酸序列的抗體,和/或使用如本文所公開的制備人抗體的任一技術所制備的抗體。人抗體的這個定義特地排除包含非人抗原結合殘基的人源化抗體。
人抗體可使用本領域已知的各種技術來產生。如上文所提及的,可使用噬菌體展示技術來提供根據本發明教導的免疫活性結合區。因此,本發明的某些實施例提供產生抗CD46抗體或其抗原結合部分的方法,該方法包括如下步驟:在噬菌體上合成(優選人)抗體的文庫;用CD46或其抗體結合部分篩選該文庫;分離結合CD46的噬菌體;以及從該噬菌體獲得免疫反應性片段。舉例而言,一種制備用于噬菌體展示技術的抗體文庫的方法包括如下步驟:用CD46或其抗原性部分免疫包含人或非人免疫球蛋白基因座的非人動物以產生免疫應答;從經免疫的動物提取產生抗體的細胞;從所提取的細胞分離編碼本發明抗體的重鏈和輕鏈的RNA;反轉錄該RNA以產生cDNA;使用引物擴增該cDNA;以及將該cDNA插入噬菌體展示載體中以使得抗體在噬菌體上表達。更具體而言,通過PCR將編碼VH域和VL域的DNA與scFv接頭重組在一起并克隆進噬菌粒載體(如pCANTAB 6或pComb 3HSS)中。然后可將該載體電穿孔進大腸桿菌中,接著用輔助噬菌體感染該大腸桿菌。用于這些方法中的噬菌體通常為絲狀噬菌體,包括fd和M13,并且通常將VH域和VL域與噬菌體基因III或基因VIII重組融合。
本發明的重組人抗CD46抗體可通過篩選如上所制備的重組組合抗體文庫來分離。在一個優選的實施例中,該文庫為scFv噬菌體展示文庫,其使用由自B細胞分離的mRNA制備的人VL和VH cDNA來產生。制備和篩選這類文庫的方法是本領域所熟知的,并且用于產生噬菌體展示文庫的試劑盒可商購獲得(例如Pharmacia Recombinant Phage Antibody System(Pharmacia重組噬菌體抗體系統),目錄號為27-9400-01;以及Stratagene SurfZAPTM噬菌體展示試劑盒,目錄號為240612)。也存在其他可用于產生和篩選抗體展示文庫的方法和試劑(參見例如美國專利No.5,223,409;PCT公布No.WO 92/18619、No.WO 91/17271、No.WO 92/20791、No.WO 92/15679、No.WO 93/01288、No.WO 92/01047、No.WO 92/09690;Fuchs等人,Bio/Technology(《生物技術》)9:1370-1372(1991);Hay等人,Hum.Antibod.Hybridomas(《人抗體和雜交瘤》)3:81-85(1992);Huse等人,Science(《科學》)246:1275-1281(1989);McCafferty等人,Nature(《自然》)348:552-554(1990);Griffiths等人,EMBO J.(《歐洲分子生物學學會雜志》)12:725-734(1993);Hawkins等人,J.Mol.Biol.(《分子生物學雜志》)226:889-896(1992);Clackson等人,Nature(《自然》)352:624-628(1991);Gram等人,Proc.Natl.Acad.Sci.USA(《美國科學院院刊》)89:3576-3580(1992);Garrad等人,Bio/Technology(《生物技術》)9:1373-1377(1991);Hoogenboom等人,Nuc.Acid Res.(《核酸研究》)19:4133-4137(1991);和Barbas等人,Proc.Natl.Acad.Sci.USA(《美國科學院院刊》)88:7978-7982(1991)。
由原始文庫(naive library)(天然的或合成的)產生的抗體可具有中等親和力(Ka為約106至107M-1),但也可如本領域中所述通過構建次級文庫(secondary library)并從其中再次選擇來體外模擬親和力成熟。例如,可通過使用Hawkins等人,J.Mol.Biol.(《分子生物學雜志》)226:889-896(1992)的方法中或Gram等人,Proc.Natl.Acad.Sci.USA(《美國科學院院刊》),89:3576-3580(1992)的方法中的易錯聚合酶(報道于Leung等人,Technique(《技術》),1:11-15(1989)),來體外隨機引入突變。另外,可通過例如利用PCR,使用帶有跨越所關注CDR的隨機序列的引物,在所選的單獨FV克隆中使一個或多個CDR隨機突變并篩選親和力較高的克隆來進行親和力成熟。WO 9607754描述了在免疫球蛋白輕鏈的互補決定區中誘導誘變以產生輕鏈基因的文庫的方法。另一有效方法是,將通過噬菌體展示而選擇的VH域或VL域與獲自未經免疫的供體的天然V域變體組庫(repertoire)進行重組并在數輪的鏈改組中針對較高親和力進行篩選,如Marks等人,Biotechnol.(《生物技術》),10:779-783(1992)中所述。這個技術使得能產生解離常數Kd(koff/kon)為約10-9M或更小的抗體和抗體片段。
應進一步認識到,可采用使用包含在其表面上表達結合對的真核細胞(例如酵母)的文庫的類似程序。如同噬菌體展示技術一般,針對所關注抗原(即CD46)對真核生物文庫進行篩選并分離和克隆表達候選結合對的細胞。可進行使文庫內含物優化以及反應性結合對親和力成熟的步驟。參見例如美國專利No.7,700,302和美國系列號No.12/404,059。在一個實施例中,人抗體選自噬菌體文庫,其中該噬菌體文庫表達人抗體(Vaughan等人,Nature Biotechnology(《自然生物技術》)14:309-314(1996);Sheets等人,Proc.Natl.Acad.Sci.(《美國科學院院刊》)95:6157-6162(1998);Hoogenboom和Winter,J.Mol.Biol(《分子生物學雜志》),227:381(1991);Marks等人,J.MoI.Biol(《分子生物學雜志》),222:581(1991))。在其他實施例中,人結合對可分離自諸如酵母之類的真核細胞中所產生的組合抗體文庫。參見例如美國專利No.7,700,302。這類技術有利地允許篩選大量候選調節劑并且可相對容易操縱候選序列(例如通過親和力成熟或重組改組)。
人抗體也可通過將人免疫球蛋白基因座引入轉基因動物(例如內源性免疫球蛋白基因已部分或完全失活的小鼠)中來制備。攻擊后,觀察人抗體的產生情況,其在全部方面均非常類似于在人中所見的,包括基因重排、組裝和抗體組庫(repertoire)。這個方法例如描述于關于技術的美國專利No.5,545,807、No.5,545,806、No.5,569,825、No.5,625,126、No.5,633,425、No.5,661,016以及美國專利No.6,075,181和No.6,150,584,以及如下科學出版物:Marks等人,Bio/Technology(《生物技術》)10:779-783(1992);Lonberg等人,Nature(《自然》)368:856-859(1994);Morrison,Nature(《自然》)368:812-13(1994);Fishwild等人,Nature Biotechnology(《自然生物技術》)14:845-51(1996);Neuberger,Nature Biotechnology(《自然生物技術》)14:826(1996);Lonberg和Huszar,Intern.Rev.Immunol.(《免疫學國際評論》)13:65-93(1995)。或者,人抗體可經由使產生針對標靶抗原的抗體的人B-淋巴細胞(這類B淋巴細胞可自患有贅生性障礙的個體回收或可在體外進行免疫)永生化來制備。參見例如Cole等人,Monoclonal Antibodies and Cancer Therapy(《單克隆抗體和癌癥療法》),Alan R.Liss,第77頁(1985);Boerner等人,J.Immunol(《免疫學雜志》),147(l):86-95(1991);以及美國專利No.5,750,373。
VI.抗體特征
不管如何獲得抗體調節劑或其采取上述何種形式(例如人源化抗體、人抗體等),所公開的調節劑的優選實施例都可表現出各種特征。就這一點而言,可對產生抗CD46抗體的細胞(例如雜交瘤或酵母菌落)進行選擇、克隆,并針對所需特征(包括例如強盛生長、高抗體產率以及如下文更詳細論述的所需抗體特征)進行進一步篩選。雜交瘤可在同系動物中、缺乏免疫系統的動物(例如裸小鼠)中體內擴增或在細胞培養物中體外擴增。選擇、克隆和擴展雜交瘤和/或菌落的方法是本領域普通技術人員所熟知的,其中每一方法均產生分立的抗體種類。
a.中和抗體
在尤其優選的實施例中,本發明的調節劑將包含中和抗體或其衍生物或片段。術語“中和抗體”或“中和拮抗劑”是指這樣的抗體或拮抗劑,它能與CD46或任何配體或酶結合或相互作用并防止該配體或酶與其結合伴侶(例如CD46)或底物結合,從而中斷本來會由這類分子的相互作用引起的生物反應。在評估抗體或其免疫功能片段或衍生物的結合和特異性時,若過量抗體使結合于標靶分子的結合伴侶的量降低至少約20%、30%、40%、50%、60%、70%、80%、85%、90%、95%、97%、99%或更多(如在例如本文“實例”中所述的體外競爭性結合測定法中所測量),則抗體或片段將實質上抑制配體或酶與其結合伴侶或底物的結合。就CD46的抗體而言,中和抗體或拮抗劑將優選使CD46在通過血清因子I使補體組分C3b和C4b失活方面的能力降低至少約20%、30%、40%、50%、60%、70%、80%、85%、90%、95%、97%、99%或更多,從而降低游離磷脂酰肌醇蛋白聚糖(glypican)的濃度。應當理解,這個減少的活性可直接使用本領域公認的技術來測量,或可通過這個減少會對補體活性產生的影響來測量。
b.內化抗體
雖然證據表明CD46可被細胞分泌,但至少一些CD46很可能保持與細胞表面締合,從而使得所公開的調節劑可以內化。因此,抗CD46抗體可至少在一定程度上被表達CD46的細胞內化。例如,結合至腫瘤起始細胞表面上的CD46的抗CD46抗體可被腫瘤起始細胞內化。在尤其優選的實施例中,可將這類抗CD46抗體與在內化后殺滅細胞的細胞毒性部分締合或綴合。
本文所用的“內化的抗CD46抗體”為在結合至與哺乳動物細胞締合的CD46后被該細胞吸收的抗體。內化抗體包括抗體片段、人或人源化抗體和抗體綴合物。內化可在體外或體內進行。對于治療性應用,內化可在體內進行。內化的抗體分子的數目可足以或足夠殺滅表達CD46的細胞,尤其是表達CD46的腫瘤起始細胞。取決于抗體或抗體綴合物的效價,在一些情況下,單一抗體分子攝入進細胞中就足以殺滅抗體結合的標靶細胞。例如,某些毒素殺滅效能很高,使得內化一分子與抗體綴合的毒素就足以殺滅腫瘤細胞。在結合哺乳動物細胞上的CD46后抗CD46抗體是否內化可通過包括下文“實例”中所述的測定法在內的各種分析來確定。檢測抗體是否內化進細胞中的方法在美國專利No.7,619,068中進行了描述,將該專利以引用的方式全文并入本文。
c.消耗性抗體
在其他優選的實施例中,本發明的調節劑將包含消耗性抗體或其衍生物或片段。術語“消耗性抗體”是指與細胞表面上或其附近的CD46結合或締合并且誘導、促進或引起細胞死亡或消除(例如,通過補體依賴性細胞毒性或抗體依賴性細胞毒性)的抗體或片段。在下文更全面論述的一些實施例中,所選的消耗性抗體將與細胞毒性劑締合或綴合。優選地,消耗性抗體將能夠移除、消除或殺滅確定的細胞群體中至少20%、30%、40%、50%、60%、70%、80%、85%、90%、95%、97%或99%的腫瘤永續細胞。在一些實施例中,該細胞群體可包含經富集、分區、純化或分離的腫瘤永續細胞。在其他實施例中,細胞群體可包含含有腫瘤永續細胞的整個腫瘤樣品或異質腫瘤提取物。本領域技術人員應當理解,下文“實例”中所述的標準生化技術可用于監測和定量根據本文教導的腫瘤永續細胞的消耗。
d.表位結合
將進一步理解,所公開的抗CD46抗體將與由所選的標靶遞呈的分立表位或決定簇締合或結合。本文所用的術語“表位”是指標靶抗原中能夠被特定抗體識別和特異性結合的部分。當該抗原為多肽如CD46時,表位可由鄰接氨基酸和通過蛋白質三級折疊而并置的非鄰接氨基酸形成。由鄰接氨基酸形成的表位通常在蛋白質變性后保留,而通過三級折疊形成的表位通常在蛋白質變性后丟失。表位通常包括至少3個且更通常至少5個或8-10個氨基酸,呈獨特的空間構象。更具體地講,本領域技術人員應當理解,術語“表位”包括任何能夠特異性結合至免疫球蛋白或T細胞受體或者以別的方式與分子相互作用的蛋白質決定簇。抗原決定簇一般由諸如氨基酸或碳水化合物或糖側鏈之類的分子的化學活性表面簇(grouping)組成,且一般具有特異性的三維結構特征以及特異性的電荷特征。另外,表位可為線性的或構象性的。在線性表位中,蛋白質與相互作用分子(例如抗體)之間的所有相互作用點均沿著該蛋白質的一級氨基酸序列線性存在。在構象表位中,相互作用點存在于蛋白質上在線性上彼此間隔開的氨基酸殘基當中。
一旦確定抗原上的所需表位,則有可能例如使用本發明中所述的技術產生該表位的抗體。或者,在發現過程中,抗體的產生和表征可闡明有關所需表位的信息。根據該信息,則有可能以競爭方式篩選結合至相同表位的抗體。實現此舉的方法是進行競爭研究以找到彼此競爭性結合的抗體,即抗體競爭與抗原的結合。根據它們的交叉競爭將抗體分類別(binning)的高通量方法描述于WO03/48731中。
如本文所用的術語“分類別”是指根據它們的抗原結合特征將抗體分組的方法。類別(bin)的歸類有些武斷,其取決于所測試抗體的所觀察到的結合模式的差別。因此,雖然該技術是可用于將本發明的抗體分類的工具,但該類別并不始終直接與表位相關且這種初始的判定應通過其他本領域公認的方法進一步證實。
在此告誡下,可通過使用本領域已知的和本文“實例”中所述的方法確定所選的第一抗體(或其片段)與第二抗體是結合于同一表位還是交叉競爭結合。在一個實施例中,在飽和條件下讓本發明的第一抗體結合至CD46,然后測量第二抗體與CD46結合的能力。若測試抗體能夠與第一抗CD46抗體同時結合至CD46,則該第二抗體結合的表位與該第一抗體不同。然而,若該第二抗體不能夠同時結合至CD46,則該第二抗體結合至同一表位、重疊表位或與該第一抗體所結合的表位極接近的表位。如本領域已知的以及下文“實例”中所詳細描述的,所需數據可用固相直接或間接放射免疫測定法(RIA)、固相直接或間接酶免疫測定法(EIA)、夾心競爭測定法、BiacoreTM系統(即表面等離子共振–通用電氣醫療公司(GE Healthcare))、Analyzer分析儀(即生物層干涉測量法,富迪生物有限公司(ForteBio,Inc.))或流式細胞法來獲得。本文所用的術語“表面等離子共振”是指使得可以通過檢測生物傳感器基質中蛋白質濃度的變化來分析實時生物特異性相互作用的光學現象。在一個尤其優選的實施例中,如下文“實例”中所證實的,該分析用Biacore或ForteBio儀器來進行。
術語“競爭”在用于競爭同一表位的抗體的上下文中時意指抗體之間的競爭,其通過其中所測試的抗體或免疫功能片段防止或抑制參考抗體與共同抗原特異性結合的測定法來測定。通常,這種測定法涉及使用結合于帶有未經標記的測試免疫球蛋白及經標記的參考免疫球蛋白中任一者的固體表面或細胞的純化抗原。競爭性抑制是通過測定在測試免疫球蛋白的存在下結合至固體表面或細胞的標記的量來測量。測試免疫球蛋白通常過量存在。通過競爭測定法鑒別的抗體(競爭抗體)包括其所結合的表位與參考抗體所結合的表位相同的抗體以及結合至這樣的相鄰表位的抗體,該相鄰表位與參考抗體所結合的表位足夠接近以便發生空間位阻。關于測定競爭性結合的方法的其他細節在本文“實例”中提供。通常,當競爭抗體過量存在時,其將抑制參考抗體與共同抗原的特異性結合達至少40%、45%、50%、55%、60%、65%、70%或75%。在一些情況下,結合受抑制達至少80%、85%、90%、95%或97%或更多。
除了表位特異性,所公開的抗體還可用多種不同的物理特征來表征,包括例如結合親和力、解折疊溫度(melting temperature,Tm)和等電點。
e.結合親和力
就這一點來說,本發明還涵蓋具有高的CD46結合親和力的抗體的用途。當解離常數Kd(koff/kon)≤10-8M時本發明的抗體可說成是特異性結合其靶標抗原。當Kd≤5×10-9M時,抗體以高的親和力特異性結合抗原,當Kd≤5×10-10M時,抗體以十分高的親和力特異性結合抗原。在本發明的一個實施例中,抗體的Kd≤10-9M且解離速率為約1×10-4/秒。在本發明的一個實施例中,解離速率<為1×10-5/秒。在本發明的其他實施例中,抗體將以約10-8M至10-10M的Kd結合至CD46,在又一個實施例中,其將以≤2×10-10M的Kd結合。本發明的另外其他所選的實施例包括解離常數或Kd(koff/kon)小于10-2M、小于5×10-2M、小于10-3M、小于5×10-3M、小于10-4M、小于5×10-4M、小于10-5M、小于5×10-5M、小于10-6M、小于5×10-6M、小于10-7M、小于5×10-7M、小于10-8M、小于5×10-8M、小于10-9M、小于5×10-9M、小于10-10M、小于5×10-10M、小于10-11M、小于5×10-11M、小于10-12M、小于5×10-12M、小于10-13M、小于5×10-13M、小于10-14M、小于5×10-14M、小于10-15M或小于5×10-15M的抗體。
在特定的實施例中,與CD46免疫特異性結合的本發明抗體的結合速率常數kon速率(CD46(Ab)+抗原(Ag)kon←Ab-Ag)為至少105M-1s-1、至少2×105M-1s-1、至少5×105M-1s-1、至少106M-1s-1、至少5×106M-1s-1、至少107M-1s-1、至少5×107M-1s-1或至少108M-1s-1。
在另一個實施例中,與CD46免疫特異性結合的本發明抗體的koff速率(CD46(Ab)+抗原(Ag)koff←Ab-Ag)小于10-1s-1、小于5×10-1s-1、小于10-2s-1、小于5×10-2s-1、小于10-3s-1、小于5×10-3s-1、小于10-4s-1、小于5×10-4s-1、小于10-5s-1、小于5×10-5s-1、小于10-6s-1、小于5×10-6s-1、小于10-7s-1、小于5×10-7s-1、小于10-8s-1、小于5×10-8s-1、小于10-9s-1、小于5×10-9s-1或小于10-10s-1。
在本發明的其他所選的實施例中,抗CD46抗體的親和力常數或Ka(kon/koff)為至少102M-1、至少5×102M-1、至少103M-1、至少5×103M-1、至少104M-1、至少5×104M-1、至少105M-1、至少5×105M-1、至少106M-1、至少5×106M-1、至少107M-1、至少5×107M-1、至少108M-1、至少5×108M-1、至少109M-1、至少5×109M-1、至少1010M-1、至少5×1010M-1、至少1011M-1、至少5×1011M-1、至少1012M-1、至少5×1012M-1、至少1013M-1、至少5×1013M-1、至少1014M-1、至少5×1014M-1、至少1015M-1或至少5×1015M-1。
f.等電點
除上述結合性質外,像所有多肽一樣,抗CD46抗體及其片段具有等電點(pI),一般定義為多肽不帶凈電荷時的pH。本領域已知道,當溶液的pH等于蛋白質的等電點(pI)時,蛋白質溶解度通常最低。因此,通過改變抗體中可電離殘基的數目和位置以調節pI來優化溶解度是可能的。例如,可通過進行適當的氨基酸置換(例如通過用帶電氨基酸如賴氨酸置換不帶電殘基如丙氨酸)來操縱多肽的pI。不希望受任何特定理論束縛,抗體中引起該抗體的pI改變的氨基酸置換可改善抗體的溶解度和/或穩定性。本領域技術人員將會理解哪些氨基酸置換將最適合于特定抗體實現所需的pI。
蛋白質的pI可通過多種方法來測定,包括但不限于等電聚焦和各種計算機算法(參見例如Bjellqvist等人,1993,Electrophoresis(《電泳》)14:1023)。在一個實施例中,本發明的抗CD46抗體的pI高于約6.5、約7.0、約7.5、約8.0、約8.5或約9.0。在另一實施例中,本發明的抗CD46抗體的pI高于6.5、7.0、7.5、8.0、8.5或9.0。在又另一個實施例中,引起本發明抗體的pI改變的置換將不會顯著減弱其對CD46的結合親和力。如下文更詳細論述的,特別設想到引起FcγR結合改變的Fc區置換也可引起pI改變。在一個優選的實施例中,對Fc區置換進行專門選擇以同時實現FcγR結合的所需變化和pI的任何所需改變。本文所用的pI值定義為主要電荷形式的pI。
g.熱穩定性
還應該理解,抗體的Fab域的Tm可為抗體的熱穩定性的良好指標且還可指示存放期。Tm僅為使給定結構域或序列50%解折疊時的溫度。Tm較低指示聚集較多/穩定性較小,而較高Tm指示聚集較少/穩定性較高。因此,具有較高Tm的抗體或片段或衍生物是優選的。此外,使用本領域公認的技術,有可能改變抗CD46抗體或其結構域的組成以提高或優化分子穩定性。參見例如美國專利No.7,960,142。因此,在一個實施例中,所選的抗體的Fab域的Tm值高于至少50℃、55℃、60℃、65℃、70℃、75℃、80℃、85℃、90℃、95℃、100℃、105℃、110℃、115℃或120℃。在另一個實施例中,抗體的Fab域的Tm值高于至少約50℃、約55℃、約60℃、約65℃、約70℃、約75℃、約80℃、約85℃、約90℃、約95℃、約100℃、約105℃、約110℃、約115℃或約120℃。蛋白質域(例如Fab域)的熱解折疊溫度(Tm)可使用本領域已知的任何標準方法來測量,例如通過差示掃描量熱法(參見例如Vermeer等人,2000,Biophys.J.(《生物物理雜志》)78:394-404;Vermeer等人,2000,Biophys.J.(《生物物理雜志》)79:2150-2154,將這兩篇文獻以引用的方式并入本文)。
VII.CD46調節劑片段和衍生物
無論本發明的作用劑(agent)包含完整的融合構建體、抗體、片段還是衍生物,所選的調節劑均將與CD46反應、結合、組合、復合、連接、附接、接合、相互作用或以其他方式締合,從而提供所需的抗贅生性作用。本領域技術人員應當理解,包含抗CD46抗體的調節劑是通過在抗體上表達的一個或多個結合位點與CD46相互作用或締合。更具體地講,本文所用的術語“結合位點”包含多肽中負責選擇性結合至所關注標靶分子(例如酶、抗原、配體、受體、底物或抑制劑)的區域。結合域包含至少一個結合位點(例如完整的IgG抗體將具有兩個結合域和兩個結合位點)。例示性的結合域包括抗體可變域、配體的受體結合域、受體的配體結合域或酶促域。出于本發明的目的,CD46的酶活性區域(例如作為Fc-CD46融合構建體的一部分)可包含底物(例如磷脂酰肌醇蛋白聚糖)的結合位點。
a.片段
不管選擇何種形式的調節劑(例如嵌合的、人源化的等待)來實施本發明,應當理解根據本文教導可使用其免疫反應性片段。在最廣泛意義上,術語“抗體片段”包含完整抗體(例如天然存在的免疫球蛋白)的至少一部分。更具體地講,術語“片段”是指抗體或抗體鏈(或在Fc融合物的情況下為CD46分子)的一部分,其包含的氨基酸殘基比完整的或完全的抗體或抗體鏈少。術語“抗原結合片段”是指免疫球蛋白或抗體中結合抗原或與完整抗體(即與其所來源的完整抗體)競爭抗原結合(即特異性結合)的多肽片段。本文所用的術語“抗體分子的片段”包括抗體的抗原結合片段,例如抗體輕鏈(VL)、抗體重鏈(VH)、單鏈抗體(scFv)、F(ab')2片段、Fab片段、Fd片段、Fv片段、單域抗體片段、雙體抗體、線性抗體、單鏈抗體分子和由抗體片段形成的多特異性抗體。類似地,CD46的酶活性片段包含CD46分子中保留其與CD46底物相互作用且以類似于完整CD46的方式修飾該底物(例如將該底物剪短)的能力(不過效率可能略低)的部分。
本領域技術人員應當理解,片段可通過化學或酶處理完整的或完全的調節劑(例如抗體或抗體鏈)或通過重組手段來獲得。就這一點而言,雖然各種抗體片段依據完整抗體的消化來定義,但本領域技術人員應當理解,這類片段可通過化學法或通過使用重組DNA方法從頭合成。因此,本文所用的術語“抗體”明確地包括通過修飾整個抗體而產生的或使用重組DNA方法從頭合成的抗體或其片段或衍生物。
更具體地講,用木瓜蛋白酶消化抗體可產生兩個相同的抗原結合片段(稱為Fab片段,各具有單個抗原結合位點)和殘余的Fc片段,其名稱反映其容易結晶的能力。胃蛋白酶處理產生F(ab')2片段,其具有兩個抗原結合位點且仍能夠交聯抗原。Fab片段還含有輕鏈的恒定域和重鏈的第一恒定域(CH1)。Fab'片段與Fab片段的不同在于重鏈CH1域的羧基末端添加少量殘基,包括一個或多個來自抗體鉸鏈區的半胱氨酸在內。Fab'-SH在本文中為其中恒定域的半胱氨酸殘基帶有至少一個游離巰基的Fab'的名稱。F(ab')2抗體片段最初以Fab'片段對的形式產生,該兩個片段之間具有鉸鏈半胱氨酸。抗體片段的其他化學偶聯也是已知的。關于其他抗體片段的更詳細描述,參見例如Fundamental Immunology(《基礎免疫學》),W.E.Paul編輯,Raven Press,N.Y.(1999)。
將進一步理解,Fv片段為含有完整抗原識別和結合位點的抗體片段。這個區域由一個重鏈可變域和一個輕鏈可變域緊密締合的二聚體組成,該緊密締合在性質上可以是共價締合,例如在scFv中。各可變域的三個CDR正是以這個構造發生相互作用而限定VH-VL二聚體的表面上的抗原結合位點。六個CDR或其子集共同地賦予抗體對抗原的結合特異性。然而,甚至單個可變域(或Fv的一半,其僅包含三個對抗原有特異性的CDR)也具有識別和結合抗原的能力,不過其親和力通常低于完整結合位點的親和力。
在另一個實施例中,抗體片段例如為包含Fc區、保留當存在于完整抗體中時通常與Fc區相關的至少一種生物學功能(例如FcRn結合、抗體半衰期調節、ADCC功能和補體結合)的片段。在一個實施例中,抗體片段為具有實質上類似于完整抗體的體內半衰期的單價抗體。例如,這種抗體片段可包含連接于Fc序列的抗原結合臂,其能夠賦予該片段體內穩定性。
b.衍生物
在另一個實施例中,將進一步理解,本發明的調節劑可為單價或多價(例如二價、三價等)。本文所用的術語“效價”是指抗體所具有的潛在標靶(即CD46)結合位點的數目。每一標靶結合位點可特異性結合一個標靶分子或標靶分子上的特定位置或座位。當本發明的抗體包含不止一個標靶結合位點(多價)時,每個標靶結合位點可特異性結合相同或不同分子(例如可結合于不同配體或不同抗原,或同一抗原上的不同表位或位置)。出于本發明的目的,本發明的抗體將優選具有至少一個對人CD46具有特異性的結合位點。在一個實施例中,本發明的抗體將為單價抗體,因為該分子的每個結合位點將特異性結合單一CD46位置或表位。在其他實施例中,抗體將為多價抗體,因為其包含不止一個結合位點并且這些不同結合位點與不止一個的單一位置或表位特異性締合。在這類情況下,多個表位可存在于所選的CD46多肽或剪接變體上,或者某單一表位可存在于CD46上,同時第二不同表位可存在于另一分子或表面上。參見例如美國專利No.2009/0130105。
如上文所提及的,多價抗體可免疫特異性地結合至所需標靶分子的不同表位或者可免疫特異性地結合至標靶分子以及異源表位(例如異源多肽或固體載體材料)二者。雖然抗CD46抗體的優選實施例僅結合兩種抗原(即雙特異性抗體),但本發明也涵蓋具有額外的特異性的抗體(例如三特異性抗體)。雙特異性抗體的例子包括但不限于哪些具有一個針對CD46的臂和另一個針對任何其他抗原(例如調節劑細胞標記物)的臂的抗體。制備雙特異性抗體的方法是本領域已知的。傳統上全長雙特異性抗體的產生是基于兩個免疫球蛋白重鏈-輕鏈對的共表達,其中兩條鏈具有不同特異性(Millstein等人,1983,Nature(《自然》),305:537-539)。其他更復雜的相容性多特異性構建體及其制造方法描述于美國專利No.2009/0155255中。
在另外其他實施例中,具有所需結合特異性的抗體可變域(抗體-抗原組合位點)與免疫球蛋白恒定域序列融合。該融合優選為與包含鉸鏈區、CH2區和/或CH3區的至少一部分的免疫球蛋白重鏈恒定域的融合。在一個例子中,含有輕鏈結合所需的位點的第一重鏈恒定區(CH1)存在于這類融合物的至少一者中。將編碼免疫球蛋白重鏈融合物和(在需要時)免疫球蛋白輕鏈的DNA插入單獨的表達載體中,并共轉染至適合的宿主生物體中。在當用于構建的不等比率的三條多肽鏈提供最佳產率時的實施例中,這為調整三個多肽片段的相互比例提供極大靈活性。然而,當等比率的至少兩條多肽鏈的表達產生高產率時或當該比率并不特別重要時,可以將兩條或全部三條多肽鏈的編碼序列插入一個表達載體中。
在這個方法的一個實施例中,雙特異性抗體由一個臂中具有第一結合特異性(例如CD46)的雜交免疫球蛋白重鏈與另一個臂中雜交免疫球蛋白重鏈-輕鏈對(提供第二結合特異性)構成。發現這個不對稱結構有助于所需雙特異性化合物與非所需免疫球蛋白鏈組合的分離,因為免疫球蛋白輕鏈僅存在于雙特異性分子的一半中可提供一種簡便的分離方式。這個方法公開于WO 94/04690中。關于產生雙特異性抗體的更多細節,參見例如Suresh等人,1986,Methods in Enzymology(《酶學方法》)121:210。根據WO96/27011中所述的另一方法,一對抗體分子可經工程改造而使自重組細胞培養物回收的異型二聚體的百分比最大化。優選的界面包含抗體恒定域的CH3域的至少一部分。在這個方法中,用較大側鏈(例如酪氨酸或色氨酸)置換來自第一抗體分子界面的一個或多個小氨基酸側鏈。通過用較小氨基酸側鏈(例如丙氨酸或蘇氨酸)置換大氨基酸側鏈,在第二抗體分子界面上產生尺寸與大側鏈相同或類似的補償腔。這可提供使異型二聚體的產率提高超過其他非所需最終產物(例如同型二聚體)的機制。
雙特異性抗體還包括交聯抗體或雜綴合抗體(heteroconjugate antibody)。例如,雜綴合物(heteroconjugate)中的抗體中的一者可與抗生物素蛋白偶聯,另一者與生物素偶聯。例如,已提出將這種抗體用于使免疫系統細胞靶向非所需細胞(美國專利No.4,676,980)并用于治療HIV感染(WO 91/00360、WO 92/200373和EP 03089)。雜綴合抗體可用任何便利的交聯方法來制備。合適的交聯劑是本領域所熟知的,并且與多種交聯技術一起公開于美國專利No.4,676,980中。
VIII.CD46調節劑-恒定區修飾
a.Fc區和Fc受體
除上文所述的所公開調節劑(例如Fc-CD46或抗CD46抗體)的可變區或結合區的各種修飾、置換、添加或缺失外,本領域技術人員應當理解,本發明的所選的實施例也可包含恒定區(即Fc區)的置換或修飾。更具體地講,設想到本發明的CD46調節劑可特別是含有一個或多個另外的氨基酸殘基置換、突變和/或修飾,其產生具有優選的特征的化合物,這類特征包括但不限于:藥物動力學改變、血清半衰期增加、結合親和力增加、免疫原性降低、產量增加、Fc配體結合改變、ADCC或CDC活性增強或降低、糖基化和/或二硫鍵改變以及結合特異性修飾。就這一點而言,應當理解這些Fc變體可有利地用于增強所公開的調節劑的有效抗贅生性性質。
本文中的術語“Fc區”用于限定免疫球蛋白重鏈的C端區域,包括天然序列Fc區和變體Fc區在內。盡管免疫球蛋白重鏈的Fc區的邊界可變化,但人IgG重鏈Fc區通常定義為自位置Cys226的氨基酸殘基或自Pro230延伸至其羧基末端。Fc區的C端賴氨酸(殘基447,根據EU編號系統)可例如在產生或純化抗體期間或通過對編碼抗體重鏈的核酸進行重組工程改造來移除。因此,完整抗體的組成可包含移除了所有K447殘基的抗體群體、未移除K447殘基的抗體群體和具有有和無K447殘基的抗體的混合物的抗體群體。功能Fc區具有天然序列Fc區的效應子功能。例示性的效應子功能包括C1q結合;CDC;Fc受體結合;ADCC;吞噬作用;下調細胞表面受體(例如B細胞受體;BCR)等。這類效應子功能一般需要Fc區與結合域(例如抗體可變域)組合且可使用如例如本文定義中所公開的各種測定法來評估。
Fc受體或FcR描述與抗體的Fc區結合的受體。在一些實施例中,FcR為天然人FcR。在一些實施例中,FcR為結合IgG抗體的FcR(γ受體)并且包括FcγRI、FcγRII及FcγRIII亞類的受體,包括那些受體的等位基因變體和選擇性剪接形式在內。FcγRII受體包括FcγRIIA(活化性受體)和FcγRIIB(抑制性受體),其具有類似氨基酸序列,主要不同之處為其細胞質結構域。活化性受體FcγRIIA在其細胞質結構域中含有基于免疫受體酪氨酸的活化基序(ITAM)。抑制性受體FcγRIIB在其細胞質結構域中含有基于免疫受體酪氨酸的抑制基序(ITIM)。(參見例如Daeron,Annu.Rev.Immunol.(《免疫學年度評論》)15:203-234(1997))。FcR例如在Ravetch和Kinet,Annu.Rev.Immunol(《免疫學年度評論》)9:457-92(1991);Capel等人,Immunomethods(《免疫方法》)4:25-34(1994);以及de Haas等人,J.Lab.Clin.Med.(《實驗和臨床醫學雜志》)126:330-41(1995)中進行了綜述。本文中的術語“FcR”涵蓋其他FcR,包括有待將來鑒別的FcR。術語“Fc受體”或“FcR”也包括新生兒受體FcRn,其在某些情況下負責母體IgG向胎兒的轉移(Guyer等人,J.Immunol.(《免疫學雜志》)117:587(1976)以及Kim等人,J.Immunol.(《免疫學雜志》)24:249(1994))和免疫球蛋白的穩態的調節。測量與FcRn的結合的方法是已知的(參見例如Ghetie和Ward.,Immunol.Today(《當代免疫學》)18(12):592-598(1997);Ghetie等人,Nature Biotechnology(《自然生物技術》),15(7):637-640(1997);Hinton等人,J.Biol.Chem.(《生物化學雜志》)279(8):6213-6216(2004);WO 2004/92219(Hinton等人))。
b.Fc功能
如本文中所使用,補體依賴性細胞毒性及CDC是指標靶細胞在補體存在下溶解。補體活化途徑是通過補體系統的第一組分(C1q)與分子(例如與同源(cognate)抗原復合的抗體)的結合來起始。為評估補體活化,可進行CDC測定法,例如如Gazzano-Santoro等人,1996,J.Immunol.Methods(免疫學方法雜志),202:163中所述。
此外,抗體依賴性細胞介導的細胞毒性或ADCC是指這樣的細胞毒性形式,即結合于某些細胞毒性細胞(例如天然殺傷(NK)細胞、中性粒細胞和巨噬細胞)上存在的Fc受體(FcR)上的分泌性Ig使得這些細胞毒性效應細胞能夠特異性結合于帶有抗原的標靶細胞并隨后用細胞毒素殺滅該標靶細胞。針對標靶的特異性高親和力IgG抗體武裝細胞毒性細胞并且絕對是這種殺滅所需的。標靶細胞的溶解是在細胞外發生的,需要細胞與細胞直接接觸,不涉及補體。
FcR結合親和力或ADCC活性改變的CD46調節劑變體,是與親本或未經修飾的抗體或與包含天然序列Fc區的調節劑相比FcR結合活性和/或ADCC活性增強或減弱的調節劑。展示出FcR結合增加的調節劑變體,其結合至少一個FcR的親和力好于親本或未經修飾的抗體或包含天然序列Fc區的調節劑。展示出FcR結合降低的變體,其結合至少一個FcR的親和力差于親本或未經修飾的抗體或包含天然序列Fc區的調節劑。展示出FcR結合降低的這類變體可具有極少的或沒有明顯的FcR結合,例如與天然序列IgG Fc區相比FcR結合為0-20%,例如由本領域熟知的技術所測定的。
關于FcRn,本發明的抗體也包含或涵蓋具有這樣的恒定區修飾的Fc變體,所述修飾在哺乳動物(優選人)中提供大于5天、大于10天、大于15天、優選大于20天、大于25天、大于30天、大于35天、大于40天、大于45天、大于2個月、大于3個月、大于4個月或大于5個月的半衰期。本發明的抗體(或含有Fc的分子)在哺乳動物(優選人)中的半衰期增加導致所述抗體或抗體片段在哺乳動物中的血清滴度較高,因此降低施用所述抗體或抗體片段的頻率和/或降低要施用的所述抗體或抗體片段的濃度。體內半衰期增加的抗體可通過本領域技術人員已知的技術來產生。例如,體內半衰期增加的抗體可通過修飾(例如置換、缺失或添加)被鑒別為涉及Fc域與FcRn受體之間的相互作用的氨基酸殘基來產生(參見例如國際公開No.WO 97/34631號;No.WO 04/029207;美國專利No.6,737,056和美國專利No.2003/0190311)。人FcRn高親和力結合多肽與人FcRn的體內結合以及其血清半衰期,可例如在表達人FcRn的轉基因小鼠或經轉染的人細胞系中或在施用具有變體Fc區的多肽的靈長類動物中進行測定。WO 2000/42072描述了與FcRn結合改善或減弱的抗體變體。還可參見例如Shields等人,J.Biol.Chem.(《生物化學雜志》)9(2):6591-6604(2001)。
c.糖基化修飾
在另外其他實施例中,本發明抗體的糖基化模式或組成是經改良的。更具體而言,本發明的優選實施例可包含一種或多種經工程改造的糖型(glycoform),即糖基化模式改變或共價連接至包含Fc區的分子的碳水化合物組成改變。經工程改造的糖型可用于多種目的,包括但不限于增強或降低效應子功能、增加抗體對標靶抗原的親和力或促進抗體產生。在需要降低效應子功能的情況下,應當理解,分子可經工程改造以呈非糖基化形式表達。這類碳水化合物修飾可通過例如改變抗體序列內的一個或多個糖基化位點來實現。即,可進行一個或多個氨基酸置換,使一個或多個可變區構架糖基化位點消除,從而消除該位點的糖基化(參見例如美國專利No.5,714,350和6,350,861)。相反,可通過在一個或多個另外的糖基化位點進行工程改造來給含有Fc的分子賦予增強的效應子功能或改善的結合。
另外或者作為另一種選擇,可制備糖基化組成改變的Fc變體,例如巖藻糖基殘基量減少的低巖藻糖基化抗體或對分GlcNAc結構增加的抗體。已證明這些及類似的經改變的糖基化模式可增加抗體的ADCC能力。經工程改造的糖型可通過本領域技術人員已知的任何方法來產生,例如通過使用經工程改造的或變體表達株、通過與一種或多種酶(例如N-乙酰葡糖胺基轉移酶III(GnTI 11))共表達、通過在多種生物體或來自多種生物體的細胞系中表達包含Fc區的分子或通過在已表達包含Fc區的分子后修飾碳水化合物來產生。參見例如Shields,R.L.等人,(2002)J.Biol.Chem.(《生物化學雜志》)277:26733-26740;Umana等人,(1999)Nat.Biotech.(《自然生物技術》)17:176-1以及歐洲專利No:EP 1,176,195;PCT公開WO 03/035835;WO 99/54342;Umana等人,1999,Nat.Biotechnol.(《自然生物技術》)17:176-180;Davies等人,20017Biotechnol Bioeng(《生物技術和生物工程》)74:288-294;Shields等人,2002,J Biol Chem(《生物化學雜志》)277:26733-26740;Shinkawa等人,2003,J Biol Chem(《生物化學雜志》)278:3466-3473);美國專利No.6,602,684;美國專利No.10/277,370;10/113,929;PCT WO 00/61739A1;PCT WO 01/292246A1;PCT WO 02/311140A1;PCT WO 02/30954A1;PotillegentTM技術(Biowa,Inc.);GlycoMAbTM糖基化工程改造技術(GLYCART biotechnology AG);WO 00061739;EA01229125;美國專利No.2003/0115614;Okazaki等人,2004,JMB,336:1239-49。
IX.調節劑表達
a.概述
編碼所需CD46調節劑的DNA容易使用常規程序(例如通過使用能夠特異性結合至編碼抗體重鏈和輕鏈的基因的寡核苷酸探針)進行分離和測序。如果調節劑為抗體,則經分離和亞克隆的雜交瘤細胞(或來源于噬菌體或酵母的集落)可用作該DNA的優選來源。如果需要,可進一步如本文所述操縱核酸以產生包括融合蛋白或嵌合抗體、人源化抗體或全人抗體的作用劑(agent)。更具體而言,分離的DNA(其可經修飾)可用于克隆恒定區和可變區序列以用于如美國專利No.7,709,611中所述的抗體制造。
該例示性方法需要從所選的細胞提取RNA、轉化成cDNA以及使用抗體特異性引物通過PCR擴增。合適的引物是本領域所熟知的并且如本文所例示的,容易從多種商業來源商購獲得。應當理解,為表達通過篩選組合文庫分離的重組人或非人抗體,將編碼抗體的DNA克隆進重組表達載體中并引入宿主細胞中,包括哺乳動物細胞、昆蟲細胞、植物細胞、酵母和細菌。在另外其他實施例中,將調節劑引入原本不產生所需構建體的猿COS細胞、NS0細胞、中國倉鼠卵巢(CHO)細胞或骨髓瘤細胞中并由其表達。如下文將更詳細論述的,表達所需調節劑的轉化細胞可相對大量地生長以提供融合構建體或免疫球蛋白的臨床和商業供應。
無論編碼CD46調節劑的所需部分的核酸是以合成方式獲自或來源于噬菌體展示技術、酵母文庫、基于雜交瘤的技術還是獲自商業來源,應當了解本發明明確涵蓋編碼CD46調節劑(包括融合蛋白和抗CD46抗體或其抗原結合片段或衍生物)的核酸分子和序列。本發明進一步涵蓋在高嚴格雜交條件下或者在中等或較低嚴格雜交條件下(例如如下文所定義的),與互補于具有編碼本發明調節劑或其片段或變體的多核苷酸序列的核酸的多核苷酸雜交的核酸或核酸分子(例如多核苷酸)。本文所用的術語“核酸分子”或“分離的核酸分子”意在包括至少DNA分子和RNA分子。核酸分子可為單鏈或雙鏈,但優選為雙鏈DNA。此外,本發明包括任何摻有該編碼調節劑的多核苷酸的載體或構建體,包括但不限于載體、質粒、宿主細胞、粘粒或病毒構建體。
術語“分離的核酸”意指該核酸(i)例如通過聚合酶鏈反應(PCR)體外擴增,(ii)通過克隆重組產生,(iii)例如通過裂解和膠凝-電泳分級分離而純化,或(iv)例如通過化學合成而合成。分離的核酸為可用于通過重組DNA技術操縱的核酸。
更具體而言,還提供編碼調節劑(包括本發明抗體的一條或兩條鏈)或其片段、衍生物、突變蛋白或變體的核酸、足以用作雜交探針的多核苷酸、用于鑒別、分析、突變或擴增編碼多肽的多核苷酸的PCR引物或測序引物、用于抑制多核苷酸表達的反義核酸和上述各者的互補序列。核酸可為任何長度。其長度可為例如5、10、15、20、25、30、35、40、45、50、75、100、125、150、175、200、250、300、350、400、450、500、750、1,000、1,500、3,000、5,000個或更多個核苷酸,和/或其可包含一條或多條其他序列(例如調節序列)和/或為較大核酸(例如載體)的一部分。這些核酸可為單鏈或雙鏈且可包含RNA和/或DNA核苷酸以及其人造變體(例如肽核酸)。編碼本發明的調節劑(包括抗體或其免疫反應性片段或衍生物)的核酸優選已如上文所述分離。
b.雜交和同一性
如所指出,本發明還提供在特定雜交條件下與其他核酸雜交的核酸。使核酸雜交的方法是本領域所熟知的。參見例如Current Protocols in Molecular Biology(《現代分子生物學實驗技術》),紐約約翰父子出版社(John Wiley&Sons,N.Y.)(1989),6.3.1-6.3.6。出于本申請案的目的,中等嚴格雜交條件使用含有5×氯化鈉/檸檬酸鈉(SSC)、0.5%SDS、1.0mM EDTA(pH8.0)的預洗滌溶液,含有約50%甲酰胺、6×SSC的雜交緩沖液和55℃的雜交溫度(或其他類似雜交溶液,例如含有約50%甲酰胺的溶液,使用42℃的雜交溫度),以及60℃、在0.5×SSC、0.1%SDS中的洗滌條件。嚴格雜交條件在45℃下在6×SSC中進行雜交,隨后在68℃下在0.1×SSC、0.2%SDS中洗滌一次或多次。此外,本領域技術人員可操縱雜交和/或洗滌條件以提高或降低雜交嚴格性,使得包含彼此具有至少65%、70%、75%、80%、85%、90%、95%、98%或99%同一性的核苷酸序列的核酸通常仍保持彼此雜交。更一般而言,出于本公開的目的,關于核酸序列的術語“與...實質相同”可視為核苷酸序列展現與參考核酸序列具有至少約85%或90%或95%或97%序列同一性。
影響雜交條件的選擇的基本參數以及設計合適條件的指導例如由Sambrook,Fritsch和Maniatis(1989,Molecular Cloning:A Laboratory Manual(《分子克隆:實驗室手冊》),紐約冷泉港的冷泉港實驗室出版社(Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Y.),第9章和第11章;以及Current Protocols in Molecular Biology(《現代分子生物學實驗室方法》),1995,Ausubel等人編輯,約翰父子公司(John Wiley&Sons,Inc.),章節2.10和6.3-6.4)描述,并且容易由本領域一般技術人員根據例如核酸的長度和/或堿基組成來確定。
應進一步理解,根據本發明,核酸可單獨存在或與可能同源或異源的其他核酸組合存在。在優選的實施例中,核酸與相對于所述核酸而言可能同源或異源的表達控制序列功能性連接。就此而論,術語“同源”意指核酸也天然地與該表達控制序列功能性連接,術語“異源”意指核酸并非天然地與該表達控制序列功能性連接。
c.表達
若核酸(例如表達RNA和/或蛋白質或肽的核酸)與表達控制序列以使得所述核酸的表達或轉錄受所述表達控制序列控制或影響的方式彼此共價連接,則它們彼此功能性連接。若核酸待翻譯成功能性蛋白質,則在表達控制序列與編碼序列功能性連接下,誘導所述表達控制序列可使所述核酸轉錄,而不會引起所述編碼序列的移碼或所述編碼序列不能夠被翻譯成所需蛋白質或肽。
根據本發明,術語“表達控制序列”包含啟動子、核糖體結合位點、增強子和調節基因轉錄或mRNA翻譯的其他控制元件。在本發明的特定實施例中,表達控制序列可經調節。表達控制序列的確切結構可隨物種或細胞類型而異,但一般包含分別涉及轉錄和翻譯的起始的5'非轉錄序列與5'-和3'-非翻譯序列,例如TATA盒、加帽序列、CAAT序列等等。更具體而言,5'-非轉錄表達控制序列包含包括用于對功能性連接的核酸進行轉錄控制的啟動子序列的啟動子區。表達控制序列還可包含增強子序列或上游激活序列(upstream activator sequence)。
根據本發明,術語“啟動子”或“啟動子區”是指位于所表達的核酸序列的上游(5')且通過提供RNA聚合酶的識別和結合位點來控制該序列的表達的核酸序列。啟動子區可包括針對涉及調節基因轉錄的其他因子的其他識別和結合位點。啟動子可控制原核或真核基因的轉錄。此外,啟動子可為誘導型的且可響應誘導劑而起始轉錄,或者如果轉錄不受誘導劑控制,則可為組成型的。如果不存在誘導劑,則受誘導型啟動子控制的基因不表達或僅以很小程度表達。在誘導劑的存在下,該基因被打開或轉錄水平增加。這一般通過特定轉錄因子的結合來介導。
根據本發明的優選啟動子包括SP6、T3和T7聚合酶的啟動子、人U6RNA啟動子、CMV啟動子和它們的人造雜交啟動子(例如CMV)(其中一部分或一些部分與其他細胞蛋白質例如人GAPDH(甘油醛-3-磷酸脫氫酶)的基因的啟動子的一部分或一些部分融合),并且包括或不包括額外內含子。
根據本發明,術語“表達”以其最一般含義使用,包含RNA的產生或RNA和蛋白質/肽的產生。其也包括核酸的部分表達。此外,表達可短暫或穩定進行。
在一個優選的實施例中,根據本發明,核酸分子存在于適當時具有控制該核酸的表達的啟動子的載體中。術語“載體”在本文中以其最一般的含義使用,包含任何用于核酸而使所述核酸例如能夠引入原核和/或真核細胞中以及適當時整合進基因組中的中間載體。這類載體優選在細胞中復制和/或表達。載體可包含質粒、噬菌粒、噬菌體或病毒基因組。本文所用的術語“質粒”一般是指染色體外遺傳物質的構建體,通常為環狀DNA雙鏈體,其可獨立于染色體DNA進行復制。
在實施本發明時,應當理解可任選使用分子生物學、微生物學和重組DNA技術中的許多常規技術。這類常規技術與本文所定義的載體、宿主細胞和重組方法相關。這些技術是眾所周知的并且例如在如下文獻中進行說明:Berger和Kimmel,Guide to Molecular Cloning Techniques(《分子克隆技術指南》),Methods in Enzymology(《酶學方法》),第152卷,學術出版社,加州圣地亞哥(Academic Press,Inc.,San Diego,Calif.);Sambrook等人,Molecular Cloning-A Laboratory Manual(《分子克隆-實驗室手冊》)(第3版),第1-3卷,紐約冷泉港的冷泉港實驗室出版社(Cold Spring Harbor Laboratory,Cold Spring Harbor,N.Y.),2000年以及Current Protocols in Molecular Biology(《現代分子生物學實驗方法》),F.M.Ausubel等人編輯(出處同上)。其他有用的參考文獻,例如關于細胞分離和培養(例如關于后續核酸或蛋白質分離)包括:Freshney(1994)Culture of Animal Cells,a Manual of Basic Technique(《動物細胞的培養:基礎技術手冊》),第三版,紐約Wiley-Liss出版社,以及其中引用的文獻;Payne等人,(1992)Plant Cell and Tissue Culture in Liquid Systems(《液體系統中的植物細胞和組織培養》),紐約約翰·威利父子出版公司(John Wiley&Sons,Inc.New York,N.Y.);Gamborg和Phillips(編輯)(1995)Plant Cell,Tissue and Organ Culture;Fundamental Methods Springer Lab Manual(《植物細胞、組織和器官培養:基本方法-斯普林格實驗室手冊》),施普林格出版社(Springer-Verlag)(柏林、海德爾堡、紐約);以及Atlas和Parks(編輯)The Handbook of Microbiological Media(《微生物培養基手冊》)(1993)弗羅里達州伯克萊屯的CRC出版社(CRC Press,Boca Raton,Fla)。制備核酸的方法(例如通過體外擴增、從細胞純化或化學合成)、操縱核酸的方法(例如定點誘變、通過限制酶消化、連接等)以及各種可用于操縱和制備核酸的載體、細胞系等等在如上參考文獻中進行了描述。另外,基本上任何多核苷酸(包括例如,經標記或生物素化的多核苷酸)均可從多個商業來源中的任一個定制或標準訂購。
因此,在一個方面中,本發明提供使本發明的抗體或其部分可以重組表達的重組宿主細胞。通過在這類重組宿主細胞中表達而產生的抗體在本文中稱為重組抗體。本發明還提供這類宿主細胞的子代細胞,以及由其產生的抗體。
本文所用的術語“重組宿主細胞”(或簡稱為宿主細胞)意指已引入重組表達載體的細胞。應當理解,重組宿主細胞和宿主細胞不僅意指特定受試細胞,而是還意指這種細胞的子代。因為某些修飾可能因突變或環境影響而在后續各代中發生,所以這種子代實際上可能與親本細胞不相同,但其仍包括在本文所用的術語宿主細胞的范疇內。這類細胞可包含如上文所述的根據本發明的載體。
在另一個方面中,本發明提供制備如本文所述的抗體或其一部分的方法。根據一個實施例,所述方法包括培養用如上文所述的載體轉染或轉化的細胞,以及回收該抗體或其部分。
如上文所指出,本發明的抗體(或其片段或變體)的表達優選包括含有編碼所需抗CD46抗體的多核苷酸的表達載體。本領域技術人員熟知的方法可用于構建包含抗體編碼序列和適當的轉錄及翻譯控制信號的表達載體。這些方法包括例如體外重組DNA技術、合成技術和體內遺傳重組。因此,本發明的實施例提供可復制載體,該載體包含與啟動子有效連接的編碼本發明抗CD46抗體(例如完全抗體、抗體的重鏈或輕鏈、抗體的重鏈或輕鏈可變域或它們的部分,或者重鏈或輕鏈CDR、單鏈Fv或它們的片段或變體)的核苷酸序列。在優選的實施例中,這類載體可包括編碼抗體分子的重鏈(或其片段)的核苷酸序列、編碼抗體的輕鏈(或其片段)或重鏈與輕鏈二者的核苷酸序列。
一旦本發明的核苷酸已根據本文教導分離和修飾,則可將其用于產生包括抗CD46抗體或其片段的所選的調節劑。
X.調節劑產生和純化
使用本領域公認的分子生物學技術和當前蛋白質表達方法,可產生相當大數量的所需調節劑。更具體而言,可將編碼調節劑(例如如上文所述獲得以及經工程改造的抗體)的核酸分子整合到所熟知的以及市售的蛋白質產生系統(包含各種類型的宿主細胞)中以提供臨床前、臨床或商業數量的所需醫藥產品。應當理解,在優選的實施例中,將編碼調節劑的核酸分子工程改造進載體或表達載體中,所述載體或表達載體使其有效整合進所選的宿主細胞中并隨后提供高表達水平的所需CD46調節劑。
優選地,編碼CD46調節劑的核酸分子和包含這些核酸分子的載體可用于轉染合適的哺乳動物、植物、細菌或酵母宿主細胞,但應當理解,可使用原核系統產生調節劑。轉染可通過任何將多核苷酸引入宿主細胞中的已知方法來進行。將異源多核苷酸引入哺乳動物細胞中的方法是本領域所熟知的,包括葡聚糖介導的轉染、磷酸鈣沉淀、聚凝胺(polybrene)介導的轉染、原生質體融合、電穿孔、多核苷酸封裝于脂質體以及DNA直接顯微注射進細胞核中。另外,核酸分子可通過病毒載體引入哺乳動物細胞中。轉化哺乳動物細胞的方法是本領域所熟知的。參見例如美國專利No.4,399,216、No.4,912,040、No.4,740,461和No.4,959,455。此外,轉化植物細胞的方法是本領域所熟知的,包括例如農桿菌(Agrobacterium)介導的轉化、生物射彈轉化、直接注射、電穿孔以及病毒轉化。轉化細菌和酵母細胞的方法也是本領域所熟知的。
此外,可將宿主細胞用兩種本發明的表達載體(例如編碼衍自重鏈的多肽的第一載體和編碼衍自輕鏈的多肽的第二載體)共轉染。兩種載體可含有使得能夠實質上同等表達重鏈和輕鏈多肽的相同選擇性標記。或者,可使用編碼且能夠表達重鏈和輕鏈多肽二者的單一載體。在這種情況下,優選將輕鏈置于重鏈之前以避免過量的毒性游離重鏈。重鏈和輕鏈的編碼序列可包含cDNA或基因組DNA。
a.宿主表達系統
多種宿主表達載體系統(許多可商購獲得)與本文的教導相容且可用于表達本發明的調節劑。這類宿主表達系統代表可使所關注的編碼序列被表達且隨后純化的載體,也代表當用適當核苷酸編碼序列轉化或轉染時可原位表達本發明的分子的細胞。這類系統包括但不限于:轉染有含有調節劑編碼序列的重組噬菌體DNA、質粒DNA或粘粒DNA表達載體的微生物如細菌(例如大腸桿菌、枯草芽孢桿菌(B.subtilis)、鏈霉菌屬(streptomyces));轉染有含有調節劑編碼序列的重組酵母表達載體的酵母(例如酵母屬(Saccharomyces)、畢赤酵母屬(Pichia));轉染有含有調節劑編碼序列的重組病毒表達載體(例如桿狀病毒)的昆蟲細胞系統;感染有含有調節劑編碼序列的重組病毒表達載體(例如花椰菜花葉病毒,CaMV;煙草花葉病毒,TMV)或轉染有含有調節劑編碼序列的重組質粒表達載體(例如Ti質粒)的植物細胞系統(例如煙草屬(Nicotiana)、擬南芥屬(Arabidopsis)、浮萍、玉米、小麥、馬鈴薯等);或具有含有衍自哺乳動物細胞基因組的啟動子(例如金屬硫蛋白啟動子)或衍自哺乳動物病毒的啟動子(例如腺病毒晚期啟動子;牛痘病毒7.5K啟動子)的重組表達構建體的哺乳動物細胞系統(例如COS、CHO、BHK、293、3T3細胞)。
在細菌系統中,可根據所表達分子的預定用途有利地選擇多種表達載體。例如,當要產生大量的該蛋白質時,為了產生調節劑的藥物組合物,引導易于純化的融合蛋白產物的高水平表達的載體可能是合乎需要的。這類載體包括但不限于:大腸桿菌表達載體pUR278(Ruther等人,EMBO 1.2:1791(1983)),其中編碼序列可單獨地連接進該載體中與lac Z編碼區同框,使得融合蛋白得以產生;pIN載體(Inouye&Inouye,Nucleic Acids Res.(《核酸研究》)13:3101-3109(1985);Van Heeke&Schuster,J.Biol.Chem.(《生物化學雜志》)24:5503-5509(1989))等等。pGEX載體也可用于將外來多肽表達為具有谷胱甘肽5-轉移酶(GST)的融合蛋白。一般而言,這類融合蛋白為可溶性的,可通過吸附及結合至基質谷胱甘肽瓊脂糖珠然后在游離谷胱甘肽存在下洗脫,來容易地從裂解的細胞純化。pGEX載體設計成包括凝血酶或因子Xa蛋白酶切割位點,使得所克隆的標靶基因產物可從GST部分釋放出來。
在昆蟲系統中,苜蓿銀紋夜蛾(Autographa californica)核型多角體病毒(AcNPV)可用作表達外來基因的載體。這種病毒在草地貪夜蛾(Spodoptera frugiperda)細胞中生長。可將編碼序列單獨地克隆進該病毒的非必需區(例如多角體蛋白基因)中并置于AcNPV啟動子(例如多角體蛋白啟動子)的控制下。
在哺乳動物宿主細胞中,可將多種基于病毒的表達系統用于引入所需核苷酸序列。在使用腺病毒作為表達載體的情形中,可將所關注的編碼序列連接至腺病毒轉錄/翻譯控制復合物,例如晚期啟動子和三聯前導序列。然后可通過體外或體內重組,將該嵌合基因插入在腺病毒基因組中。插入在病毒基因組的非必需區(例如區域E1或E3)中將產生在受感染宿主中有活力且能夠表達該分子的重組病毒(例如參見Logan和Shenk,Proc.Natl.Acad.Sci.USA(《美國科學院院刊》)8 1:355-359(1984))。所插入的編碼序列的有效翻譯也可能需要特定的起始信號。這些信號包括ATG起始密碼子和相鄰序列。此外,該起始密碼子必須與所需的編碼序列的閱讀框架同相(in phase),以確保整個插入物的翻譯。這些外源的翻譯控制信號和起始密碼子可具有多種來源(天然來源和合成來源二者)。表達效率可通過包括適當的轉錄增強子元件、轉錄終止子等來提高(參見例如Bittner等人,Methods in Enzymol.(《酶學方法》)153:51-544(1987))。因而,可用作表達宿主的相容的哺乳動物細胞系是本領域所熟知的且包括可得自美國典型培養物保藏中心(American Type Culture Collection,ATCC)的許多永生化細胞系。這些細胞尤其包括中國倉鼠卵巢(CHO)細胞、NS0細胞、SP2細胞、HEK-293T細胞、293Freestyle細胞(美國生命科技公司(Life Technologies))、NIH-3T3細胞、海拉細胞(HeLa cell)、幼倉鼠腎(BHK)細胞、非洲綠猴腎細胞(COS)、人肝細胞癌細胞(例如Hep G2)、A549細胞以及多種其他細胞系。
為長期高收率產生重組蛋白質,穩定表達是優選的。因此,可用本領域公認的標準技術來工程改造出穩定表達所選的調節劑的細胞系。可用受適當的表達控制元件(例如啟動子、增強子、序列、轉錄終止子、多腺苷酸化位點等)控制的DNA和用選擇性標記轉化宿主細胞,而非使用含有病毒復制起點的表達載體。引入外來DNA后,可讓經工程改造的細胞在富集培養基中生長1-2天,然后轉入選擇培養基中。重組質粒中的選擇性標記賦予對選擇的抗性并且讓細胞將質粒穩定整合進其染色體中并生長至形成轉化灶(foci),轉化灶繼而可進行克隆并擴增成細胞系。這個方法可有利地用于對表達該分子的細胞系進行工程改造。這類經工程改造的細胞系尤其可用于篩選和評價與該分子直接或間接相互作用的組合物。
多種選擇系統是本領域所熟知的且可以使用,包括但不限于:單純皰疹病毒胸苷激酶(Wigler等人,Cell(《細胞》)11:223(1977))、次黃嘌呤鳥嘌呤磷酸核糖轉移酶(Szybalska&Szybalski,Proc.Natl.Acad.Sci.USA(《美國科學院院刊》)48:202(1992))和腺嘌呤磷酸核糖轉移酶(Lowy等人,Cell(《細胞》)22:8 17(1980))基因,它們分別可用于tk細胞、hgprt細胞或aprt細胞中。此外,抗代謝物抗性可用作選擇以下基因的基礎:dhfr,其賦予對甲氨喋呤的抗性(Wigler等人,Natl.Acad.Sci.USA(《美國科學院院刊》)77:357(1980);O'Hare等人,Proc.Natl.Acad.Sci.USA(《美國科學院院刊》)78:1527(1981));gpt,其賦予對霉酚酸的抗性(Mulligan和Berg,Proc.Natl.Acad.Sci.USA(《美國科學院院刊》)78:2072(1981));neo,其賦予對氨基糖苷G-418的抗性(Clinical Pharmacy(《臨床藥學》)12:488-505;Wu和Wu,Biotherapy(《生物療法》)3:87-95(1991);Tolstoshev,Ann.Rev.Pharmacol.Toxicol.(《藥理學與毒理學年度評論》)32:573-596(1993);Mulligan,Science(《科學》)260:926-932(1993);以及Morgan和Anderson,Ann.Rev.Biochem.(《生物化學年度評論》)62:191-217(1993);TIB TECH 11(5):155-2 15(1993年5月));和hygro,其賦予對潮霉素的抗性(Santerre等人,Gene(《基因》)30:147(1984))。可按常規將重組DNA技術領域通常已知的方法應用于選擇所需的重組克隆,這類方法例如描述于如下文獻中:Ausubel等人(編輯),Current Protocols in Molecular Biology(《現代分子生物學實驗方法》),紐約約翰·威利父子出版公司(John Wiley&Sons,NY)(1993);Kriegler,Gene Transfer and Expression,A Laboratory Manual(《基因轉移和表達-實驗室手冊》),Stockton Press,NY(1990);以及第12章和第13章,Dracopoli等人(編輯),Current Protocols in Human Genetics(《當代人類遺傳學實驗方法》),紐約約翰·威利父子出版公司(1994);Colberre-Garapin等人,J.Mol.Biol.(《分子生物學雜志》)150:1(1981)。應當理解,一種尤其優選的確立穩定高收率細胞系的方法包括谷氨酰胺合成酶基因表達系統(GS系統),其提供在某些條件下增強表達的有效方法。該GS系統在EP專利0 216 846、0 256 055、0 323 997和0 338 841中完整或部分地進行了論述,將這些專利每一者以引用的方式并入本文。
另外,可選擇調節所插入序列的表達或以所需的特定方式修飾和加工基因產物的宿主細胞株。蛋白質產物的這類修飾(例如糖基化)和加工(例如切割)對于蛋白質的功能和/或純化可能是重要的。不同宿主細胞具有用于蛋白質及基因產物的翻譯后加工和修飾的特征性和特異性機制。如本領域已知的,可選擇適當細胞系或宿主系統以確保對所表達的多肽進行所需的修飾和加工。為此,具有用于初級轉錄物的適當加工、基因產物的糖基化和磷酸化的細胞機構的真核宿主細胞可尤其有效用于本發明。因此,尤其優選的哺乳動物宿主細胞包括但不限于CHO、VERY、BHK、HeLa、COS、NS0、MDCK、293、3T3、W138以及乳腺癌細胞系(例如BT483、Hs578T、HTB2、BT2O和T47D)以及正常乳腺細胞系(例如CRL7O3O和HsS78Bst)。根據調節劑和所選的產生系統,本領域技術人員可容易地選擇和優化適當的宿主細胞以有效表達該調節劑。
b.化學合成
除了上述宿主細胞系統外,應當理解本發明的調節劑可用本領域已知的技術以化學方法合成(例如參見Creighton,1983,Proteins:Structures and Molecular Principles(《蛋白質:結構和分子原理》),W.H.Freeman&Co.,N.Y.,以及Hunkapiller,M.等人,1984,Nature(《自然》)310:105-111)。例如,對應于本發明多肽片段的肽可通過使用肽合成儀來合成。此外,如果需要,非經典氨基酸或化學氨基酸類似物可作為置換或添加引入多肽序列中。非經典氨基酸包括但不限于:常見氨基酸的D-異構體、2,4-二氨基丁酸、a-氨基異丁酸、4-氨基丁酸、Abu、2-氨基丁酸、g-Abu、e-Ahx、6-氨基己酸、Aib、2-氨基異丁酸、3-氨基丙酸、鳥氨酸、正亮氨酸、正纈氨酸、羥脯氨酸、肌氨酸、瓜氨酸、高瓜氨酸、磺丙氨酸、叔丁基甘氨酸、叔丁基丙氨酸、苯基甘氨酸、環己基丙氨酸、b-丙氨酸、氟代氨基酸、設計氨基酸(designer amino acid)(例如b-甲基氨基酸、Ca-甲基氨基酸、Na-甲基氨基酸)以及一般氨基酸類似物。此外,氨基酸可以是D型(右旋)或L型(“左旋”)的。
c.轉基因系統
還可通過產生對所關注免疫球蛋白重鏈和輕鏈序列(或其片段或衍生物或變體)而言是轉基因的哺乳動物或植物以及以可回收形式產生所需化合物,來以轉基因方式產生本發明的CD46調節劑。關于在哺乳動物中的轉基因生產,例如,抗CD46抗體可在山羊、奶牛或其他哺乳動物的乳汁中產生并從其中回收。參見例如美國專利No.5,827,690、No.5,756,687、No.5,750,172和No.5,741,957。在一些實施例中,用如上文所述的CD46或其免疫原性部分免疫包含人免疫球蛋白基因座的非人轉基因動物。在植物中制備抗體的方法例如描述于美國專利No.6,046,037和5,959,177中。
根據本文的教導,非人轉基因動物或植物可通過使用標準轉基因技術將一個或多個編碼本發明的CD46調節劑的核酸分子引入動物或植物中來產生。參見Hogan以及美國專利No.6,417,429。用于制備轉基因動物的轉基因細胞可為胚胎干細胞或體細胞或受精卵。轉基因非人生物體可為嵌合、非嵌合雜合子以及非嵌合純合子。參見例如Hogan等人,Manipulating the Mouse Embryo:A Laboratory Manual 2nd ed.(《操縱小鼠胚:實驗室手冊-第2版》),冷泉港實驗室出版社(Cold Spring Harbor Press)(1999);Jackson等人,Mouse Genetics and Transgenics:A Practical Approach(《小鼠遺傳學和轉基因:實用手冊》),牛津大學出版社(Oxford University Press)(2000);以及Pinkert,Transgenic Animal Technology:A Laboratory Handbook(《轉基因動物技術:實驗室手冊》),美國學術出版社(Academic Press)(1999)。在一些實施例中,轉基因非人動物具有由編碼例如所關注的重鏈和/或輕鏈的靶向構建體作出的定向破壞和替換。在一個實施例中,轉基因動物包含并表達編碼與CD46的重鏈和輕鏈特異性結合的核酸分子。雖然抗CD46抗體可在任何轉基因動物中制備,但在尤其優選的實施例中,非人動物為小鼠、大鼠、綿羊、豬、山羊、牛或馬。在另外的實施例中,非人轉基因動物在血液、乳汁、尿、唾液、眼淚、粘液及其他體液中表達所需醫藥產物,該產物容易使用本領域公認的純化技術從這類體液中獲得。
由不同細胞系表達或在轉基因動物中表達的調節劑(包括抗體)很可能會具有彼此不同的糖基化模式。然而,由本文所提供的核酸分子編碼或包含本文所提供的氨基酸序列的所有調節劑均為本發明的一部分,而不管分子的糖基化狀態如何,且更一般地說,不管翻譯后修飾存在與否。另外,本發明涵蓋在翻譯期間或之后,例如通過糖基化、乙酰化、磷酸化、酰胺化、由已知保護基/封閉基團衍生、蛋白水解切割、與抗體分子或其他細胞配體鍵合等進行差異修飾的調節劑。多種化學修飾中的任一種可通過已知技術進行,包括但不限于:通過溴化氰、胰蛋白酶、胰凝乳蛋白酶、木瓜蛋白酶、V8蛋白酶、NaBH4進行的特定化學切割,乙酰化,甲酰化,氧化,還原,在衣霉素(tunicamycin)存在下的代謝合成等。本發明還涵蓋各種翻譯后修飾,包括例如N-連接或O-連接碳水化合物鏈、N末端或C末端加工、化學部分附接于氨基酸主鏈、N-連接或O-連接碳水化合物鏈的化學修飾以及由原核宿主細胞表達引起的N末端甲硫氨酸殘基的添加或缺失。此外,如正文和下文的“實例”中所述,多肽也可用可檢測標記如酶標記、熒光標記、放射性同位素標記或親和標記進行修飾,以便調節劑的檢測和分離。
d.純化
一旦本發明的調節劑通過重組表達或本文所公開的其他技術中的任一者產生,其可通過本領域已知的任何用于純化免疫球蛋白的方法純化,或更一般地通過任何其他用于純化蛋白質的標準技術純化。就此而言,可分離調節劑。如本文所用,分離的CD46調節劑為已被鑒別和分離和/或從其自然環境的組分回收的調節劑。其自然環境的污染物組分為將會干擾該多肽的診斷或治療用途的物質,且可包括酶、激素及其他蛋白質或非蛋白質溶質。分離的調節劑包括原位處于重組細胞內的調節劑,因為該多肽自然環境的至少一種組分將不存在。
當使用重組技術時,CD46調節劑(例如抗CD46抗體或其衍生物或片段)可在細胞內、在周質間隙中產生或直接分泌到培養基中。如果所需分子在細胞內產生,則作為第一步驟,微粒碎片(宿主細胞或溶解的片段)可例如通過離心或超濾移除。例如,Carter等人,Bio/Technology(《生物技術》)10:163(1992)描述了分離被分泌至大腸桿菌周質間隙中的抗體的程序。簡而言之,在乙酸鈉(pH 3.5)、EDTA和苯基甲基磺酰氟(PMSF)的存在下經約30分鐘使細胞糊狀物(cell paste)解凍。可通過離心移除細胞碎片。當抗體分泌到培養基中時,通常首先使用市售蛋白質濃縮過濾器(例如Amicon或Millipore Pellicon超濾裝置)濃縮得自這類表達系統的上清液。可在任何上述步驟中包括蛋白酶抑制劑如PMSF以抑制蛋白水解,并且可包括抗生素以防止外來污染物生長。
從細胞制備的調節劑(例如fc-CD46或抗CD46抗體)組合物可使用例如羥基磷灰石色譜、凝膠電泳、透析和親和色譜來純化,其中親和色譜是優選的純化技術。A蛋白作為親和配體的適合性取決于物種和存在于所選的構建體中的任何免疫球蛋白Fc域的同種型。A蛋白可用于純化基于人IgG1、IgG2或IgG4重鏈的抗體(Lindmark等人,J Immunol Meth(《免疫學方法雜志》)62:1(1983))。對于所有小鼠同種型以及對于人IgG3均推薦使用G蛋白(Guss等人,EMBO J 5:1567(1986))。親和配體所附接的基質最常為瓊脂糖,不過也可利用其他基質。與用瓊脂糖可實現的流動速率和加工時間相比,機械穩定的基質(例如可控孔度玻璃或聚(苯乙烯二乙烯基)苯)使流動速率更快且加工時間更短。在該抗體包含CH3域的情況中,Bakerbond ABXTM樹脂(新澤西州菲利普斯堡的J.T.Baker公司(J.T.Baker;Phillipsburg,N.J.))可用于純化。取決于待回收的抗體,也可利用其他蛋白質純化技術,例如離子交換柱分級分離、乙醇沉淀、反相HPLC、二氧化硅色譜、肝素色譜、陰離子或陽離子交換樹脂(例如聚天冬氨酸柱)瓊脂糖色譜、色譜聚焦、SDS-PAGE和硫酸銨沉淀。在尤其優選的實施例中,本發明的調節劑將至少部分使用A蛋白或G蛋白親和色譜來純化。
XI.綴合的CD46調節劑
一旦本發明的調節劑已根據本文教導純化,其即可與藥物活性部分或診斷性部分或生物相容性修飾劑連接、融合、綴合(例如以共價或非共價方式)或以別的方式締合。本文所用的術語“綴合物”將以廣義使用且認為意指任何與所公開的調節劑締合的分子,而無論締合方法如何。就此而言,應當理解這類綴合物可包含肽、多肽、蛋白質、聚合物、核酸分子、小分子、模擬劑、合成藥物、無機分子、有機分子和放射性同位素。此外,如上文所指出,所選的綴合物可共價或非共價連接至調節劑且展現出各種摩爾比,這至少部分取決于用于實現綴合的方法。
在優選的實施例中,顯而易見,本發明的調節劑可與賦予所選的特征的蛋白質、多肽或肽(例如生物毒素、生物標記物、純化標簽等)綴合或締合。更一般地說,在所選的實施例中,本發明涵蓋與異源蛋白質或多肽重組融合或化學綴合(包括共價和非共價綴合二者)的調節劑或其片段的用途,其中該多肽包含至少10個、至少20個、至少30個、至少40個、至少50個、至少60個、至少70個、至少80個、至少90個或至少100個氨基酸。該構建體不一定需要直接連接,而可通過接頭序列進行。例如,通過將本發明的調節劑與對特定細胞表面受體具有特異性的抗體融合或綴合,抗體可用來在體外或體內使異源多肽靶向表達CD46的特定細胞類型。此外,與異源多肽融合或綴合的調節劑還可用于體外免疫測定法且可與本領域已知的純化方法相容。參見例如國際專利公開No.WO 93/21232;歐洲專利No.EP 439,095;Naramura等人,1994,Immunol.Lett.(《免疫學快訊》)39:91-99;美國專利No.5,474,981;Gillies等人,1992,PNAS 89:1428-1432;以及Fell等人,1991,J.Immunol.(《免疫學雜志》)146:2446-2452。
a.生物相容性修飾劑
在一個優選的實施例中,本發明的調節劑可視需要與可用于調節、改變、改善或緩和調節劑特征的生物相容性修飾劑綴合或以別的方式締合。例如,體內半衰期延長的抗體或融合構建體可通過附接諸如市售聚乙二醇(PEG)或類似生物相容性聚合物之類的相對高分子量聚合物分子來產生。本領域技術人員應當理解,PEG可以許多不同分子量及分子構型獲得,可選擇這些分子量和分子構型以賦予抗體特定性質(例如可定制半衰期)。PEG可在有或無多官能接頭的情況下附接至調節劑或抗體片段或衍生物,該附接是通過PEG與所述抗體或抗體片段的N末端或C末端的位點特異性綴合進行,或經由賴氨酸殘基上存在的ε-氨基進行。可使用使生物活性損失最小的線型或分支聚合物衍生(derivatization)。綴合程度可通過SDS-PAGE和質譜法來密切監測以確保PEG分子與抗體分子的最佳綴合。未反應的PEG可通過例如分子排阻色譜或離子交換色譜與抗體-PEG綴合物分離。以類似方式,所公開的調節劑可與白蛋白綴合以使抗體或抗體片段在體內更穩定或具有更長的體內半衰期。這類技術是本領域所熟知的,參見例如國際專利公開No.WO 93/15199、NO.WO 93/15200和No.WO 01/77137;以及歐洲專利No.0 413,622。其他生物相容性綴合物對于本領域普通技術人員而言是顯而易見的且容易根據本文教導鑒別。
b.診斷劑或檢測劑
在其他優選的實施例中,將本發明的調節劑或其片段或衍生物與可為生物分子(例如肽或核苷酸)或小分子或放射性同位素的診斷劑或可檢測劑綴合。這類調節劑可用于監測過度增殖障礙的發展或進展或者作為臨床測試程序的一部分來測定包括所公開的調節劑的特定療法的功效。這類標記物也可用于純化所選的調節劑、分離或離析TIC或可用于臨床前程序或毒物學研究。
這種診斷和檢測可通過將調節劑與可檢測物質偶聯來完成,這類可檢測物質包括但不限于:各種酶,包含例如辣根過氧化物酶、堿性磷酸酶、β-半乳糖苷酶或乙酰膽堿酯酶;輔基,例如但不限于鏈霉親和素/生物素和抗生物素蛋白/生物素;熒光物質,例如但不限于傘形酮、熒光素、異硫氰酸熒光素、羅丹明、二氯三嗪基胺熒光素、丹磺酰氯或藻紅蛋白;發光物質,例如但不限于魯米諾(luminol);生物發光物質,例如但不限于螢光素酶、螢光素和水母素(aequorin);放射性物質,例如但不限于碘(131I、125I、123I、121I)、碳(14C)、硫(35S)、氚(3H)、銦(115In、113In、112In、111In)和锝(99Tc)、鉈(201Ti)、鎵(68Ga、67Ga)、鈀(103Pd)、鉬(99Mo)、氙(133Xe)、氟(18F)、153Sm、177Lu、159Gd、149Pm、140La、175Yb、166Ho、90Y、47Sc、186Re、188Re、142Pr、105Rh、97Ru、68Ge、57Co、65Zn、85Sr、32P、153Gd、169Yb、51Cr、54Mn、75Se、113Sn和117Tin;使用各種正電子發射斷層攝影術的正電子發射金屬、非放射性順磁性金屬離子以及經放射性標記或與特定放射性同位素綴合的分子。在這類實施例中,適當的檢測方法是本領域所熟知的且容易從多種商業來源獲得。
如上文所指出,在其他實施例中,可將調節劑或其片段與標記序列如肽或熒光團融合,以便利純化或診斷程序(如免疫組織化學或FAC)。在優選的實施例中,標記氨基酸序列為六組氨酸肽,例如pQE載體(Qiagen)中提供的標簽等等,其中許多可商購獲得。例如,如Gentz等人,1989,Proc.Natl.Acad.Sci.USA(《美國科學院院刊》)86:821-824中所述,六組氨酸可便利融合蛋白的純化。其他可用于純化的肽標簽包括但不限于血凝素“HA”標簽(其對應于衍自流感血凝素蛋白的表位(Wilson等人,1984,Cell(《細胞》)37:767))和“flag”標簽(美國專利No.4,703,004)。
c.治療部分
如先前所提及的,調節劑或其片段或衍生物也可與治療部分綴合、連接或融合或以別的方式締合,該治療部分為例如細胞毒素或細胞毒性劑(例如細胞生長抑制劑或殺細胞劑)、治療劑或放射性金屬離子(例如α或β發射體)。如本文所用,細胞毒素或細胞毒性劑包括任何對細胞有害且可抑制細胞生長或存活的作用劑或治療部分。例子包括紫杉醇、細胞松弛素B、短桿菌肽D、溴化乙錠、吐根堿、絲裂霉素、依托泊苷、替尼泊苷(tenoposide)、長春新堿、長春堿、秋水仙堿、多柔比星、柔紅霉素、二羥基炭疽菌素、美登木素類(例如DM-1和DM-4(Immunogen,Inc.)、二酮、米托蒽醌、光輝霉素、放線菌素D、1-去氫睪酮、糖皮質素類、普魯卡因、丁卡因、利多卡因、普萘洛爾、嘌呤霉素、表柔比星和環磷酰胺以及它們的類似物或同系物。其他細胞毒素包括奧瑞他汀(auristatins),包括單甲基奧瑞他汀E(MMAE)和單甲基奧瑞他汀F(MMAF)(西雅圖遺傳公司(Seattle Genetics,Inc.))在內;鵝膏蕈堿(amanitin),例如α-鵝膏蕈堿、β-鵝膏蕈堿、γ-鵝膏蕈堿或ε-鵝膏蕈堿(海德爾堡制藥股份公司(HeidelbergPharma AG));DNA小溝結合劑,例如倍癌霉素(duocarmycin)衍生物(Syntarga,B.V.);以及經修飾的吡咯并苯并二氮雜(艸卓)二聚體(PBD,Spirogen有限公司(Spirogen,Ltd))。此外,在一個實施例中,本發明的CD46調節劑可與抗CD3結合分子締合以募集細胞毒性T細胞并且使其靶向腫瘤起始細胞(BiTE技術;參見例如Fuhrmann,S.等人,Annual Meeting of AACR Abstract(《AACR年會摘要》)No.5625(2010),將其以引用的方式并入本文中)。
另外的相容性治療部分包含:細胞毒性劑,包括但不限于抗代謝物(例如甲氨喋呤、6-巰基嘌呤、6-硫鳥嘌呤、阿糖胞苷、5-氟尿嘧啶、達卡巴嗪(decarbazine))、烷基化劑(例如氮芥、噻替哌(thioepa)、苯丁酸氮芥、美法侖、卡莫司汀(BCNU)和洛莫司汀(CCNU)、環磷酰胺、白消安、二溴甘露糖醇、鏈脲菌素、絲裂霉素C和順二氯二氨鉑(II)(DDP)、順鉑)、蒽環類抗生素(例如柔紅霉素(以前稱為道諾霉素(daunomycin))和多柔比星)、抗生素(例如更生霉素(以前稱為放線菌素)、博來霉素、光輝霉素和氨茴霉素(AMC))以及抗有絲分裂劑(例如長春新堿和長春堿)。治療部分的更詳盡列表可見于PCT專利公布WO 03/075957和美國專利No.2009/0155255,將它們每一者以引用的方式并入本文。
還可將所選的調節劑與治療部分如放射性物質或可用于綴合放射金屬離子(參見上文放射性物質的例子)的大環螯合劑綴合。在某些實施例中,大環螯合劑為1,4,7,10-四氮雜環十二烷-N,N',N”,N”-四乙酸(DOTA),其可經由接頭分子附接至抗體。這類接頭分子是本領域眾所周知的,在Denardo等人,1998,Clin Cancer Res.(《臨床癌癥研究》)4:2483;Peterson等人,1999,Bioconjug.Chem.(《生物綴合物化學》)10:553;以及Zimmerman等人,1999,Nucl.Med.Biol.(《核醫學和生物學》)26:943中有描述。
可與本發明的這個方面相容的示例性放射性同位素包括但不限于:碘(131I、125I、123I、121I)、碳(14C)、銅(62Cu、64Cu、67Cu)、硫(35S)、氚(3H)、銦(115In、113In、112In、111In)、鉍(212Bi、213Bi)、锝(99Tc)、鉈(201Ti)、鎵(68Ga、67Ga)、鈀(103Pd)、鉬(99Mo)、氙(133Xe)、氟(18F)、153Sm、177Lu、159Gd、149Pm、140La、175Yb、166Ho、90Y、47Sc、186Re、188Re、142Pr、105Rh、97Ru、68Ge、57Co、65Zn、85Sr、32P、153Gd、169Yb、51Cr、54Mn、75Se、113Sn、117Tin、225Ac、76Br和211At。其他放射性核素也可用作診斷劑和治療劑,尤其是那些能量范圍在60至4,000keV的放射性核素。取決于待治療的病癥以及所需治療概況,本領域技術人員可容易選擇適合與所公開的調節劑一起使用的放射性同位素。
本發明的CD46調節劑也可與改變給定生物學響應的治療部分或藥物綴合。也就是說,與本發明相容的治療劑或治療部分不應理解為限于經典的化學治療劑。例如,在尤其優選的實施例中,藥物部分可以是具有所需生物活性的蛋白質或多肽或其片段。這類蛋白質可包括例如:毒素,例如相思豆毒素、蓖麻毒素A、豹蛙酶(Onconase)(或另一細胞毒性RNA酶)、假單胞菌(pseudomonas)外毒素、霍亂毒素或白喉毒素;蛋白質,例如腫瘤壞死因子、α-干擾素、β-干擾素、神經生長因子、血小板衍生生長因子、組織纖溶酶原激活物、凋亡劑(例如TNF-α、TNF-β、AIM I(參見國際專利公開No.WO97/33899)、AIM II(參見國際公開No.WO97/34911)、Fas配體(Takahashi等人,1994,J.Immunol.(《免疫學雜志》),6:1567)和VEGI(參見國際公開No.WO99/23105))、血栓形成劑或抗血管生成劑(例如血管抑素或內皮抑素);或生物響應修飾劑,例如淋巴因子(例如白介素-1(“IL-1”)、白介素-2(“IL-2”)、白介素-6(“IL-6”)、粒細胞巨噬細胞集落刺激因子(“GM-CSF”)及粒細胞集落刺激因子(“G-CSF”))或生長因子(例如生長激素(“GH”))。如上文所述,使調節劑與多肽部分融合或綴合的方法是本領域已知的。除先前所公開的本發明參考文獻外,參見例如美國專利No.5,336,603;No.5,622,929;No.5,359,046;No.5,349,053;No.5,447,851和No.5,112,946;EP 307,434;EP 367,166;PCT專利公開WO 96/04388和WO 91/06570;Ashkenazi等人,1991,PNAS USA 88:10535;Zheng等人,1995,J Immunol(《免疫學雜志》)154:5590;以及Vil等人,1992,PNAS USA 89:11337,將其中的每一者以引用的方式并入本文。調節劑與部分不一定需要直接締合,而可經由接頭序列締合。這類接頭分子是本領域眾所周知的,在Denardo等人,1998,Clin Cancer Res(《臨床癌癥研究》)4:2483;Peterson等人,1999,Bioconjug Chem(《生物綴合物化學》)10:553;Zimmerman等人,1999,Nucl Med Biol(《核醫學和生物學》)26:943;Garnett,2002,Adv Drug Deliv Rev(《先進藥物遞送評論》)53:171中有描述,將其中的每一者以引用的方式并入本文。
更一般而言,使治療部分或細胞毒性劑與調節劑綴合的技術是眾所周知的。部分可通過任何本領域公認的方法與調節劑綴合,包括但不限于:醛/席夫鍵、巰基鍵、酸不穩定鍵、順烏頭基鍵、腙鍵、酶可降解鍵(一般參見Garnett,2002,Adv Drug Deliv Rev(《先進藥物遞送評論》)53:171)。還可參見Amon等人,“Monoclonal Antibodies For Immunotargeting Of Drugs In Cancer Therapy(癌癥療法中用于藥物的免疫靶向的單克隆抗體)”,載于:Monoclonal Antibodies And Cancer Therapy(《單克隆抗體和癌癥療法》),Reisfeld等人(編輯),第243-56頁(Alan R.Liss,Inc.1985);Hellstrom等人,“Antibodies For Drug Delivery(藥物遞送用抗體)”,載于:Controlled Drug Delivery(《受控藥物遞送》)(第2版),Robinson等人(編輯),第623-53頁(馬塞爾·德克爾公司(Marcel Dekker,Inc.)1987);Thorpe,“Antibody Carriers Of Cytotoxic Agents In Cancer Therapy:A Review(《癌癥療法中的細胞毒性劑的抗體載體:綜述》)”,載于:Monoclonal Antibodies'84:Biological And Clinical Applications(《單克隆抗體'84:生物及臨床應用》),Pinchera等人(編輯),第475-506頁(1985);“Analysis,Results,And Future Prospective Of The Therapeutic Use Of Radiolabeled Antibody In Cancer Therapy(《癌癥療法中放射標記抗體治療用途的分析、結果和未來展望》)”,載于:Monoclonal Antibodies For Cancer Detection And Therapy(《用于癌癥檢測和療法的單克隆抗體》),Baldwin等人(編輯),第303-16頁(美國學術出版社(Academic Press)1985)以及Thorpe等人,1982,Immunol.Rev.(《免疫學評論》)62:119。在優選的實施例中,與治療部分或細胞毒性劑綴合的CD46調節劑可在結合至與細胞表面締合的CD46分子后被細胞內化,從而遞送該治療有效載荷。
XII.診斷和篩選
如所指出,本發明提供檢測或診斷過度增殖障礙的方法以及從患者篩選細胞以鑒別腫瘤起始細胞的方法。這類方法包括鑒別患有癌癥的個體以治療癌癥或監測其進展,該鑒別包括使從患者獲得的樣品與如本文所述的CD46調節劑接觸以及檢測該調節劑與該樣品中結合的或游離的CD46締合的存在與否或水平。當該調節劑包含抗體或其免疫活性片段時,與樣品中的CD46締合指示該樣品可能含有腫瘤永續細胞(例如癌癥干細胞),從而指示該患有癌癥的個體可用如本文所述的CD46調節劑有效治療。該方法可還包括比較與對照的結合水平的步驟。相反,當所選的調節劑是Fc-CD46時,可監測(直接或間接)當與樣品接觸時本文所述的分子的酶學性質以提供所需的信息。其他與本文教導相容的診斷方法是本領域所熟知的并且可使用商業材料如專用報道系統(dedicated reporting systems)來實施。
示例性的相容測定方法包括放射性免疫測定法、酶免疫測定法、競爭性結合測定法、熒光免疫測定法、免疫印跡測定法、蛋白質印跡分析、流式細胞測定法和ELISA測定法。更一般地講,檢測生物樣品中的CD46或測量CD46酶活性(或其抑制)可用任何本領域已知的測定法來完成。
在另一方面,如下文更詳細論述的,本發明提供用于檢測、監控或診斷過度增殖障礙、鑒別患有這種障礙的個體(為了可能的治療)或監測患者中該障礙的進展(或退化)的試劑盒,其中該試劑盒包含如本文所述的調節劑以及用于檢測該調節劑對樣品的影響的試劑。
CD46調節劑和包含CD46調節劑的細胞、培養物、群體以及組合物(包括它們的子代)也可用于篩選或鑒別通過與CD46(例如多肽或其遺傳組分)相互作用而影響腫瘤起始細胞或其子代的功能或活性的化合物或作用劑(例如藥物)。因此,本發明還提供用于評價或鑒別可通過與CD46或其底物締合而影響腫瘤起始細胞或其子代的功能或活性的化合物或作用劑的系統和方法。這類化合物和作用劑可以是藥物候選物,例如對其進行篩選以治療過度增殖障礙。在一個實施例中,系統或方法包括展示CD46的腫瘤起始細胞和化合物或作用劑(例如藥物),其中所述細胞與化合物或作用劑(例如藥物)彼此接觸。
本發明還提供篩選和鑒別用于改變腫瘤起始細胞或子代細胞的活性或功能的CD46調節劑或作用劑以及化合物的方法。在一個實施例中,方法包括使腫瘤起始細胞或其子代與試驗作用劑或化合物接觸;以及確定該試驗作用劑或化合物是否調節CD46hi腫瘤起始細胞的活性或功能。
試驗作用劑或化合物調節群體中這類腫瘤起始細胞或其子代的CD46相關活性或功能則鑒定該試驗作用劑或化合物為活性劑。可調節的示例性性活性或功能包括細胞形態改變、標記物表達改變、分化或去分化改變、成熟改變、增殖改變、生活力改變、凋亡或細胞死亡神經元祖細胞或其子代改變。
當關于細胞或細胞培養物或方法步驟或治療而使用時,“接觸”意指組合物(例如CD46hi細胞或細胞培養物)與另一提及的實體之間的直接或間接相互作用。直接相互作用的一個具體例子為物理相互作用。間接相互作用的一個具體例子為組合物作用于中間分子,后者繼而又作用于所提及的實體(例如細胞或細胞培養物)。
在本發明的這個方面中,調節指示以與檢測對已被確定與本發明腫瘤起始細胞或子代細胞的特定方面(例如轉移或增殖)相關的細胞活性或功能的作用相容的方式影響腫瘤起始細胞或子代細胞的活性或功能。示例性的活性和功能包括但不限于:測量形態、發育標記物、分化、增殖、生活力、細胞呼吸、粒線體活性、膜完整性或與某些病癥相關的標記物的表達。因此,可通過使腫瘤起始細胞或子代細胞與化合物或作用劑(例如藥物候選物)接觸,并測量任何對如本文所公開的或本領域技術人員將會知道的腫瘤起始細胞或子代細胞活性或功能的調節,來評價該化合物或作用劑對這類細胞或子代細胞的作用。
篩選和鑒別作用劑和化合物的方法包括那些適合于高通量篩選的方法,所述方法包括定位或放置(任選地)于預定位置或位址的細胞陣列(例如微陣列)。高通量機器人或人工處理方法可在短時間內探測許多基因的化學相互作用以及測定其表達水平。已開發了利用分子信號(例如熒光團)和自動分析(以極快速率處理信息)的技術(參見例如Pinhasov等人,Comb.Chem.High Throughput Screen.(《組合化學和高通量篩選》)7:133(2004))。例如,微陣列技術已廣泛用于即刻探測數千基因的相互作用,同時提供關于特定基因的信息(參見例如Mocellin和Rossi,Adv.Exp.Med.Biol.(《實驗醫學和生物學進展》)593:19(2007))。
這類篩選方法(例如高通量篩選方法)可快速有效地鑒別活性劑和化合物。例如,可將細胞定位或置放(預接種)于培養皿、管、燒瓶、滾瓶或板(例如單一多孔板或盤,例如8、16、32、64、96、384和1536多孔板或盤)上,任選處于規定位置,以用于鑒別潛在的治療性分子。可篩選的文庫包括例如小分子文庫、噬菌體展示文庫、完全人抗體酵母展示文庫(Adimab,LLC)、siRNA文庫和腺病毒轉染載體。
XIII.藥物制備和治療用途
a.配制和施用途徑
取決于調節劑的形式以及任何任選的綴合物、預定遞送模式、所治療或監測的疾病以及多種其他變量,本發明的組合物可根據需要使用本領域公認的技術來配制。也就是說,在本發明的多個實施例中,將包含CD46調節劑的組合物與多種可藥用載體一起配制(參見例如Gennaro,Remington:The Science and Practice of Pharmacy with Facts and Comparisons:Drugfacts Plus,第20版(2003);Ansel等人,Pharmaceutical Dosage Forms and Drug Delivery Systems(《藥物劑型和藥物遞送系統》),第7版,Lippencott Williams和Wilkins(2004);Kibbe等人,Handbook of Pharmaceutical Excipients(《藥物賦形劑手冊》),第3版,醫藥出版社(Pharmaceutical Press)(2000))。各種可藥用載體(包括介質、佐劑和稀釋劑)容易購自多個商業來源。此外,多種可藥用輔助物質(例如pH值調節劑和緩沖劑、張度調節劑、穩定劑、濕潤劑等等)也可獲得。某些非限制性的示例性載體包括鹽水、緩沖鹽水、右旋糖、水、甘油、乙醇以及它們的組合。
更具體而言,應當理解,在一些實施例中,本發明的治療組合物可以純形式施用或以含有極微量另外的組分的形式施用。反之,本發明的CD46調節劑可任選配制成含有本領域所熟知并且為相對惰性物質的適合可藥用載體(包含賦形劑和助劑),所述相對惰性物質便于施用該調節劑或有助于將活性化合物加工成在藥學上對于遞送至作用部位而言最佳的制劑。例如,賦形劑可賦予形狀或稠度或者充當改善該調節劑的藥物動力學的稀釋劑。合適的賦形劑包括但不限于:穩定劑、濕潤劑和乳化劑、改變滲透性的鹽、包囊劑、緩沖劑和皮膚滲透增強劑。
用于全身性施用的所公開的調節劑可配制用于腸內、腸胃外或局部施用。實際上,所有三種類型的調制劑可同時使用以實現活性成分的全身性施用。用于腸胃外和非腸胃外藥物遞送的賦形劑以及制劑在Remington,The Science and Practice of Pharmacy(《雷明頓:藥學科學與實踐》)第20版,Mack出版公司(Mack Publishing)(2000)中進行了描述。適合于腸胃外施用的制劑包括水溶性形式的活性化合物(例如水溶性鹽)的水溶液。另外,可施用適于油性注射混懸劑的活性化合物的混懸劑。合適的親脂性溶劑或介質包括脂肪油例如芝麻油或合成的脂肪酸酯(例如油酸乙酯或三甘油酯)。水性注射混懸劑可含有增加混懸劑粘度的物質,這種物質包括例如羧甲基纖維素鈉、山梨糖醇和/或葡聚糖。任選地,混懸劑還可含有穩定劑。也可使用脂質體封裝作用劑以遞送到細胞中。
適合于腸內施用的制劑包括硬或軟明膠膠囊、丸劑、片劑(包括包衣片劑)、酏劑、混懸劑、糖漿劑或吸入劑以及它們的控釋形式。
一般而言,包含CD46調節劑的本發明化合物和組合物可通過多種途徑體內施用給有需要的受試者,這類途徑包括但不限于:經口、靜脈內、動脈內、皮下、腸胃外、鼻內、肌肉內、心內、心室內、氣管內、口腔內、直腸、腹膜內、皮內、局部、透皮以及鞘內,或者通過植入或吸入。本發明的組合物可配制成固體、半固體、液體或氣體形式的制劑;包括但不限于:片劑、膠囊劑、散劑、顆粒劑、軟膏劑、溶液劑、栓劑、灌腸劑、注射劑、吸入劑和氣溶膠。適當的制劑和施用途徑可根據預定的應用和治療方案來選擇。
b.劑量
類似地,特定給藥方案(即劑量、時間設置和重復)將取決于特定個體和個體的病史。諸如半衰期之類的經驗性考慮因素一般將有助于確定劑量。施用頻率可在治療過程中確定和調整,并且是基于減少過度增殖性或贅生性細胞(包括腫瘤起始細胞)的數目、維持這類贅生性細胞的減少、減少贅生性細胞的增殖或延遲轉移的發展。或者,本發明的治療組合物的持續連續釋放制劑可能是適當的。如上文所提及的,各種用于實現持續釋放的制劑和裝置是本領域已知的。
從治療的觀點來看,藥物組合物以有效治療或預防特定適應癥的量施用。治療有效量通常取決于所治療受試者的體重、其身體或健康狀況、待治療病癥的廣泛性或所治療受試者的年齡。一般而言,本發明的CD46調節劑可以以每劑約10μg/kg體重至約100mg/kg體重的范圍內的量施用。在某些實施例中,本發明的CD46調節劑可以以每劑約50μg/kg體重至約5mg/kg體重的范圍內的量施用。在某些其他實施例中,本發明的CD46調節劑可以以每劑約100μg/kg體重至約10mg/kg體重的范圍內的量施用。任選,本發明的CD46調節劑可以以每劑約100μg/kg體重至約20mg/kg體重的范圍內的量施用。還任選地,本發明的CD46調節劑可以以每劑約0.5mg/kg體重至約20mg/kg體重的范圍內的量施用。在某些實施例中,給予劑量為至少約100μg/kg體重、至少約250μg/kg體重、至少約750μg/kg體重、至少約3mg/kg體重、至少約5mg/kg體重、至少約10mg/kg體重的本發明化合物。
其他給藥方案可基于如美國專利No.7,744,877(將其以全文引用的方式并入本文)中所公開的體表面積(BSA)計算法。如本領域所熟知的,BSA用患者的身高和體重來計算,并且提供受試者的由其身體表面積來表示的大小的量度。在本發明的使用BSA的所選的實施例中,調節劑可以10mg/m2至800mg/m2的劑量施用。在其他優選的實施例中,調節劑將以50mg/m2至500mg/m2的劑量,并且甚至更優選以100mg/m2、150mg/m2、200mg/m2、250mg/m2、300mg/m2、350mg/m2、400mg/m2或450mg/m2的劑量施用。當然,應當理解,不管劑量如何計算,可在所選的時段內施用多個劑量以提供實質上高于個別施用的絕對劑量。
在任何情況下,CD46調節劑優選按需施用給有需要的受試者。施用頻率可由本領域技術人員(例如主治醫師)根據所治療的病癥、所治療的受試者的年齡、所治療的病癥的嚴重程度、所治療的受試者的一般健康狀況等等的考慮因素來確定。一般來講,給受試者施用有效劑量的CD46調節劑一次或多次。更具體地講,給受試者施用有效劑量的調節劑一月一次、一月一次以上或少于一月一次。在某些實施例中,可施用有效劑量的CD46調節劑多次,包括持續至少一個月、至少六個月或至少一年的時間。
對于已給予一次或多次施用的個體,用于所公開的治療組合物的劑量和方案也可憑經驗確定。例如,可給予個體遞增劑量的如本文所述制備的治療組合物。為評估所選的組合物的功效,可跟蹤特定疾病、障礙或病癥的標志。在其中個體患有癌癥的實施例中,這些標志包括經由觸診或目測觀察直接測量腫瘤大小、通過x射線或其他成像技術間接測量腫瘤大小;通過直接腫瘤活組織檢查和腫瘤樣品的顯微鏡檢查來評估的改善;測量間接腫瘤標記物(例如對于前列腺癌為PSA)或根據本文所述的方法鑒別的抗原、疼痛或麻痺減少;說話、視力、呼吸或其他與腫瘤相關的失能得到改善;食欲增加;或如通過認可的測試所測量的生活品質提高,或存活時間延長。對本領域技術人員將顯而易見的是,取決于個體、贅生性病癥的類型、贅生性病癥的階段、贅生性病癥是否已開始轉移至個體的其他部位以及所使用的過往及同期治療,劑量將有所變化。
c.組合療法
本發明設想的組合療法可尤其適用于減少或抑制非所需的贅生性細胞增殖(例如內皮細胞)、減少癌癥發生、減少或防止癌癥再發或減少或防止癌癥擴散或轉移。在這類情況下,本發明的化合物可通過移除支撐及維持腫塊的TPC(例如NTG細胞)來充當敏化劑或化學敏化劑,并使得當前護理標準減積劑或抗癌劑更有效地使用。也就是說,包含CD46調節劑和一種或多種抗癌劑的組合療法可用于減弱已確立的癌癥,例如減少所存在的癌細胞的數目和/或降低腫瘤負荷,或改善癌癥的至少一種表現或副作用。因此,組合療法是指施用CD46調節劑和一種或多種抗癌劑,這類抗癌劑包括但不限于:細胞毒性劑、細胞生長抑制劑、化學治療劑、靶向抗癌劑、生物響應調節劑、免疫治療劑、癌癥疫苗、抗血管生成劑、細胞因子、激素療法、放射療法和抗轉移劑。
根據本發明的方法,并不要求組合結果為分開進行各治療(例如抗CD46抗體和抗癌劑)時所觀察到的效果的累加。盡管至少累加效果一般而言是所需的,但任何超過單一療法其中一者的抗腫瘤效果增加也是有益的。此外,本發明不需要組合治療展現出協同效應。然而,本領域技術人員應當理解,在構成優選的實施例的某些所選的組合下可觀察到協同作用。
為實施本發明的組合療法,可將與一種或多種抗癌劑組合的CD46調節劑(例如抗CD46抗體)以在受試者中有效產生抗癌活性的方式施用給有需要的受試者。CD46調節劑和抗癌劑可根據需要以在腫瘤環境中有效產生它們的組合存在及它們的組合作用的量和時間段提供。為實現該目標,CD46調節劑和抗癌劑可以單一組合物形式或以兩種或更多種不同組合物形式,使用相同或不同施用途徑同時施用受試者。
或者,調節劑可在抗癌劑治療之前或之后,例如間隔數分鐘至數周的時間。在其中抗癌劑與抗體分開施用給受試者的某些實施例中,各遞送時間之間的時段將使得抗癌劑和調節劑能夠對腫瘤發揮組合效果。在一個特定的實施例中,設想到抗癌劑與CD46調節劑在彼此間隔約5分鐘至約2周內施用。
在另外其他實施例中,調節劑與抗癌劑的施用之間可間隔數天(2、3、4、5、6或7天)、數周(1、2、3、4、5、6、7或8周)或數月(1、2、3、4、5、6、7或8個月)。CD46調節劑與一種或多種抗癌劑(組合療法)可施用一次、兩次或至少一段時間,直至病癥得到治療、減輕或治愈。優選地,組合療法施用多次。組合療法可每天施用三次至每六個月施用一次。可根據諸如每天三次、每天兩次、每天一次、每兩天一次、每三天一次、每周一次、每兩周一次、每月一次、每兩個月一次、每三個月一次、每六個月一次之類的時間表進行施用,或可經由微型泵連續施用。如先前所指出,組合療法可經由經口、粘膜、口腔、鼻內、可吸入、靜脈內、皮下、肌肉內、腸胃外、腫瘤內或局部途徑來施用。可在遠離腫瘤部位的部位施用組合療法。通常在腫瘤存在的時間內都將施用組合療法,前提條件是該組合療法使腫瘤或癌停止生長或減小重量或體積。
在一個實施例中,將CD46調節劑與一種或多種抗癌劑組合施用給癌癥患者持續較短治療周期以治療癌癥。用抗體治療的持續時間可根據所用特定抗癌劑而變。本發明還設想到不連續的施用或分成若干次部分施用的日劑量。本領域技術人員應當理解適合于特定抗癌劑的治療時間,且本發明設想到對各抗癌劑的最佳治療時間表的持續評估。
本發明設想到至少一個施用組合療法的周期,優選超過一個周期。本領域技術人員應當理解適合于一個周期的時段,也應當了解周期總數及各周期之間的時間間隔。本發明設想到對各調節劑和抗癌劑的最佳治療時間表的持續評估。此外,本發明還提供一次以上的抗CD46抗體或抗癌劑施用。調節劑和抗癌劑可隔天或隔周交替施用;或可給予一系列抗體治療,然后給予一次或多次抗癌劑療法的治療。在任何情況下,如本領域一般技術人員會認識到,化學治療劑的適當劑量一般將約為已在其中該化學治療劑單獨施用或與其他化學治療劑組合施用的臨床療法中應用的劑量。
在另一個優選的實施例中,本發明的CD46調節劑可用于維持療法中以在疾病最初呈現后降低或消除腫瘤再發的機會。優選地,障礙將得到治療且初始腫瘤塊得以消除、減小或者以別的方式改善,因此患者無癥狀或得到緩解。此時,可施用給受試者藥學有效量的所公開的效應物一次或多次,即使使用標準診斷程序幾乎沒有或者沒有指示有疾病。在一些實施例中,效應物將在一段時間里定期施用。例如,可每周、每兩周、每月、每六周、每兩個月、每三個月、每六個月或每年施用CD46調節劑。根據本文教導,本領域技術人員可容易地確定有利于降低疾病再發的可能性的劑量和給藥方案。此外,這類治療可持續數周、數月、數年的時間或甚至無限期地持續,這取決于患者響應和臨床與診斷參數。
在又另一個優選的實施例中,本發明的效應物可用于預防性地防止或降低減積手術后腫瘤轉移的可能性。如本發明所用,減積手術以廣義定義且應意指任何消除、減少、治療或改善腫瘤或腫瘤增生的手術、技術或方法。示例性的減積手術包括但不限于外科手術、輻射治療(即射束輻射)、化學療法或切除。在容易由本領域技術人員根據本發明確定的適當時間,CD46調節劑可如臨床和診斷程序所建議進行施用以減少腫瘤轉移。效應物可以如使用標準技術所確定的藥學有效劑量施用一次或多次。優選地,給藥方案將伴隨適當的診斷或監測技術以便視需要對該方案進行修改。
d.抗癌劑
本文所用的術語“抗癌劑”意指任何可用于治療細胞增殖性障礙如癌癥的作用劑,包括細胞毒性劑、細胞生長抑制劑、抗血管生成劑、減積劑、化學治療劑、放射療法和放射治療劑、靶向抗癌劑、生物響應調節劑、抗體和免疫治療劑。應當理解,在如上文所論述的所選的實施例中,抗癌劑可包含綴合物且在施用之前可與調節劑締合。
術語“細胞毒性劑”意指降低或抑制細胞功能和/或引起細胞破壞的物質,即該物質對細胞具有毒性。通常,該物質為衍自活生物體的天然存在的分子。細胞毒性劑的例子包括但不限于以下各者的小分子毒素或酶活性毒素:細菌(例如白喉毒素、假單胞菌內毒素和外毒素、葡萄球菌腸毒素A)、真菌(例如α-帚曲菌素、局限曲菌素)、植物(例如相思豆毒素、蓖麻毒素、蒴蓮根毒素、槲寄生凝集素(viscumin)、商陸抗病毒蛋白、皂草素、白樹毒素、momoridin、天花粉蛋白、大麥毒素、油桐(Aleurites fordii)蛋白、石竹素蛋白、美洲商陸(Phytolacca mericana)蛋白(PAPI、PAPII和PAP-S)、苦瓜(Momordica charantia)抑制劑、麻風樹毒素、巴豆毒素、石堿草(saponaria officinalis)抑制劑、白樹毒素、mitegellin、局限曲菌素、酚霉素、新霉素以及單端孢霉烯族毒素類(tricothecenes))或動物(例如細胞毒性RNA酶、DNA酶I,包括其片段和/或變體)。
化學治療劑意指非特異性降低或抑制癌細胞的生長、增殖和/或存活的化合物(例如細胞毒性劑或細胞生長抑制劑)。這類化學劑通常針對細胞生長或分裂所必需的細胞內過程,因此尤其有效對抗通常快速生長和分裂的癌細胞。例如,長春新堿使微管解聚,從而抑制細胞進入有絲分裂。一般而言,化學治療劑可包括任何抑制或被設計成抑制癌細胞或可能變成癌細胞或產生致瘤子代的細胞(例如TIC)的化學劑。這類藥劑通常以組合形式施用,且通常以組合形式為最有效,例如在制劑CHOP中。
可與本發明的調節劑組合使用(或綴合)的抗癌劑的例子包括但不限于:烷基化劑、烷基磺酸鹽、氮丙啶、乙烯亞氨和甲基三聚氰胺(methylamelamine)、多聚乙酰、喜樹堿、苔蘚蟲素、callystatin、CC-1065、念珠藻環肽(cryptophycin)、多拉司他汀(dolastatin)、倍癌霉素、艾榴塞洛素(eleutherobin)、pancratistatin、sarcodictyin、海綿抑素、氮芥、抗生素、烯二炔抗生素、達內霉素(dynemicin)、雙膦酸鹽、埃斯培拉霉素(esperamicin)、色蛋白烯二炔抗生素發色團、阿克拉霉素、放線菌素、authramycin、重氮絲氨酸、博來霉素、放線菌素C、carabicin、洋紅霉素、嗜癌霉素、色霉素、更生霉素、柔紅霉素、地托比星、6-重氮-5-氧代-L-正亮氨酸、多柔比星、表柔比星、依索比星、伊達比星、麻西羅霉素、絲裂霉素、霉酚酸、諾加霉素、橄欖霉素、培洛霉素、potfiromycin、嘌呤霉素、三鐵阿霉素、羅多比星、鏈黑菌素、鏈脲菌素、殺結核菌素、烏苯美司、凈司他丁、佐柔比星;抗代謝物、葉酸類似物、嘌呤類似物、雄激素、抗腎上腺劑、葉酸補充劑(例如frolinic acid)、醋葡醛內酯、醛磷酰胺糖苷、氨基乙酰丙酸、恩尿嘧啶、安吖啶、bestrabucil、比生群、依達曲沙、defofamine、地美可辛、地吖醌、依氟鳥氨酸、依利醋銨、埃博霉素、依托格魯、硝酸鎵、羥基脲、香菇多糖、lonidainine、類美登素(maytansinoids)、米托胍腙、米托蒽醌、mopidanmol、nitraerine、噴司他丁、蛋氨氮芥、吡柔比星、洛索蒽醌、鬼臼酸、2-乙肼、丙卡巴肼、多糖復合物(俄勒岡州尤金的JHS天然產物公司(JHS Natural Products,Eugene,OR))、雷佐生;根霉素;西佐喃;鍺螺胺;細交鏈孢菌酮酸;三亞胺醌;2,2',2"-三氯三乙胺;單端孢霉烯族毒素(尤其是T-2毒素、verracurin A、桿孢菌素A和anguidine);烏拉坦;長春地辛;達卡巴嗪;甘露醇氮芥;二溴甘露醇;二溴衛矛醇;哌泊溴烷;gacytosine;阿拉伯糖苷(“Ara-C”);環磷酰胺;噻替哌;紫杉烷類、苯丁酸氮芥;吉西他濱;6-硫鳥嘌呤;巰嘌呤;甲氨喋呤;鉑類似物、長春堿;鉑;依托泊苷(VP-16);異環磷酰胺;米托蒽醌;長春新堿;長春瑞賓;米托蒽醌;替尼泊苷;依達曲沙;道諾霉素;氨基蝶呤;希羅達;伊班膦酸鹽;伊立替康(Camptosar,CPT-11)、拓撲異構酶抑制劑RFS 2000;二氟甲基鳥氨酸(DMFO);類視黃醇;卡培他濱;考布他汀;甲酰四氫葉酸(LV);奧沙利鉑;減少細胞增殖的PKC-α、Raf、H-Ras、EGFR和VEGF-A的抑制劑,以及以上任一者的可藥用的鹽、酸或衍生物。該定義中還包括用于調節或抑制激素對腫瘤的作用的抗激素劑,例如抗雌激素劑和選擇性雌激素受體調節劑(SERM)、抑制調節腎上腺中的雌激素產生的芳香酶的芳香酶抑制劑、抗雄激素劑;以及曲沙他濱(1,3-二氧戊環核苷胞嘧啶類似物);反義寡核苷酸;核酶如VEGF表達抑制劑和HER2表達抑制劑;疫苗、rIL-2;拓撲異構酶1抑制劑;rmRH;長春瑞濱和埃斯波霉素以及上述任一者的可藥用鹽、酸或衍生物。其他實施例包括使用批準用于癌癥療法的抗體,包括但不限于:利妥昔單抗、曲妥單抗、吉妥單抗、阿侖單抗、替伊莫單抗、托西莫單抗、貝伐單抗、西妥昔單抗、帕尼單抗、奧伐木單抗(ofatumumab)、伊匹單抗和貝倫妥單抗-維多汀(brentuximab vedotin)。本領域技術人員將能夠容易鑒別與本文教導相容的其他抗癌劑。
e.放射療法
本發明還提供CD46調節劑與放射療法(即任何用于誘導腫瘤細胞中局部DNA損傷的機制,例如γ-照射、X射線、UV照射、微波、電子發射等等)的組合。還設想到使用將放射性同位素定向遞送至腫瘤細胞的組合療法,并且其可結合靶向抗癌劑或其他靶向手段使用。通常,放射療法在約1周至約2周的時間里以脈沖形式施用。放射療法可施用給患有頭頸部癌的受試者持續約6周至7周。任選地,放射療法可以單次劑量或以多次連續劑量進行施用。
f.贅生性病癥
無論單獨施用還是與抗癌劑或放射療法組合施用,本發明的CD46調節劑尤其可用于總體治療患者或受試者的贅生性病癥,這類病癥可包括:良性或惡性腫瘤(例如腎癌、肝癌、腎臟癌、膀胱癌、乳腺癌、胃癌、卵巢癌、結腸直腸癌、前列腺癌、胰腺癌、肺癌、甲狀腺癌、肝癌;肉瘤;膠質母細胞瘤;及各種頭頸部腫瘤);白血病和淋巴惡性腫瘤;其他障礙,例如神經元障礙、神經膠質障礙、星形細胞障礙、下丘腦和其他腺體障礙、巨噬細胞障礙、上皮障礙、基質障礙和囊胚腔障礙;以及炎性障礙、血管生成障礙、免疫障礙和由病原體引起的障礙。用本發明的治療組合物和方法治療的尤其優選的標靶為贅生性病癥,包含實體腫瘤。在其他優選的實施例中,本發明的調節劑可用于診斷、預防或治療血液惡性腫瘤。優選地,待治療的受試者或患者將為人,不過如本文所用,該術語明確地被認為包括任何哺乳動物物種。
更具體而言,根據本發明進行治療的贅生性病癥可選自包括但不限于:腎上腺腫瘤、AIDS相關的癌癥、腺泡狀軟組織肉瘤、星形細胞腫瘤、膀胱癌(鱗狀細胞癌和移行細胞癌)、骨癌(釉質瘤、動脈瘤樣骨囊腫、骨軟骨瘤、骨肉瘤)、腦癌和脊髓癌、轉移性腦腫瘤、乳腺癌、頸動脈體瘤、子宮頸癌、軟骨肉瘤、脊索瘤、嫌色細胞型腎細胞癌、透明細胞癌、結腸癌、結腸直腸癌、皮膚良性纖維性組織細胞瘤、結締組織增生性小圓細胞腫瘤、室管膜瘤、尤因氏瘤、骨外粘液樣軟骨肉瘤、骨纖維生成不良、骨纖維性結構不良、膽囊癌和膽管癌、妊娠性滋養層疾病、生殖細胞腫瘤、頭頸部癌、胰島細胞瘤、卡波西氏肉瘤、腎癌(腎胚細胞瘤、乳頭狀腎細胞癌)、白血病、脂肪瘤/良性脂肪瘤性腫瘤、脂肪肉瘤/惡性脂肪瘤性腫瘤、肝癌(肝母細胞瘤、肝細胞癌)、淋巴瘤、肺癌(小細胞癌、腺癌、鱗狀細胞癌、大細胞癌等)、髓母細胞瘤、黑素瘤、腦膜瘤、多發性內分泌瘤、多發性骨髓瘤、骨髓發育不良綜合征、成神經細胞瘤、神經內分泌腫瘤、卵巢癌、胰腺癌、乳頭狀甲狀腺癌、甲狀旁腺腫瘤、兒童癌癥、周圍神經鞘腫瘤、嗜鉻細胞瘤、垂體瘤、前列腺癌、后葡萄膜黑素瘤(posterious unveal melanoma)、罕見血液障礙、腎轉移癌、橫紋肌樣瘤、橫紋肌肉瘤、肉瘤、皮膚癌、軟組織肉瘤、鱗狀細胞癌、胃癌、滑膜肉瘤、睪丸癌、胸腺癌、胸腺瘤、甲狀腺轉移癌和子宮癌(子宮頸癌、子宮內膜癌及和滑肌瘤)。在某些優選的實施例中,癌細胞是選自包括但不限于如下的實體腫瘤:乳腺癌、非小細胞肺癌(NSCLC)、小細胞肺癌、胰腺癌、結腸癌、前列腺癌、肉瘤、腎轉移癌、甲狀腺轉移癌和透明細胞癌。
關于血液惡性腫瘤,應進一步理解,本發明的化合物和方法可尤其有效治療多種B細胞淋巴瘤,包括低度/NHL濾泡細胞淋巴瘤(FCC)、套細胞淋巴瘤(MCL)、彌漫性大細胞淋巴瘤(DLCL)、小淋巴細胞性(SL)NHL、中度/濾泡性NHL、中度彌漫性NHL、高度免疫母細胞性NHL、高度淋巴母細胞性NHL、高度小無核裂細胞NHL、巨瘤性NHL、華氏巨球蛋白血癥、淋巴漿細胞樣淋巴瘤(LPL)、套細胞淋巴瘤(MCL)、濾泡性淋巴瘤(FL)、彌漫性大細胞淋巴瘤(DLCL)、伯基特淋巴瘤(BL)、AIDS相關的淋巴瘤、單核細胞性B細胞淋巴瘤、血管免疫母細胞性淋巴結病;小淋巴細胞性、濾泡性、彌漫性大細胞、彌漫性小核裂細胞、大細胞免疫母細胞性淋巴母細胞瘤;小無核裂性伯基特與非伯基特濾泡性、主要大細胞淋巴瘤;濾泡性、主要小核裂細胞淋巴瘤;以及濾泡性、混合小核裂細胞與大細胞淋巴瘤。參見Gaidono等人,“Lymphomas(淋巴瘤)”,載于:CANCER:PRINCIPLES&PRACTICE OF ONCOLOGY(《癌癥:腫瘤學原理與實踐》),第2卷:2131-2145(DeVita等人編輯,第5版1997)。本領域技術人員應清楚,由于改變分類系統,故這些淋巴瘤通常將具有不同名稱,且具有歸類為不同名稱的淋巴瘤的患者也可受益于本發明的組合治療方案。
在另外其他優選的實施例中,CD46調節劑可用于有效地治療某些骨髓和血液惡性腫瘤,包括白血病,例如慢性淋巴細胞性白血病(CLL或B-CLL)。CLL主要為老年人疾病,其在五十歲后發病率開始增加且在年近七旬時達到峰值。其一般涉及贅生性外周血淋巴細胞的增殖。CLL的臨床表現涉及淋巴細胞增多癥、淋巴結病、脾腫大、貧血和血小板減少癥。CLL的典型特征是單克隆B細胞增殖和停滯于分化中間狀態的B淋巴細胞的積聚,在該狀態下這類B細胞表達表面IgM(sIgM)或者sIgM與sIgD二者,且單一輕鏈的密度低于在正常B細胞上的密度。然而,如上文所論述以及隨附“實例”中所示的,所選的CD46表達(例如CD46)在B-CLL細胞上被上調,從而提供所公開的調節劑的引人關注的標靶。
本發明也為具有良性腫瘤或癌前腫瘤的受試者提供防治性或預防性治療。據信不應將任何特定類型的腫瘤或贅生性障礙排除在使用本發明的治療之外。然而,腫瘤細胞的類型可與本發明與第二治療劑、尤其化學治療劑及靶向抗癌劑的組合使用有關。
本發明的另外其他優選的實施例包括使用CD46調節劑治療患有實體腫瘤的受試者。在這類受試者中,這些實體腫瘤中的多者包含展現各種遺傳突變的組織,這類遺傳突變可使其尤其易于用所公開的效應物治療。例如,KRAS、APC和CTNNB1突變在結腸直腸癌患者中相對常見。此外,患有具有這些突變的腫瘤的患者通常用當前療法最難治愈;尤其是那些具有KRAS突變的患者。通常導致單一氨基酸置換的KRAS激活突變也與其他難以治療的惡性腫瘤有關,包括肺腺癌、粘蛋白腺瘤以及胰腺的導管癌。
目前,例如,結腸直腸癌患者是否會響應EGFR抑制性藥物或VEGF抑制性藥物的最可靠預測是測試某些KRAS“激活”突變。KRAS在35-45%的結腸直腸癌中發生突變,且其腫瘤表達突變型KRAS的患者不會對這些藥物產生良好應答。例如,在結腸直腸癌中,KRAS突變預示缺乏對帕尼單抗及西妥昔單抗療法的響應(Lievre等人,Cancer Res(《癌癥研究》)66:3992–5;Karapetis等人,NEJM 359:1757-1765)。大約85%的結腸直腸癌患者在APC基因中具有突變(Markowitz和Bertagnolli.NEJM361:2449-60),且超過800個APC突變已在家族性腺瘤性息肉病和結腸直腸癌患者中表征。這些突變中的大部分會導致截短型APC蛋白,其介導β-聯蛋白破壞的功能性能力降低。β-聯蛋白基因CTNNB1的突變也可導致該蛋白的穩定增強,從而引起核輸入以及隨后激活若干致瘤轉錄程序,其也是突變型APC無法適當地介導為保持正常細胞增殖和分化程序受控制所需的β-聯蛋白破壞而引起的瘤形成的機制。
XIV.制品
還提供包括一個或多個容器、包括一個或多個劑量的CD46調節劑的藥物包裝和試劑盒。在某些實施例中,提供單位劑量,其中該單位劑量含有預定量的包含例如抗CD46抗體且有或無一種或多種另外的作用劑的組合物。對于其他實施例,該單位劑量在用于注射的一次性預充式注射器中提供。在另外其他實施例中,單位劑量中所含的組合物可包含鹽水、蔗糖等;緩沖液,例如磷酸鹽等;和/或在穩定且有效的pH范圍內配制。或者,在某些實施例中,組合物可以凍干粉形式提供,其可在添加適當液體(例如無菌水)后復原。在某些優選的實施例中,組合物包含一種或多種抑制蛋白質聚集的物質,其包括但不限于蔗糖和精氨酸。容器上或與容器相關的任何標簽指示所密封的組合物是用于診斷或治療所選的疾病病癥。
本發明還提供用于產生CD46調節劑和任選的一種或多種抗癌劑的單次劑量或多次劑量施用單元的試劑盒。該試劑盒包括容器和容器上或與容器相關的標簽或包裝插頁。合適的容器包括例如瓶子、小瓶、注射器等。容器可由各種材料如玻璃或塑料形成。容器容納可有效治療病癥的組合物并且可具有無菌進入孔(例如該容器可為具有皮下注射針可刺穿的塞子的靜脈注射溶液袋或小瓶)。這類試劑盒一般在合適容器中裝有可藥用的CD46調節劑制劑以及任選地在同一或不同容器中裝有一種或多種抗癌劑。試劑盒還可裝有用于診斷或組合療法的其他可藥用制劑。例如,除本發明的CD46調節劑外,這類試劑盒可裝有多種抗癌劑中的任一者或多者,例如化學治療或放射治療藥物;抗血管生成劑;抗轉移劑;靶向抗癌劑;細胞毒性劑;和/或其他抗癌劑。這類試劑盒也可提供使CD46調節劑與抗癌劑或診斷劑綴合的適當試劑(例如參見美國專利No.7,422,739,將其以全文引用的方式并入本文)。
更具體而言,試劑盒可具有裝有CD46調節劑且有或無另外的組分的單一容器,或其可具有用于每一所需作用劑的不同容器。在提供組合治療劑進行綴合的情況中,可將單一溶液以摩爾當量組合的形式或以一種組分超過其他組分的形式進行預先混合。或者,在施用給患者之前,試劑盒的CD46調節劑和任何任選的抗癌劑可分開保持在不同容器中。試劑盒也可包括用于容納無菌可藥用的緩沖液或其他稀釋劑(例如抑菌性注射用水(BWFI)、磷酸鹽緩沖鹽水(PBS)、林格氏溶液和右旋糖溶液)的第二/第三容器裝置。
當試劑盒的組分以一種或多種液體溶液提供時,該液體溶液優選為水溶液,其中無菌水溶液是尤其優選的。然而,試劑盒的組分可以干粉形式提供。當試劑或組分以干粉形式提供時,該粉末可通過添加合適的溶劑來復原。預想到該溶劑也可提供于另一容器中。
如上文簡單地指出,試劑盒也可裝有用來向動物或患者施用抗體和任何任選的組分的裝置,例如一個或多個針或注射器,或甚至滴眼管、吸管或其他這類類似設備,制劑可從該裝置注射或引入到動物中或施用于身體患病區域。本發明的試劑盒也將通常包括用于容納小瓶或像這類東西的裝置,以及用于商業銷售的其他密閉組件,例如置放和保存所需小瓶和其他設備的注塑成型或吹塑成型塑料容器。任何標簽或包裝插頁均指示CD46調節劑組合物是用于治療癌癥,例如結腸直腸癌。
XV.研究試劑
本發明的其他優選的實施例也利用所公開的調節劑的性質,作為可用于通過諸如熒光激活細胞分選(FACS)、磁性激活細胞分選(MACS)或激光介導的分區這類的方法對腫瘤起始細胞的群體或亞群進行鑒別、分離、分區或富集的工具。本領域技術人員應當理解,調節劑可用于若干相容的表征和操縱TIC(包括癌癥干細胞)的技術中(例如參見美國專利No.12/686,359、No.12/669,136和No.12/757,649,將它們每一者以引用的方式全文并入本文)。
XVI.其他內容
除非本文另有限定,否則與本發明關聯使用的科學和技術術語應具有本領域一般技術人員通常所理解的含義。此外,除非上下文另有要求,否則單數術語應包括復數且復數術語應包括單數。更具體而言,除非上下文另外明確指示,否則如本說明書和隨附權利要求書中所用,單數形式“一個”、“一種”和“該”包括多個指代物。因此,例如,提及“蛋白質”包括多個蛋白質;提及“細胞”包括細胞混合物等等。另外,說明書和隨附的權利要求書中所提供的范圍包括端點和端點之間的所有點。因此,2.0至3.0的范圍包括2.0、3.0以及2.0與3.0之間的所有點。
一般來講,與本文所述的細胞和組織培養、分子生物學、免疫學、微生物學、遺傳學和蛋白質以及核酸化學及雜交關聯使用的命名法及其技術,是本領域所熟知且常用的命名法和技術。除非另外指明,否則本發明的方法和技術一般根據本領域所熟知的常規方法且如本說明書中通篇引用和論述的各種一般和更特定的參考文獻中所述來進行。參見例如,Sambrook J.和Russell D.Molecular Cloning:A Laboratory Manual(《分子克隆:實驗室手冊》),第3版,紐約冷泉港的冷泉港實驗室出版社(Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Y.)(2000);Ausubel等人,Short Protocols in Molecular Biology:A Compendium of Methods from Current Protocols in Molecular Biology(《分子生物學簡明實驗技術:現代分子生物學實驗技術的方法概要》),約翰威立父子出版公司(Wiley,John&Sons,Inc.)(2002);Harlow和Lane,Using Antibodies:A Laboratory Manual (《使用抗體:實驗室手冊》),紐約冷泉港的冷泉港實驗室出版社(Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Y.)(1998);以及Coligan等人,Short Protocols in Protein Science(《蛋白質科學的簡明實驗技術》),約翰威立父子出版公司(Wiley,John&Sons,Inc.)(2003)。酶促反應和純化技術是根據制造商的說明書,如本領域中通常所實現或如本文中所述來進行。與本文所述的分析化學、合成有機化學以及藥物化學和藥物化學關聯使用的命名法及其實驗室程序和技術,是本領域中熟知且常用的命名法及實驗室程序和技術。
本說明書中公開或引用的所有參考文獻或文件均不加限制地以引用的方式全文并入本文。此外,本文中所使用的任何章節標題僅用于篇章組織目的,而不應理解為限制所描述的主題。
實例
參考以下實例將更容易了解如此大致描述的本發明,這類實例是以說明的方式提供且無意于限制本發明。所述實例無意表示如下實驗為所進行的全部或唯一實驗。除非另外指示,否則份數為重量份,分子量為重量平均分子量,溫度以攝氏度計,壓力為大氣壓或近大氣壓。
實例1
腫瘤起始細胞群體中的CD46表達
為表征實體腫瘤在其存在于癌癥患者中時的細胞異質性,使用特定表型標記物闡明腫瘤永續細胞(TPC;即癌癥干細胞:CSC)的種類(identity),并鑒別臨床相關的治療標靶,使用了本領域公認的技術開發并維持了大的非傳統異種移植物(NTX)腫瘤庫。通過將最初獲自患有各種實體瘤惡性腫瘤的許多癌癥患者的異質腫瘤細胞多次繼代,在免疫功能降低的小鼠中增殖了包含大量分立的腫瘤細胞系的NTX腫瘤庫。具有明確譜系的大量分立的早期繼代NTX腫瘤細胞系的持續可獲得性能極大便利對TPC的鑒別和分離,因為它們使得可以可再現地和重復地表征從這些細胞系純化的細胞。更具體地講,根據分離或純化的TPC在重演所述細胞所來源的患者腫瘤樣品的小鼠中產生表型上以及形態上異質的腫瘤的能力,分離或純化的TPC得到最準確的回顧性定義。因此,使用小的分離細胞群體在小鼠中產生完全異質腫瘤的能力可有力指示所述分離細胞包含TPC的事實。在該工作中,使用繼代最少的NTX細胞系可大大簡化體內實驗并提供可容易驗證的結果。此外,早期繼代NTX腫瘤也響應諸如伊立替康(即)之類的治療劑,這提供對于驅動腫瘤生長的潛在機制、對當前療法的耐受性以及腫瘤再發的臨床相關洞察。
當建立NTX腫瘤細胞系時,使用流式細胞術分析組分腫瘤細胞表型以鑒別可用于表征、分離、純化或富集腫瘤起始細胞(TIC)并分離或分析該群體內的TPC和TProg細胞的分立標記物。就此而言,本發明人使用了基于蛋白組的專有平臺(即PhenoPrintTm陣列),其提供基于蛋白質表達的細胞快速表征以及伴隨的對潛在有用的標記物的鑒別。PhenoPrint陣列是一種專有蛋白組平臺,其包含數百種排列于96孔板中的分立結合分子,其中許多分子獲自商業來源,其中每個孔含有在藻紅蛋白熒光通道中的獨特抗體以及在排列于整個板每個孔中的不同熒光染料中的多種另外的抗體。這使得可以通過快速包括相關細胞或經由非藻紅蛋白通道消除非相關細胞來測定所選的腫瘤細胞亞群中所關注抗原的表達水平。當PhenoPrint陣列與本領域熟知的組織解離、移植和干細胞技術(Al-Hajj等人,2004;Dalerba等人,2007;以及Dylla等人,2008(全部出處同上),將這些文獻每一者以引用的方式全文并入本文)聯合使用時,有可能有效鑒別相關標記物以及隨后高效分離和移植特定人腫瘤細胞亞群。
因此,在建立各種NTX腫瘤細胞系時,如對于嚴重免疫功能降低的小鼠中的人腫瘤通常所進行的,腫瘤在達到800-2,000mm3后將其從小鼠切除并用本領域公認的酶消化技術(參見例如美國專利No.2007/0292414,將其并入本文)將細胞解離為單細胞懸浮液。用PhenoPrint陣列從這些懸浮液獲得的數據提供了逐個細胞的絕對(每個細胞)和相對(相對于群體中的其他細胞)表面蛋白質表達,從而實現細胞群體的更復雜表征和分層(stratification)。更具體而言,PhenoPrint陣列的使用使得可以快速鑒別有望將TIC或TPC與NTG本體腫瘤細胞和腫瘤基質區分開來的蛋白質或標記物,并且當從NTX腫瘤模型分離時,提供對表達不同水平的特定細胞表面蛋白質的腫瘤細胞亞群的相對快速的表征。具體地講,在腫瘤細胞群體中具有異質表達的蛋白質使得可以分離表達高和低水平的特定蛋白質或標記物的獨特且高度純化的腫瘤細胞亞群并將其移植進免疫功能降低的小鼠中,從而有助于評估TPC富集于一個亞群還是另一個亞群中。
術語“富集”與分離細胞同義使用,意指與初始或起始細胞群體相比,一種類型的細胞的收率(比率)相對于其他類型的細胞的比率增加。優選地,富集是指與初始細胞群體相比,細胞群體中一種類型的細胞的百分數增加約10%、約20%、約30%、約40%、約50%或大于50%。
如本文所用,在細胞或組織的情形中,標記物意指與特定細胞、細胞群體或組織以可鑒別方式相關聯或在特定細胞、細胞群體或組織中或其上特異性存在的任何化學或生物學實體形式的特征,包括那些在受疾病或障礙影響的組織或細胞群體中或其上所鑒別的特征。如所指明的,標記物在性質上可以是形態標記物、功能標記物或生物化學標記物。在優選的實施例中,標記物為由特定細胞類型(例如TPC)或由細胞在某些條件下(例如在細胞生命周期的特定時間點期間或處于特定小生境中的細胞)差異或優先表達的細胞表面抗原。優選地,這類標記物是蛋白質,更優選地,具有本領域所知的抗體、適體或其他結合分子的表位。然而,標記物可由存在于表面上或細胞中的任何分子組成,包括但不限于蛋白質(肽和多肽)、脂質、多糖、核酸和類固醇。形態標記物特征或性狀的例子包括但不限于形狀、大小和核質比。功能標記物特征或性狀的例子包括但不限于附著于特定基底的能力、摻入或排斥特定染料(例如但不限于排斥親脂性染料)的能力、在特定條件下遷移的能力以及沿特定譜系分化的能力。標記物也可為從報告基因表達的蛋白質,例如報告基因由于編碼報告基因的核酸序列向細胞中的引入及其轉錄而由細胞表達,從而產生可用作標記物的報告蛋白。可用作標記物的這類報告基因是例如但不限于熒光蛋白酶、染色粒蛋白、抗性基因等等。
在相關意義上,在組織、細胞或細胞群體的情形中,術語“標記物表型”(例如穩定的TPC表型)意指任何可用于表征、鑒別、分開、分離或富集特定細胞或細胞群體的標記物或標記物組合。在特定實施例中,標記物表型是可通過檢測或鑒別細胞表面標記物的組合的表達來確定的細胞表面表型。
本領域技術人員應了解,已將多種標記物(或其不存在)與各種癌癥干細胞群體相關聯并用于分離或表征腫瘤細胞亞群。就此而言,示例性的癌癥干細胞標記物包含OCT4、Nanog、STAT3、EPCAM、CD24、CD34、NB84、TrkA、GD2、CD133、CD20、CD56、CD29、B7H3、CD46、轉鐵蛋白受體、JAM3、羧肽酶M、ADAM9、抑癌蛋白M、Lgr5、Lgr6、CD324、CD325、巢蛋白、Sox1、Bmi-1、eed、easyh1、easyh2、mf2、yy1、smarcA3、smarckA5、smarcD3、smarcE1、mllt3、FZD1、FZD2、FZD3、FZD4、FZD6、FZD7、FZD8、FZD9、FZD10、WNT2、WNT2B、WNT3、WNT5A、WNT10B、WNT16、AXIN1、BCL9、MYC、(TCF4)SLC7A8、IL1RAP、TEM8、TMPRSS4、MUC16、GPRC5B、SLC6A14、SLC4A11、PPAP2C、CAV1、CAV2、PTPN3、EPHA1、EPHA2、SLC1A1、CX3CL1、ADORA2A、MPZL1、FLJ10052、C4.4A、EDG3、RARRES1、TMEPAI、PTS、CEACAM6、NID2、STEAP、ABCA3、CRIM1、IL1R1、OPN3、DAF、MUC1、MCP、CPD、NMA、ADAM9、GJA1、SLC19A2、ABCA1、PCDH7、ADCY9、SLC39A1、NPC1、ENPP1、N33、GPNMB、LY6E、CELSR1、LRP3、C20orf52、TMEPAI、FLVCR、PCDHA10、GPR54、TGFBR3、SEMA4B、PCDHB2、ABCG2、CD166、AFP、BMP-4、β-聯蛋白、CD2、CD3、CD9、CD14、CD31、CD38、CD44、CD45、CD74、CD90、CXCR4、飾膠蛋白聚糖、EGFR、CD105、CD64、CD16、CD16a、CD16b、GLI1、GLI2、CD49b和CD49f。參見例如Schulenburg等人,2010,PMID:20185329;美國專利No.7,632,678和美國專利No.2007/0292414、No.2008/0175870、No.2010/0275280、No.2010/0162416和No.2011/0020221,將上述參考文獻和專利中的每一者以引用的方式并入本文。應當理解,許多這些標記物包括在上述PhenoPrint陣列中。
類似地,與某些腫瘤類型的癌癥干細胞相關聯的細胞表面表型的非限制性例子包括:CD44hiCD24low、ALDH+、CD133+、CD123+、CD34+CD38-、CD44+CD24-、CD46hiCD324+CD66c-、CD133+CD34+CD10-CD19-、CD138-CD34-CD19+、CD133+RC2+、CD44+α2β1hiCD133+、CD44+CD24+ESA+、CD271+、ABCB5+以及本領域已知的其他癌癥干細胞表面表型。參見例如Schulenburg等人,2010(出處同上);Visvader等人,2008,PMID:18784658;以及美國專利No.2008/0138313,將上述參考文獻和專利的每一者以引用的方式全文并入本文。本領域技術人員應當理解,諸如上文剛剛示例的那些之類的標記物表型可結合標準的流式細胞檢測分析以及細胞分選技術來使用,以表征、分離、純化或富集TIC和/或TPC細胞或細胞群體以供進一步分析。對本發明有意義的是,CD46、CD324以及任選的CD66c在許多人結腸直腸癌(“CR”)、乳腺癌(“BR”)、非小細胞肺癌(NSCLC)、小細胞肺癌(SCLC)、胰腺癌(“PA”)、黑素瘤(“Mel”)、卵巢癌(“OV”)以及頭頸部癌(“HN”)腫瘤細胞的表面上高度或異質表達,不管所分析的腫瘤樣本是原發性患者腫瘤樣本(圖1A)還是來源于患者的NTX腫瘤(圖1B)。
圖1A和B中示出的數據是基于流式細胞術的蛋白質表達數據,其用FACSCanto II(BD生物科學公司(BD Biosciences))根據生產商的說明書產生。數據示出了以直方圖顯示的各個腫瘤細胞,其中同種型對照抗體的背景染色顯示為灰色的填充直方圖,用MEM-258抗體(BioLegend公司(BioLegend Inc.))測定的CD46表達用加粗黑線條顯示。
陰性表達(即“-”)的細胞在本文中定義為在對另外的熒光發射通道中其他所關注蛋白質進行標記的完整抗體染色混合物的存在下,那些表達小于或等于用熒光通道中的同種型對照抗體所觀察到的表達的95%的細胞。本領域技術人員應理解,該定義陰性事件的程序稱為“熒光扣除對照(fluorescence minus one)”或“FMO”染色。表達大于使用上述FMO染色程序用同種型對照抗體所觀察到的表達的95%的細胞在本文中定義為“陽性”(即“+”)。如本文所定義的,存在廣義定義為“陽性”的各種細胞群體。首先,低表達(即“lo”)細胞一般定義為那些觀察到表達超過使用FMO染色用同種型對照抗體所測定的表達的95%,且在使用上述FMO染色程序用同種型對照抗體所觀察到的表達的95%的一個標準偏差內的細胞。“高”表達(即“hi”)細胞可定義為那些觀察到表達超過使用FMO染色用同種型對照抗體所測定的表達的95%,且超過使用上述FMO染色程序用同種型對照抗體所觀察到的表達的95%一個標準偏差以上的細胞。在其他實施例中,99%可優選用作陰性與陽性FMO染色之間的分界點,在尤其優選的實施例中該百分位數可大于99%。
CD46表達在患有實體瘤的各患者中是可變的;然而,表達通常高于用同種型對照抗體所測定的背景染色(圖1A和1B)。CD46表達在來源于大多數結腸直腸癌和胰腺癌患者的腫瘤中是尤其異質的,其中獨特的細胞亞群通常分別展示出陰性、低和高的CD46表達(圖1B)。
實例2
通過FACS和移植富集腫瘤起始細胞群體的示范
在其中存在所關注的特定蛋白質的異質表達的腫瘤中,根據這些蛋白質的高表達或不表達/低表達對細胞進行分離,然后將細胞移植進免疫功能降低的小鼠中。出人意料的是,據觀察,大多數用專有PhenoPrint陣列鑒別為異質表達的獨特標記物未展示出在富集腫瘤起始細胞富集方面的實用性。為了分別確定具有高或低的CD46細胞表面表達的結腸直腸腫瘤細胞和胰腺腫瘤細胞是否在免疫功能降低的小鼠中富集致瘤活性,利用本領域技術人員所熟知的細胞解離和FACS技術從NTX腫瘤分離了獨特的細胞群體,然后以每只小鼠1,000至3個細胞移植。當腫瘤達到800-2,000mm3時,對小鼠實施安樂死,移出腫瘤并用酶消化解離為單細胞懸浮液用于進行表型表征,以確定所產生的腫瘤是否代表最初從中分離所述移植細胞的親本腫瘤。
表1示出了這些實驗的結果。空白表示所指示的實驗未進行。從上皮特異性抗原(ESA)-陽性CD46hi細胞產生的腫瘤一致地產生異質腫瘤,盡管在移植細胞數目低于200個細胞/小鼠時需要另外的標記物(即結腸直腸癌:CD324+CD66c-;胰腺癌:CD324+)來有效地實現這一點。
表1
通過FACS富集結腸直腸和胰腺腫瘤起始細胞群體并移植進免疫功能降低的小鼠中的示范
實例3
通過在NTX模型中進行系列繼代CD46hi腫瘤起始細胞亞群展示出腫瘤永續能力
雖然大部分腫瘤細胞缺少腫瘤形成能力并因而可表征為非致瘤(NTG),但在正常胚胎發育和造血腫瘤二者中高度增殖性細胞在移植后能夠重新構建腫瘤和/或組織方面存在先例,不過其不具有自我更新能力(即有限的壽命)并因而被稱為短期重構細胞或祖細胞。
為了確定CD46hi細胞亞群是否比其他亞群致瘤性更強或更弱,將CD46與另外的標記物標記物系統地組合來進行細胞分離和移植。這個工作導致鑒別了結腸直腸癌的兩個另外的細胞表面標記物(CD324和CD66c)和胰腺癌的一個另外的標記物(CD324),它們能夠有助于根據各抗原的高表達或陰性表達/低表達對腫瘤起始細胞進行富集。作為這些標記物在結腸直腸癌中的實用性的證明,例如由ESA+CD46hi CD324+CD66c-細胞移植產生的腫瘤(即p1,第1代)是完全異質性的且反映它們所來源的親本腫瘤(圖2;p1腫瘤對比親本腫瘤)。相比之下,用小數目的ESA+CD46hi CD324+CD66c+細胞移植未產生完全異質性的腫瘤,因為存在顯著較少的CD66c-細胞,這表明ESA+CD46hi CD324+CD66c+細胞是具有顯著增殖能力的腫瘤祖細胞(TProg),但缺乏自我更新性質。對預期的TPC(ESA+CD46hi CD324+CD66c-細胞)和TProg(ESA+CD46hi CD324+CD66c+細胞)進行系列移植證實了這些腫瘤細胞亞群的種類,因為在系列移植50個細胞時由ESA+CD46hi CD324+CD66c-細胞產生的ESA+CD46hi CD324+CD66c-細胞子集有效產生了腫瘤(圖2;p2對比p1腫瘤),而由ESA+CD46hi CD324+ CD66c+細胞產生的腫瘤中的細胞在系列移植后不能有效重新起始腫瘤。更清楚地說,從分別由僅200個CD66c-或CD66c+細胞產生的腫瘤分離的50個ESA+CD46hi CD324+CD66c+細胞是很少致瘤的:尤其是從CD66c+衍生的腫瘤獲得的那些細胞。令人驚奇的是,這些數據證明了關于實體瘤的一個開創性觀察結果,即ESA+CD46hi CD324+CD66c-細胞是TPC而ESA+ CD46hi CD324+CD66c+細胞是TProg細胞。
為了確定上述TPC表型在結腸直腸癌中的準確性,通過如上所述的FACS分離ESA+CD46hi CD324+CD66c-細胞(圖3A;FACS后對比FACS前)并分別以有限稀釋度:每只小鼠50、20、8和3個細胞進行移植。基于陽性事件定義為成功致瘤而使用泊松分布統計(見圖3B和3C)得到了計算結果,ESA+CD46hi CD324+CD66c-TPC當中真正的腫瘤起始細胞出現率大約為7±3個細胞中有1個。
還不知道組合用于富集結腸直腸腫瘤中上文所定義的TPC和TProg細胞群體的每種蛋白質與任何組織或贅生物中含有該活性的細胞有關聯,不過其他人已定義了可類似地用于富集致瘤細胞的細胞表面標記物或酶活性(Dylla等人,2008(出處同上))。這個工作代表該方法的解決方案的重大改進,可進一步改善用于鑒別、分離和表征獨特的、高度富集的在移植后專有地含有腫瘤產生能力的實體瘤細胞亞群的技術,并可區分具有或不具有自我更新能力的致瘤細胞亞群(即TProg和TPC)。然而,TPC和高度增殖性TProg亞群二者均在細胞表面上表達CD46,從而表明CD46靶向調節劑將通過消除高度增殖性細胞(即TProg)和那些負責腫瘤生長和再發的細胞(即TPC)而有益于癌癥患者。
雖然使用標準的FACS方案觀察到使用PhenoPrint陣列鑒別的大部分細胞標記物未表現出富集結腸直腸腫瘤中的腫瘤起始細胞群體的能力,但可使用獨特的標記物組合來鑒別兩個腫瘤起始細胞亞群:TPC和TProg。
實例4
用伊立替康治療可增加CD46hi腫瘤永續細胞的出現率
癌癥干細胞范例的中心原則是CSC(即TPC)相對耐受化學治療劑,如伊立替康。為了確定CD46hi TPC是否耐受化學療法,用SCRx-CR4和CR14結腸直腸腫瘤對小鼠進行初始處理。一旦平均腫瘤負荷達到約300mm3,將小鼠隨機化并用15mg/kg伊立替康或介質對照(PBS)處理,每周兩次,為期二十天,屆時對小鼠實施安樂死(圖4A)。在腫瘤收獲時,介質處理的對照小鼠攜帶的腫瘤約700mm3,而用伊立替康處理的小鼠的腫瘤接近該尺寸的一半(約388mm3)。來自各處理組的腫瘤內的TPC出現率(如用上文定義的ESA+CD46hi CD324+CD66c-表型所定義)在來自用伊立替康處理的小鼠的腫瘤中相對于介質對照富集了2.5倍(n=7;P<0.0001;圖4B)。TPC頻率的富集未受腫瘤尺寸的影響,因為當單獨與介質處理小鼠比較時伊立替康處理組中的小腫瘤明顯TPC富集(圖4C)。
TPC和高度增殖性TProg細胞群體二者均表達CD46以及TPC在處理后的殘留腫瘤中顯著富集的上述觀察結果,證明CD46hi細胞很大程度上促成腫瘤生長、再發和對療法耐受兩者。因此,從若干結腸直腸起源和胰腺起源的實體瘤分離了CD46hi細胞,使得它們的蛋白質和基因表達可通過使用SOLiD3新一代測序平臺對各腫瘤細胞亞群的整個轉錄組進行測序來進行更密切的研究。
實例5
SOLiD全轉錄組測序揭示腫瘤永續細胞群體中的CD46剪接變體
將如實例1中所述產生和繼代的若干結腸直腸癌NTX細胞系(SCRx-CR2、CR4、CR11和CR14)和胰腺癌NTX細胞系(SCRx-PA3和PA6)用于在免疫功能降低的小鼠中起始腫瘤。移出由這些NTX系產生的腫瘤,如實例1中所述使用FACS從新鮮切除的NTX腫瘤分別分離TPC、TProg和NTG細胞。更具體地講,使用CD46、CD324和CD66c標記物通過熒光激活細胞分選(FACS)分離細胞群體,立即離心得到離心沉淀物并在Qiagen RLTPlus RNA裂解緩沖液(凱杰公司(Qiagen,Inc.))中裂解。然后將裂解物保存于-80℃下直至使用。解凍后,按照供應商的說明書,使用Qiagen RNeasy分離試劑盒(凱杰公司)提取總RNA,并再次使用供應商的方案及所推薦的儀器設置,在Nanodrop(賽默飛世爾公司(Thermo Scientific))和Bioanalyzer 2100(安捷倫公司(Agilent))上定量。所得總RNA制備物適合于基因測序和分析。
制備獲自如上文所述自介質或伊立替康處理的小鼠分離的TPC、TProg和NTG細胞群體的RNA樣品,以使用Applied Biosystems SOLiD3.0(Sequencing by Oligo Ligation/Detection(通過寡聚物連接/檢測測序))新一代測序平臺(美國生命科技公司(Life Technologies)),由每份樣品至少5ng總RNA開始,進行全轉錄組測序。由SOLiD平臺產生的映射至來自人基因組的34,609個基因的數據能夠檢測CD46并提供全部樣品中的CD46水平的可檢驗測量。
總體上,SOLiD3新一代測序平臺使得能夠對連接至小珠的克隆擴增RNA/DNA片段進行平行測序。然后將通過與染料標記的寡核苷酸連接進行的測序用于產生存在于樣品中的每個片段的50個堿基讀數,總共超過5千萬個讀數,從而精確表示了基因組中蛋白質的mRNA轉錄水平表達。SOLiD3平臺不僅能夠捕捉表達,而且還能捕捉SNP、已知和未知的選擇性剪接事件,并且潛在地僅基于讀數范圍(獨特映射至基因組位置的讀數)捕捉到新外顯子發現。因此,該新一代平臺的使用使得可以測定轉錄水平表達的差異以及那些表達的mRNA轉錄物的特定剪接變體的差異或偏好。此外,用SOLiD3平臺使用來自應用生物系統公司(Applied Biosystems)的改進的全轉錄組方案進行分析僅需要大約5ng的起始物質預擴增。這與從分選細胞群體提取總RNA一樣重要,在所述細胞群體中TPC細胞子集例如在數目上與NTG或本體腫瘤相比極少,因此導致可使用起始物質的數量極小。將來自SOLiD3平臺的一式兩份操作得到的測序數據進行歸一化和轉換并按標準行業規范計算倍率。令人驚奇的是,如在結腸直腸或胰腺NTX腫瘤系中所測量的,CD46基因表達在CD46hi或CD46-/lo細胞群體中并不明顯不同,盡管這兩種細胞群體在很大程度上是基于CD46蛋白的差異表面表達來分離的。
高等哺乳動物中蛋白質多樣性的一個重大來源是由翻譯期間信使RNA(mRNA)所編碼的外顯子的差異包含或切除(即選擇性剪接)而引起。通過對轉錄組(即mRNA轉錄物)進行測序,可以有意義地洞察特定細胞群體中所編碼的蛋白質,而其他測量mRNA用法和/或基因表達的技術分別地需要明顯更多的工作(靶向重測序)或不能測定外顯子-外顯子連接區的用法(微陣列)。如表2中所見的,通過使用mRNA擴增方案和在ABI SOLiD3平臺上進行的新一代測序對全轉錄組進行測序而獲得的對CD46轉錄物數據的分析顯示,在來自數份患者樣品的TPC上表達的CD46的第一變體(primary variant)包括使用外顯子1-6、8-12和14,在外顯子7和13附近剪接并因而不包括這兩個外顯子(變體D;NM_153826)(表2)。在大多數TPC中表達的第二變體(secondary variant)也忽略掉外顯子8,從而導致CD46蛋白質改變,在其中包括外顯子1-6、9-12和14(變體F;NM_172353)。概括地說,結腸直腸和胰腺TPC中表達的所有變體均利用外顯子1-6和10-14,但絕大多數轉錄物還忽略掉編碼該蛋白質的細胞內部分的外顯子13。結腸直腸和胰腺TPC中所表達的CD46轉錄物的主要多樣性因而來源于外顯子8的包括或切除。與其他結腸直腸腫瘤相反,CD46外顯子7在來自SCRx-CR14NTX腫瘤的轉錄物中被利用,雖然這些CD46變體J(NM_172356)轉錄物仍次于CD46變體D表達(表2)。外顯子13的使用在來自結腸直腸或胰腺腫瘤細胞亞群的轉錄物中極少觀察到。
表2
通過SOLiD全轉錄組測序鑒定結腸直腸和胰腺腫瘤永續細胞中的選擇性剪接CD46同種型
對來自獨特NTX腫瘤細胞亞群的mRNA的全轉錄組測序看起來能夠精確鑒定轉錄后的CD46外顯子用法。令人驚奇的是,TPC亞群不總是呈現出編碼和或利用與它們更分化的子代(TPro和NTG細胞)相同的CD46轉錄物。然而,關于在各腫瘤細胞亞群中編碼何種轉錄物的知識可有助于開發靶向TIC群體上表達的CD46蛋白的療法。
實例6
RT-PCR驗證腫瘤起始細胞富集的細胞群體中的CD46剪接變體種類
為了確定通過SOLiD全轉錄組測序觀察到的CD46剪接形式的種類是否實際上在通過FACS從NTX腫瘤分離的獨特細胞群體中表達,使用RNeasy Plus Micro試劑盒(凱杰公司)在-70℃下保存于含有1%β-巰基乙醇的RLT-Plus緩沖液(由該生產商提供)后從裂解物分離總RNA。具體而言,將解凍的裂解物用QIAshredder離心柱(凱杰公司)均質化并用gDNA Eliminator柱消除基因組DNA,然后施加至RNeasy MiniElute離心柱來捕獲總RNA。洗滌后,用無RNA酶水洗脫總RNA。使用RNA 6000Pico試劑盒根據制造商的方案,用NanoDrop 1000分光光度計或Agilent 2100生物分析儀對分離的總RNA進行定量。接著,將20ng總RNA用Quanta qScript cDNA SuperMix進行逆轉錄,并用AmpliTaqGold DNA聚合酶,采用圖5A中所列的e6正向引物和e14反向引物進行PCR擴增(54℃退火以及72℃延伸1分鐘,進行40個循環)。使用集成DNA技術公司(Integrated DNA Technologies)的PrimerQuest和OligoAnalyzer 3.0程序,將引物(SEQ ID NO:1和SEQ ID NO:2)設計為利用所觀察到的變體中的保守外顯子(外顯子6和14)。在具有100bp DNA分子量標準(DNA ladder)的2%E-gel上分析擴增子(圖5B)。擴增后,用QIAGEN QIAquick PCR純化試劑盒純化PCR產物,并克隆進pCR4-TOPO載體中。然后使用TOP10細胞(TOPO TA測序用克隆試劑盒(TOPO TA Cloning Kit for Sequencing),英杰公司)進行該載體的轉化,通過PCR針對插入物的存在對集落進行篩選。用EZNA Plasmid MiniPrep試劑盒I(Omega Bio-Tek公司)分離含有正確插入物的質粒并用T3和T4測序引物進行測序。
顯示來自從SCRx-CR5和SCRx-CR11NTX腫瘤分離的CD46hi細胞的CD46外顯子6至14擴增產物的溴化乙錠染色凝膠在圖5B泳道1(CR5)和泳道2(CR11)中示出。100堿基對分子量標準在泳道L中繪出,在第4泳道加載了無模板對照。在分離目視觀察到的條帶后,純化cDNA,然后克隆進表達載體和細菌中。挑選單個集落并如上所述用T3和T4引物將插入物進行測序。具體而言,從CR5腫瘤細胞擴增的初級轉錄物含有外顯子6、9、10、11、12和14(代表變體F的323bp擴增子;vF),而在CR11腫瘤細胞中確認的初級轉錄物含有外顯子6、8、9、10、11、12和14(代表變體D的368bp擴增子;vD)(圖5C)。檢測到次級轉錄物并確認存在(在圖5C中的表中指出),盡管肉眼幾乎不可見到條帶(數據未示出)。還擴增了來自SCRx-CR4NTX腫瘤系的TPC、TProg和NTG細胞群體的mRNA并測序,證明在各種腫瘤細胞亞群中變體D和F的利用更不確定(圖5C);盡管如此,變體用法確認了上述全轉錄組SOLiD3測序工作中的觀察結果。
實例7
用剪接變體特異性引物/探針組的qRT-PCR來測定本體腫瘤和富集的細胞群體中的CD46剪接變體表達
為了更快速地確定給定細胞群體和/或全組織樣本中的CD46剪接變體(具體而言,外顯子6至12的用法)的表達水平,設計了將會與ABI7900HT實時定量PCR儀相容的定制qRT-PCR引物和FAM探針(圖6)。各FAM探針的每一者被設計用于檢測特定剪接變體所獨有的特異性CD46外顯子-外顯子連接區,并在384孔板中的至少重復孔中用標準的qRT-PCR方案進行PCR。例如,FAM標記探針被設計為包含外顯子8-9連接區,其能區分利用外顯子6、8、9和10的轉錄物用法(CD46變體C、D和M)與利用外顯子6、7、8、9和10的轉錄物用法(CD46變體A和B)。類似地,FAM標記的探針被設計用于分別捕獲外顯子6-9對和8-10對的用法,使得利用外顯子6、9和10的轉錄物(CD46變體E和F)和利用外顯子6、8和10的轉錄物(CD46變體I和J)也可以通過qRT-PCR快速區分和定量。
與前面的實例中描述的數據類似,來自12個結腸直腸NTX腫瘤的代表性數據表明,包括CD46外顯子6、8、9和10或CD46外顯子6、7、8、9和10的轉錄物是大多數結腸直腸腫瘤中所用的第一剪接變體(圖6)。如上面實例中所述,全轉錄組測序和捕獲轉錄物的靶向重新測序二者證實,第一轉錄物用法是6、8、9和10并且這些通常不包括外顯子7,因而表明大多數結腸直腸腫瘤中的初級轉錄物是CD46變體D。利用外顯子6、9和10的轉錄物(變體F)和利用外顯子6、8和10的轉錄物(變體J)也分別在大多數患者中存在,但程度逐漸減小(圖6)。用這些外顯子-外顯子連接區特異性引物(SEQ ID NO:3-8)篩選的十二個樣品之一表明,表達外顯子6、9和10的變體是NTX腫瘤系SCRx-CR15中的初級CD46轉錄物,而編碼CD46外顯子6、8、9和10的轉錄物表達程度較低。令人驚奇的是,這些數據和上面實例中描述的數據表明,結腸直腸腫瘤起始細胞中的第一CD46剪接變體利用外顯子6、8、9和10(變體D)或外顯子6、9和10(變體F)。因為CD46總是與結腸直腸腫瘤和胰腺腫瘤二者中的腫瘤起始能力相關并且這些特異性的外顯子-外顯子連接區通常用于編碼在這些細胞表面上表達的CD46蛋白,外顯子連接區6-8、6-9以及在較低程度上外顯子連接區8-10和9-10(當外顯子13也被剪掉時存在于變體B、D和F中)是強化抗體(empowered antibody)的靶標,該抗體可例如遞送毒素或募集細胞毒T細胞至腫瘤起始細胞并因而消除腫瘤起始細胞。
實例8
CD46在示例性腫瘤樣品中的蛋白質表達
在證明CD46在TIC表面上的表達增強并表征這些細胞和腫瘤中用于編碼CD46的外顯子連接區后,如前面實例中所描述的,就尋找相似腫瘤樣品中CD46蛋白的相應增加的證據。就此而言,提供包含來自11種腫瘤類型或它們各自的正常相鄰組織的432份組織裂解物的4種稀釋液的反相癌癥蛋白質裂解物陣列(ProteoScanTM陣列;傲銳基因科技有限公司(OriGene Technologies)),以及由無或有由外源性啟動子驅動的TP53過表達的HEK-293細胞組成的對照。使用針對人CD46而產生的兔多克隆抗體(HPA;西格瑪奧德里奇公司(Sigma Aldrich))或針對編碼CD46外顯子6、8、9和10的蛋白質構建體而產生的小鼠單克隆抗體(來自下面實例10的SC1.N29)檢測該陣列上裂解物中的CD46蛋白表達。比色檢測試劑和方案由ProteoScan陣列的生產商提供。使用BZScan2 java軟件(http://tagc.univ-mrs.fr/ComputationalBiology/bzscan/)用平板掃描儀將該制造的陣列上的光點轉換為數據圖像以對光點強度進行定量。
這些陣列的結果在圖7A-7C和圖8A-C中示出,并表明在數種不同的腫瘤類型中CD46蛋白的表達上調。更具體而言,圖7A-C采用泛CD46抗體來顯示來自從患有不同腫瘤類型的、處于疾病的多個階段的患者獲得的樣本(即原發性腫瘤樣品)的正常相鄰組織或腫瘤組織中的人CD46表達水平。類似地,圖8A-C使用與CD46的外顯子10反應的抗體來顯示各種腫瘤樣品中的表達水平。如上文所述產生數據并以每個光點的平均像素強度(光點強度)表示。對每個數據集所繪的線條表示每一類別中的樣本的平均值。
使用識別所有已知CD46剪接變體上存在的由外顯子1-6編碼的區域內的區域的泛CD46抗體(HPA)所檢測到的CD46蛋白表達,看起來在結腸直腸腫瘤樣本的子集中(尤其是在IV期疾病患者中)顯著升高(圖7A)。圖7B示出了來自患有胰腺癌的神經內分泌形式和非神經內分泌形式的患者的腫瘤樣品上的表達水平,而圖7C示出了來自患有不同階段的卵巢癌的患者的樣品上的表達水平。類似地,識別全部14種CD46轉錄物所利用的CD46外顯子10的選擇性更強的抗體(SC1.N29;特異性在下面實例15中表征)看起來與晚期結腸直腸腫瘤(圖8A)、卵巢腫瘤(圖8B)和胰腺腫瘤的神經內分泌亞型(圖8C)的裂解物的反應特異性比與正常相鄰組織的裂解物的反應特異性更強。此外,與多克隆的泛抗CD46抗體相反,當用CD46外顯子10特異性抗體SC1.N29探測時,正常相鄰組織樣品中的光點強度和標準偏差顯著較低。這些結果表明,上述腫瘤中的CD46蛋白表達在癌癥中上調,但在正常組織中極微。
這些數據支持上面實例中的觀察結果,即CD46過表達可能涉及腫瘤起始細胞和/或TPC增殖和存活。鑒于上面實例顯示CD46表達可至少部分地區分結腸直腸腫瘤和胰腺腫瘤中的TPC富集細胞群體以及CD46表面表達與致瘤性和腫瘤傳播相關,決定構建可用于產生抗CD46抗體的CD46免疫原。
實例9
可溶性CD46構建體的制造和表達
使用D、F和J同種型制備三種可溶性CD46構建體,以用于產生CD46調節劑和表征該調節劑。
將CD46同種型D的全長開放閱讀框(包含CD46基因的外顯子1-6、8-12和14;等同于NM_153826的編碼序列)和同種型F的全長開放閱讀框(包含外顯子1-6、9-12和14;等同于NM_172353的編碼序列)從獲自腫瘤樣品Cd4p2的cDNA通過PCR克隆進pENTR載體(美國生命科技公司(Life Technologies))中。DNA測序證實同種型F克隆相對于NCBI參考序列(NM_172353)無突變,而同種型D克隆在開放閱讀框內在核苷酸+822處含有單個C->T沉默突變(其中+1=野生型CD46開放閱讀框的起始ATG中的“A”)。CD46同種型J的全長開放閱讀框(包含外顯子1-6、8、10-12和14;等同于NM_172356的編碼序列(cds))用剪接重疊延伸PCR使用CD46同種型D cDNA作為模板產生。DNA測序用于確認在同種型J克隆中除了上述沉默突變外沒有另外的突變。
將編碼這三個CD46變體每一者的細胞外結構域(ECD)的序列與鼠Igκ-鏈引導序列和8X His標簽通過PCR同框克隆進pSec-2-Hygro載體(美國生命科技公司)中。所有三種CD46ECD cDNA均編碼CD46蛋白,這種蛋白以成熟N末端殘基(Cys35)開始直至每種同種型的跨膜結構域(對應于變體a同種型中的殘基343)。所有cDNA構建體使用高保真AccuPrimeTMTaq DNA聚合酶(美國生命科技公司)通過PCR產生并克隆進pSec-Tag(美國生命科技公司)的獨特SfiI-PmeI位點中。用編碼不同CD46剪接變體的質粒瞬時轉染HEK-293T細胞。使用鎳親和柱從瞬時轉染的細胞培養物上清液純化可溶性的分泌的與組氨酸標簽融合的CD46ECD蛋白。在磷酸鹽緩沖鹽水(PBS)(pH 7.2)中,使用Superdex200柱(通用電氣醫療公司(GE Healthcare))通過尺寸排阻色譜進一步純化蛋白質。
在下面列出所得構建體的氨基酸序列:CD46D-His(SEQ ID NO:9)、CD46F-His(SEQ ID NO:10)和CD46J-His(SEQ ID NO:11)。
CD46D-His(SEQ ID NO:9)
CD46F-His(SEQ ID NO:10)
CD46J-His(SEQ ID NO:11)
實例10
CD46調節劑的產生
根據本文教導通過用CD46D-His接種來產生鼠抗體形式的CD46調節劑。就這一點而言,將三個小鼠品系用于產生高親和力鼠單克隆抗體,所述抗體可在治療上用于抑制CD46的作用以治療過度增殖障礙。具體而言,如下將Balb/c、CD-1和FVB小鼠品系用人重組CD46進行免疫并用于產生雜交瘤。
抗原
用來自實例9的包含CD46-D-His的細胞外部分的重組融合蛋白和源于CD46蛋白質序列且位于外顯子6-8和6-9的外顯子-外顯子連接區內的兩種合成肽免疫小鼠。
兩種肽(長21–22個氨基酸)用固相合成法合成(AnaSpec公司(AnaSpec,Inc.))。基于CD46蛋白的肽的氨基酸序列如下:
外顯子6-8連接區:CVPKSLKVSTSSTTKSPASSAS(SEQ ID NO:12)
外顯子6-9連接區PVPKSLKGPRPTYKPPVSNYPG(SEQ ID NO:13)
免疫
用三個雌性小鼠品系Balb/c、CD-1和FVB制備CD46的小鼠單克隆抗體。用十個劑量的合成CD46肽1和2的混合物(每次免疫每只小鼠50μg)聯合重組CD46D-His(每只小鼠10μg)通過足墊注射免疫小鼠。在注射之前,將該免疫原混合物用等體積的TITERMAX或明礬佐劑乳化。
產小鼠單克隆抗CD46抗體的雜交瘤的產生
處死血清陽性的免疫小鼠,解剖出引流淋巴結(如果增大,則是腿彎部和腹股溝的淋巴結)并用作產抗體細胞的來源。通過電融合將B細胞的單細胞懸浮液(6.35×107個細胞)與非分泌型P3x63Ag8.653骨髓瘤細胞(ATCC#CRL-1580)以1:1的比率融合。使用ECM2001型融合產生器(Genetronic公司(Genetronic,Inc.))進行細胞電融合。將細胞重新懸浮于補加有HAT(Sigma#A9666)的雜交瘤選擇培養基(DMEM(Cellgro目錄號為15-017-CM)培養基,含有15%Fetal Clone I血清(Hyclone公司)、1mM丙酮酸鈉、4mM L-谷氨酰胺、10μg/mL慶大霉素、50μM 2-巰基乙醇、100μM次黃嘌呤、0.4μM氨基喋呤和16μM胸苷)中,然后根據每個96孔板最終接種2×106個B細胞以200μL/孔接種于二十個96孔平底組織培養板中。然后將板置于容納有5%CO2和95%空氣的增濕37℃保溫箱中7-10天。
抗人CD46抗體的篩選:
通過ELISA篩選來自十五個96孔板的上清液。更具體地講,用碳酸鹽緩沖液中的來自轉染的HEK-293細胞的純化重組CD46D-His融合蛋白以每孔100ng包被ELISA微量滴定板。將板在4℃下溫育過夜,然后用每孔200μl含3%BSA的PBS/吐溫(0.05%)封閉。將來自雜交瘤板的上清液添加至每個孔并在環境溫度下溫育1-2小時。用PBS/吐溫洗滌各板,然后在室溫下和與辣根過氧化物酶綴合的山羊抗小鼠IgG(Fc片段特異性的)(Jackson ImmunoResearch公司)溫育一小時。洗滌后,將各板用TMB(3,3',5,5'-四甲基聯苯胺)底物(賽默飛世爾公司34028)顯影,并通過分光光度計在OD 450下分析。
將CD46特異性雜交瘤(與抗原反應的154份上清液)在細胞培養物中擴增,再次平板接種,再次篩選并通過有限稀釋或單細胞FACS分選進行連續亞克隆。擴增所得的克隆群體,低溫保存于冷凍介質(90%FBS、10%DMSO)中并儲存于液氮中。
實例11
通過流式細胞術進行CD46調節劑表征
對于流式細胞測定法,將50×106個SW480細胞(ATCC目錄號為CCL-228;已知天然表達高水平的人CD46)與等數目的中國倉鼠卵巢細胞(CHO-S;其不表達人CD46)混合至終濃度為2.5×106個細胞/mL。在十五塊96孔板的每個孔中,將20μL該細胞混合物添加至25μL含CD46抗體的上清液,該上清液源自如實例10中所述獲得的不同克隆。輕輕地渦旋混合樣品并在4℃下將板溫育30分鐘。然后用PBS將細胞洗滌一次,然后用DyLight649抗小鼠IgG(BioLegend公司(BioLegend Inc.))在暗處于4℃染色30分鐘。溫育后,用PBS洗滌細胞并用DAPI(4',6-二脒基-2-苯基吲哚;用于從分析中除去死細胞)復染。用市售的小鼠單克隆CD46抗體(MEM-258;BioLegend公司)的1:100稀釋液制備陽性對照樣品,而陰性對照僅用抗小鼠IgG標記。通過流式細胞術分析樣品。
使用上述流式細胞術方案,154份陽性雜交瘤上清液(自1,440份預期表達CD46抗體的雜交瘤克隆)中的114份據判斷含有與細胞表面上的人CD46相互作用的抗體(數據未顯示)。用流式細胞術進行的抗體篩選證明,本發明的調節劑可用于有效表征細胞表面CD46表達以及用于分離CD46陽性細胞。
實例12
CD46調節劑內化
篩選來自產抗CD46抗體的雜交瘤的上清液在K562細胞中內化的能力,該K562細胞在細胞表面上表達CD46。在室溫下用Human TruStain(BioLegend公司)封閉起始濃度為106/ml的K562細胞(單細胞懸浮液)10分鐘,并稀釋至每種條件5×104個細胞。然后在冰上用含抗體的上清液將一式兩份的樣品染色30分鐘,最終體積為50μl。然后用FACS染色培養基(FSM;2%胎牛血清/Hank's緩沖鹽水溶液/25mM HEPES[pH 7.4])洗滌細胞以移除未結合的抗體。該步驟之后,在冰上用驢抗小鼠Alexa647(美國生命科技公司)進行第二次染色,歷時30分鐘。再次洗滌樣品以移除未結合的抗體,然后重新懸浮于內化培養基(2%胎牛血清/伊斯考夫改良杜爾貝科培養基(Iscove's Modified Dulbecco's Medium))中。
為進行內化,將樣品在5%CO2、37℃(或對于對照組為4℃)下溫育1小時。然后通過將樣品轉移至冰并添加過量的冰冷FSM來中止內化。為移除任何未內化且殘留于細胞表面上的抗體,在冰上用低pH PBS(pH 2.0)處理樣品10分鐘。根據該“酸性剝脫(acid strip)”程序,用FSM充分洗滌樣品,重新懸浮于150ul含有2ug/ml DAPI的FSM中,并通過流式細胞術分析。所檢測到的除背景外的任何信號均由抗體內化產生:抗體內化是一種保護熒光綴合物免于在酸性剝脫過程中從細胞表面移除的過程。除非另外指明,否則所有溫育均在FSM中進行。
使用上述酸性剝脫方案篩選至少75份含CD46抗體的雜交瘤克隆上清液后,許多上清液顯示出相對于IgG1和IgG2b陰性對照抗體的陽性熒光偏移(圖9A)。例如,示例性的SC1.N149和SC1.N71克隆證明,在來自這些克隆的上清液中的抗體方面的良好內化能夠內化Alexa647二抗并保護其免于酸性剝脫。這些數據證明,針對人CD46剪接變體特異性肽和CD46D-His的抗體中的一部分可在抗原呈遞于細胞表面上時結合抗原并能夠內化(圖9)。
實例13
作為靶向部分的CD46調節劑
靶向穩定連接至抗體的細胞毒性藥物代表一種強化抗體方法,該方法可能會對實體瘤患者具有很大治療有益效果。為了確定上述CD46特異性抗體是否能夠介導細胞毒性劑向活細胞的遞送,進行了體外細胞殺傷測定法,其中將與核糖體失活蛋白皂草素綴合的抗小鼠二抗(先進靶向系統公司(Advanced Targeting Systems))與CD46抗體通過其小鼠Fc區結合,并在72小時后通過測量細胞生活力來測量這些皂草素綴合物內化并殺傷細胞的能力。
具體而言,將每孔5,000個K562細胞接種于96孔板的孔中。將上述抗CD46抗體作為含抗體上清液進行篩選,或者將該抗體從上清液純化然后稀釋至20μg/mL。分別將每一抗體的等分試樣以1:1與抗小鼠ZAP或IgG-ZAP(先進靶向系統公司)混合,渦旋混合5秒,然后在室溫下溫育1小時。然后制備抗體-皂草素綴合物的兩份額外的系列10倍稀釋物,并分別將50μL的每種混合物添加至容納K562細胞的孔中,所述孔已容納有50μL培養基。然后將細胞/抗體綴合物混合物在37℃下溫育24小時。在該溫育后,將細胞在圓底96孔板中離心,移除上清液,并將100μL新鮮培養基添加至每個孔。然后將細胞再溫育72小時,然后根據制造商的方案使用CellTiter-Glo(普洛麥格公司(Promega Inc.))計算活細胞數目。
如上所述篩選CD46特異性的內化性抗體克隆介導皂草素毒素內化和細胞殺傷的能力后,在實例12的內化測定法中能夠內化的所有抗體克隆都能夠介導體外細胞殺傷,而非特異性的小鼠IgG SAP抗體對照不能殺傷細胞(圖9B)。這些觀察結果證實,本文所述的內化性抗CD46抗體能夠介導細胞毒性毒素向細胞的遞送,例如從而導致CD46hi細胞的消除。由于負責腫瘤再生和對療法的耐受性的結腸直腸腫瘤細胞和胰腺腫瘤細胞是如上所述的CD46hi,本文描述的單克隆抗體具有作為治療劑的巨大潛力,該治療劑可能會顯著影響總體患者存活率超過當前的護理標準療法。
實例14
CD46調節劑的測序
基于前文所述,選擇多種以明顯高的親和力結合固定化的人CD46的例示性獨特單克隆抗體。如圖11A和11B中以表格形式所示,對編碼來自實例10的單克隆抗體的DNA進行的序列分析證實了許多具有獨特的VDJ重排并且呈現新穎的互補決定區。注意,圖11B中所示的互補決定區是根據Chothia等人(出處同上)定義。
對于測序的起始,TRIZOL試劑購自英杰公司(美國生命科技公司)。One step RT PCR試劑盒和QIAquick PCR純化試劑盒購自凱杰公司,其中RNasin購自普洛麥格公司。定制的寡核苷酸購自集成DNA技術公司。
將雜交瘤細胞在TRIZOL試劑中裂解用于RNA制備。將104μL至105個細胞重新懸浮于1ml TRIZOL中。添加200μl氯彷后用力震蕩管。將樣品在4℃下離心10分鐘。將水相轉移至新的微量離心管中并添加等體積的異丙醇。用力震蕩管并讓其在室溫下溫育10分鐘。然后將樣品在4℃下離心10分鐘。用1ml 70%乙醇洗滌離心沉淀物一次并在室溫下稍作干燥。用40μL經DEPC處理的水重新懸浮RNA離心沉淀物。通過在1%瓊脂糖凝膠中分級分離3μL來確定RNA制備物的品質。將RNA儲存于-80℃冷凍機中直至使用。
使用可變域引物的混合物獲得用對鼠免疫球蛋白重鏈和κ輕鏈具有特異性的通用引物組擴增的雜交瘤的可變DNA序列。使用One step RT-PCR試劑盒擴增來自每份RNA樣品的VH和VK基因區段。Qiagen One-Step RT-PCR試劑盒提供Sensiscript和Omniscript逆轉錄酶、HotStarTaq DNA聚合酶、Qiagen OneStep RT-PCR緩沖液、dNTP混合物和Q溶液(一種使得能夠有效擴增“困難”(例如富含GC)模板的新型添加劑)的共混物。
制備反應混合物,該混合物包括3μL RNA、0.5μL 100μM重鏈或κ輕鏈引物、5μL 5×RT-PCR緩沖液、1μL dNTP、1μL含有逆轉錄酶和DNA聚合酶的酶混合物以及0.4μL核糖核酸酶抑制劑RNasin(1單位)。該反應混合物含有逆轉錄和PCR所需的所有試劑。熱循環儀程序為逆轉錄步驟50℃持續30分鐘、95℃持續15分鐘,接著進行30個循環:95℃持續30秒、48℃持續30秒、72℃持續1.0分鐘。然后在72℃下最后溫育10分鐘。
為制備用于直接DNA測序的PCR產物,使用QIAquickTMPCR純化試劑盒根據制造商的方案純化這些產物。使用50μL無菌水從離心柱洗脫DNA,然后直接從兩條鏈測序。直接對PCR片段測序并使用VBASE2分析DNA序列(Retter等人,Nucleic Acid Res.(《核酸研究》)33;671-674,2005)。
如上文所論述的,在圖10A–10R中分別列出了十八(18)個示例性抗體重鏈和輕鏈可變區的氨基酸和核酸序列(SEQ ID NO:14-85),而在圖11A和11B中分別以表格形式列出了這些抗hCD46抗體的遺傳排列方式和推導的CDR(如Chothia等人(出處同上)所定義)(SEQ ID NOs:86-193)。
值得注意的是,經測序的這18種單克隆抗體中大部分(50%)含有VK10和VK14輕鏈種系區段。更具體而言,在免疫小鼠組庫(repertoire)中強烈地偏倚于IGKV10-94和IGKV14-111基因的使用。進一步分析顯示,18種單克隆抗體中有6種使用IGKV10-94基因,19種單克隆抗體中有3種使用IGKV14-111基因。使用IGKV14-111基因區段的三種抗體(SC1.N56、SC1.N66和SC1N77)能識別CD46sushi結構域1內的表位。使用IGKV10-94基因區段的六種抗體中有五種能識別Sushi結構域3-4內的表位。雖然不清楚克隆選擇過程的性質,但有可能是這些種系基因區段的CDR區形成有利于結合CD46的抗原決定簇的構象。同時,在相應重鏈中未觀察到可變區偏倚。
實例15
CD46調節劑的表位確定
如上文所論述的,CD46是I型膜糖蛋白,其中細胞外結構域的氨基末端結構域(即由外顯子1-6所編碼的那些,是所有CD46轉錄物共有的)由四個短共有重復序列(SCR)構成。這些SCR每一者是大約60個氨基酸的富含半胱氨酸的結構域。接在CD46的這四個SCR后面的是STP結構域,該結構域限定三種剪接變體CD46D、CD46F和CD46J,如Karosi等人(出處同上)所述,將該文獻以引用的方式全文并入本文。為了區分泛CD46抗體(即結合一個或多個SCR的抗體)與同種型特異性CD46抗體,大致如實例9中所述在pSec-Tag載體中產生泛CD46ECD-Fc構建體。該構建體編碼四個SCR(即外顯子1-6),將其用于使用與上文針對CD46ECD變體所述相同的方法在HEK-293T細胞中表達CD46ECD-Fc(數據未示出)。針對與泛CD46ECD蛋白或同種型特異性CD46ECD蛋白每一者的結合,對雜交瘤上清液每一者進行了測試。將源于CD46外顯子1-6的序列的帶His標簽的純化CD46抗原和來自實例9的CD46D-His、CD46F-His和CD46J-His用于包被ELISA板。通過HRP標記的山羊抗小鼠IgG檢測每種單克隆抗體的結合。泛CD46抗體通過其與包括CD46細胞外結構域的前六個外顯子而缺少外顯子7-10的CD46抗原反應的能力來鑒別。發現160種單克隆抗體中有155種為泛抗體,其結合至所有的CD46重組表達的胞外結構域。五種單克隆抗體不能識別CD46的前6個外顯子中的表位,但識別限定CD46D、CD46F和CD46J這三種剪接變體的STP結構域。
圖12A示出了SC1.N122和SC1.N29抗體的ELISA數據的圖示。數據顯示,SC1.N122是泛CD46抗體,因為其結合至CD46外顯子1-6(即CD46ECD-Fc)、CD46D-His、CD46F-His和CD46J-His。在另一方面,SC1.N29顯示與CD46外顯子1-6很少結合或沒有結合,但確實顯示出與CD46D-His、CD46F-His和CD46J-His結合。因而,這些數據表明SC1.N29與由外顯子8和外顯子9編碼的ST結構或外顯子10內的近膜結構域結合。
為了更具體地鑒別CD46中為SC1.N29所識別的區域,將源于CD46的各個外顯子-外顯子連接區的合成肽直接包被在ELISA板上。通過HRP標記的山羊抗小鼠IgG檢測SC1.N29與那些肽的結合。如圖12B中所示,SC1.N29結合至肽4,該肽源于外顯子9-外顯子10連接區。由于SC1.N29與肽4(圖12B)和CD46J(圖12A)結合,這些數據表明SC1.N29與外顯子10中的區域結合,因為僅這些殘基是所述肽與CD46J蛋白二者所共有的。
實例16
單克隆抗體CD46調節劑的人源化
使用計算機輔助CDR移植方法(Abysis數據庫,UCL Business Plc.)和標準的分子工程改造技術將鼠抗體SC1.N71和SC1.N149人源化以提供hSC1.N71和hSC1.N149調節劑。基于與小鼠構架序列的最高序列同源性及其典型結構選擇可變區的人構架區。出于分析的目的,根據Kabat等人的編號方式將氨基酸分配至各CDR域。制備了若干人源化抗體變體以產生最佳人源化抗體。這兩類人源化抗體均保留與人構架區聯合的來自小鼠雜交瘤的抗原結合互補決定區(CDR)。人源化的SC1.N71單克隆抗體以改善的親和力結合至CD46抗原,而人源化的SC1.N149單克隆抗體保持與其小鼠對等物相同的抗原親和力。
使用本領域公認的技術進行分子工程改造程序。為此,根據制造商的方案(Plus RNA純化系統,美國生命科技公司)從雜交瘤提取總mRNA。將設計用于靶向整個小鼠組庫的包含三十二種小鼠特異性5'前導序列引物的引物混合物與3'小鼠Cγ1引物組合使用,以擴增抗體重鏈的可變區并測序。類似地,將設計用于擴增Vk小鼠家族中的每一者的三十二種5'Vk前導序列引物混合物與對小鼠κ恒定區具有特異性的單一反向引物的組合用于擴增κ輕鏈并測序。使用逆轉錄酶聚合酶鏈反應(RT-PCR)從100ng總RNA擴增VH和VL轉錄物。
對每一雜交瘤進行總共八次RT-PCR反應:Vκ輕鏈四次,Vγ重鏈(γ1)四次。使用QIAGEN One Step RT-PCR試劑盒進行擴增(凱杰公司)。使用特異性V區引物直接對所提取的PCR產物進行測序。使用IMGT分析核苷酸序列以鑒別具有最高序列同源性的種系V、D和J基因成員。使用V-BASE2(Retter等人,出處同上)以及通過將VH和VL基因與小鼠種系數據庫比對,來將所得的序列與Ig V區和Ig J區的種系DNA序列相比較。
根據核苷酸序列信息,獲得關于SC1.N71和SC1.N149的重鏈和輕鏈的V、D和J基因區段的數據。基于序列數據,設計對抗體的Ig VH和VK鏈的前導序列具有特異性的新引物組,用于重組單克隆抗體的克隆。隨后,將V-(D)-J序列與小鼠Ig種系序列比對。N71的重鏈基因鑒別為VHQ52.a13.37(V)、DSP2.9(D)和JH3,而N149基因的重鏈鑒別為IGHV1-18(V)、DSP2.8(D)和JH3。對于這兩種單克隆抗體,輕鏈基因均來自IGKV10-94和JK1種系基因家族。
將從SC1.N71獲得的重鏈和輕鏈序列與功能性人可變區序列比對并評估同源性和典型結構。基于該分析,選取了VH4-59種系和JH4J區段,其中在人源化SC1.N71構建體中未使用架構氨基酸置換。人源化SC1.N71重鏈的可變區顯示與人VH4-59種系序列具有88%同源性,且與小鼠可變區具有78%序列同源性。對于SC1.N71的輕鏈,采用類似的處理,結果是選擇人種系VK O2和J區段JK1,無架構氨基酸置換。所得的hSC1.N71k輕鏈可變區顯示與人VKO2種系序列具有90%同源性(陽性Z分值為0.945),且與小鼠可變區具有85%序列同源性。人源化SC1.N71重鏈的核酸序列和相應的氨基酸序列(SEQ ID NO:198和199)以及人源化輕鏈的核酸序列和相應的氨基酸序列(SEQ ID NO:200和201)在圖13A中示出,其中所述CDR(如Kabat等人所定義)標有下劃線。
按照類似的程序來產生hSC1.N149。該分析提供了包含VH1-18基因區段和J區段JH4的人源化重鏈,無架構氨基酸置換。人源化SC1.N149重鏈的可變區顯示與人VH1-18種系序列具有87%同源性,且與小鼠可變區具有77%序列同源性。對于輕鏈可變區,該分析表明,無架構置換的VK O2和J區段JK1將會是有效的。人源化SC1.N149k輕鏈可變區顯示與人VKO2種系序列具有87%同源性(陽性Z分值為0.942),且與小鼠可變區具有80%序列同源性。人源化SC1.N149重鏈的核酸序列和相應的氨基酸序列(SEQ ID NO:202和203)以及人源化輕鏈的核酸序列和相應的氨基酸序列(SEQ ID NO:204和205)在圖13A中示出,其中所述CDR(如Kabat等人所定義)標有下劃線。
將兩條重鏈的合成的人源化可變DNA片段(集成DNA技術公司)克隆進人IgG1表達載體中。將可變輕鏈片段克隆進人C-κ表達載體中。通過將重鏈和輕鏈共轉染進CHO細胞中來表達抗體。
更具體而言,為產生抗體,將鼠和人源化可變基因PCR產物定向克隆進人免疫球蛋白表達載體中。在Ig基因特異性PCR中使用的所有引物均包括限制位點(對于IgH為AgeI和XhoI,對于IgK為XmaI和DraIII),其使得可以分別直接克隆進含有人IgG1和IGK恒定區的表達載體中。簡而言之,用Qiaquick PCR純化試劑盒(凱杰公司)純化PCR產物,隨后分別用AgeI和XhoI(IgH)、XmaI和DraIII(IgK)進行消化。純化經消化的PCR產物,隨后連接進表達載體中。以10μL總體積用200U T4-DNA連接酶(紐英倫生物技術公司(New England Biolabs))、7.5μL經消化并純化的基因特異性PCR產物和25ng線性化載體DNA進行連接反應。通過在42℃下熱休克用3μL連接產物使感受態大腸桿菌DH10B細菌(美國生命科技公司)轉化并平板接種于氨芐青霉素板(100μg/mL)上。然后將VH區的AgeI-EcoRI片段插入pEE6.4HuIgG1表達載體的相同位點中,同時將合成的XmaI-DraIII VK插入物克隆進各pEE12.4Hu-k表達載體的XmaI-DraIII位點中。
通過用適當的質粒使用293fectin轉染HEK 293細胞來產生產人源化抗體的細胞。就此而言,用QIAprep離心柱(凱杰公司)純化質粒DNA。在150mm板(BD-Falcon公司(Falcon,Becton Dickinson))中,在標準條件下,在補充有10%熱滅活FCS、100μg/mL鏈霉素、100U/mL青霉素G(均來自美國生命科技公司)的達爾伯克氏改良伊格爾氏培養基(DMEM)中培養人胚腎(HEK)293T(ATCC No CRL-11268)細胞。
對于短暫轉染,將細胞培養至80%匯合。將等量IgH和相應IgL鏈載體DNA(12.5μg每種載體DNA)添加至與1.5mL opti-MEM中的50μL HEK 293轉染試劑混合的1.5mL Opti-MEM中。將該混合物在室溫下溫育30分鐘并均勻地分布于培養板。轉染后三天采集上清液,用20mL補充有10%FBS的新鮮DMEM更換并在轉染后6天再次采集。通過以800×g離心10分鐘使培養物上清液去除細胞碎片并保存于4℃下。用蛋白G珠(通用電氣醫療公司)純化重組嵌合抗體和人源化抗體。
實例17
CD46調節劑的結合特征的確定
使用多種方法分析所選的如上文所述產生的CD46調節劑的結合特征。具體而言,對于大致使用如上文實例9中所述的標準技術產生和表達的三種CD46同源物,就親和力、動力學、分類別(binning)和交叉反應性對多種CD46抗體進行表征。更具體而言,表達并純化獼猴(在本公司內進行蛋白質測序和表達,數據未示出)、狨猴(Callithrix jacchus;GenBank登錄號:Q8HYX8.2)和松鼠猴(Saimiri sciureus;使用GenBank登錄號:AAB66819.1和AAC39671.1的組合制備構建體;數據未示出)CD46同源物,然后通過ForteBIO分析。還通過蛋白質印跡測量所述抗體與還原的或未還原的抗原的反應性,十分少的所測抗體與還原的抗原結合。這些實驗的結果在圖14中以表格形式列出。
關于該數據,以三種方式測量親和力以確保精確度。首先,在ELISA中測量固定量的針對抗原系列稀釋液探測的抗體的結合信號,以測定相對調節劑活性(數據未示出)。其次,接著使用標準的抗原濃度系列在ForteBIO RED(ForteBIO公司(ForteBIO,Inc.))上利用生物層干涉測定分析法測量所選的調節劑的親和力和動力學常數kon和koff。最后,通過表面等離子共振(Biacore System,通用電氣醫療公司)測量所選的調節劑的親和力。基于標準抗原濃度系列以及使用1:1Langmuir結合模型,測定抗體與抗原結合的Kd以及動力學常數kon和koff。圖14確定了用于產生該表中包括的親和力測量值的方法(F代表ForteBIO,B代表Biacore)。一般而言,所選的調節劑顯示具有處于納摩爾范圍內的相對高的親和力。
為了進一步表征CD46調節劑,制備了截短型蛋白質構建體,其每一種缺失四個sushi結構域中的一個。使用ELISA測試了與這些構建體的結合以鑒別特定調節劑的CD46靶標區域。該工作的實驗細節在實例14中列出,其中每種所測抗體的結合結構域在圖14中示出。
為確定由CD46調節劑識別的表位是包含鄰接氨基酸還是通過抗原的二級結構所并置的非鄰接氨基酸形成,在還原和非還原條件下進行了蛋白質印記法。更具體地講,使用本領域所熟知的標準電泳技術,使兩種狀態下的CD46抗原暴露于所選的調節劑。如圖14中詳細說明的,大部分CD46調節劑實質上僅與二硫鍵完整的抗原(NR)反應,而有兩種調節劑與非還原和還原的抗原(NR/R)均反應。
最后,在ForteBIO中使用一系列濃度的重組表達的單體CD46抗原來評價獼猴、狨猴和松鼠猴CD46同源物的交叉反應性。如圖14中所列,所選的調節劑可與多種的同源物反應。具體而言,SC1.N71和SC1.N149可與獼猴和狨猴反應,但不與松鼠猴反應。表格中的ND表示未測定數據。
實例18
所選的CD46調節劑的表位確定
為了確定由所選的如上文所述產生的CD46調節劑所限定的表位,構建并表達了CD46ECD的若干不同變體。更具體而言,使用擴增各種CD46SCR結構域的引物設計CD46缺失突變體(如Adams等人,Journ.Immunol.(《免疫學雜志》),第147卷:3005,1991中所述,將該文獻以引用的方式全文并入本文)并將這些突變體與His標簽融合以進行親和純化(凱杰公司,Ni-NTA)。然后使用標準的生物化學技術大致如實例9中所述克隆并表達四種單獨的His融合構建體,各略掉四個SCR結構域中的一個。使用293Fectin(美國生命科技公司),將分離的無內毒素質粒DNA(凱杰公司)用于轉染貼壁HEK-293細胞。在轉染后72小時,收獲包含所表達的缺失型突變體的HEK-293轉染細胞的上清液。對若干CD46的單克隆抗體通過其識別缺失確定的SCR結構域的各CD46蛋白的能力進行了測試。更具體地講,通過大致使用本文其他地方描述的方法所進行的ELISA測定法,所選的抗體調節劑被鑒別為分別針對SCR結構域1至4的任何組合。這些調節劑中的十二種的數據可以表格形式見于圖14中的標題“結構域”下,其中指明了所得的結合結構域。應該指出的是,一種抗體(SC1.N29)不結合至任何sushi結構域而是結合至外顯子9,如實例15中所證實的。
本實例再次證明了能夠產生和選擇與所述治療靶標的所選的同種型或剪接變體免疫特異性締合的CD46調節劑。
實例19
單克隆抗體CD46調節劑的表征
使用實例17中所述的技術,對人源化構建體hSC1.N71和hSC1.N149進行分析以確定它們的結合特征。更具體地講,對于兩種抗體,將人源化抗體結合直接與親本鼠抗體進行比較以鑒別由人源化過程引起的速率常數的任何微小變化。
就這一點而言,使用表面等離子共振(SPR)通過Biacore測量鼠SC1.N71的親和力以提供圖15A中所示的結果。基于濃度系列12.5、6.25、3.125和1.5625nM(產生圖15A和15B中從上到下的曲線)以及使用1:1Langmuir結合模型,抗體與抗原結合的Kd估計為1.1nM。接著用人源化構建體進行的類似實驗顯示出同等結果(圖15B),這表明人源化過程并未不利地影響親和力。就這一點而言,測量結果表明,當用人CD46測試時人源化構建體的Kd為0.7×10-9,相比之下親本鼠抗體的Kd為1.1×10-9(圖15C)。
然后進行類似的實驗以將hSC1.N149的結合與其鼠親本SC1.N149的結合相比較(數據未示出)。如可在圖15C中所見的,人源化抗體的Kd為1.2×10-9,相比之下,親本鼠抗體的Kd為1.1×10-9。
除了親和力測量外,進一步測試抗體以測定關于狨猴和獼猴抗原的交叉反應性。如圖15C中所示,SC1.N71和SC1.N149二者均與獼猴和狨猴CD46同源物二者發生強的交叉反應,從而有利于毒理學研究。與狨猴和獼猴的反應性盡管稍低于對人靶標的反應性,但仍完全處于可接受的治療窗口內。
實例20
CD46調節劑可用作診斷劑
根據本文的教導,可將所公開的CD46調節劑用作診斷劑以檢測來自患者的生物樣品中的CD46相關生物標記。
如先前提到的,CD46是I型糖蛋白,已知存在于細胞質膜中但可通過金屬蛋白酶的作用從膜分開。CD46由于其mRNA的選擇性剪接而以多種分子量同種型存在,該選擇性剪接是基于外顯子切換和/或省略掉跨膜結構域兩側的近膜區。由于顯示具有這類性質,在某些疾病病癥中CD46應可以在體液如血清或血漿中檢測到,并因而可用于診斷目的或用作疾病生物標記。為了確認本發明的這一方面,使用夾心ELISA格式用抗CD46抗體產生如圖16A所示(插圖)的標準曲線,并將該標準曲線的一部分(圖16A的主圖)用于定量從健康受試者和患有各種實體瘤的患者獲得的血清樣品中的CD46水平(圖16B)。
更具體而言,將50mM碳酸鈉緩沖液(pH9.6)中的單克隆抗體SC1.N35.6以1μg/ml吸收至標準ELISA板。在用含有0.05%(v/v)吐溫-20的PBS(PBST)洗滌板后,在環境溫度下將板在含有2%(w/v)牛血清白蛋白的PBS(從現在起稱為“稀釋劑”)中封閉兩小時。彈去板的內含物,在環境溫度下將不同濃度的純化重組CD46D-His或在稀釋劑中稀釋的血清樣品添加至板中保持最少兩個小時。將板在PBST中洗滌,然后將稀釋劑中的與生物素綴合的CD46特異性山羊多克隆抗體以0.5μg/ml添加。溫育一小時后,再次用PBST洗滌該板并與綴合至辣根過氧化物酶的鏈霉親和素(Jackson Immuno Research公司)的1:2000稀釋物一起溫育30分鐘。在用PBST將全部板洗滌兩次后,將100μL TMB底物(賽默飛世爾公司)添加至孔并在暗處溫育30分鐘。通過每孔添加100μL 2M硫酸來終止顏色反應。使用標準的讀板儀讀取所有孔中的λ=450nm的吸光度。
在該數據集中,將來自12名健康成人的血清中的CD46水平與來自17名結腸直腸癌患者、6名骨髓瘤患者、15名乳腺癌患者、7名卵巢癌患者、10名非小細胞肺癌患者、14名前列腺癌患者和9名胰腺癌患者的血清樣品相比較。如圖16B中所示,這些數據顯示健康成人血清樣品中的平均CD46濃度為大約12.1±2.2ng/ml,而結腸直腸癌、乳腺癌和非小細胞肺癌患者中的CD46濃度顯著較高(分別是26.6±3.4、30.6±2.3和42.0±7.1ng/ml)。這些結果清楚地證明,本發明所公開的調節劑可有效充當診斷劑用于檢測和/或監測贅生性障礙。
實例21
充當靶向部分的CD46調節劑
穩定連接至抗體的細胞毒性藥物的靶向代表一種強化抗體方法,該方法可能會對實體瘤患者具有很大治療有益效果。為了確定上述CD46特異性抗體是否能夠介導細胞毒性劑向活細胞的遞送,進行了體外細胞殺滅測定法,其中將與核糖體失活蛋白皂草素綴合的鏈霉親和素(先進靶向系統公司)結合至生物素化的CD46抗體調節劑,并在72小時后通過測量細胞生活力來測量這些皂草素復合物內化并殺滅細胞的能力。更具體而言,將每孔10,000個HEK-293T細胞接種于96孔板的孔中。第二天,將上述純化的且生物素化的抗CD46抗體稀釋至100nM。分別將每一抗體的等分試樣以1:1的摩爾比與鏈霉親和素-ZAP(先進靶向系統公司)混合,然后在室溫下溫育30分鐘。將抗體–鏈霉親和素-ZAP綴合物系列稀釋并將所有稀釋液添加至細胞。然后將細胞/抗體-皂草素混合物在37℃/5%CO2下溫育72小時。在該溫育后,使用CellTiter-Glo(普洛麥格公司)按照生產商的方案對活細胞數目進行計數。無抗體–鏈霉親和素-ZAP的培養物用作參照,并將它們的發光值設定為“100%活細胞”。
使用該方案,數種如先前實例中所述能夠內化的抗體也能夠介導活體外細胞殺滅(數據未示出),而生物素標記的同種型對照抗體不能殺滅細胞。也就是說,這些內化性調節劑中的數種能夠介導導致細胞死亡的皂草素毒素內化。圖17示出了示例性的內化性調節劑SC1.N71、SC1.N146(作為小鼠/人嵌合抗體)和SC1.N149的這種細胞殺滅能力,其中曲線的下行部分代表與對照相比細胞以濃度依賴的方式死亡。此外,圖17中所示數據證明,來自實例16的兩種抗CD46抗體(hSC1.N71和hSC1.N149)保留初始小鼠抗體介導細胞的CD46依賴性的毒素攝入的能力。具體而言,記錄了如下引起50%細胞死亡的有效濃度(EC50):生物素-人IgG1,53.1nM;生物素-小鼠SC1.N71,51.4pM;生物素人SC1.N71,26.6pM;生物素嵌合SC1.N146,12.1pM;生物素-小鼠SC1.N149,70.4pM;生物素人SC1.N149,174pM。
實例22
CD46調節劑與細胞表面上的受體相互作用
為了證明細胞殺滅是由CD46調節劑與細胞表面上表達的CD46受體之間的相互作用介導,將慢病毒用于穩定遞送小發夾RNA(shRNA),該RNA在轉導進宿主細胞后,即整合進宿主細胞的基因組中,并在表達后,特異性結合至CD46mRNA的區域,從而引起細胞內的快速mRNA降解以及宿主細胞的CD46表達降低或喪失。
使用確立的技術制備并濃縮含有CD46發夾的第三代慢病毒原種(美國生命科技公司)。用慢病毒原種轉導HEK293T細胞,該病毒原種編碼CD46特異性shRNA和作為成功轉導的標記物的藍色熒光蛋白。轉導后第六天,通過流式細胞術分析細胞的CD46表達和高的藍色熒光蛋白表達(未示出),通過FACS分選展現出最大CD46下調和最高藍色熒光蛋白表達的細胞(即表達shRNA C1的那些細胞)。將分選的細胞另外培養7天,然后在類似于上文實例21中所述的測定法的體外殺滅測定法中將它們與它們的親本對等物平行測試。另外,兩類細胞系均用與熒光團藻紅蛋白綴合的抗CD46抗體(R&D Systems公司)染色并通過流式細胞術進行分析,以證明經慢病毒轉導(并分選)的細胞系中CD46表達下調。結果在圖18A和18B中示出。
更具體地講,圖18A證明,當用抗CD46抗體染色時,HEK-293T-C1細胞(灰色峰)與其親本對等物(白色峰)相比平均熒光強度降低10倍。HEK-293T細胞被CD46調節劑有效殺滅,但它們的衍生HEK293T-C1(其表達會下調CD46表達的shRNA)沒有被CD46調節劑有效殺滅(圖18B)。在該特定實例中,將指定濃度的純化抗體和120nM的與核糖體失活蛋白皂草素綴合的抗小鼠IgG分子的Fab片段(先進靶向系統公司;FAB-ZAP)添加至HEK293T細胞或分選的HEK293T-C1細胞。在溫育72小時后,使用CellTiter-Glo(普洛麥格公司)按照生產商的方案測定活細胞數目。僅含有細胞和FAB-ZAP的培養物用作對照,并將它們的發光值設定為“100%活細胞”。
實例23
CD46調節劑介導受體依賴的毒素攝入
在體外培養許多代的傳統細胞系與源自患者的原發性腫瘤細胞在其生物學方面顯著不同。為了評估CD46調節劑是否可以介導類似于患者腫瘤的癌細胞所進行的受體依賴的毒素攝入,在體外殺滅測定法中測試了衍自患者的在免疫功能降低的小鼠中繼代的非傳統異種移植物。
具體而言,將BR31p6細胞(源于乳腺癌患者的細胞系)以10,000/孔接種于Primaria TC板中并在低氧培養箱中培養24小時。更換培養基并將如上面實例21中所述制備的生物素化抗體和鏈霉親和素-ZAP綴合物添加至該培養物保持72小時。使用CellTiter-Glo(普洛麥格公司)按照生產商的方案對活細胞數目進行計數。無抗體–鏈霉親和素-ZAP的培養物用作參照,并將它們的發光值設定為“100%活細胞”。BR31細胞僅在生物素化SC1.N149和鏈霉親和素-ZAP一起存在時被殺滅。單獨的SC1.N149或生物素化同種型對照抗體+鏈霉親和素-ZAP均不介導顯著的細胞殺滅(圖19A)。
為了證明CD46調節劑可在許多實體瘤適應癥中用作細胞毒性有效載荷的媒介物,將源于非傳統異種移植物CR42p3(一種源于結腸直腸癌患者的細胞系)和PA20p6(一種源于胰腺癌患者的細胞系)的腫瘤以每孔2000個細胞接種于Primaria TC板中。在低氧培養箱中培養72小時后,將1.0nM純化抗體(CD46調節劑或其同種型對照)和40nM FAB-ZAP(參見圖19B)添加至培養物,另外培養168小時。使用CellTiter-Glo(普洛麥格公司)按照生產商的方案對活細胞數目進行計數。僅含有細胞和FAB-ZAP的培養物用作對照,并將它們的發光值設定為“100%活細胞”。抗體SC1.N71和SC1.N149特異性地殺滅CR42和PA20細胞,其中相比于SC1.N149,SC1.N71看起來稍微更強效(圖19B)。
這些數據清楚地證明了所公開的調節劑在充當細胞毒性有效負載在表達CD46配體的致瘤細胞中的選擇性內化的載體時的特異性和廣泛有效性。
實例24
CD46調節劑使胰腺腫瘤對化學療法敏感
為了評估所公開的調節劑是否可以增加胰腺腫瘤的化學敏感性,將抗CD46抗體與抗癌劑在體內測定法中組合。
更具體地講,使用源于患者的NTX-PA14腫瘤系在免疫功能降低的小鼠中起始腫瘤,然后當所有小鼠的平均腫瘤體積達到大約500mm3時將這些小鼠隨機分配進三組中的其中一組(每組10只小鼠)。兩組每周用20mg/kg劑量的吉西他濱和10mg/kg靶向CD46的抗體(SC1.N149)或對照非特異性同種型匹配抗體(MOPC)處理兩次。用作對照的剩余的一組每周一次接受2mg/kg劑量的抗CD46抗體-藥物綴合物,該綴合物不能內化或介導細胞殺滅。在第3次處理后的第一天(隨機分組后的第8天),并且當腫瘤積極響應相應的給藥方案時,對每組2只小鼠實施安樂死并通過流式細胞術對殘余TPC的出現率進行計算。具體而言,將分離自如上所述處理的小鼠的腫瘤細胞的單細胞懸浮液與抗標記物抗體接觸,該標記物使得可以對TPC亞群進行鑒別和定量。在來自用抗CD46抗體SC1.N149與吉西他濱的組合處理的小鼠的腫瘤中,表達與TPC群體相關聯的細胞表面標記物(即CD46和CD324)的人細胞的百分比顯著低于對照組和吉西他濱+MOPC抗體處理組(27%的人細胞對比約39%)(圖20A)。
除了在該研究中用作對照的小鼠(由于它們的腫瘤負荷大而必須將它們實施安樂死)外,其余的每組8只小鼠繼續接受另外的11次吉西他濱和抗體處理(總共14次處理),為期7周,此后將小鼠僅用抗體(分別是MOPC或SC1.N149)每周處理兩次并監測腫瘤負荷(即腫瘤體積測量)。總的來說,兩個吉西他濱處理組中的腫瘤均響應它們各自的處理方案并退化至低于100mm3;然而,用SC1.N149抗體和吉西他濱處理的那些小鼠顯示出比單獨用吉西他濱處理的小鼠中的腫瘤更長的無進展生存期(分別是75天和30天)(圖20B)。
這些數據證明,在胰腺癌中靶向CD46的抗體能夠使腫瘤細胞對護理標準的化療劑吉西他濱敏感。考慮到先前證明了TIC刺激腫瘤再發—相比于僅用吉西他濱處理,用裸抗CD46抗體和吉西他濱二者處理的小鼠中該TIC刺激的腫瘤再發被顯著延緩—這里給出的數據表明裸SC1.N149抗體能夠特異性地有利于TIC對化療藥物例如吉西他濱的敏感性。
實例25
CD46調節劑可減少NTX小鼠中的腫瘤起始細胞
通過皮下、腎包囊或異位移植人腫瘤片段或人腫瘤細胞的單細胞懸浮液對小鼠進行異種移植,其中至少有亞群表達CD46,使得其攜帶人腫瘤。一旦腫瘤達到100–500mm3的負荷即對攜帶人腫瘤的小鼠進行隨機分組并用靶向人CD46的抗體-藥物綴合物(ADC)處理,例如通過以最多10mg/kg單獨或與護理標準化療劑如伊立替康或吉西他濱組合一周給藥一次或兩次來進行。優選地,ADC將包含與細胞毒性藥物部分或毒素綴合的抗CD46抗體。
在處理數周后,觀察到腫瘤或變小直至無腫瘤塊存留、或經歷部分退化(其中某些腫瘤塊存留),或保持其腫瘤塊而不繼續生長。在后面的情形中,對殘余腫瘤塊進行檢查表明在腫瘤塊中無人細胞存留(即其由殘留的鼠基質細胞構成),或者顯示腫瘤起始細胞減少或消除,如通過各種體外測定法(如對集落形成細胞進行計數)和體內測定法(如有限稀釋分析以證明在經處理的腫瘤中腫瘤起始細胞的絕對減少或消除)所測定的。對小鼠進一步觀察確認了通過腫瘤生長再發顯著延緩(即>60天)或完全阻止腫瘤再發所體現的TIC的減少或消除。
本領域技術人員應進一步理解,在不脫離本發明的精神或其中心屬性的情況下,本發明可以其他特定形式實施。因為本發明的以上描述僅公開其示例性實施例,所以應了解設想到其他變化形式涵蓋在本發明的范圍內。因此,本發明并不限于本文已詳細描述的具體實施例。相反,應參考指示本發明的范圍和內容的隨附權利要求。
- 還沒有人留言評論。精彩留言會獲得點贊!