促進骨再生的活性支架材料、其制備方法及應用與流程
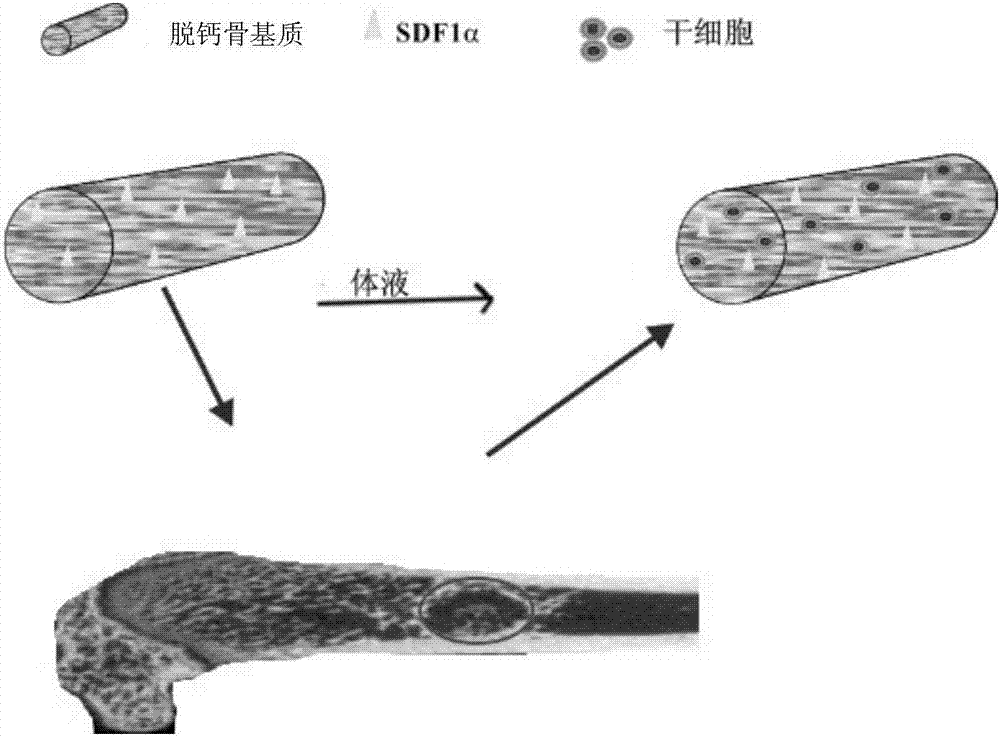
本發明涉及一種生物支架材料,具體涉及一種具有膠原結合區的基質細胞衍生因子修飾的脫鈣骨基質支架材料、其制備方法及應用,屬于生物醫學材料領域。
背景技術:
骨組織是少數幾個具有自我再生能力的組織器官之一,這種再生能力不僅伴隨著個體的骨骼發育以及骨組織損傷修復過程,甚至在個體成熟后仍然可以有效的工作。然而,當大面積的骨損傷發生時,骨組織就無法利用本身的再生能力進行修復愈合。目前骨組織損傷后的重建主要依賴于移植治療,但會帶來多種并發癥以及產生免疫排斥反應。在臨床治療中,自體骨移植是比較理想的方法,但該方法也有許多的缺點,例如并發癥患病率高,需要多個手術位點和有限的自體骨組織。為了避免這些缺點,許多種材料如金屬、塑料和化學分子聚合物等被用作為骨替代物,但是這些骨替代物材料都無法促進內源性骨再生,甚至可能引起免疫排斥反應,會對患者造成二次傷害。
在骨損傷修復和新骨生成過程中,富含緩慢釋放生物活性因子的生物活性支架材料具有至關重要的作用。利用修飾了趨化因子的生物支架材料可以促進新骨的生成和骨組織損傷處的修復。近年來研究發現基質細胞衍化生長因子1α(sdf1α,又稱為cxcl12)可以有效的募集間充質干細胞、造血干細胞等到骨損傷處。而研究表明在一定的微環境下,間充質干細胞可以分化為成骨細胞,促進骨損傷的修復。
但是,天然的基質細胞衍生因子在體內維持的濃度較低,并且容易彌散。若利用化學交聯等方法將其交聯到支架材料上雖然會提高sdf1α的局部濃度,但也會引入有毒或有害的化學交聯分子進入體內。
因此,研究具有生物活性因子的生物支架材料作為骨替代物是亟待解決的難題,而如何在體內控制生物活性因子的緩慢釋放、降低骨損傷移植的免疫排斥反應是另一個難題。
技術實現要素:
本發明的主要目的在于提供一種促進骨再生的活性支架材料、其制備方法及應用,以克服現有技術的不足。
為了實現上述目的,本發明的技術方案如下:
本發明實施例提供了一種促進骨再生的脫鈣骨基質支架材料,其包括:
趨化因子;
負載所述趨化因子的脫鈣骨基質,所述脫鈣骨基質具有疏松孔狀內部結構,并主要由具有空間網狀結構的膠原分子組成;
其中,所述趨化因子以共價鍵或者非共價鍵方式與所述脫鈣骨基質中的膠原分子結合。
進一步的,所述趨化因子包括基質細胞衍生因子(sdf1α)。
尤其優選的,所述趨化因子還包括與所述基質細胞衍生因子連接的膠原結合區。
即,所述趨化因子選自具有膠原結合區(cbd)的基質細胞衍生因子(cbd-sdf1α)
進一步的,所述趨化因子以其膠原結合區與所述脫鈣骨基質中的膠原分子結合。
本發明實施例還提供了制備所述的促進骨再生的脫鈣骨基質支架材料的方法,其包括:
提供具有疏松孔狀內部結構的脫鈣骨基質;
使所述脫鈣骨基質與趨化因子溶液接觸,從而使所述脫鈣骨基質負載趨化因子,形成所述脫鈣骨基質支架材料。
進一步的,所述的制備方法包括:采用點基因融合表達的方法將膠原結合區結合至基質細胞衍生因子上,從而形成所述趨化因子。
本發明實施例還提供了所述的促進骨再生的脫鈣骨基質支架材料的用途。
與現有技術相比,本發明通過將膠原結合區與基質細胞衍生因子融合表達,從而獲得的具有膠原結合區的基質細胞衍生因子(cbd-sdf1α),該具有膠原結合區的基質細胞衍生因子不僅可與膠原分子結合,且具有天然(nat-sdf1α)的生物活性,引入的膠原結合區是一個可與膠原分子結合的小分子肽段,具有良好的生物相容性和生物可降解性;進而,采用具有膠原結合區的基質細胞衍生因子修飾脫鈣骨基質而形成的生物活性支架材料緩慢釋放生物活性因子的穩定性好,極大的提高了損傷處趨化分子的局部濃度,可迅速的動員體內的干細胞到骨損傷處,同時釋放持續時間長,而且此生物活性支架材料具有疏松孔狀的內部構造可以提供細胞粘附、生長、分化的環境,同時此生物活性支架材料整體又具有一定的硬度,可以在移植早期局部代替骨支撐身體的作用。
附圖說明
為了更清楚地說明本發明結構特征和技術要點,下面結合附圖和具體實施方式對本發明進行詳細說明。
圖1為本發明實施例1中一種sdf1α修飾的脫鈣骨基質支架材料的制備工藝原理圖;
圖2a-2b分別為本發明實施例1中一種具有疏松孔狀的內部結構的脫鈣骨基質的宏觀及微觀結構示意圖;
圖3為本發明實施例1中一種sdf1α修飾的脫鈣骨基質支架材料緩慢釋放sdf1α的統計圖;
圖4a-4b為本發明實施例1中一種sdf1α修飾的脫鈣骨基質支架材料用于大鼠股骨損傷移植的照片;
圖5a為本發明實施例1中利用cd34及c-kit免疫熒光染色顯示sdf1α修飾的脫鈣骨基質支架材料在體內募集干細胞情況的熒光顯微照片;
圖5b為本發明實施例1中一種sdf1α修飾的脫鈣骨基質支架材募集干細胞數量的統計圖;
圖6a為本發明實施例1中一種sdf1α修飾的脫鈣骨基質支架材料移植4周后的骨礦化密度值的統計結果的示意圖;
圖6b為本發明實施例1中一種sdf1α修飾的脫鈣骨基質支架材料移植8周后的骨礦化密度值的統計結果的示意圖;
圖7a為本發明實施例2中一種cbd-sdf1α修飾的脫鈣骨基質支架材料的制備工藝原理圖;
圖7b為本發明實施例2中一種脫鈣骨基質支架材料緩慢釋放細胞因子的統計圖;
圖7c為本發明實施例2中一種脫鈣骨基質支架材料可以為細胞的生長提供良好的微環境的sem圖,其中*p<0.05,**p<0.01;
圖8a為本發明實施例2中脫鈣骨基質在礦化液中逐步被礦化的sem圖;
圖8b為本發明實施例中礦化后的脫鈣骨基質材料的元素分析統計圖;
圖9a為本發明實施例2中反映cbd-sdf1α和nat-sdf1α具有相同的生物活性的結晶紫染色圖;
圖9b為本發明實施例2中反映cbd-sdf1α和nat-sdf1α具有相同的生物活性的結晶紫染色統計圖;
圖10a為本發明實施例2中cbd-sdf1α修飾的脫鈣骨基質支架材料用于大鼠股骨損傷移植的照片(大鼠股骨缺損模型的建立);
圖10b為本發明實施例2中microct的二體積分析法的示意圖;
圖10c為本發明實施例2中修飾了cbd-sdf-1α的脫鈣骨基質在體內短期募集干細胞的情況的熒光顯微照片;
圖10d為本發明實施例中修飾了cbd-sdf-1α的脫鈣骨基質在體內短期募集干細胞的統計結果圖,*p<0.05;
圖11a為本發明實施例中大鼠股骨樣品的ct掃描軸狀圖;
圖11b為本發明實施例中大鼠股骨樣品的ct掃描冠狀圖;
圖12a為本發明實施例中h&e染色的樣品在50倍放大鏡下的觀察圖;
圖12b為本發明實施例中h&e染色樣品在200倍放大鏡下的觀察圖;
圖12c為本發明實施例中masson染色的樣品在50倍放大鏡下的觀察圖;
圖12d為本發明實施例中骨組織樣品中成骨細胞的統計圖;
圖12e為本發明實施例中骨組織樣品中破骨細胞的統計圖,其中黑色的尖箭頭指示的是破骨細胞,黑色鈍箭頭指示的是成骨細胞,*p<0.05,**p<0.01,***p<0.001;
圖13a為本發明實施例中移植治療4周后的骨組織樣品的opg染色圖;
圖13b為本發明實施例中移植治療4周后骨組織樣品的opn染色分析圖;
圖13c為本發明實施例中移植治療12周后骨組織樣品的ocn染色分析圖,其中黑色箭頭指示的是褐色的陽性染色區域;
圖14a為本發明實施例中移植治療4周的股骨缺損處活體ct掃描冠狀圖;
圖14b為本發明實施例中移植治療8周的股骨缺損處活體ct掃描冠狀圖;
圖14c為本發明實施例中移植治療4周的股骨缺損處(v1及v2)骨礦化密度值統計圖;
圖14d為本發明實施例中移植治療8周的股骨缺損處(v1及v2)骨礦化密度值統計圖;
圖14e為本發明實施例中移植治療4周的股骨缺損處(v1)新生骨體積值統計圖;
圖14f為本發明實施例中移植治療4周的股骨缺損處(v2)新生骨體積值統計圖,*p<0.05,**p<0.01,***p<0.001;
圖15a為本發明實施例中三點彎曲實驗示意圖;
圖15b為本發明實施例中移植治療4周的股骨樣品三點彎曲測試結果統計圖;
圖15c為本發明實施例中移植治療8周的股骨樣品三點彎曲測試結統計圖;
圖15d為本發明實施例中移植治療12周的股骨樣品三點彎曲測試結果統計圖,其中*p<0.05,**p<0.01,***p<0.001。
具體實施方式
以下將結合附圖及較佳實施例對本發明的技術方案作進一步的說明:
本發明實施例提供的一種促進骨再生的脫鈣骨基質支架材料包括:
趨化因子;
負載所述趨化因子的脫鈣骨基質,所述脫鈣骨基質具有疏松孔狀內部結構,并主要由具有空間網狀結構的膠原分子組成;
其中,所述趨化因子以共價鍵或者非共價鍵方式與所述脫鈣骨基質中的膠原分子結合。
進一步的,所述趨化因子包括基質細胞衍生因子。
優選的,所述趨化因子還包括與所述基質細胞衍生因子連接的膠原結合區。
進一步的,所述趨化因子以其膠原結合區與所述脫鈣骨基質中的膠原分子結合。
進一步的,所述脫鈣骨基質內的至少部分孔洞中修飾有所述趨化因子。
本發明提供的修飾了具有膠原結合能力的基質細胞衍生因子的脫鈣骨基質支架材料,即前述的脫鈣骨基質支架材料可以通過募集內源間充質干細胞來促進新骨生成,并可用于體內移植治療。
將修飾具有膠原結合能力的基質細胞衍生因子的脫鈣骨基質生物活性支架材料作為骨移植替代物移植到大鼠股骨損傷處可動員內源干細胞到損傷部位。術后檢查其恢復情況可發現,這種生物活性的支架材料促進新骨的生成及骨組織功能的恢復。
本發明具有顯著優點:本發明提供的復合趨化因子的脫鈣骨基質支架材料緩慢釋放生物活性因子的穩定性好,極大的提高了損傷處趨化分子的局部濃度,可迅速的動員體內的干細胞到骨損傷處,同時釋放持續時間長;另外,此復合的生物活性支架材料具有疏松孔狀的內部構造可以提供細胞粘附、生長、分化的環境。而生物活性支架材料整體又具有一定的硬度,可以在移植早期局部代替骨支撐身體的作用。
本發明實施例提供的一種制備所述的促進骨再生的脫鈣骨基質支架材料的制備方法包括:
提供具有疏松孔狀內部結構的脫鈣骨基質;
使所述脫鈣骨基質與趨化因子溶液接觸,從而使所述脫鈣骨基質負載趨化因子,形成所述脫鈣骨基質支架材料。
進一步的,所述的制備方法包括:采用點基因融合表達的方法將膠原結合區結合至基質細胞衍生因子上,從而形成所述趨化因子。
進一步的,所述的制備方法包括:將所述趨化因子溶液緩慢施加在所述脫鈣骨基質上,從而使所述脫鈣骨基質負載趨化因子。
進一步的,所述趨化因子溶液的濃度在10nm以上。
進一步的,所述的制備方法包括:提供異體來源的長骨骨組織,先剪切成合適大小,然后在有機溶劑中充分浸泡,去除骨組織表面的雜質,之后以水充分清洗,再以鹽酸溶液處理脫鈣,最后以水清洗、凍干、輻射滅菌,獲得脫鈣骨基質,備用。
進一步的,所述有機溶劑可采用丙酮,但不限于此。
較為優選的,所述鹽酸溶液的濃度可以為0.6mol/l。
進一步的,所述的制備方法包括:在無菌條件下,將趨化因子溶于磷酸鹽緩沖液中而形成所述趨化因子溶液,之后將所述趨化因子溶液逐滴、多點地滴加到所述脫鈣骨基質上,并在37℃孵育30min以上,使趨化因子被修飾到所述脫鈣骨基質上,形成所述脫鈣骨基質支架材料。
本發明可采用酸堿的方法制備脫鈣骨基質,使得獲得的脫鈣骨基質具有疏松孔狀的內部結構、具有一定的硬度同時也極大的降低了免疫原性。同時還可采用點基因融合表達的方法獲得具有膠原結合能力的基質細胞衍生因子(cbd-sdf1α),進而實現了趨化因子的生物活性的保存和與脫鈣骨基質材料的有效結合。同時,所述cbd-sdf1α不僅可與膠原分子結合并且具有天然(nat-sdf1α)的生物活性,而且引入膠原結合區是可與膠原分子結合的小分子肽段,具有良好的生物相容性和生物可降解性。
相應的,本發明實施例還提供了所述的促進骨再生的脫鈣骨基質支架材料于制備活性支架材料中的用途,所述活性支架材料至少能夠通過募集內源性干細胞而促進骨再生。
相應的,本發明實施例還提供了所述的促進骨再生的脫鈣骨基質支架材料在制備骨缺損移植治療產品中的用途。
如下結合附圖和若干實施例對該技術方案、其實施過程及原理等作進一步的解釋說明。
實施例1
(一)修飾趨化因子的脫鈣骨基質支架材料的制備方法
1)首先,利用業界已知的基因工程方法構建趨化因子的大腸桿菌表達載體,純化表達出高純度的趨化因子,其中趨化因子采用sdf1α;
2)其次,利用酸堿的方法處理脫鈣骨基質材料,具體的,提供異體來源的長骨骨組織,先剪切成合適大小,然后在丙酮中處理48小時去除表面的軟組織、脂肪等物質,隨后用雙蒸水清洗數次再用0.6mhci溶液處理脫鈣,最后雙蒸水清洗后凍干;再輻照滅菌后備用,獲得的脫鈣骨基質具有疏松孔狀的內部結構(如圖2a-圖2b所示),可以提供細胞粘附、生長、分化的環境,而脫鈣骨基質支架材料整體又具有一定的硬度,可以在移植早期局部代替骨支撐身體的作用;
3)最后,在無菌條件下,用20μl的pbs溶解10nm的sdf1α,再逐滴、多點地滴加到剪切好的脫鈣骨基質材料上,注意此步操作時要緩慢,從而保證生物活性因子sdf1α充分的負載到脫鈣骨基質支架材料上,參閱圖1展示了sdf1α修飾到脫鈣骨基質支架材料的情況。
(二)修飾趨化因子的脫鈣骨基質支架材料緩慢釋放趨化因子的檢測方法
1)在無菌條件下,選取一個48孔板,在每個孔內均放置一塊sdf1α修飾的脫鈣骨基質支架材料,并在每個孔內添加500μl的pbs;
2)將48孔板放入水平轉速為150轉/分鐘的小搖床上,再整體放入到溫度恒定為37℃的恒溫培養箱中,每隔12小時更換一次pbs溶液,并且每次收取更換掉的溶液凍存于-20℃冰箱中,一直延續此動作至84小時;
3)利用sdf的elisa試劑盒檢測收集的凍存的溶液中的sdf1α的含量,如圖3所示,體現了sdf1α修飾的脫鈣骨基質支架材料緩慢釋放sdf1α的情況,從圖中可以看出,sdf1α從脫鈣骨基質支架材料上的釋放是一個均勻的、緩慢的過程,一直到測試開始的84小時后,sdf1α在脫鈣骨基質支架材料上的濃度仍然維持在一個相對較高的水平上(30%以上)。
(三)sdf1α修飾的脫鈣骨基質支架材料在大鼠體內短期募集干細胞的表征
1)首先,構建一個大鼠股骨損傷的模型,如圖4a展示了,大鼠股骨滑車處手術處理形成一個3×3mm的缺損;
2)然后,將sdf1α修飾的脫鈣骨基質支架材料填充到骨損傷部位(如圖4b),移植手術三天后,用4%的戊巴比妥鈉腹腔注射麻醉大鼠處死,而后取出移植的sdf1α修飾的脫鈣骨基質支架材料。
3)將取出的sdf1α修飾的脫鈣骨基質支架材料包埋后進行冰凍切片,選取cd34和c-kit作為干細胞的標記,進行染色處理,利用dapi進行細胞核染色,所有染色處理完成后在激光共聚焦顯微鏡下觀察cd34和c-kit陽性細胞的數量。
4)設計三個實驗組:對照組、dbm材料組(脫鈣骨基質支架材料組)及sdf1α修飾的dbm支架材料組。在圖5a的共聚焦圖片中可以看出,sdf1α修飾的dbm支架材料組可以募集到更多的干細胞,而在圖5b的統計圖中也可以表明sdf1α修飾的dbm支架材料組的募集細胞數量更多,這在骨移植治療中更有利于新骨的生成。
(四)sdf1α修飾的脫鈣骨基質支架材料移植后骨損傷恢復的表征
在移植手術進行之后,依賴microct的技術,可以檢測到骨的礦化程度,新骨生成的情況以及直觀的看到松質骨愈合情況。在移植手術進行4周、8周后分別進行了microct的檢測。圖6a、6b展示了移植手術進行4周、8周后各個實驗組的骨礦化密度值的統計,其清晰地表明在相同的恢復時間內,sdf1α修飾的dbm支架材料組的骨礦化密度值更高,且相對其他有顯著性差異。
實施例2
1.cbd-sdf1α修飾的脫鈣骨基質支架材料的制備及宏觀、微觀結構的表征
首先,利用基因工程的方法構建cbd-sdf1α/nat-sdf1α的大腸桿菌表達載體,純化表達出高純度的cbd-sdf1α/nat-sdf1α。其次,是利用酸堿的方法獲得脫鈣骨基質材料(dmb支架),輻照滅菌后備用(與實施例1相同,形貌可參閱圖2a-圖2b)。無菌條件下,用20μl的pbs溶解10nm的cbd-sdf1α/nat-sdf1α,逐滴、多點地滴加到剪切好的材料上,注意此步操作時要緩慢,保證生物活性因子充分的負載到脫鈣骨基質支架材料上,如圖7a展示了cbd-sdf1α/nat-sdf1α負載到脫鈣骨基質支架材料的情況。
2.cbd-sdf1α修飾的脫鈣骨基質支架材料緩慢釋放的表征
制備含有10nm的cbd-sdf1α/nat-sdf1α的脫鈣骨基質支架材料,檢測在模擬體內條件下,這種具有生物活性因子的支架材料緩慢釋放生物活性因子cbd-sdf1α/nat-sdf1α的能力。無菌條件下,選取一個48孔板,在每個孔都放置一塊含有cbd-sdf1α/nat-sdf1α的dbm支架材料,然后每個孔都添加500μl的pbs。將48孔板放入水平轉速為150轉/分鐘的小搖床上,再整體放入到溫度恒定為37℃的恒溫培養箱中。每12小時換一次pbs,收取的液體凍存于-20℃的冰箱中,一直檢測到84小時。然后利用sdf1α的elisa試劑盒檢測收集的樣品中sdf1α的含量。圖7b展示了cbd-sdf1α/nat-sdf1α修飾的脫鈣骨基質支架材料緩慢釋放cbd-sdf1α的情況。在統計的圖中可以看到,cbd-sdf1α從脫鈣骨基質上的釋放是一個均勻的、緩慢的過程。一直到釋放實驗開始的84小時后,cbd-sdf1α在脫鈣骨基質支架材料上的濃度仍然維持在一個相對較高的水平上(30%)。而nat-sdf1α在釋放實驗12小時后快速被釋放,到36小時其濃度僅為初始值的一半左右。
3.脫鈣骨基質支架材料培養間充質干細胞的表征
檢測人臍帶間充質干細胞在脫鈣骨基質材料上的生長情況具體是將含有間充質干細胞的細胞懸液逐滴滴加到脫鈣骨基質支架材料上,置于37℃恒溫的5%co2細胞培養箱中培養。細胞培養2-3天后,將含有間充質干細胞的脫鈣骨基質材料浸沒于4%的多聚甲醛中于室溫條件下固定2小時。對固定后的樣品采用梯度濃度酒精進行脫水處理,最后置于真空干燥箱中干燥處理3小時。圖7c展示的為場發射掃描電子顯微鏡觀察下的間充質干細胞可以在脫鈣骨基質材料上的很好的粘附和生長。
4.脫鈣骨基質支架材料礦化活性的分析
本研究采用10倍濃度的模擬體液(10×sbf)作為研究脫鈣骨基質材料礦化活性的礦化液。在礦化實驗前,利用nahco3調節10×sbf的ph到6.5,然后將脫鈣骨基質材料完全浸沒在礦化液中,分別于1,2,3小時取出脫鈣骨基質材料。將礦化后的材料進行梯度濃度的酒精脫水處理,然后置于真空干燥箱內干燥處理3小時,最后利用場發射掃描電子顯微鏡觀察。如圖8a和圖8b,脫鈣骨基質材料可以很好的被礦化,礦化實驗3小時基本可以將材料完全礦化。元素分析的統計結果表明,在礦化實驗中,材料中的鈣離子濃度逐漸提高,材料表面被逐步的礦化。
5.cbd-sdf1α和nat-sdf1α活性比較
采用boyden小室的方法對cbd-sdf1α和nat-sdf1α活性進行比較。首先,在48孔板的每個孔中分別加入600μl含有500ng的cbd-sdf1α/nat-sdf1α的細胞培養基,然后把小室放入到24孔板中并向小室上部加入200μl細胞濃度為1×106個/ml間充質干細胞的懸液。然后將24孔板放入細胞培養箱中培養12小時,取出小室。將小室的內部用棉簽擦拭干凈后浸沒于4%的多聚甲醛固定1小時,最后對小室進行結晶紫染色。染色的結果可通過光學顯微鏡觀察,如圖9a所示。在相同的實驗條件下,cbd-sdf1α和nat-sdf1α組誘導遷移的細胞數量相當。隨機選取5個視野統計遷移的細胞獲得細胞遷移率如圖9b,進一步驗證了cbd-sdf1α和nat-sdf1α組誘導遷移的細胞能力相似,不存在統計學差異。
6.構建大鼠股骨損傷模型及microct分析方法
建立大鼠股骨缺損模型如圖10a-10d所示。首先采用腹腔注射戊巴比妥鈉溶液(50mg/kg)的方法對實驗大鼠進行麻醉。然后選取大鼠股骨的遠端、滑車正對下方作為手術的位點,造成一個3×3的骨缺損模型,最后移植修飾了具有膠原結合區的基質細胞衍生因子的脫鈣骨基質材料并將打開的傷口進行縫合處理。在建模一周后,采用ct活性掃描的方法檢測建模是否成功。如圖11a-圖11b所示,在大鼠股骨缺損模型造模一周后,無處理的對照組ct掃描顯示并未有新生骨的生成,骨缺損的尺寸基本沒變化。
為了全面細致的分析骨缺損的ct掃描數據,本研究采用兩體積分析的方法。如圖10b所示,將股骨樣品的表面以3mm圓面為截面向軸向縱深1.5mm為vi;同樣以3mm圓面為截面,沿股骨的軸向移動1.5mm形成v2。通過利用v1、v2可以對骨組織樣品的礦化物密度值、新生骨體積值進行統計和分析,從而獲得不同方面的骨再生的情況。
7.cbd-sdf1α修飾的脫鈣骨基質支架材料在大鼠體內短期募集干細胞的表征
采用對常見干細胞標記物cd34及c-kit染色的方法,研究cbd-sdf1α修飾的脫鈣骨基質支架材料在大鼠體內募集內源性干細胞的情況。首先,麻醉處死移植治療3天的實驗大鼠,收獲移植的生物樣品,用o.c.t.包埋后于-80℃冷凍處理1天。利用冰凍切片機將包埋好的樣品制備成6μm厚度的冰凍切片,然后浸沒于丙酮中固定30分鐘。將冰凍切片分別滴加mouse-anti-rat-anti-cd34和anti-c-kit-biotin并置于4℃過夜處理。取出切片,用pbs溶液清洗3次,然后再對切片分別在孵育rabbitanti-mouseigg-pe以及fitc-streptavidin中室溫孵育1小時。最后,采用dapi溶液對所有的切片進行細胞核染色處理。如圖10c所示,共聚焦顯微鏡獲得的熒光圖表明,各個實驗組在大鼠股骨缺損治療后具有一定數量的干細胞被募集到損傷部位,其中cbd-sdf1α組的干細胞數量更為豐富。圖10d為利用image-proplus軟件對圖10c的熒光染色圖進行統計分析進一步表明cbd-sdf1α組比nat-sdf1α組及dbm組募集更多的干細胞。
8.cbd-sdf1α修飾的脫鈣骨基質支架材料移植后骨損傷修復的表征
1)組織形態學分析cbd-sdf1α修飾的脫鈣骨基質支架材料可以促進骨的再生
采用常規組織化學染色-h&e、masson染色分析方法。首先,過量注射4%的戊巴比妥鈉溶液對移植治療4、8及12周的實驗大鼠進行安樂死,收集股骨組織樣品。用pbs溶液將骨組織樣品清洗3次,以洗凈骨樣品表面的細胞、血管等軟組織;再將骨組織樣品浸沒于15%的edta(ph7.4左右)溶液中,室溫條件下脫鈣12周(每3-4天更換一次脫鈣液且脫鈣液需現用現配)。用針刺法檢測骨組織樣品是否脫鈣完全。對于已經完全脫鈣的骨組織樣品,用雙蒸水清洗后再利用梯度酒精溶液進行脫水處理,然后用石蠟包埋并制備成石蠟切片。最后對各個實驗組的石蠟切片進行h&e、masson染色,光學顯微鏡下觀察獲得圖12a-12e。如圖12a-12b所示,移植治療4周后不同實驗組的骨缺損部位均有一定程度的愈合,其中cbd-sdf1α組的愈合效果最好且成骨細胞數量最多(箭頭所示)。在針對膠原染色的圖12c中可以觀察到,cbd-sdf1α組的新生膠原最多。通過對各組中成骨細胞及破骨細胞的統計分析(圖12d-12e)可以進一步證明cbd-sdf1α組具有更多數量的成骨細胞并且可以一定程度的抑制破骨細胞的數量。
2)cbd-sdf1α修飾的脫鈣骨基質支架材料可以促進具有骨誘導活性蛋白的表達
為了研究cbd-sdf1α修飾的脫鈣骨基質材料是否具有骨誘導活性,我們針對骨誘導蛋白:骨保護素opg、骨橋蛋白opn以及骨鈣蛋白ocn進行染色。在制備獲得骨組織石蠟切片后,將切片分別與anti-osteoprotegerin、anti-osteopontin以及anti-osteocalcin在4℃條件下孵育過夜,隔天利用pbs溶液清洗3次后再分別與二抗溶液室溫共孵育1小時后,置于光學顯微鏡下觀察。圖13a-13b展示了cbd-sdf1α組在骨缺損治療4周后表達相對多的骨保護素及骨橋蛋白,并且在骨移植治療12周后累積表達的骨鈣蛋白的量也明顯高于其他實驗組(圖13c)。
3)cbd-sdf1α修飾的脫鈣骨基質支架材料可以促進骨礦化密度值和新生骨體積的增加
利用microct進行骨組織樣品掃描檢測以及活體掃描檢測可以獲得移植治療后大鼠骨缺損處恢復的直觀圖以及缺損處骨礦化密度值和新生骨體積值。如圖14a-14b所示,在移植治療4周后,各個實驗的骨缺損部位具有一定程度的愈合,其中以cbd-sdf1α組的愈合效果最好,nat-sdf1α組和dbm組的愈合程度相似;在移植治療8周后cbd-sdf1α組的骨缺損部位基本完全愈合,而其他實驗組均還有一定程度的缺口未愈合。
為了進一步比較各個實驗組的治療效果,我們對microct獲得的數據統計分析。圖14c-14d分別展示了移植治療4周及8周的骨缺損樣品的礦化物密度值,cbd-sdf1α修飾的脫鈣骨基質極大的促進了骨缺損處的礦化物的累積,相對于其他實驗組具有明顯的優勢。圖14e-14f則表示移植治療4周后v1/v2處的新生骨體積的增長情況。cbd-sdf1α修飾的脫鈣骨基質材料均可促進v1/v2處的新生骨體積的增長,其對v2處的新生骨體積增長促進效果更為顯著。
4)cbd-sdf1α修飾的脫鈣骨基質支架材料可以促進骨組織力學性能的恢復
力學性能是評價骨組織功能恢復的重要指標,因此,采用三點彎曲對移植治療的骨缺損樣品進行力學性能的檢測。如圖15a所示,三點測試的過程是:給待測的樣品兩端各一個支點且兩點之間的距離大于2cm,在兩支點的中間正上方給予一個具有恒定速度向下且不斷增加的壓力,檢測樣品斷裂時的最大負載力。通過對移植治療4、8以及12周的骨缺損樣品進行三點彎曲測試,統計得到圖15b-15d。在移植治療4周后,各個實驗組的骨組織樣品所能承受的最大負載力差別最大,其中cbd-sdf-1α組顯著高于nat-sdf-1α組;在移植治療8周和12周后,各組間能承受的最大負載力差距縮小,cbd-sdf-1α組雖然還高于nat-sdf-1α組但卻沒有顯著性差異。
應當理解,上述具體實施方式僅為說明本發明的技術構思和結構特征,目的在于讓熟悉此項技術的相關人士能夠據以實施,但以上所述內容并不限制本發明的保護范圍,凡是依據本發明的精神實質所作的任何等效變化或修飾,均應落入本發明的保護范圍之內。
- 還沒有人留言評論。精彩留言會獲得點贊!