一種ZnPc?UCNP?PEG?G納米復合物的制備方法與流程
本發明涉及生物醫用材料技術領域,具體是一種ZnPc-UCNP-PEG-G納米復合物的制備方法。
背景技術:
光動力治療又稱作光化學治療 (Photodynamic therapy, PDT) 它是指利用特定波長的光照射事先局部或全身注入機體的藥物(光敏劑, PS),光敏劑隨之活化并與氧分子作用產生具有細胞毒性的活性氧 (ROS) ,經過直接與間接作用對腫瘤組織產生不可逆的損傷。光動力學治療不同于傳統的治療腫瘤手段,它對靶組織及損傷程度都具有可選擇性,可減少對正常組織的損傷,在人體內能較快代謝,避免對身體其它部位產生毒性,化學穩定性和光穩定性高等優點。但是傳統的光動力療法仍存在一些不足,如光敏劑對腫瘤組織的靶向性不足,同時由于光敏劑的吸收波長較短,其組織穿透能力有限,因此,對體積較大的腫瘤或深層腫瘤的治療效果不佳。現如今,納米技術的快速發展為解決光動力治療中光敏劑的腫瘤靶向性及治療深度等問題提供了新途徑。
分子靶向治療是指在細胞分子水平上通過已確定的致癌位點(即與腫瘤細胞和腫瘤組織相關的特異性分子靶點,該靶點可能是腫瘤細胞內某一蛋白質分子、某一核酸片段或者某一基因產物),設計相應配體或抗體與特異性位點相結合,從而有效的抑制基因癌變或者阻斷細胞信號傳導通路以及腫瘤血管形成,最終導致腫瘤細胞死亡而不會傷害正常細胞的一種全新的治療模式。與傳統的化療和放療治療方式相比,分子靶向治療有很高的選擇性,在對腫瘤細胞高效殺傷的同時還能保證較低損傷正常組織的理想治療結果。小分子靶向藥物吉非替尼是一種選擇性表皮生長因子受體 (EGFR) 酪氨酸激酶抑制劑,酪氨酸激酶通常表達于上皮來源的實體腫瘤之中,可通過對EGFR酪氨酸激酶活性的抑制來間接抑制腫瘤細胞的生長和血管生成,并加速腫瘤細胞的凋亡。吉非替尼(Gefitinib)在2003年被美國 FDA 批準用于治療非小細胞肺癌,是首個獲得批準上市的用于治療非小細胞肺癌 (NSCLC) 的口服型小分子靶向藥物。臨床試驗結果顯示,吉非替尼對結腸癌、前列腺癌、乳腺癌及頭頸部腫瘤等治療均證實有效。
稀土上轉換發光材料 (upconversion luminescence nanoparticles,UCNPs) 是一種能被近紅外光 (NIR) 激發而發出可見光的發光材料,即上轉換納米材料可通過多光子機制把長波轉換成短波,因此被稱之為“上轉換”。由于上轉換材料的發光過程違背了斯托克斯 (Stokes) 定律,因此又被稱為反斯托克斯 (anti-Stokes) 定律發光材料。上轉換納米材料具有穩定且獨特的發光性質,對細胞的毒性低,其激發波長處在近紅外區(通常為980 nm,位于生物組織的光透過窗口800-1200 nm范圍內),對生物組織的穿透性能力強,且不會對組織、蛋白質等造成光傷害,同時能有效的降低檢測的背景自熒光,提高熒光信噪比,因此在生物標記、多模成像、藥物運輸和光動力治療等方面有著廣闊的應用前景。
在UCNP /光敏劑納米系統引入分子靶點藥,通過制備分子靶向抗癌納米平臺系統,使腫瘤藥物治療的切入點由目前研究的細胞水平提高至分子水平。合成的UCNP/光敏劑/吉非替尼化合物中,UCNP和光敏劑的FRET作用可解決腫瘤治療深度問題,光敏劑和吉非替尼分子靶點藥的協同作用可解決靶向性不強和藥物在腫瘤細胞的滯留時間短的問題。這些優點為該設計體系成為新型分子靶向光動力載藥平臺提供了極大可能。
技術實現要素:
本發明的目的在于提供一種ZnPc-UCNP-PEG-G納米復合物的制備及其應用,解決了光動力治療中藥物靶向性不足及治療深度淺的問題。
為實現上述發明目的,本發明采用如下技術方案:
一種ZnPc-UCNP-PEG-G納米復合物的制備方法,具體步驟如下:
(1)稱取0.4 g NaOH于100 mL 反應釜中,再分別加入20 mL去離子水,30 mL乙醇,7.5 mL的油酸和4 mL的正己烷,攪拌混勻為溶液Ⅰ;稱取0.8 mmol稀土硝酸鹽溶解在5 mL去離子水中,以20滴/min滴入溶液Ⅰ得溶液Ⅱ,再稱取3.2 mmol NaF溶解在5 mL去離子水中加入到溶液Ⅱ中,置于180 ℃下反應6 h;反應結束后自然冷卻至室溫,用30 mL環己烷分三次萃取,收集環己烷層,加入過量乙醇離心收集;再用去離子水和乙醇交替洗3次,最后分散在10 mL 環己烷中待用;
(2)量取8 mL 步驟(1)的UCNPs的環己烷溶液,加入12 mL環己烷和10 mL二氯甲烷;再加入25 mg間氯過氧苯甲酸,升溫至54 ℃攪拌回流3 h,冷卻至室溫,加入1.0 g PEG-OH繼續反應8 h;反應結束后,減壓旋干,再用乙醇和去離子水交替洗3次,-60℃凍干得到UCNP-PEG-OH;
(3)稱取3 mg β -ZnPc-COOH和8 mg HOOC-PEG-COOH溶于5 mL DMSO中得到混合液Ⅰ,再稱取6 mg N,N-二環己基碳二亞胺(DCC)和4 mg 4-二甲氨基吡啶(DMAP)分別溶在200 μL的DMSO中,加入到混合液Ⅰ中攪拌1 h,再加入30 mg 步驟(2)產物,室溫下反應48 h;離心收集,用DMSO洗3次,-60℃凍干得到ZnPc-UCNP-PEG-COOH;
(4)將步驟(3)產物溶在12 mL DMSO中,加入7 mg DCC和5 mg DMAP攪拌1h,加入化合物G,室溫下反應48 h;離心收集,用DMSO洗3次,得到產物ZnPc-UCNP-PEG-G。
所述的稀土硝酸鹽為Y(NO3)·6H2O和Yb(NO3) ·5H2O和Er(NO3) ·5H2O以質量比68:30:2混合。
步驟(4)中化合物G的加入量為反應產物總量的5%~20%。
所述化合物G為8-羥基-3,6烷氧雜辛基-吉非替尼。
本發明的有益效果在于:
1)本發明將合成ZnPc-UCNP-PEG-G納米復合物,解決光動力治療中藥物靶向性不足,治療深度淺的問題。
2)合成的ZnPc-UCNP-PEG-G納米復合物粒徑均勻,熒光共振能量轉移效率高,在980nm激發下單線態氧產率高,解決了治療深度淺的問題。
3)合成的ZnPc-UCNP-PEG-G納米復合物表現出優越的光動力活性,在體外光動力治療過程對細胞的殺傷能力具有一定的劑量依賴性,隨著濃度的增加,殺傷能力增強,而在無光照條件下對細胞未表現出明顯的殺傷作用。
4) 合成的ZnPc-UCNP-PEG-G納米復合物對癌細胞具有明顯的靶向性,而在正常細胞中分布較少,降低了癌癥治療過程中的副作用。
附圖說明
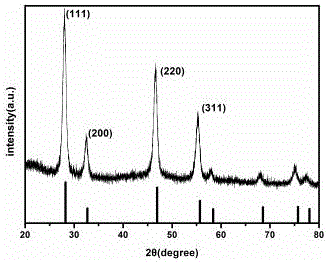
圖1是 (a)上轉換納米粒子NaYF4:Yb3+,Er3+ (UCNPs)的X射線衍射圖;
圖2是 (a)上轉換納米粒子NaYF4:Yb3+,Er3+ (UCNPs)與 (b) UCNP-PEG-OH的TEM圖;
圖3是UCNPs上轉換納米粒子和UCNP-PEG-OH的紅外光譜圖;
圖4是 NaYF4:Yb3+,Er3+ (UCNPs)上轉換發光圖;
圖5中Ⅰ和Ⅱ為UCNPs對應的熒光發射光,Ⅲ和Ⅳ為ZnPc-UCNP-PEG對應的熒光發射光;
圖6a 為DPBF, UCNPs, UCNP-PEG, β-ZnPc-COOH, ZnPc-UCNP-PEG, ZnPc-UCNP- PEG-G的Ф比較圖;圖6b為ZnPc-UCNP-PEG-G不同條件下的Ф比較圖;
圖7是HepG2細胞 (圓形) 和HELF細胞 (條形) 對ZnPc-UCNP-PEG-G競爭攝取24 h激光共聚焦成像圖;
圖8是目標物ZnPc-UCNP-PEG-G和對照物ZnPc-UCNP-PEG對HepG2細胞孵育24 h后的熒光統計數據柱狀圖;
圖9a和圖9b是ZnPc-UCNP-PEG-G在癌細胞HepG2中的攝取,指示的UCNPs和β -ZnPc-COOH的共同定位在細胞內;
圖10無光照下不同濃度ZnPc-UCNP-PEG-G和ZnPc-UCNP-PEG孵育下HepG2細胞存活率圖;
圖11是有光照下不同濃度ZnPc-UCNP-PEG-G和ZnPc-UCNP-PEG孵育下HepG2細胞存活率圖。
具體實施方式
下面以具體實施例對本發明的技術方案做進一步說明,但本發明的保護范圍不限于此:
實施例1
一種ZnPc-UCNP-PEG-G納米復合物的制備方法,具體步驟為:
1) 稱取0.4 g NaOH于100 mL 反應釜中,再分別量取20 mL去離子水,30 mL乙醇,7.5 mL的油酸和4 mL的正己烷,攪拌讓其形成均勻的溶液。稱取0.8 mmol稀土硝酸鹽 (0.2390 g Y(NO3)·6H2O,0.1065 g Yb(NO3) ·5H2O,0.0069 g Er(NO3) ·5H2O)溶解在5 mL去離子水中以20滴/min滴入到上述反應液中,再稱取0.1314 g (3.2 mmol) NaF溶解在5 mL 去離子水中加入到反應液中,取出攪拌磁子封裝置于烘箱中180 ℃下反應6 h。反應結束后自然冷卻至室溫,用30 mL 環己烷分三次萃取,收集環己烷層,加入過量乙醇離心收集。再用去離子水和乙醇交替洗3次,最后分散在10 mL 環己烷中待用。
2) 量取8 mL UCNPs的環己烷溶液,加入12 mL環己烷和10 mL二氯甲烷,再稱取25 mg 間氯過氧苯甲酸,升溫至54 ℃攪拌回流3 h后,冷卻至室溫,加入1.0 g PEG-OH繼續反應8 h。反應結束后,減壓旋干,再用乙醇和去離子水交替洗3次,-60℃凍干得到UCNP-PEG-OH。
3) 稱取3 mg β-ZnPc-COOH和8 mg HOOC-PEG-COOH溶于5 mL DMSO中,再稱取6 mg N,N-二環己基碳二亞胺(DCC) 和4 mg 4-二甲氨基吡啶(DMAP)分別溶在200 μL的DMSO中加入到上述反應液中攪拌1 h,活化羧基,加入30 mg UCNP-PEG- OH室溫下反應48 h。離心收集,用DMSO洗3次,-60℃凍干得到β -ZnPc-COOH和HOOC-PEG-COOH加載的上轉換納米粒子產物簡寫為ZnPc-UCNP-PEG-COOH。
4) 將上一步的產物ZnPc-UCNP-PEG-COOH溶在12 mL DMSO中加入7 mg DCC和5 mg DMAP攪拌一小時,活化羧基,加入8 mg化合物G,室溫下反應48 h。離心收集,用DMSO洗3次,凍干得到的產物簡寫為ZnPc-UCNP-PEG-G。
所述化合物G為8-羥基-3,6烷氧雜辛基-吉非替尼。
應用實施例1
通過ZnPc-UCNP -PEG-G納米復合物單線態氧產率的研究,研究其光的組織穿透能力,為研究治療深度提供參考,具有較重要的意義。
采用化學探針1,3 二苯基異苯并呋喃(DPBF) 對ZnPc-UCNP -PEG-G納米體系在980 nm激光照射下單線態氧的產生能力進行檢測。具體實驗操作方法為:稱取少量的DPBF用DMSO充分溶解,然后調節使其在420 nm處的吸光度值為1,同時調整ZnPc-UCNP-PEG-G的DMSO溶液在670 nm處的吸光度值也為1。取1 mL的DMSO溶劑和1 mL的ZnPc-UCNP- PEG-G溶液于比色皿中充分混合,作為參比消除系統誤差,再取DPBF和ZnPc-UCNP-PEG-G的DMSO溶液各1 mL混合均勻,測定其在420 nm處的吸光度值,此時為0 s時DPBF的吸光度值,然后用功率密度為1 W/cm2的980 nm的激光器照射比色皿中的混合溶液,每照射30 s測一下吸光度,測10個時間點。分別對DPBF,UCNPs,UCNP-PEG,β -ZnPc-COOH,ZnPc-UCNP-PEG,ZnPc-UCNP-PEG-G溶液的1O2進行測量。測試結果如圖6a和圖6b所示。在比色皿口加一層1 cm厚的組織,用670 nm和980 nm波長的激光分別來測定ZnPc-UCNP-PEG-G的Ф 單線態氧產率,并與未加組織的做比較。
由圖6a和圖6b實驗數據可以看出,加了1 cm的組織覆蓋后,用980 nm光照射的單線態氧產率僅下降了40.68 %,而用670 nm光照射的單線態氧產率下降了88.9 %。因此,與用670 nm的光直接激發β -ZnPc-COOH相比,用980 nm的光間接激發β -ZnPc-COOH具有穿透厚組織的優點,進一步凸顯了ZnPc-UCNP-PEG-G在實體或深層腫瘤治療的適用性。
應用實施例2
藥物能否有效的殺死腫瘤細胞或者對腫瘤細胞造成一定的損傷跟腫瘤細胞對藥物的攝取量有很大的關系,因此,研究細胞對藥物的攝取量很有必要
選取處于對數生長期的HepG2細胞,經過PBS洗滌后加胰酶消化處理,再加入培養基將細胞吹打均勻,離心后加入新的培養基將細胞再次吹打均勻,對細胞進行計數,用培養基將細胞稀釋至30萬cell/mL,在96孔板中每孔加入以100 μL,每個藥物設6個復孔,將細胞置于細胞培養箱中過夜生長。貼壁后棄去舊的培養基,每孔加入100 μL藥物-培養基溶液(藥物母液為64 mg/ mL,溶劑是DMSO;為了保證培養基中DMSO量≤ 1%故最終加藥濃度為640 μg/ mL),置于培養箱中孵育24 h。棄去上層培養基,用PBS洗滌三遍,以徹底除去未攝取的藥物,然后向每孔中加入120 μL濃度為1%的SDS裂解液,將其置于37 oC搖床搖晃裂解30 min,以相應藥物的激發波長的光激發,用多功能酶標儀檢測其在最大發射波長處的熒光強度。
同時,做相應藥物的標準曲線(8個濃度,2個復孔):將藥物均用SDS為溶劑從325 μg/ mL依次兩倍稀釋得到八個不同濃度,以相同條件測定各自的熒光強度,用Origin 8.5軟件處理,做熒光強度-濃度直線圖,即得各自藥物的標準曲線。由實驗組各孔的熒光強度經藥物標準曲線即可得到各孔細胞攝取藥物濃度。
利用BCA蛋白定量檢測法,計算出各孔的蛋白含量(直接計算結果需擴大6倍,即為各實驗組的值)。再以各孔的藥物濃度值除以各孔蛋白總量,其比值則為單位蛋白中所含的光敏劑的量。用Graph Pad Prism 5.0統計分析軟件對個比值做柱狀圖(圖8),結果以Mean±SEM表示,相同條件下重復三次平行實驗。
連接了聚乙二醇修飾后的靶向分子吉非替尼 (G) 得到的ZnPc-UCNP-PEG-G在HepG2細胞中的攝取量遠高于沒有連接吉非替尼的ZnPc-UCNP-PEG,說明ZnPc-UCNP-PEG-G對肝癌細胞HepG2具有很好的靶向性。
應用實施例3
細胞毒性測試主要是研究光動力治療中光的安全性,以及藥物對細胞的毒性作用。
取生長狀態良好的處在對數期的HepG2細胞,經過洗滌、消化處理后,對細胞進行計數,將計數好的細胞稀釋至濃度為10萬cell/mL,然后于96孔板中每孔接種100 μL,將細胞培養箱中過夜培養。將ZnPc-UCNP-PEG-G和ZnPc-UCNP -PEG用DMSO溶液配制7個濃度梯度的母液,再用培養基將各個濃度稀釋100倍。經PBS洗滌3遍后,取100 μL稀釋后的藥物溶液加入至96孔板中的每個孔中,實驗組設6個復孔。設置空白對照組和細胞對照組和實驗組,加藥完畢后置于放入細胞培養箱中孵育24 h。
暗毒實驗:將之前加藥處理過的細胞孵育24 h后,棄去之前舊的培養基,用PBS洗3遍,再向每孔中加入100 μL培養基,置于培養箱中孵育24 h。
光毒實驗:孵育24 h后,棄去之前舊的培養基,用PBS洗3遍,再向每孔中加入100 μL新培養基,用980 nm LED燈照射20 min (功率密度為1.0 W/cm2)后,再將96孔板置于37 °C 恒溫以及 5% CO2培養基中繼續孵育24 h。
OD值檢測:將上述孵育完的細胞每孔加入10 μL已配好的MTT溶液(5 mg/mL),置于培養箱中孵育4 h,棄去孔板中原來的液體,再在每孔加入100 μL DMSO,置于搖床中震蕩半小時左右,待甲瓚完全溶解后,測定96孔板中每孔在570 nm處的OD值。將所得結果用 Graph Pad Prism 5.0 處理,結果以 Mean±SEM 表示。
實驗結果表明ZnPc-UCNP-PEG-G納米復合物對肝癌細胞HepG2具有明顯的殺傷作用,并且殺傷能力具有一定的劑量依賴性,隨著濃度的增加,殺傷能力增強,圖10在無光照條件下ZnPc-UCNP-PEG對HepG2細胞無明顯殺傷作用,而ZnPc-UCNP-PEG-G在一定的濃度范圍內對HepG2細胞仍具有一定的殺傷作用,這說明吉非替尼的引入在提高了藥物靶向性的同時還實現了吉非替尼的化療作用,實現了靶向PDT和化療的雙重療效。
以上所述僅為本發明的較佳實施例,凡依本發明申請專利范圍所做的均等變化與修飾,皆應屬本發明的涵蓋范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!