一種瑞普拉生無水合物晶型及其制備方法和用途與流程
本發明屬于藥物化學技術領域,具體涉及一種瑞普拉生無水合物晶型及其制備方法和用途。
背景技術:
瑞普拉生(即鹽酸洛氟普啶)的化學通用名為5,6-二甲基-2-(4-氟苯胺基)-4-(1-甲基-1,2,3,4-四氫異喹啉)嘧啶鹽酸鹽。洛氟普啶為酸泵拮抗劑(也可稱為可逆性質子泵抑制劑、鉀競爭性酸阻滯劑、p-cabs)。與傳統的ppi不同,p-cabs是通過競爭性抑制質子泵(即h+、k+-atp酶)中的k+而起作用,是一種可逆的k+拮抗劑,p-cabs具有親脂性、弱堿性、解離常數高和在低ph值時穩定的特點。由于p-cabs的抑酸效果與質子泵活化情況無關,在臨床上可明顯減少夜間酸突破的發生。在酸性環境下,p-cabs立刻離子化,離子化形式通過離子型結合抑制h+、k+-atp酶,不需要集中于胃壁細胞的微囊、微管以及不需要激活酸即能迅速升高胃內ph值,離解后酶活性恢復。人和動物口服p-cabs后能吸收迅速,達到血漿濃度的峰值。臨床和動物試驗表明,p-cabs比ppi或h2受體阻滯劑起效更快,升高ph的作用更強。而瑞普拉生對h+、k+-atp酶的選擇性比na+、k+-atp酶高100倍以上,表明在治療劑量時p-cabs對其它酶的影響很小,對機體生理功能影響小。
專利wo2014060908公開了一種瑞普拉生無水合物的晶型及其制備方法,將瑞普拉生直接采用有機醇溶劑重結晶獲得,其x粉末衍射圖譜具有7.4±0.2°,10.3±0.2°,12.3±0.2°,13.3±0.2°,16.3±0.2°,17.0±0.2°,17.7±0.2°,19.7±0.2°,20.8±0.2°,22.2±0.2°,23.4±0.2°,24.3±0.2°,25.7±0.2°,26.1±0.2°,27.1±0.2°的2θ角的衍射峰。該瑞普拉生無水合物晶型的制備方法在有機溶劑中進行,需要濃縮有機溶劑才能析晶,操作相對繁瑣;特別是析出的顆粒過快,物料粘性強,易粘附于反應設備和攪拌槳,造成該瑞普拉生晶型藥物在單劑量制劑中的含量難以控制,不利于工業化放大生產。
瑞普拉生在水及0.1mol/l鹽酸溶液中幾乎不溶,屬于難溶性藥物,導致其在胃腸道中的溶出很低。對于固體口服制劑,瑞普拉生的晶型至關重要,為獲得可工業化生產的穩定的晶型才能有效保證藥品的質量,為廣大群眾的安全用藥提供保障。
技術實現要素:
本發明所要解決的技術問題是提供一種穩定性較強、高純度結晶態的瑞普拉生無水合物及其制備方法和用途,本發明所述制備工藝流程簡捷,成本低,收率高,適合于工業化生產;制備得到的普拉生無水合物析出顆粒粒徑適宜,物料粘性弱,不易粘附于反應設備和攪拌槳,同時該無水合物晶型穩定,便于貯存和運輸,利于工業化放大生產。
本申請發明人對瑞普拉生的制備和析晶工藝進行了大量研究,令人驚奇地發現,用于實現上述目的的技術方案如下:
本發明提供一種瑞普拉生無水合物(化學通用名:5,6-二甲基-2-(4-氟苯胺基)-4-(1-甲基-1,2,3,4-四氫異喹啉)嘧啶鹽酸鹽;結構如下式(i)所示)的晶型,
使用cu-ka輻射,所述晶型的x-射線粉末衍射在衍射角2θ為7.3±0.2°,10.3±0.2°,12.2±0.2°,13.3±0.2°,16.3±0.2°,16.9±0.2°,17.6±0.2°,19.3±0.2°,20.7±0.2°,22.2±0.2°,22.5±0.2°,23.4±0.2°,24.3±0.2°,25.6±0.2°,26.9±0.2°,27.0±0.2°處有衍射峰;并且所述晶型具有d50=5-20μm的粒徑;
所述制備方法包括以下步驟:
(1)將瑞普拉生和極性溶劑混合,升溫至溶解,趁熱過濾,得到濾液;
(2)將反溶劑加入步驟(1)所述濾液中,冷卻,析晶,過濾,干燥。
本發明所述制備方法得到的晶型的x-射線粉末衍射圖如圖1所示;
所述晶型含水量為0-1.0%,優選0-0.5%。
所述步驟(1)中所述極性溶劑選自丙酮、甲醇或乙醇中的一種或多種;
優選地,所述步驟(1)中所述升溫至溶解為升溫至50-82℃以使瑞普拉生溶解,優選升溫至所述極性溶劑的回流溫度;
優選地,按體積重量比計,所述步驟(1)中所述極性溶劑與所述瑞普拉生的比例為5-50ml:1g,優選6-18ml:1g。
所述步驟(2)中所述反溶劑為乙酸乙酯和/或乙二醇;
優選地,按體積重量比計,所述步驟(2)中所述反溶劑與所述瑞普拉生的比例為5-20ml:1g,優選10ml:1g;
優選地,所述步驟(2)中所述冷卻為冷卻至30-40℃;
優選地,所述步驟(2)中所述析晶的方式為添加晶種誘導析晶或玻璃微屑誘導析晶;
優選地,所述步驟(2)中所述析晶的方式為添加晶種誘導析晶,所述添加的晶種為所述瑞普拉生無水合物;
優選地,所述步驟(2)中在30-40℃下添加晶種;
當添加晶種誘導析晶時,溫度對析晶得到的晶型有著重要影響,冷卻至高于40℃加入晶種無法析晶;冷卻至低于30℃時加入晶種,析晶得到的是瑞普拉生混晶。因此,宜在30-40℃下加入晶種。
優選地,所述步驟(2)中所述添加的晶種與所述瑞普拉生的重量比為1-5:100,優選3:100;
優選地,所述步驟(2)中添加晶種后繼續降溫至5-20℃養晶0.5-5h、優選3h;
優選地,所述步驟(2)中所述析晶的方式為玻璃微屑誘導析晶,采用玻璃棒攪拌1-10min至析晶,后繼續降溫至5-20℃養晶0.5-5h、優選3h;
優選地,所述步驟(2)中所述干燥在40-65℃、優選50℃下干燥至恒重。
所述制備方法包括以下步驟:
(1)將瑞普拉生和極性溶劑混合,升溫至50-82℃、優選極性溶劑的回流溫度以使瑞普拉生溶解,趁熱過濾,得到濾液;
(2)將乙酸乙酯和/或乙二醇加入步驟(1)所述濾液中并冷卻至30-40℃,玻璃微屑誘導析晶或加入晶種誘導析晶,冷卻至5-20℃養晶0.5-5h,過濾,40-65℃、優選50℃下干燥至恒重。
本發明還提供一種藥物組合物,其包含治療和/或預防有效量的本發明所述制備方法得到的晶型以及至少一種藥學上可接受的載體或賦形劑。
本發明所述制備方法得到的晶型在制備治療和/或預防與胃酸分泌紊亂有關的疾病的藥物中的用途;優選地,所述疾病包括十二指腸潰瘍、糜爛性食道炎、急性胃炎、慢性胃炎、胃粘膜病變、胃潰瘍或胃食管反流性疾病。
與現有技術相比,本發明的有益效果是:
本發明通過使用本發明所述的極性有機溶劑和反溶劑實現了所述瑞普拉生無水合物的制備并同時避免了濃縮有機溶劑的步驟,因此本發明所述瑞普拉生無水合物的制備方法更簡捷,成本低,收率高,其晶型穩定,便于貯存和運輸;進一步地,本發明制備得到的普拉生無水合物析出顆粒粒徑適宜,物料粘性弱,不易粘附于反應設備和攪拌槳,因此在口服藥物制劑制備過程中,特別是在制粒以及壓片或充填膠囊過程中,本發明所述瑞普拉生無水合物的附著性和聚結性得到極大改善,物理性質穩定,使得單劑量制劑中所含瑞普拉生的差異小,易于成型。
附圖說明
圖1為本發明瑞普拉生無水合物晶型的x射線粉末衍射圖譜;
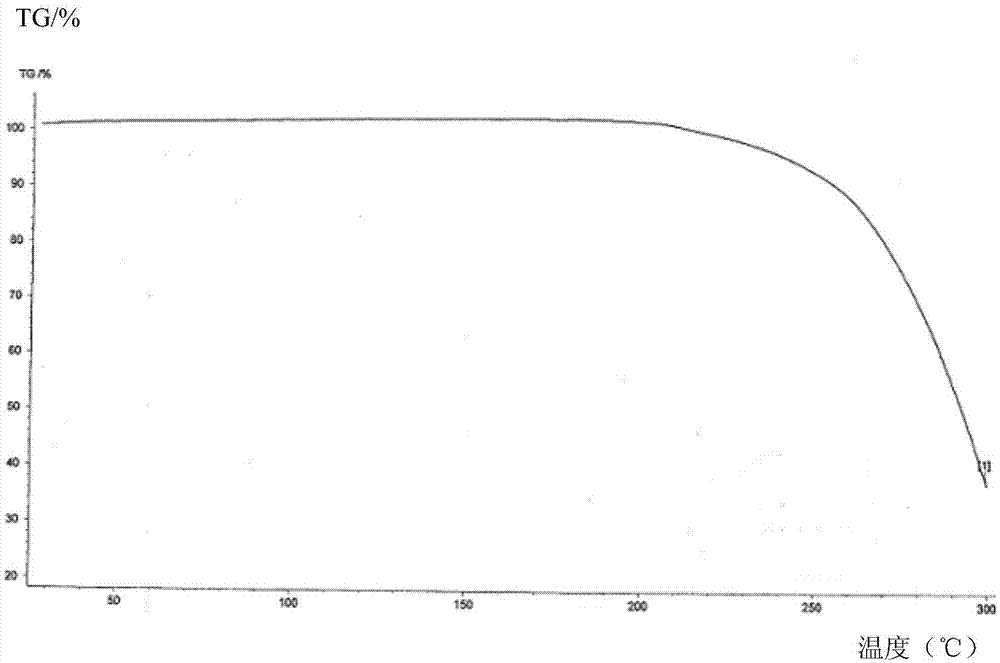
圖2為本發明瑞普拉生無水合物晶型的tg圖譜;
圖3為本發明瑞普拉生無水合物晶型的dsc圖譜。
具體實施方式
下面結合具體實施方式對本發明進行進一步的詳細描述,給出的實施例僅為了闡明本發明,而不是為了限制本發明的范圍。
下述實施例中的實驗方法,如無特殊說明,均為常規方法。下述實施例中所用的藥材原料、試劑材料等,如無特殊說明,均為市售購買產品。
實施例1:本發明所述瑞普拉生無水合物晶體的制備
向1l三口圓底燒瓶中加入24.0g瑞普拉生,后加入168ml甲醇,在65℃下回流加熱,瑞普拉生溶解后趁熱過濾,在所述濾液中加入240ml乙酸乙酯,降溫至36℃,使用玻璃棒摩擦誘導析晶,攪拌0.5h,繼續冷卻至10℃養晶3h,過濾,50℃下干燥至恒重(約48h),得到白色固體22.4g。經檢測,收率93.3%,水分0.7%。
采用smartlab系列x射線衍射儀使用cu-ka輻射測得本發明無水合物x射線粉末衍射圖,圖譜中的峰情況見下表1。
表1:本發明所述瑞普拉生無水合物x射線衍射圖譜峰值
實施例2:本發明所述瑞普拉生無水合物晶體的制備
向1l三口圓底燒瓶中加入24.0g瑞普拉生,后加入400ml乙醇,在78℃下回流加熱,瑞普拉生溶解后趁熱過濾,在所述濾液中加入240ml乙二醇,降溫至34℃,加入0.5g實施例1制備的瑞普拉生無水合物,繼續冷卻至20℃左右后攪拌養晶3h,過濾,50℃下干燥至恒重(約60h),得到白色固體22.4g。經檢測,收率93.3%,水分0.7%。
實施例3:本發明所述瑞普拉生無水合物晶體的制備
向1l三口圓底燒瓶中加入24.0g瑞普拉生,后加入380ml丙酮,在56℃下回流加熱,瑞普拉生溶解后趁熱過濾,在所述濾液中加入240ml乙酸乙酯,降溫至37℃,加入1.0g實施例2制備的瑞普拉生無水合物,繼續冷卻至5℃左右后攪拌養晶3h,過濾,50。℃下干燥至恒重(約48h),得到白色固體22.8g。經檢測,收率95.0%,水分0.5%。
實施例4:本發明所述瑞普拉生無水合物結晶水分析
分別將實施例1-3得到的瑞普拉生無水合物進行結晶水分析,上述晶體的dsc圖譜表明其在100℃左右范圍內無吸熱峰且其tg圖譜在0-100℃無明顯的失重平臺,表明上述晶體不含結晶水;上述晶體的dsc圖譜表明其在200-240℃范圍內有強的吸熱峰且其tg圖譜在200℃開始失重,表明上述晶體在200℃開始溶解,其熔點在220℃左右。采用德國netzschdsc204差示掃描量熱儀測定本發明瑞普拉生無水合物的熱分析tg圖譜和dsc圖譜分別見圖2和圖3。
對比例1:瑞普拉生無水合物晶體的制備
向1l三口圓底燒瓶中加入24.0g瑞普拉生,后加入168ml甲醇,在60~65℃下回流加熱,瑞普拉生溶解后,趁熱過濾,濾液于60-65℃蒸餾出極性溶劑甲醇124ml,降溫至0-5℃養晶3h,抽濾,50℃下干燥至恒重(約20h),得到白色固體19.1g,收率79.6%,水分0.6%。
將本申請實施例1-3制備的無水合物與對比例1的無水合物進行如下比較,由于對比例中含有極微小粒徑的瑞普拉生無水合物使得其極易吸附在器具上,所獲得的無水合物粘性大,因此本申請實施例1-3所制備的無水合物相對于對比例1的無水合物具有更適宜的粒徑,其粒徑較對比實施例的小且更均勻,且物料粘性弱,更有利于難溶性口服固體制劑的溶出,更適合用于瑞普拉生片的制備,檢測結果見表2;
表2:不同制備方法對無水合物晶型的影響
實施例5:極性溶劑和反溶劑種類的選擇
發明人采用不同的極性溶劑和反溶劑進行瑞普拉生無水合物的制備,結果如表3所示;瑞普拉生在極性溶劑甲醇、乙醇、丙酮中的溶解性較大,而在反溶劑乙酸乙酯、醋酸丁酯、乙二醇、叔丁醇的溶解性較小;
表3:不同極性溶劑和反溶劑對瑞普拉生無水合物的影響
從表3可知,采用甲醇、乙醇、丙酮作為極性溶劑,乙二醇、乙酸乙酯作為反溶劑,可制備出粒徑適宜、粘度較小的無水合物晶型;
相比之下,而采用甲醇、乙醇、丙酮作為極性溶劑,醋酸丁酯作為反溶劑,則制備出的無水合物晶型粒徑過大而粘度較小,此大于20μm粒徑的瑞普拉生無水合物不利于難溶性口服固體制劑的溶出;采用甲醇、乙醇、丙酮作為極性溶劑,叔丁醇作為反溶劑,則制備出的無水合物晶型粒徑較小、粘度較大且為混晶;粒徑≤5μm的瑞普拉生無水合物會使物料的粘性大。
以上對本發明具體實施方式的描述并不限制本發明,本領域技術人員可以根據本發明作出各種改變或變形,只要不脫離本發明的精神,均應屬于本發明所附權利要求的范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!