一種EB病毒特異性TCR及其重組慢病毒載體與應用的制作方法
本發明涉及抗腫瘤免疫技術領域,尤其是一種EB病毒特異性TCR及其重組慢病毒載體與應用。
背景技術:
EB病毒(epstein-barr virus,EBv),是Epstein和Barr于1964年首次成功地將Burkitt非洲兒童淋巴瘤細胞通過體外懸浮培養而建株,并在建株細胞涂片中用電鏡觀察到皰疹病毒顆粒,認為該病毒是多種惡性腫瘤(如鼻咽癌)的病因之一,它主要感染人類口咽部的上皮細胞和B淋巴細胞。在中國南方鼻咽癌患病人群中大多都檢測到有EB病毒基因組存在。
鼻咽癌(nasopharyngeal carcinoma,NPC)是中國南部常見的惡性腫瘤之一。流行病學調查顯示,鼻咽癌可見于世界的許多國家和地區,但是大部分地區發病率較低,一般在1/10萬以下。我過南部(廣東、廣西、福建、香港、湖南和江西)是世界鼻咽癌的高發區,其發病率高達50/10萬,其中以廣東省為最高。世界衛生組織(WTO)于1991年提出將鼻咽癌分為:角化性鱗狀細胞癌、非角化性癌和未分化癌,其中非角化性癌在鼻咽癌高發區常見。
EB病毒與非角化性鼻咽癌密切相關。表現在:鼻咽癌患者活檢組織中可發現EB病毒DNA基因產物表達,特別是在非角質化癌中EB病毒檢出率幾乎為100%,應用原位雜交或多聚酶鏈反應(PCR),鼻咽癌患者的血清/血漿中科院定量檢測到游離的EBV DNA,EB病毒的DNA水平可預測鼻咽癌預后和生存率;在鼻咽癌血清/血漿中可檢測到較高滴度的EBV特異性抗體,尤其是EBV早期抗原(EA)和病毒衣殼抗原(VCA)的IgA抗體的陽性率很高。EB病毒相關的腫瘤感染都處于潛伏期,EB病毒的潛伏感染分為3種類型:I型感染表達EBNA1和EBERs,相關的惡性腫瘤是Burkitt’s淋巴瘤;II型感染表達EBNA1、LMP1、LMP2及Bam HI片段的轉錄產物,見于非角化性NPC和何杰氏病(HD);III型感染表達所有潛伏期基因,包括6種核抗原(EBNA1、EBNA2、EBNA3A、EBNA3B、EBNA3C、EBNA-LP),2種潛伏膜蛋白(LMP1、LMP2)和2種小核糖核酸(EBER1、EBER2),見于傳染性單核細胞增多癥(IM)、PTLD及部分艾滋病(AIDS)相關淋巴瘤等。鼻咽癌中病毒以潛伏II型方式存在,表達EBNA1、LMP1、LMP2及Bam HI片段的轉錄產物等病毒產物。EBNA1在維持病毒感染中具有重要作用,是唯一在EB病毒陽性細胞中始終表達的抗原。EBNA1內部存在甘氨酸-丙氨酸重復區域,其抑制蛋白酶體復合物對抗原的加工和MHC-I類分子限制的抗原遞呈作用,從而逃避殺傷性T細胞介導的細胞免疫。LMP1是明確的癌基因,有促進細胞轉化及惡變的作用,參與了EB病毒致癌過程。LMP2基因編碼兩種蛋白:LMP2A和LMP2B,兩者僅N端第一個外顯子不同。BamHI的一段區域的這種轉錄在所有EB病毒陽性的腫瘤中都存在,特別是NPC中。這段轉錄產物編碼至少三個多肽(BARF0,RPMS1和A73),但是這些當愛是否真的存在還沒有得到最終確證。
鼻咽癌患者針對EBNA、VCA、EA、MA及DNase均產生相應的IgG和IgA抗體,體液免疫能阻止外源性病毒感染,卻不能消滅病毒的潛伏感染,研究這些抗體,對早期篩查和診斷鼻咽癌及監測療效具有重要意義。應用多聚酶鏈反應(PCR),并且結核VCA-IgA還可以提高診斷鼻咽癌的靈敏度。
鼻咽癌患者機體可以產生針對EB病毒的特異性CTL細胞應答,CTL在清楚病毒、控制潛伏感染狀態的細胞、防止腫瘤發生中具有重要作用。EB病毒潛伏感染時免疫優勢表位位于EBNA3家族,鼻咽癌中EBV處于II潛伏感染,主要表達弱免疫原性的EBNA1、LMP1、LMP2蛋白,而不表達EBNA3家族蛋白。EBNA1由于大量甘氨酸-丙氨酸重復序列,阻止HLA-I類分子對其加工、處理和遞呈。LMP1是癌基因,具有獨立轉化細胞的能力,而且在鼻咽癌病人中易發生突變,使轉化細胞的能力增強,并逃避體內CTL的識別。故EBNA1和LMP1不合適作為鼻咽癌免疫治療的靶抗原。LMP2A本身不是轉化基因,無致癌性,在鼻咽癌腫瘤細胞能穩定表達,LMP2A的大量HLA限制的T細胞表位已被鑒定出,且能誘導CTL發揮作用。因此,目前認為LMP2A是鼻咽癌免疫治療最理想的靶抗原。
鼻咽癌的傳統治療方式是手術結合放療及化療,這兩種治療手段特別是放療對鼻咽癌早期患者敏感,但中晚期鼻咽癌患者對放療及化療均不敏感,治療后復發率高。因此以EBV為靶點的細胞免疫治療為鼻咽癌的綜合治療提供了有力的手段。鼻咽癌(NPC)具備免疫治療的基本要素。第一,鼻咽癌細胞幾乎100%地感染EB病毒。其次,NPC細胞表面有正常表達HLAI類分子以及CD54、CD70等表面標識分子,并且可以通過HLAI累途徑將內源性的抗原呈遞給CTL識別。第三,盡管EBV誘導多種細胞因子表達,鼻咽癌微環境對CTL活性無明顯抑制作用。這些特點提示鼻咽癌是一種適合于免疫治療的腫瘤。2002年,香港林成龍用已知CTL識別的LMP2多肽(SSC、TYG、IED)負載自體的DC回輸治療晚期鼻咽癌患者,結果顯示,16例患者中有9例患者產生持續3個月的抗原表位特異性CTL反應,其中2例有腫瘤的減小。2004年P.Comoli報道用部分HLA匹配的健康攜帶者的EBV特異性CTL的過繼性免疫治療鼻咽癌。2005年straathof和P.Comoli分別報道了應用自體EBV特異性細胞毒性T淋巴細胞(CTL)對一些晚期鼻咽癌患者進行過繼性免疫治療。
腫瘤特異性T淋巴細胞(CTL)即細胞毒性T淋巴細胞,是從抗原呈遞細胞接受了抗原信息,并經過克隆擴增的可特異性識別和殺傷抗原特異性靶細胞的效應T淋巴細胞,CTL是機體清除癌變細胞的主要機制,在抗腫瘤免疫過程中發揮著主要作用。CTL不僅能通過顆粒酶和穿孔素等物質直接殺死腫瘤細胞,還可以通過分泌一些細胞因子和IFN-γ和TNFα等間接地殺傷腫瘤細胞。隨著生物醫學,基因工程技術的發展,腫瘤特異性T淋巴細胞治療近年來日益受到重視,顯示出良好的應用前景,多種特異性CTL誘導培養方案應運而生。早在2000年日本用過繼性T淋巴細胞移植治療肝癌獲得了很好的療效,復發率降低,生存率提高,研究發表在醫學權威雜志《柳葉刀》上;2004年,Rosenburg教授研究的腫瘤浸潤淋巴細胞(TIL,特異性CTL的一類)在治療轉移性黑色素瘤上獲得了良好的結果。腫瘤特異性CTL治療腫瘤疾病具有安全,靶向,高效的特點。這主要是由T淋巴細胞表面特異性識別腫瘤抗原的T細胞受體(T Cell Receptor,TCR)決定的。然而機體內針對各種抗原的TCR千差萬別,2014年《科學》雜志發表Rosenberg教授的文章,利用TCR免疫組庫深度測序技術從轉移性膽管上皮細胞癌患者的腫瘤浸潤T淋巴細胞群中,篩選并得到了腫瘤抗原特異性的TCR序列,根據序列合成了TCR的DNA,并通過基因工程技術轉導在患者自體T細胞表面,獲得了良好的治療效果。
T細胞受體(TCR)是細胞表面受體,參與T細胞的活化以響應抗原的呈現。一般來說,TCR由α和β兩條鏈(其裝配以形成異源二聚體)注冊,并且與CD3轉導亞基相連以在細胞表面上呈現形成T-細胞受體復合物。TCR的每條α和β鏈由免疫球蛋白樣N-端可變(V)和恒定(C)區、疏水跨膜結構域和短的細胞質區域組成。關于免疫球蛋白分子,α和β鏈的可變區由V(D)J重組產生,在T細胞群中產生抗原特異性的大量多樣性。然而,同識別完整抗原的免疫球蛋白相比,T細胞被與MHC分子相關的經處理肽片段活化,通過T細胞將另外的特征引入至抗原識別,被稱為MHC限制性。
技術實現要素:
本發明要解決的技術問題是:為了解決上述背景技術中存在的問題,提供一種改進的EB病毒特異性TCR及其重組慢病毒載體,利用慢病毒載體將其轉染到T細胞中,獲得表達針對EB病毒特異TCR的T細胞。
本發明解決其技術問題所采用的技術方案是:一種EB病毒特異性TCR,包括α鏈和β鏈,所述的α鏈的序列如下:
atgtaggacgcccctccggtcacggcatttctgatagtgcatcgacgtgactcacccgccgacacaggaagagggtggagaaccgtctcgggttccaatggctttttcctagtgttttgagggaaagaaacaatctatatatatactcttctaggcgggcgcccccttcccctcaaactcttttttttcctcctctgccaagctttgtttgttgagaaaaaacaaaaaattcgctcctggtaactctctttccgcctccaggggagtccccaacccggaaaaaacccccccccccccccccccaagtttttttaatctaggtaggcccgcggttggaaaactccccccccccccccccctgaagcctcacacagcccagtaactttgctagtacctcttgagtgcaaggtggagaattaagatctggatttgagacggagcacggaacatttcactcaggggaagagctatgaacatgctgactgccagcctgttgagggcagtcatagcctccatctgtgttgtatccagcatggctcagaaggtaactcaagcgcagactgaaatttctgtggtggagaaggaggatgtgaccttggactgtgtgtatgaaacccgtgatactacttattacttattctggtacaagcaaccaccaagtggagaattggttttccttattcgtcggaactcttttgatgagcaaaatgaaataagtggtcggtattcttggaacttccagaaggatcgctgaagacagaaagtccagtaccttgatcctgcaccgtgctaccttgagagatgctgctgtgtactactgttcagccggtggtgctacaaacaagctcatctttggaactggcactctgcttgctgtccagccaaatatccagaaccctgaccctgccgtgtaccagctgagagactctaaatccagtgacaagtctgtctgcctattcaccgattttgattctcaaacaaatgtgtcacaaagtaaggattctgatgtgtatatcacagacaaaactgtgctagacatgaggtctatggacttcaagagcaacagtgctgtggcctggagcaacaaatctgactttgcatgtgcaaacgccttcaacaacagcattattccagaagacaccttcttccccagcccagaaagttcctgtgatgtcaagctggtcgagaaaagctttgaaacagatacgaacctaaactttcaaaacctgtcagtgattgggttccgaatcctcctcctgaaagtggccgggtttaatctgctcatgacgctgcggctgtggtccagc,所述的β鏈的序列如下:
ccatcctgccctgaccctgccatgggcaccaggctcctcttctgggtggccttctgtctcctgggggcagatcacacaggagctggagtctcccagtcccccagtaacaaggtcacagagaagggaaaggatgtagagctcaggtgtgatccaatttcaggtcatactgccctttactggtaccgacagagcctggggcagggcctggagtttttaatttacttccaaggcaacagtgcaccagacaaatcagggctgcccagtgatcgcttctctgcagagaggactgggggatccgtctccactctgaccctacacgccctgcagcCAGAAGACTCAGCCCTGTATCTCTGCGCCAGCAGCCAAGACTGGACACCTAATGAGCAGTTCTTCGGGCCAGGGACACGGCTCACCGTGCTAGAGGACCtgaaaaacgtgttcccacccgaggtcgctgtgtttgagccatcagaagcagagatctcccacacccaaaaggccacactggtatgcctggccacaggcttctaccccgaccacgtggagctgagctggtgggtgaatgggaaggaggtgcacagtggggtcagcacagacccgcagcccctcaaggagcagcccgccctcaatgactccagatactgcctgagcagccgcctgagggtctcggccaccttctggcagaacccccgcaaccacttccgctgtcaagtccagttctacgggctctcggagaatgacgagtggacccaggatagggccaaacctgtcacccagatcgtcagcgccgaggcctggggtagagcagactgtggcttcacctccgagtcttaccagcaaggggtcctgtctgccaccatcctctatgagatcttgctagggaaggccaccttgtatgccgtgctggtcagtgccctcgtgcatggccatggtcaagagaaaggattccagaggctagctccaaaaccatcccaggtcattcttcatcctcacccaggattctcctgtacctgctcccaatctgtgttcctaaaagtgattctcactctgcttcatctcctacttacatgaatacttctctcttttttctgtttccctgaagattgagctcccaacccccaagtacgaaataggctaaaccaataaaaaaatggtgtgtt。
一種EB病毒特異性TCR重組慢病毒載體的應用,分別釆取HLA-A2陽性和陰性的健康人的PBMC,以lxl06/ml的密度接種到24孔板,加入600lU/mlIL-2、50ng/mlanti-CD3(OKT-3)的含10%人AB血清AIM-V培養基培養2~3d。Jurkat細胞按Ixl06細胞/ml混于上述慢病毒上清液放于24孔板中,在32℃以l000g速度離心90min,4h后,用新鮮培養液重懸細胞,37℃孵育過夜。兩種細胞的感染復數(multiplicity of infection,MOI)均為0,15~0.5,重復感染2次,孵育48~72h后用上流式機檢測。
本發明的有益效果是,本發明的一種EB病毒特異性TCR及其重組慢病毒載體與應用篩選出EB病毒抗原特異的TCR,利用慢病毒載體將其轉染到T細胞中,獲得表達針對EB病毒特異TCR的T細胞。
附圖說明
下面結合附圖和實施例對本發明進一步說明。
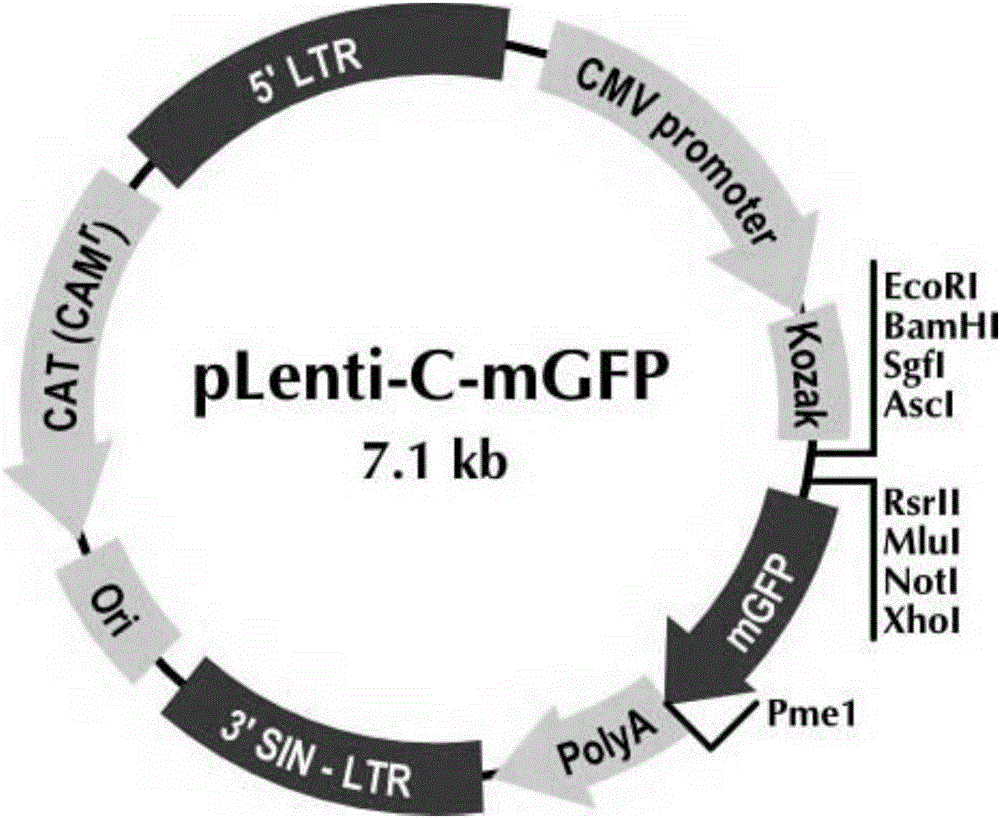
圖1是本發明中pLenti-C-mGFP空載體的示意圖。
圖2是本發明中TCRα和β鏈重組載體示意圖。
具體實施方式
現在結合附圖對本發明作進一步詳細的說明。這些附圖均為簡化的示意圖,僅以示意方式說明本發明的基本結構,因此其僅顯示與本發明有關的構成。
圖1和圖2所示的一種EB病毒特異性TCR,包括α鏈和β鏈,所述的α鏈的序列如下:
atgtaggacgcccctccggtcacggcatttctgatagtgcatcgacgtgactcacccgccgacacaggaagagggtggagaaccgtctcgggttccaatggctttttcctagtgttttgagggaaagaaacaatctatatatatactcttctaggcgggcgcccccttcccctcaaactcttttttttcctcctctgccaagctttgtttgttgagaaaaaacaaaaaattcgctcctggtaactctctttccgcctccaggggagtccccaacccggaaaaaacccccccccccccccccccaagtttttttaatctaggtaggcccgcggttggaaaactccccccccccccccccctgaagcctcacacagcccagtaactttgctagtacctcttgagtgcaaggtggagaattaagatctggatttgagacggagcacggaacatttcactcaggggaagagctatgaacatgctgactgccagcctgttgagggcagtcatagcctccatctgtgttgtatccagcatggctcagaaggtaactcaagcgcagactgaaatttctgtggtggagaaggaggatgtgaccttggactgtgtgtatgaaacccgtgatactacttattacttattctggtacaagcaaccaccaagtggagaattggttttccttattcgtcggaactcttttgatgagcaaaatgaaataagtggtcggtattcttggaacttccagaaggatcgctgaagacagaaagtccagtaccttgatcctgcaccgtgctaccttgagagatgctgctgtgtactactgttcagccggtggtgctacaaacaagctcatctttggaactggcactctgcttgctgtccagccaaatatccagaaccctgaccctgccgtgtaccagctgagagactctaaatccagtgacaagtctgtctgcctattcaccgattttgattctcaaacaaatgtgtcacaaagtaaggattctgatgtgtatatcacagacaaaactgtgctagacatgaggtctatggacttcaagagcaacagtgctgtggcctggagcaacaaatctgactttgcatgtgcaaacgccttcaacaacagcattattccagaagacaccttcttccccagcccagaaagttcctgtgatgtcaagctggtcgagaaaagctttgaaacagatacgaacctaaactttcaaaacctgtcagtgattgggttccgaatcctcctcctgaaagtggccgggtttaatctgctcatgacgctgcggctgtggtccagc,所述的β鏈的序列如下:
ccatcctgccctgaccctgccatgggcaccaggctcctcttctgggtggccttctgtctcctgggggcagatcacacaggagctggagtctcccagtcccccagtaacaaggtcacagagaagggaaaggatgtagagctcaggtgtgatccaatttcaggtcatactgccctttactggtaccgacagagcctggggcagggcctggagtttttaatttacttccaaggcaacagtgcaccagacaaatcagggctgcccagtgatcgcttctctgcagagaggactgggggatccgtctccactctgaccctacacgccctgcagcCAGAAGACTCAGCCCTGTATCTCTGCGCCAGCAGCCAAGACTGGACACCTAATGAGCAGTTCTTCGGGCCAGGGACACGGCTCACCGTGCTAGAGGACCtgaaaaacgtgttcccacccgaggtcgctgtgtttgagccatcagaagcagagatctcccacacccaaaaggccacactggtatgcctggccacaggcttctaccccgaccacgtggagctgagctggtgggtgaatgggaaggaggtgcacagtggggtcagcacagacccgcagcccctcaaggagcagcccgccctcaatgactccagatactgcctgagcagccgcctgagggtctcggccaccttctggcagaacccccgcaaccacttccgctgtcaagtccagttctacgggctctcggagaatgacgagtggacccaggatagggccaaacctgtcacccagatcgtcagcgccgaggcctggggtagagcagactgtggcttcacctccgagtcttaccagcaaggggtcctgtctgccaccatcctctatgagatcttgctagggaaggccaccttgtatgccgtgctggtcagtgccctcgtgcatggccatggtcaagagaaaggattccagaggctagctccaaaaccatcccaggtcattcttcatcctcacccaggattctcctgtacctgctcccaatctgtgttcctaaaagtgattctcactctgcttcatctcctacttacatgaatacttctctcttttttctgtttccctgaagattgagctcccaacccccaagtacgaaataggctaaaccaataaaaaaatggtgtgtt。
一種EB病毒特異性TCR重組慢病毒載體的應用,分別釆取HLA-A2陽性和陰性的健康人的PBMC,以lxl06/ml的密度接種到24孔板,加入600lU/mlIL-2、50ng/mlanti-CD3(OKT-3)的含10%人AB血清AIM-V培養基培養2~3d。Jurkat細胞按Ixl06細胞/ml混于上述慢病毒上清液放于24孔板中,在32℃以l000g速度離心90min,4h后,用新鮮培養液重懸細胞,37℃孵育過夜。兩種細胞的感染復數(multiplicity of infection,MOI)均為0,15~0.5,重復感染2次,孵育48~72h后用上流式機檢測。
本發明的有益效果是,本發明的一種EB病毒特異性TCR及其重組慢病毒載體與應用篩選出EB病毒抗原特異的TCR,利用慢病毒載體將其轉染到T細胞中,獲得表達針對EB病毒特異TCR的T細胞。
在正常的T細胞中,T細胞受體從由不成熟的胸腺細胞表達的前-T細胞受體(pTCR)放出,并且對于從雙陰性(CD4-CD8-)至雙陽性(CD4+CD8+)階段的T細胞發展是至關重要的。在TCRβ基因座成功地有效重排的前T細胞表達功能性TCRβ鏈,該TCRβ鏈與不變的前Tα鏈和CD3信號組件配對以形成前TCR復合物。
T細胞抗原受體(T cell receptor,TCR)是所有T細胞表面的特征性標志,在T細胞抗原識別中起關鍵作用。TCR是由α、β兩條肽鏈構成的異二聚體,每條肽鏈又可分為可變區(V區),恒定區(C區),跨膜區和胞質區等幾部分;其胞質區很短,信號傳遞主要通過與其以非共價鍵結合的aD3分子進行。TaR分子屬于免疫球蛋白超家族,其抗原特異性存在于V區;V區(Vα、Vβ)又各有三個高變區aDRl、aDR2、aDR3,其中以aDR3變異最大,直接決定了TCR的抗原結合特異性。在TCR識別MHC-抗原肽復合體時,CDRl、CDR2識別和結合MHC分子抗原結合槽的側壁,而CDR3直接與抗原肽相結合。
根據TCR Vα、Vβ基因的同源性,可將80多個TCR Vα基因分為32個家族、60多個TCR Vβ基因分為24個家族。利用每個T細胞克隆均有其獨特CDR3序列的特點,采用CDR3譜型分析技術,可測定各TCR家族各CDR3出現的頻率,由此反映T細胞的克隆性。未接受抗原刺激的T細胞中,針對各種抗原的T細胞克隆分布均勻,表現為多家族和多克隆性,具體地,表現為各家族均出現呈高斯分布的約8個CDR3峰;抗原刺激則引起識別該抗原的某一個或幾個特異TCR家族T細胞反應性增生,表現為該家族CDR3成員出現少于4個峰的寡克隆或單克隆分布,其中具有單克隆CDR3分布(表現為單峰)的TCR家族即是抗原特異單克隆增生的TCR家族。對該家族PCR產物進行測序,可獲得抗原特異TCR CDR3序列。
1.5 EBV表位特異性CD8+T細胞的獲得
1.5.1 Ficoll-Paque梯度離心法分離鼻咽癌患者外周血單個核細胞(PBMC)
1.5.1.1將淋巴細胞分離液按1:1比例加入到離心管中,離心1500rpm,10min,去上層血清。
1.5.1.2按照血細胞:PBS=1:3的比例,將用PBS稀釋后的血細胞溶液緩慢加入到裝有淋巴細胞分離液的離心管中,離心2500rpm,25min。
1.5.1.3離心后管內分為4層,最上層為血衆,最下層為紅細胞,其上有一薄層粒細胞,中間為淋巴細胞分離液,血裝與分離液之間有一層白膜層即為單個核細胞,單個核細胞包括單核細胞和T/B淋巴細胞。用玻璃吸管吸出白膜層液體至10ml離心管中,加PBS至10ml,離心2000rpm,10min。
1.5.1.4棄上清,加PBS至10ml,吹打混勾,用臺盼藍染色計數,離心1500rpm,10min。
1.5.1.5棄上清后,加含10%FBS的RPMI-1640重懸細胞,調整細胞濃度至lxl07/ml備用。
1.5.2特異性CD8+T細胞的誘導擴增
用LMP2A356-364(多肽序列:FLYALALLL)抗原多肽誘導患者的PBMC,以使特異性的CD8+T細胞增殖達到一定的量,足夠用于下一步的實驗所需要的細胞數量。將新鮮分離的PBMC按5X109/L懸于AIM-V培養基中,加入抗原肽孵育6h,然后于各孔中加入含80ml/L人類AB血清的RPMI 1640培養液,并添加細胞因子IL-2 40U/mK IL-7 20U/ml以及抗CD28抗體2mg/L。每隔7d半量換液。隔周取少量細胞進行Pentamer染色后用流式細胞術(FCM)檢測特異性CD8+T細胞頻率,其余細胞半量換液,繼續培養。
1.5,3 MACS磁珠和流式細胞術(flow cytometry,FCM)分選特異性CD8+T細胞。
應用MACS磁珠分選試劑盒富集出CD8+T細胞,用突光標記的抗CD3抗體、抗CD8抗體和Pentamer染色,用FCM分選出CD3+CD8+pentamer+T細胞,染色步驟如下:
1.5.3.1在預冷的離心機離心,轉速14000g,時間為5-10min。(保持試劑在冰上避光)。
1.5.3.2每次染色以1X106~2X106細胞為準。
1.5.3.3用2ml Wash buffer(0.1%sodium azide,0.1%BSA的PBS)清洗細胞后,以500g的轉速離心5min,棄上清,用殘余液重懸(<50μl)。始終保持預冷狀態。
1.5.3.4每次加入10ul pentamer來標記細胞,用吸管混勾。
1.5.3.5室溫避光孵育10min。
1.5.3.6同步驟1.5.3.3.
1.5.3.7加入適量抗CD8抗體,抗CD3抗體,用吸管混勻。
1.5.3.8冰上避光孵育20min。
1.5.3.9清洗細胞兩次,步驟同步驟1.5.3.3,混勻每個管。
1.5.3.10加入200μl固定液。上機檢測。(固定液可使細胞不聚團,上機前將樣品可放于冰箱避光。固定后細胞形態變化,故在進行上機分析前離開樣品3h是合理的。樣品最多可以保存2天)。
而后繼續用抗原多肽誘導其余的PBMC以使特異性CD8+T細胞增殖。將CD3+CD8+Pentamers+T細胞分選到96孔U型培養板中培養,分選前用抗CD3抗體(1mg/L)包被96孔U型培養板過夜。細胞分選的細胞數分別為每孔1、5、20、100、500、1000個CD3+CD8+Pentamers+T細胞,分選后于每孔中加入150ul含100ml/L胎牛血清(FBS)的GIBECO RPMI 1640培養液,添加細胞因子IL-2 1000U/ml,抗CD28抗體200μg/L,培養10-14d。
1.7CDNA5'末端快速擴增(5'RACE)TCR基因雙鏈及分析
1.7.15'RACE cDNA的制備
1.7.1.1準備好如下緩沖液混合物,2μl 5X First-Strand buffer,1.0μl DTT,1.0μl dNTPMix,共4μl,混合好后簡要離心一下,室溫放置。
1.7.1.2把步驟1.6獲得的RNA2.75μl及1.0μl 5'-CDS引物A加入到200μl離心管中,充分混勻并瞬時離心。
1.7.1.3 72℃孵育離心管3min,然后42℃冷卻2min,4℃放置。冷卻后,14000g離心10s,收集混合物到管底。
1.7.1.4準備好如下主要混合液,室溫下按順序混合以下試劑:4.0μl步驟1的混合物緩沖液,0.25μl RNA酶抑制劑(40U/μl)、1.0μlSMARTScibe逆轉錄酶共5.25μl。
1.7.1.5把上述5.25μl主混合物與第五步的變性RNA及SMARTer IIA引物lμl混在一起構成10μl體系;
1.7.1.6輕吹混勾體系,瞬時離心使試劑富集管底;
1.7.1.7 42℃孵育90min;70℃加熱10分鐘;用Tricine-EDTA稀釋產物,總RNA<200ng,則加20μl,否則,加100μl;保存產物于-20℃。獲得的cDNA 5'端均含有片段UMP(CTAATACGACTCACTATAGGGCAAGCAG-TGGTATCAACGCAGAGT),可作為下一步實驗的引物。
1.7.2用5'RACE獲得TCR分子α鏈和β鏈的可變區基因
應用UMP(CTAATACGACTCACTATAGGGCAAGCAGTGGTATCAACGCAGAGT)作為上游外引物,及其上游內引物NUP(AAGCAGTGGTATCAACGC-AGAGT,取自UMP上),而α、β鏈上則采取αdown3、αdown4和βdown4、βdown4作為下游內外引物。應用5μl 1.6獲得的cDNA為模板,應用SMARTer II A試劑盒的反應液(含有TAP酶、dNTP等,具體不詳),構成5μl反應體系。第一輪PCR反應引物為上述的外引物,條件為:94℃5min;94℃30s,72℃3min 5個循環;94℃30s,70℃30s,72℃3min5個循環;94℃30s,66℃30s,72℃3min 27循環;72℃5min,68℃5min,4℃保存。
1.8將獲得的α鏈和β鏈全長基因連入pLenti-C-mGFP載體,應用Xho Ⅰ內切酶把1.10獲得TCR Vβ鏈從T-easy載體上切下,用Sal Ⅰ酶將pLenti-C-mGFP載體(如圖2)上的Sal Ⅰ限制位點切開,酶切產物電泳后按1.9.1的方法膠回收目的條帶,然后進行去磷酸化反應,將反應液放入37℃溫箱30min,然后置65℃水浴30min,加熱滅活。
實施例:重組病毒轉導TCR在細胞表面的表達
分別釆取HLA-A2陽性和陰性的健康人的PBMC,以lxl06/ml的密度接種到24孔板,加入600lU/ml IL-2、50ng/ml anti-CD3(OKT-3)的含10%人AB血清AIM-V培養基培養2~3d。Jurkat細胞按Ixl06細胞/ml混于上述慢病毒上清液放于24孔板中,在32℃以l000g速度離心90min,4h后,用新鮮培養液重懸細胞,37℃孵育過夜。兩種細胞的感染復數(multiplicity of infection,MOI)均為0,15~0.5,重復感染2次。孵育48~72h后用上流式機檢測。應用CD3-percp,CD8-FITC/CD8-APC,HLA-A201-LMP2A356-364pentamer-PE,anti-vpl3TCR-PE,染色,上機檢測驗證重組TCR分子的表達情況。pentamer染色步驟同1.5.3所示方法,對于不染pentamer的抗體染色步驟具體如下:
1.13.3.1準備1xPBS(無需孵育),流式管,所染抗體。
1.13.3.2將所需染色的足量細胞加入流式管中,再加入ImlPBS,短暫震蕩后,以1500rpm,離心5min。
1.13.3.3離心后迅速棄去上清,加入適量抗體(anti-vβl3.1TCR-PE 10μl/test,CD3-Percp 5μl/test,CD8-FITC/CD8-APC 5μl/test),短暫震蕩后,室溫避光20min。
1.13.3.4加入1ml 1xPBS,短暫震蕩,1500rpm,5min離心。重復一次。
1.13.3.5加入200μl固定液1%的多聚甲酸,震蕩,上機檢測。
以上述依據本發明的理想實施例為啟示,通過上述的說明內容,相關工作人員完全可以在不偏離本項發明技術思想的范圍內,進行多樣的變更以及修改。本項發明的技術性范圍并不局限于說明書上的內容,必須要根據權利要求范圍來確定其技術性范圍。
α鏈的序列如下:
atgtaggacgcccctccggtcacggcatttctgatagtgcatcgacgtgactcacccgccgacacaggaagagggtggagaaccgtctcgggttccaatggctttttcctagtgttttgagggaaagaaacaatctatatatatactcttctaggcgggcgcccccttcccctcaaactcttttttttcctcctctgccaagctttgtttgttgagaaaaaacaaaaaattcgctcctggtaactctctttccgcctccaggggagtccccaacccggaaaaaacccccccccccccccccccaagtttttttaatctaggtaggcccgcggttggaaaactccccccccccccccccctgaagcctcacacagcccagtaactttgctagtacctcttgagtgcaaggtggagaattaagatctggatttgagacggagcacggaacatttcactcaggggaagagctatgaacatgctgactgccagcctgttgagggcagtcatagcctccatctgtgttgtatccagcatggctcagaaggtaactcaagcgcagactgaaatttctgtggtggagaaggaggatgtgaccttggactgtgtgtatgaaacccgtgatactacttattacttattctggtacaagcaaccaccaagtggagaattggttttccttattcgtcggaactcttttgatgagcaaaatgaaataagtggtcggtattcttggaacttccagaaggatcgctgaagacagaaagtccagtaccttgatcctgcaccgtgctaccttgagagatgctgctgtgtactactgttcagccggtggtgctacaaacaagctcatctttggaactggcactctgcttgctgtccagccaaatatccagaaccctgaccctgccgtgtaccagctgagagactctaaatccagtgacaagtctgtctgcctattcaccgattttgattctcaaacaaatgtgtcacaaagtaaggattctgatgtgtatatcacagacaaaactgtgctagacatgaggtctatggacttcaagagcaacagtgctgtggcctggagcaacaaatctgactttgcatgtgcaaacgccttcaacaacagcattattccagaagacaccttcttccccagcccagaaagttcctgtgatgtcaagctggtcgagaaaagctttgaaacagatacgaacctaaactttcaaaacctgtcagtgattgggttccgaatcctcctcctgaaagtggccgggtttaatctgctcatgacgctgcggctgtggtccagc
β鏈的序列如下:
ccatcctgccctgaccctgccatgggcaccaggctcctcttctgggtggccttctgtctcctgggggcagatcacacaggagctggagtctcccagtcccccagtaacaaggtcacagagaagggaaaggatgtagagctcaggtgtgatccaatttcaggtcatactgccctttactggtaccgacagagcctggggcagggcctggagtttttaatttacttccaaggcaacagtgcaccagacaaatcagggctgcccagtgatcgcttctctgcagagaggactgggggatccgtctccactctgaccctacacgccctgcagcCAGAAGACTCAGCCCTGTATCTCTGCGCCAGCAGCCAAGACTGGACACCTAATGAGCAGTTCTTCGGGCCAGGGACACGGCTCACCGTGCTAGAGGACCtgaaaaacgtgttcccacccgaggtcgctgtgtttgagccatcagaagcagagatctcccacacccaaaaggccacactggtatgcctggccacaggcttctaccccgaccacgtggagctgagctggtgggtgaatgggaaggaggtgcacagtggggtcagcacagacccgcagcccctcaaggagcagcccgccctcaatgactccagatactgcctgagcagccgcctgagggtctcggccaccttctggcagaacccccgcaaccacttccgctgtcaagtccagttctacgggctctcggagaatgacgagtggacccaggatagggccaaacctgtcacccagatcgtcagcgccgaggcctggggtagagcagactgtggcttcacctccgagtcttaccagcaaggggtcctgtctgccaccatcctctatgagatcttgctagggaaggccaccttgtatgccgtgctggtcagtgccctcgtgcatggccatggtcaagagaaaggattccagaggctagctccaaaaccatcccaggtcattcttcatcctcacccaggattctcctgtacctgctcccaatctgtgttcctaaaagtgattctcactctgcttcatctcctacttacatgaatacttctctcttttttctgtttccctgaagattgagctcccaacccccaagtacgaaataggctaaaccaataaaaaaatggtgtgtt
- 還沒有人留言評論。精彩留言會獲得點贊!