真核細胞的培養方法與流程
本申請是申請日為2010年7月6日的、發明名稱為“真核細胞的培養方法”的中國專利申請201080039284.5(pct/us2010/041082)的分案申請。
相關申請的交叉引用
本申請要求2009年6月6日提交的美國臨時專利申請no.61/223,313號的權益,該臨時申請的全部內容通過參考引用的形式并入本文。
本發明涉及在含碳酸氫鹽的培養基中培養真核細胞的裝置和方法,所述培養基允許在不直接向該培養基中添加堿的情況下維持細胞培養物的ph。
背景技術:
用于細胞建庫、用于細胞產品的生產例如重組蛋白生產的細胞培養,受到細胞生長時條件變化的妨礙。雖然不銹鋼生物反應器常被用于細胞生產,然而一次性用品(disposables)越來越多的在生物制品的制造的所有階段中使用(rao等,2009)。在上游工藝中,相比不銹鋼制品,一次性的生物反應器存在諸多的優勢(從減少交叉污染到成本和時間的節省)。wavebioreactortm是在生物醫藥工業中用于重組蛋白生產的一次性上游技術的一個文獻充分記載的實例(cronin等,2007;haldankar等,2006;ling等,2003;ye等,2009)。
由singh(singh,1999)所開發的wavebioreactortm系統包含預先消毒的、柔性的、一次性的培養室(cellbagtm),co2-和/或o2-空氣混合控制器,和用于搖動和加熱cellbagtm的氣動控制平臺。由該平臺產生的搖擺(rock)運動在cellbagtm中提供了混合和氣體傳遞。
wavebioreactortm系統可以進一步裝備以提供在線ph和溶解氧(do)監控以及實時反饋控制(mikola等,2007;tang等,2007)。然而,對額外設備的需求以及對專門設計的以容納ph和do探測器的袋子的需求,增加了運營成本和系統的復雜性。另外,在ph控制生物反應器中為使培養物ph增加到規定的設定點所需要的堿加入,會增加培養物的摩爾滲透壓濃度。取決于生物反應器中摩爾滲透壓濃度增加的程度,在細胞增長和存活力方面的相關衰減(dezengotita等,2002;zhu等,2005)可能抵消ph值控制的優勢。另外,如果ph探測器發生故障,由此產生的ph值混亂可能改變細胞代謝并促進細胞死亡(miller等,1988;osman等,2002)。
對于某些細胞培養應用來說嚴格的ph值和do控制不是必須的,諸如,例如在小規模培養系統如搖瓶和轉瓶中用于細胞的維持和擴大的常規細胞傳代。然而,ph值和do的極值對細胞生長和生存力是不利的(lin等,1993;link等,2004;miller等,1988;osman等2001),并可影響產品質量(restelli等2006;yoon等,2005)。因此,對于生物制品制造的全階段,對細胞的生長條件保持一些控制是極其重要的。研究人員先前證明,在6.8-7.3的ph值范圍內和在10-100%空氣飽和度的do值范圍內的cho細胞培養是成功的(link等2004;restelli等2006;trummer等2006;yoon等2005)。
向常規生物反應器增加功能,如實時ph監測和do監控控制,將顯著增加生物制品制造中細胞培養的成本和勞動強度。另外,這些功能的失靈或者故障可導致細胞培養的不可接受的變動和潛在的損失,這是非常耗費時間和資源的。
因此,需要用于培養真核細胞的改進方法,該方法將無需引入強堿以及無需額外地進行ph值和do的監測和實時控制。
發明概述
本發明提供了在細胞培養系統中無需加入堿即可維持ph值的裝置和方法。在含碳酸氫鹽的細胞培養基中,基于碳酸-碳酸氫鹽緩沖液平衡(反應式1):
co2+hoh<===>h2co3<===>h++hco3-
ph=pk-log([co2]/[hco3-]),
培養基中co2的量將影響培養基的ph值。
因此,本發明利用這種關系,通過使用細胞培養體系中液相和氣相的動態界面來增加或者減少溶解的co2濃度,無需添加強酸或者堿,調整細胞培養基的ph值。本發明提供了一種用于實現此調節的方法和用于實施該方法的裝置。
一般地,向本發明的裝置供給空氣、氧氣或者這些氣體的組合,以維持細胞培養物的溶解氧。通過向裝置的頂部空間提供氣體混合物(可以操控其組成和引入速度),取決于液相和氣相之間不同的co2濃度,co2可以被加入細胞培養基也可以從中移除。從頂部空間除去co2將增加培養ph值,這是因為培養基中的溶解co2會擴散進入到頂部空間中。相反,當以高于培養基中的濃度向所述裝置添加co2時,co2將溶解到培養基中并且培養ph值將減小。本發明提供了一種允許co2轉移入和轉移出細胞培養物以維持培養ph值而無需添加堿的方法。
因此,本發明提供了一種用于培養真核細胞的方法,包括在容器中在含碳酸氫鹽的培養液中培養真核細胞,其中所述容器具有封裝細胞培養物的壁和位于所述細胞培養物上方的氣相頂部空間。該容器還包括至少一個提供氣體自所述頂部空間進出的口(port)。攪動該容器以提供在液相和氣相之間的動態界面。可以監測培養物的ph,并且可以通過所述的口向頂部空間供應氣體,其中所述氣體包含一定量的co2,以隨著更多的co2溶解到細胞培養物中而降低ph,或者可以通過該口,從頂部空間排出累積的co2,以使細胞培養物ph值增加。由此ph值被維持在一個預定的范圍。
一般地,在細胞培養基中溶解的co2的分壓維持在1至200mmhg的量。在某些實施方式中,溶解的co2的分壓為10至180mmhg。在某些實施方式中,溶解的co2的分壓為20至150mmhg。在某些實施方式中,溶解的co2的分壓為100至180mmhg。在某些實施方式中,溶解的co2的分壓為20至80mmhg。在某些實施方式中,溶解的co2的分壓為30至60mmhg。在某些實施方式中,溶解的co2的分壓為35至50mmhg。在某些實施方式中,溶解的co2的分壓為40mmhg。
頂部空間清除可以連續地或間歇地進行。
一般地,do值維持在10%以上。在某些實施方式中,do值維持在20%以上。在某些實施方式中,do值維持在30%以上。在某些實施方式中,do值維持在40%以上。在某些實施方式中,do值維持在50%以上。在某些實施方式中,do值維持在60%以上。
在某些實施方式中,氣體進入容器的流速是每分鐘0.001頂部空間體積(hvm)。在某些實施方式中,氣體進入容器的流速是0.005hvm。在某些實施方式中,氣體進入容器的流速是0.01hvm。在某些實施方式中,氣體進入容器的流速是0.02hvm。在某些實施方式中,氣體進入容器的流速是0.05hvm。在某些實施方式中,氣體進入容器的流速是0.1hvm。在某些實施方式中,氣體進入容器的流速是0.2hvm。在某些實施方式中,氣體進入容器的流速是0.5hvm。在某些實施方式中,氣體進入容器的流速是0.9hvm。在某些實施方式中,氣體進入容器的流速是1.0hvm。
真核細胞可以是脊椎動物細胞,例如但不限于青蛙、兔、嚙齒動物、綿羊、山羊、狗、貓、牛、馬、豬、非人類靈長類動物或人類的細胞。
該方法可以在具有硬的或者可塑的壁的容器中進行,例如塑料容器或者一次性培養袋。
所述的容器可以通過任何能夠在容器中提供液相和氣相之間的動態界面的工具來攪動。這種攪動(agitation)可以是例如搖擺(rocking)、定軌運動(orbitalmotion)、八字形運動、轉動、振蕩(shaking)等。
在某些實施方式中,攪動通過搖擺來實現。搖擺的速度和角度可以調整以達到所需的攪動。在某些實施方式中,搖擺的角度是20°、19°、18°、17°、16°、15°、14°、13°、12°、11°、10°、9°、8°、7°、6°、5°、4°、3°、2°、或者1°。在某些實施方式中,搖擺的角度是6-16°之間。在某些實施方式中,搖擺的角度是在7-16°之間。在某些實施方式中,搖擺的角度是在8-12°之間。
在某些實施方式中,搖擺速度是1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40rpm。在某些實施方式中,搖擺速度是在19-25rpm之間。在某些實施方式中,搖擺速度是在20-24rpm之間。在某些實施方式中,搖擺速度是在21-23rpm之間。
所述方法可以在包含允許氣體進出培養物的頂部空間的單個口的容器中進行。或者,所述容器可以包含多數個進出口。
培養物的ph值可以連續地或者間歇性地監測,可以將氣體注入到頂部空間,如此提供在頂部空間中的氣體的co2水平,以增加或減少培養物液相中的溶解co2的濃度,從而將液相的ph值調整到預定值。
在一個備選實施方式中,所述的方法可以包括步驟:通過培養基進口,將新鮮的培養基灌注到細胞培養物中。所述新鮮的培養基具有在加入后能調節細胞培養物的總ph的ph值,由此通過新鮮培養基的ph值,部分地將細胞培養物維持在預定ph值范圍。在培養方法中使用具有預定ph值的新鮮培養基來調整ph值是有幫助的,但是還不足以完全控制ph值。
所述的方法可以適應于任何尺寸的培養。在某些實施方式中,所述的方法在商業可得的一次性生物反應袋中進行。可用容積500ml,1l,2l,10l,20l,50l,100l,200l,500l和1000l的該生物反應袋。
培養的多個參數可以被監測和控制。參數可以通過計算機進行計算,在自動化過程中控制。可以單獨或者組合控制的一些參數,包括但不限于,氣體流量、ph值、溶解的co2濃度、溫度和攪動。
本發明還提供了實施本發明方法的裝置。
附圖簡介
圖1顯示本發明裝置的一個例子,該裝置包括灌注過濾器。所述裝置包括氣體入口和氣體出口、用于向培養物提供新鮮培養基的口、用于排出用過的培養基的灌注過濾器、搖擺板和基部。搖擺運動允許攪動以提供在培養基內和外有效的o2和co2傳遞。
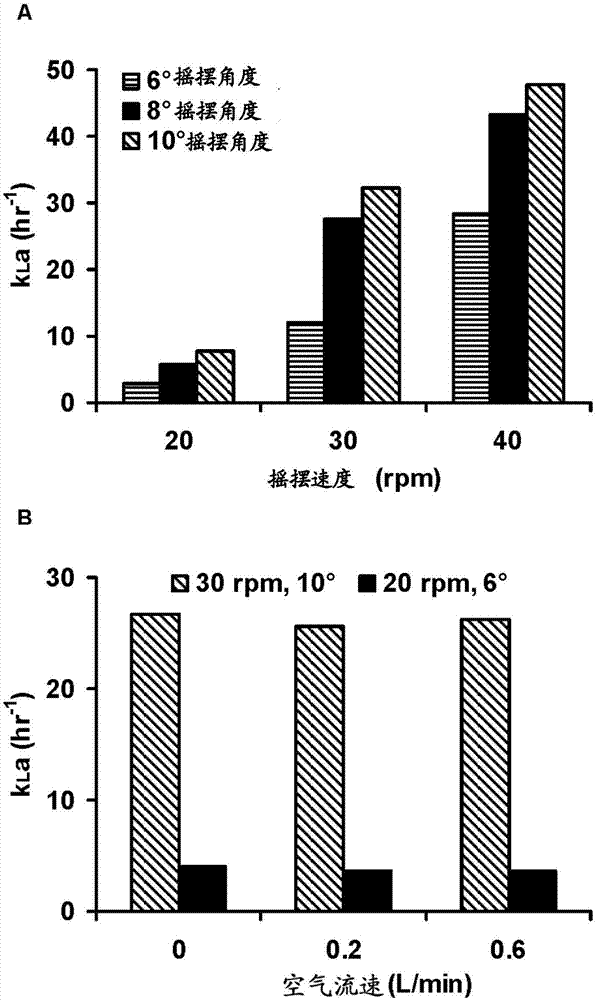
圖2顯示用于測量在wavebioreactortm中的氧氣傳遞的無細胞研究。(圖a)在恒定的0.2l/min空氣流速下搖擺速度和搖擺角度對kla的影響;(圖b)搖擺速度、搖擺角度和空氣流速對kla的影響;(圖c)對于不同的搖擺角度、搖擺速度和和恒定的0.2l/min(這里也被稱為lpm)氣體流速的原始do數據;(圖d)對于兩個的不同搖擺設定點,以不同的氣體流速得到的原始do時間-進程數據。
圖3顯示:為評估在wavebioreactortm中co2剝離(stripping)速度進行的無細胞研究。(圖a);在恒定的氣體流速0.2lpm下不同搖擺角度和搖擺速度時原始ph值上升數據;(圖b)不同氣體流速下兩個不同搖擺設定點的原始ph值上升時間-進程數據。(圖c)對于圖a所示的不同搖擺條件,計算的ph值變化速度;(圖d)對于圖b所示的不同搖擺條件和不同氣體流速,計算的ph值變化速度。實心條是頭5分鐘的ph值變化速度,空心條是計算出的下面55分鐘的ph值變化速度。
圖4顯示:對于wavebioreactortm分批培養,(圖a)vcc,(圖b)離線ph值,(圖c)離線pco2,以及(圖d)離線do曲線。工藝條件在下面表2中概述。對于(ⅰ)生產mabb的細胞系只評估了接種階段,而對于(ⅱ)生產mabc的細胞系則評估了接種和規模放大階段(在此期間,工作體積從6l增加到20l)。在每個階段,在第一天泵入到頂部空間的空氣以8%(v/v)、在第二天以5%(v/v)、其后以2%(v/v)補充了co2。
圖5顯示:對于wavebioreactortm灌流培養,使用生產maba的細胞系,在非優化條件下運行,(圖a)vcc、(圖b)培養物存活力、(圖c)離線ph,以及(圖d)do濃度。頭6天細胞以分批方式培養,隨后以灌流模式培養。在分批培養期間,cellbagtm中的工作容積首先用6l培養物接種,第3天,通過添加新鮮的培養基,將此培養物體積增加到25l。在灌流培養期間,以每天1體積的灌注速度,將培養體積維持在25l。對于這組實驗,搖擺速度18rpm,搖擺角度是8度,而進入到頂部空間的空氣流速是0.2l/min。對于整個培養持續期間,用5%co2(v/v)補充此空氣。
圖6顯示:分批(0-6天)/灌流(6-14天)過程的細胞培養物生長曲線和ph曲線。(圖a)用%pcv表示的收集細胞體積(packedcellvolume);(圖b)細胞生活力;(圖c)ph值曲線;(圖d)由vicelltmas測量的以活細胞數(vcc)表示的細胞生長。
圖7顯示:來自不同的頂部空間清除速率(hvm)的培養性能。(圖a)顯示:以一步增加氣流來實現頂部空間清除速率增加((◆)為0.1hvm和(-▲-)為0.02hvm)的2個實驗。另一種頂部空間清除速率策略是在第10和11天的多步驟增加(0.007hvm至0.013hvm至0.02hvm)(-■-)。(圖b)通過nova
圖8顯示:對于六種不同細胞系——每一種生產一種不同的mab,使用優化工藝進行wavebioreactortm培養,(圖a)vcc、(圖b)培養物生活力、(圖c)離線ph以及(圖d)do。在6l接種階段,培養物以21rpm搖擺,并且進入到頂部空間的空氣流速是0.2l/min。第一天以8%(v/v),第二天以5%(v/v),隨后以2%(v/v),在該空氣中補充co2。在20l放大階段(第3-6天),重復該空氣流方式。在20l灌流模式培養期間(自第6天起),進入頂部空間的空氣流速維持在0.6l/min,無co2補充,而在進口氣體中o2比空氣的混合在第8天由0%(v/v)增加到30%(v/v),并且在剩余的培養期間維持在30%(v/v)。20l分批和灌流培養以23rpm搖擺。所有培養的搖擺角度恒定在10°。
圖9顯示:在wavebioreactortm(●)和攪拌釜生物反應器(□)中生產mabe的細胞系的平行培養物的(圖a)vcc、(圖b)生活力、(圖c)離線ph以及(圖d)離線do。
發明詳述
本領域技術人員熟知很多用于培養真核細胞的方案和方法、以及用于該培養的許多培養基。在文獻和教科書中描述了這樣的方案和培養基,如動物細胞培養,一種實用方法,第2版,rickwood,d.和hames,b.d.編著,牛津大學出版社,紐約(1992)。一般的使用方法也可以在互聯網上得到,如:protocol-online.org/prot/cell_biology/cell_culture。細胞培養基也可以從各種熟知的來源購買獲得。這里引用的所有文獻以參考的形式特此并入。
定義
本文述及或提及的一般細胞培養技術以及工藝是本領域技術人員所熟知、和慣常以常規方法進行使用的。如果適用的話,涉及使用商購試劑盒以及試劑的操作,除非另有說明,否則通常按照制造商所規定的操作方案和/或參數來進行。
在描述本發明方法之前,應當理解的是,本發明不限于所描述的具體方法學、操作方案、細胞系、動物種或屬、構建體以及試劑,因為它們當然是可以變化的。還應當理解的是,這里使用的術語僅僅旨在用于描述特定實施方式,而不旨在對本發明范圍構成限制,本發明范圍僅由后附權利要求限定。
必須注意的是,除非上下文清楚地另有說明,這里以及在后附權利要求書中所使用的,單數形式“a”,“an”,和“the”包括復數對象。在說明書和相關權利要求中所述及的所有數字(例如,1-200mmhg等)應理解為受術語“約”修飾。
本文所提到的所有出版物通過參考而并入本文,以公開和描述與被引用的出版物有關的方法和/或材料。本文引用的出版物因其早于本申請的申請日的公開而被引用。在此無一應被解釋為承認本發明人無權依據更早的優選權日或在先發明日而享有早于這些出版物的權利。此外,實際出版日可能不同于所示的日期,需要單獨核實。
此處所使用“約”指比所述值多或少10%的值。
此處所使用的“攪動”是指擾動,以便培養物的液相和培養物上方的氣相處于動態相互作用中。攪動可以是指運動如振蕩、攪拌、搖擺、定軌振蕩、滾動、八字型搖蕩、或者能使液相處于非靜止態從而增加氣體在液相內和外的擴散的任何方式。
此處使用的“氣體”是指純氣體或者氣體的混合物,其可以包括氮氣、氧氣、以及二氧化碳。通常,氮氣以總氣體濃度的約60-90%的量存在,氧氣以總氣體濃度的約10-40%的量存在,二氧化碳以總氣體濃度的約0-50%的量存在。
此處使用的“含碳酸氫鹽的細胞培養液”是指用于培養真核細胞的合適培養基,其包含碳酸氫鹽緩沖體系作為其組成的一部分。所述培養基還可包含其他緩沖劑如hepes或者mops等,但是必須包含碳酸氫鹽基體系。
此處使用的“細胞培養物”是指在包含緩沖劑和對于活細胞的生長和/或維持所必須的營養素的液體培養基中包含真核細胞的液體制品。
此處所使用的“溶解co2的濃度”由以mmhg為單位的co2相對測量分壓表示。因此,溶解co2的分壓被用作溶解的co2的濃度的反映。
“do”是指溶解氧。
此處使用的“動態界面”是指由攪動細胞培養物引起的液相和氣相之間的增強氣體活躍交換。
此處所使用的“真核細胞”是指動物細胞,其可以是非脊椎動物或者脊椎動物的細胞。
此處所使用的“頂部空間”是指用于培養細胞的容器中位于細胞培養物的液相上方的氣相。
此處使用的hvm是指每分鐘頂部空間體積,其指示頂部空間中的氣體被清除的速度。
kla是指體積氧傳質系數(volumetricoxygentransfercoefficient)。
klaco2是指體積二氧化碳傳質系數。
lpm是指每分鐘的氣流公升數。
此處使用的“調整/調節”是指實現值的增加或者減小。
此處使用的“監測”是指通過連續或者間歇地取樣和分析以確定特定的值來跟蹤該值。
pco2是指溶解的co2濃度的分壓。
此處使用的“口”是指出入一個封閉系統的點。
此處使用的“預定的”是指針對一個具體參數提前選擇的值,該值被用作目標值。
此處使用的“rpm”是指每分鐘搖擺數。
vcc是指活細胞濃度。
此處使用的“容器”是指容納器物(container)。此處使用的容器可以是,例如,搖瓶,生物反應器,一次性生物反應袋,培養室等。
此處使用的“vvm”是指每分鐘的容器容積。
理論方面
在wavebioreactortm培養中o2的傳質
為了確定wavebioreactortm中o2的傳質速率,我們假定對在線do探測器有足夠快的響應時間,在cellbagtm中理想的混合,以及由液相界面引起的傳質阻力占主要。在這些假定條件下,以下質量平衡公式可以給出由氣相到液相的氧氣傳質速率大概值:
其中o2*是培養基中飽和的do濃度,o2是培養基中do濃度。取時間0時的o2為0,則該公式得出:
作為時間的函數對
為了增加wavebioreactortm中氧氣的傳質速率(公式1),我們可以增加體系的kla,或者增加濃度梯度(o2*-o2),或者增加兩者。為了增加wavebioreactortm體系的kla,我們可以增加搖擺速度、搖擺角度或者空氣流速(mikola,2007;singh,1999)。為了增加濃度梯度(o2*-o2)(提供o2由氣相轉移至液相的驅動力),我們可以在進口氣體中增加o2的百分比以增加o2*。
在wavebioreactortm培養中co2的傳質
在簡化模型中,在cellbagtm中氣體的co2(co2(g))與在培養基中的溶解co2達成平衡而存在:
而co2(aq)又以在和碳酸(h2co3)的平衡中存在,碳酸可以解離為碳酸氫根(hco3-):
在ph4-8范圍內hco3-向碳酸根(co32-)的進一步解離應是可以忽略不計的(royce和thornhill,1991)。
對于從培養基中放出co2的限速步驟應當是氣-液傳質(公式3)。假定界面處液體中的co2濃度處于與主氣體(bulkgas)中的co2濃度的平衡中,下面的質量平衡公式將估計出由液相到氣相的co2傳質速率:
其中
在wavebioreactortm中無溶解co2探測器,不能進行實時co2測量來直接計算co2(aq)傳質速率。然而,基于我們對在我們的培養基中的碳酸氫鹽緩沖體系的認識,我們預計co2的離去可以增加培養物ph值,這是因為公式3和4中的平衡將向左邊移動。如果對于在線ph探測器有足夠快的響應時間,在動態co2(aq)傳遞研究中它產生的ph曲線應當提供對co2(aq)剝離速度的間接估計。
為了提高培養物ph值,我們可以通過增加體系的klaco2,或者通過增加co2傳遞的驅動力(co2(aq)-co2(g)),或者通過增加二者,來增加wavebioreactortm中co2剝離速度(公式5)。具體來說,為增加wavebioreactortm體系的klaco2,我們可以增加搖擺速度和搖擺角度。為了增加驅動力(co2(aq)-co2(g)),我們可以降低進口氣體中co2的百分比以降低co2(g)。根據亨利定律(henry’slaw),cellbagtm頂部空間中co2(g)分壓(pco2(g))將限制培養基中co2(aq)濃度:
其中h=co2的亨利定律常數。
相反,為減小培養物ph值,我們可以增加進口氣體中co2(g)的濃度以增加co2(aq),由此,使公式4中的平衡向右移動。
本發明方法
本發明的方法中,真核細胞在合適的培養基以及溫度下培養以允許細胞存活。本領域公知,不同的細胞類型可在不同的培養基中生長。本領域技術人員可以容易地選擇對特定細胞類型和/或特定應用最合適的培養基。本發明的方法中,培養基必須包含碳酸氫鹽緩沖體系,以允許通過co2調整ph。所述培養基可以包含其他作為緩沖劑的試劑。
可以在本發明方法中使用的真核細胞包括動物細胞,其可以是非脊椎動物細胞也可以是脊椎動物細胞。非脊椎動物細胞包括昆蟲細胞(例如草地貪夜蛾(spodopterafrugiperda),家蠶(bombyxmori),粉紋夜蛾(trichoplusiani)細胞)。脊椎動物細胞包括哺乳類動物和非哺乳類動物細胞。脊椎動物細胞包括但不限于來自蛙(例如非洲瓜蟾(xenopuslaevis)),兔形目動物(lagomorpha)(例如,家兔和野兔),嚙齒類動物(例如,大鼠,倉鼠,沙鼠(jirds),沙鼠(gerbils),小鼠),貓,狗,綿羊,牛,山羊,豬,馬,非人類靈長類動物以及人類的細胞。
本發明方法中使用的細胞可以是重組的細胞或者非重組細胞。重組細胞可以包括表達特定蛋白質的工程化細胞(如穩定的或者瞬時轉染的細胞)、或者產生特定rnas(例如,sirna,核酶等)的工程化細胞。
在合適培養基中的細胞被放入到培養容器中,將氣體注入到頂部空間。在某些實施方式中,頂部空間的清除速率是在約0.002-0.1hvm范圍內。在某些實施方式中,頂部空間的清除速率是在約0.007-0.08hvm范圍內。在某些實施方式中,頂部空間的清除速率是在約0.009-0.06hvm范圍內。在某些實施方式中,頂部空間的清除速率是在約0.01-0.04hvm范圍內。在某些實施方式中,頂部空間的清除速率是在約0.02-0.03hvm范圍內。在其他實施方式中,頂部空間的清除速率是在約0.009-0.024hvm范圍內。在另外的實施方式中,頂部空間的清除速率是在約0.007-0.02hvm范圍內。“hvm”是氣體的體積流速(l/min)與頂部空間的體積(l)的比率。
在某些實施方式中,例如,在具有20l的培養物體積和30l的頂部空間體積的50lwavebioreactortm袋中,流入容器的氣體流速是0.1l/min-1l/min。在某些實施方式中,流入袋中的氣體流速是0.2l/min。在某些實施方式中,氣體流速是0.3l/min。在其他實施方式中,氣體流速是0.4l/min。在其他實施方式中,氣體流速是0.5l/min。在其他實施方式中,氣體流速是0.6l/min。在其他實施方式中,氣體流速是0.7l/min。在其他實施方式中,氣體流速是0.8l/min。在其他實施方式中,氣體流速是0.9l/min。
通常,細胞培養物應當維持在約6-8的范圍內。在某些實施方式中,ph值維持在約6.6-7.6的范圍內。在某些實施方式中,ph值維持在約6.9-7.5的范圍內。在某些實施方式中,ph值維持在約6.8-7.2的范圍內。在某些實施方式中,ph值維持在約7.0-7.3的范圍內。盡管本發明的方法無需監測ph值以維持利于細胞在培養中生長的ph值,但在本發明方法的某些實施方式中,培養物的ph值也可以被監測(間歇的或者連續的)。測量可以是原位或者離線進行。
在本發明方法的某些實施方式中,do值維持在10%以上。在其他實施方式中,do值維持在20%以上。在其他實施方式中,do值維持在30%以上。在其他實施方式中,do值維持在40%以上。在其他實施方式中,do值維持在50%以上。在其他實施方式中,do值維持在60%以上。在其他實施方式中,do值維持在70%以上。在其他實施方式中,do值維持在80%以上。在其他實施方式中,do值維持在90%以上。
液體培養基中co2濃度的監測是現有技術已知的,并可以使用商業上可用的技術來完成。測量可以原位或離線進行。
在本發明方法的一個特定的舉例說明性實施方式中,使用分批工藝,其中細胞使用分步方式來培養。該方法中,使用具有20l培養物工作容積的50lwavebioreactortm系統袋,其中向頂部空間注入氣體,該氣體在第一天補充了8%co2(v/v)氣體,第二天補充了5%co2(v/v)氣體,隨后補充了2%co2(v/v)氣體。對于接種物,wavebioreactortm以10°和21rpm以及0.2l/min搖擺,然后,對于規模放大階段,采用23rpm,10°搖擺角,0.2l/min。在這種安排中,由于ph可以通過所使用的參數被維持,故監測ph值不是必要的。
在本發明方法的一個特定舉例說明性實施方式中,使用灌流工藝。該方法中,使用具有20l培養物工作體積的50lwavebioreactortm袋。在開始灌流后兩天,向袋中注入補充30%(v/v)o2的氣體。氣體流速由第0天0.2l/min逐步增長,接著在第3天增加到0.4l/min,然后在第6天再次增加到0.6l/min。在這種安排中,由于ph可以通過使用的參數而維持,故監測ph值不是必要的。
在本發明方法的另外一個特定的舉例說明性實施方式中,使用灌流工藝。該方法中,使用具有20l培養物工作體積的50lwavebioreactortm袋。在開始灌流后兩天,向袋中注入用30%(v/v)o2補充的氣體。氣體流速維持在恒定的0.6l/min氣體流速。在這種安排中,由于通過使用的參數可以維持ph值,故監測ph值不是必要的。
在本發明方法的再另外一個特定舉例說明性實施方式中,使用灌流工藝。該方法中,使用具有20l培養物工作體積的50lwavebioreactortm袋。在開始灌流后兩天,向袋中注入用30%(v/v)o2補充的氣體。氣體流速維持在恒定的1.0l/min流速。在這種安排中,因為通過使用的參數可以維持ph值,故監測ph值不是必要的。
對于本領域技術人員,明顯地,培養條件的參數(氣體濃度,流速,hmv,搖擺速度,搖擺角度等),可以使用本文教導來調整以實現具有期望范圍的ph值。
裝置
容納細胞培養基的容器不限于任何特定尺寸。本發明的容器可以適用于常用生物反應器的尺寸以及本領域中使用的一次性培養袋的尺寸,也可以適用于更大的或者更小的培養。
容器對制造容器使用的材料沒有限定。容器可以由固體材料制備,如玻璃或者硬塑料,或者可以由柔性材料制備,如軟塑料,如用于生產一次性生物反應器袋的那些。
容器可任選地包含擋板以增加攪動時培養基的湍流。
容器可以配備一個或多個口以允許添加或者移除氣體和液體。氣體可以經由一個或多個口進入頂部空間和移出頂部空間。在一實施方式中,存在單一個允許氣體進入和排出的口。在其他實施方式中,存在兩個口:一個用于氣體進入,一個用于氣體排出。在其他實施方式中,使用多個口以允許氣體進出。
在某些實施方式中,裝置也可以包含ph值監測器,連續或者間歇監測細胞培養基ph值。可以使用ph值監測器,和自動化系統通訊,以向容器頂部空間進氣和脫氣以改變co2的濃度,由此調整培養基的ph值。
在某些實施方式中,本發明的裝置包含co2監測器,其連續或者間歇性監測溶解co2的分壓作為培養基中co2濃度的指示。可以使用co2監測器,和自動化系統通訊,以向容器頂部空間進氣或脫氣以改變溶解co2的濃度,從而調整由co2監測器測量到的co2實際濃度至預定值。
在某些實施方式中,本發明的裝置包含有溫度監測器,連續的或者間歇性的監測細胞培養基的溫度。可以使用溫度監測器,和自動化系統通訊,以增加或者降低溫度,從而調整由監測器測量到的實際溫度到預定的值。
各種參數監測器可以單獨或者聯合使用,并且可以使用由電腦控制的自動化控制系統進行控制。電腦可以編程以執行必要的計算來確定待用氣體輸入的或者待由頂部空間除去的co2的量以調整培養基的ph值。計算機還可以執行與溫度、攪拌速度、培養基灌流和其他參數有關的計算和控制工具以自動化方式調整參數。
任選的,本發明的裝置包括攪拌器以攪拌容器使得細胞培養基不是靜態的而是出于與頂部空間氣體的動態界面中。攪拌有利于氣體進出細胞培養基的擴散。攪拌器可以是本領域中已知的任何形式,但包括非限制性的例子如搖床、定軌搖床、旋轉混合器(rotator)、八字形搖床、搖擺式平臺、旋轉式平臺等。
自動氣體傳輸和氣體清除系統(gaspurgingsystem)可包括閥門和泵系統以通過無菌過濾器遞送加壓氣體,具有控制表用于控制氣體流入容器的流速。任何本領域中已知的傳輸氣體和排出氣體的工具都可以使用。可以響應計算機計算的信號,在細胞培養基中溶解co2的濃度偏離預定值時,引入氣體。當測量的co2濃度偏離預定值時,自動化系統計算需要添加到系統或者自系統移除的co2量,在現有氣體通過出口被清除時,將具有合適量的co2的氣體引入到頂部空間。計算機可以執行涉及在此定義的公式1,2和/或3的計算、以及如本領域技術人員基于現有文獻、商業可用系統以及這里的教導可以知曉的,用于調節系統的其他計算。
備選地或者與使用監測的co2濃度的響應系統聯合,該自動化系統也可以測量培養基的ph值,并且當測量的ph值偏離用于培養細胞的預定ph時做出響應。自動化系統可以對偏離的co2濃度和/或ph值做出響應,并且在清除現有氣體的同時使用氣體引入合適量的co2,如此以適當調整培養基的ph值。
現在參考圖1,在一個非限制性的實例中描述本發明裝置和方法。培養容器(40)包含細胞培養基和細胞(110)和頂部空間(130)。帶有過濾器(50)的進氣口(70)和容器(40)相連以允許氣體注入到頂部空間(130)。帶有過濾器(60)的出氣口(80)和容器(40)相連以允許氣體排出頂部空間(130)。容器安置在與搖擺裝置(20)和基部(10)相連的平臺(30)上,以允許細胞培養基(110)的搖擺運動和攪動。頂部空間(130)中的攪動和氣流允許o2和co2擴散進出細胞培養基(110)。如果必需的話,用于保留細胞在培養容器中的任選灌流過濾器(90)經由管(100)與培養基口(120)相連,以允許自細胞培養物移除廢培養基。
細胞在容器(40)中在細胞培養基(110)中培養。容器(40)中的頂部空間(130)充有氣體。氣體通過氣體進口(70)流入和流出氣體出口(80),使得氣體可以流過頂部空間(130),以及使得當通過在連接基部(10)的搖擺裝置上搖擺平臺(30)來攪動培養物時自細胞培養基(110)擴散出到頂部空間中的co2流出。細胞培養基(110)中溶解co2的減少導致細胞培養基(110)的ph值增加。
細胞培養基(110)可以任選補充新鮮培養基,所述新鮮培養基經由培養基管(140)通過培養基口(150)供應,并穿過灌流過濾器(90)、向上經由培養基管(100)并通過培養基出口(120)向外排出。在本發明方法的此任選特征中,在最初的細胞培養基被耗盡營養以及在細胞廢產物累積和ph值降低時,供應新鮮培養基。供應的新鮮培養基具有預定ph值,該ph值足以使混合后總的細胞培養基的ph值增加,致使細胞培養基達到預定的最佳ph范圍。
實施例
a.原理:
由于大部分哺乳動物細胞培養體系利用含碳酸氫鹽的細胞培養基,故主要通過堿/co2的添加來進行哺乳動物細胞培養中的ph值控制。該ph值控制利用碳酸-碳酸氫鹽緩沖體系。已經發現,在這種系統例如一次性袋生物反應器中,培養物的ph值可以通過操控培養基中溶解co2的濃度來調整,培養基中溶解co2的濃度可以通過調整頂部空間co2的濃度來調整。在本實施例中證實,通過調整頂部空間co2的濃度,可以實現雙向ph值調節。該方法使得無需使用堿來增加細胞培養生物反應器系統中的ph值。如果一次性生物反應器中細胞培養的ph值需要降低,可通過用co2補充進氣來增加頂部空間中co2的濃度。這將使得co2可以轉移到細胞培養物中。如果一次性袋中細胞培養物的ph值需要增加,可以降低頂部空間中co2的濃度或者可以增加頂部空間的清除速率,以利于co2從細胞培養物中移出。
這種ph值維持方法可以擴展到如下生物反應器體系,在該體系中氣體在生物反應器中的傳遞主要是通過在生物反應器中產生的大表面積來推動的。
在細胞建庫過程中基于co2添加或者移除的ph值維持策略:
在細胞培養的初始階段,當存在相對較小數量的細胞時,細胞培養物的ph值通常是上升的。為了控制ph值,通常要將co2添加到生物反應器中以降低ph值。通常,在常規攪拌釜生物反應器中,此種添加通過將co2氣體噴射入細胞培養物來完成。在本發明的一次性生物反應器中,通過改變頂部空間的二氧化碳濃度,使co2轉移的方向從氣相到液相。隨著細胞濃度在培養過程中增加,細胞培養物中的co2濃度也增加,因此通常要降低ph值。在具有常規ph值反饋控制的常規攪拌釜生物反應器中,將添加堿以控制ph值。堿的添加可以增加細胞培養物的ph值。在本發明的一次性生物反應器中,ph值的增加可以通過反轉co2轉移的方向,通過降低頂部空間的co2濃度以及增加頂部空間的清除速率來完成。這種通過操作培養基中co2濃度來維持細胞培養物ph值的方法,允許消除堿的使用。根據需求(要么增加要么降低ph值),可以分別地降低或者增加頂部空間的co2濃度。
一次性生物反應器系統可用作產生高細胞密度細胞庫的生物反應器系統,例如但不限于主細胞庫(mcb)和工作細胞庫(wcb)。灌流細胞培養工藝被認為可以在一次性生物反應器中產生高細胞密度細胞庫。在開發用于產生mcbs和wcbs的細胞培養工藝時,建議通過co2添加/移出方法來維持ph值。除了通過該氣體轉移方法來維持ph值外,細胞培養物的灌流允許額外的維持ph的機會。在灌流細胞培養工藝中,在連續的移除廢培養基的同時向生物反應器中連續地添加新鮮的細胞培養基。灌流允許移除細胞培養副產物(其可能會影響細胞培養物ph值)。除了移除細胞培養副產物,注入的新鮮細胞培養基的ph也可以改變細胞培養物的ph值。如果知道細胞培養物的ph值將降低,則可以增加進入的培養基的ph值以彌補該ph值降低。或者,也可以改變灌流速率以管理培養物ph值。所有上述方法對ph值都有影響,但是影響ph值最重要的因素是co2轉移法。因為在一次性生物反應器中氣流速度和co2補充可以被有效控制而沒有太多問題,故co2轉移也是一種更為可靠的方法。
當我們最初嘗試在沒有ph值和do反饋控制下在wavebioreactortm中培養cho細胞時,我們認識到幾個挑戰(圖5):(1)分批培養階段(第0-6天)以約0.3天-1緩慢生長;(2)灌流培養階段(自第6天起)逐步更加緩慢的生長,從頭3天期間的約0.5天-1降低至此后的少于0.3天-1;(3)初始培養物ph值有時超過7.3,并且隨后的培養物ph值常常降到ph6.8以下;(4)在第6天灌流開始后,do水平往往低于20%空氣飽和度。在使用生產其他mabs的cho細胞系(沒有顯示數據)時我們遇到了同樣的挑戰。我們將分批培養中的緩慢生長歸咎于高的初始ph值,灌流培養中生長速率的降低歸咎于ph值和do值的降低。
在無ph值反饋控制的wavebioreactortm中,這些碳酸氫鹽緩沖的培養物中的ph值將取決于cellbagtm頂部空間中的co2含量。盡管在培養基中存在碳酸氫鹽和hepes緩沖液,但是由于乳酸累積的結果,培養ph值應隨著時間最終降低。為了將培養ph值維持在我們期望的6.8-7.2范圍,我們的策略是操控cellbagtm中的co2濃度。在分批培養的早期階段,我們增加向培養基中的co2轉移以降低ph值。相反,在分批培養或者灌流培養的后期階段,我們將從培養基中剝離co2以增加ph值。在無do反饋控制的wavebioreactortm中,do水平將隨著細胞密度的增加而降低。為了維持do>20%空氣飽和度,我們將通過增加wavebioreactortm系統的氧氣體積傳質系數(kla)以及通過用o2補充進口氣體來增加向培養物中的o2轉移。
b.材料和方法:
1.cho細胞系和培養基
實施例中使用的所有細胞系均源于適應在無血清懸浮培養中生長的cho二氫葉酸還原酶缺陷型(dhfr-)宿主。產生特定單克隆抗體(mab)的每個細胞系通過使用編碼dhfr、mab輕鏈(lc)以及mab重鏈(hc)基因的dna質粒來轉染dhfr-宿主得到。隨后,穩定轉染的細胞經過在包含氨甲蝶呤的化學成分明確的專利選擇性培養基中每2-5天傳代一次來維持。同樣的培養基——除了專利營養混合物外還包含1.0g/lpluronicf-68,2.44g/l碳酸氫鈉,以及15mmhepes——用來在wavebioreactortm中在分批和灌流模式下培養細胞。
2.wavebioreactortm系統
wavebioreactortm系統(gehealthcare,piscataway,nj,usa)——用于在分批或者灌流模式下培養cho細胞——包括搖擺平臺、控制器組件和預消毒的柔性的一次性袋,袋子具有進氣口和出氣口氣體過濾器以及多個采樣口(singh,1999;tang等,2007)。每個系統都裝配有加熱墊和氣體混合盒以分別提供溫度控制和所需的進口氣體組合物(o2和/或co2與空氣混合)。所有的細胞培養實驗都是使用50lcellbagtm在工作體積6或者20l,37℃溫度設定點,19-25rpm的搖擺速度,8-12°的搖擺角下進行。在wavebioreactortm中沒有安裝在線ph或do探測器;相反,對不同氣體混合物和氣體流速策略,測試它們維持培養ph值和do水平在目標范圍內的能力。
3.wavebioreactortm中的分批培養
分批培養以6l在wavebioreactortm中通過以~7.5×105細胞/ml接種常規或灌流cellbagtm而開始。接種后幾天,當培養物積累了足夠細胞質量時,加入新鮮的培養基以增加工作體積至20l。對于每一代,培養物在分批模式下維持2-5天。
4、在wavebioreactortm中灌流培養
除非另有說明,灌流培養在分批培養累積了足夠的細胞質量后在灌流cellbagtm中以20l工作體積開始,具有23rpm的搖擺速度和10°的搖擺角度,以及每天1工作體積的灌流速率。在灌流cellbagtm中細胞保留裝置為過濾器,在培養期間其浮在液體表面上(tang等,2007)。在連續地添加新鮮培養基和移除濾液時,灌流過濾器使細胞保留在cellbagtm中。通過使新鮮培養基添加速率匹配每天一個工作體積的濾液移除速率,在灌流wavebioreactortm中維持恒定的體積。
5.攪拌釜生物反應器培養
為了比較在wavebioreactortm中和攪拌釜生物反應器中培養物的性能,來自相同seedtrain源的細胞以~7.5×105細胞/ml接種到wavebioreactortm生物反應器中和20l不銹鋼攪拌釜生物反應器(applikon,fostercity,ca,usa)中。細胞首先是在分批模式下培養,接著在累積足夠的細胞質量后開始灌流。在攪拌釜生物反應器中工作體積是在分批模式下7l和在灌流模式下15l。培養溫度,do以及攪拌分別維持在37℃、30%空氣飽和度、以及125rpm的設定值。通過添加1m碳酸鈉以增加ph值或者噴射co2氣體以降低ph值來維持培養ph值在7.15,具有0.03的死區。在灌流操作期間,使用centritech離心機系統(centritechab,norsborg,sweden)將細胞從生長培養基中分離;通過離心機,細胞被保留并返回到生物反應器,而上清液被移除(johnson等,1996)。通過使新鮮培養基的添加速率匹配每天一個工作體積的上清液移除速率,維持生物反應器中的恒定體積。
6、離線樣品分析
培養物被抽樣并用于活細胞濃度(vcc)和存活力(vi-cellas,beckmancoulter,fullerton,ca,usa)、以及用于ph,do,pco2,葡萄糖和乳酸(bioprofile400,novabiomedical,waltham,ma,usa)分析。
實施例1:無細胞研究:氣體傳質測量
cellbagtm中氣體傳質特征影響培養性能,原因是它們對do和ph水平的影響。作為將ph和do維持在我們期望的范圍內的第一步,進行了cellbagtm中無細胞研究以測量o2和co2的傳質。
a.o2傳質研究
在50l的cellbagtm中o2傳質,使用模擬的培養基,通過計算在搖擺速度(20,30,以及40rpm)、搖擺角度(8°,10°,以及12°)和氣流速(0.1,0.2,以及0.3l/min)的各種組合下o2體積傳質系數(kla)來表征。經典的動態排氣法(gassing-outmethod)被用來計算kla(dunn和einsele,1975)。用于這些研究的測試培養基被設計用來模擬專利細胞培養基:它是由1.0g/lpluronicf-68,2.44g/l碳酸氫納,以及15mmhepes組成。來自同一制造商(broadley-jamescorporation,irvine,ca,usa)的連接到40型發送機(trasmitter)的
在用于o2傳質測試的準備中,在將25l模擬培養基裝入50-lcellbagtm后,使氮氣(n2)通過氣體進入口。搖擺袋子以促進n2轉移到模擬培養基中。當模擬培養基的do含量跌到10%空氣飽和度以下時停止進入頂部空間的氮氣流。在此脫氧步驟后,按壓袋子以從頂部空間中排出殘留n2。然后在對液-氣界面干擾最小化時,向袋子中的頂部空間添加壓縮氣體。一旦袋子完全膨脹,在所定義的搖擺速度、搖擺角度以及氣流速測試條件下開始氧氣傳質測試。記錄do濃度得到的增加,并用來確定體系的kla。此外,頭5分鐘內每一分鐘,此后每5分鐘測量離線do,以驗證在線do讀數的準確性。
在恒定的空氣流速,可能是通過增加用于氧氣傳質的表面積,增加搖擺速度或者搖擺角度增加了kla(圖2a)。我們在測試的最小搖擺速度(20rpm)得到的kla值比得上其他研究者所報道的wavebioreactortm系統的值(mikola等,2007;singh,1999)。這些kla值也比得上由我們的自制攪拌釜生物反應器所得到的值(數據沒有顯示)。
在以恒定的20rpm搖擺速度進行的wavebioreactortm系統的o2傳質研究中,在2-l的規模下,空氣流速從0.01vvm增加到0.05vvm使kla從~2h-1增加到~3h-1,在20-l的規模下,空氣流速從0.01vvm增加到0.1vvm,使kla從~0.5h-1增加到~3h-1(singh,1999)。作為對比,在50-l規模的我們的研究中,在搖擺速度和搖擺角度的兩種不同組合下氣流速從0vvm增加到0.02vvm,沒有增加kla(圖2b)。我們使用的最大氣流速可能太低,不能實現在氣液界面的液體運動性,從而對kla沒有任何顯著的影響。
通過確定傳質系數kla,評價了氧氣在50l一次性袋中的傳質能力。圖2c顯示,對于恒定氣流速,隨時間的do濃度。圖2d顯示氣流速對溶解氧的影響。對于激烈的搖擺條件(更高搖擺速度和搖擺角度),傳質系數是高的。然而,令人驚訝的是,頂部空間的清除速率對氧氣傳質的kla沒有影響,在開始試驗前,模擬培養基進行去氧化。氣體中氧氣的濃度高于模擬培養基中氧氣的濃度。因此,氧氣從氣相傳質到液相中。以激烈的搖擺條件,氣液界面由于更多波的形成而增加(此處稱作動態界面)。這種表面積的增加看起來導致高氧氣傳質速率。當氣流速增加或者減少時,可以相應地變化頂部空間的清除速率。頂部空間清除的該變化不改變氣相和液相之間的差異氧氣濃度。因此,氣流速看起來對氧氣傳質系數沒有影響。當模擬培養基中氧氣的濃度等于頂部空間中的濃度時,氧氣傳質將停止。
b.co2傳質研究
在模擬培養基通過使用用于o2傳質研究的方法去氧化后,將co2通過用于供應氮氣的同樣進氣口,供應到cellbagtm。當在線ph值探測器讀數7.0時,停止co2的供應,并且使用在o2傳質研究中描述的同樣的方法來清除頂部空間。當袋完全膨脹后,在所定義的搖擺速度、搖擺角度以及氣流速測試條件下開始co2傳質研究。用與同樣的制造商(gehealthcare,piscataway,nj,usa)提供的ph20發送機相連的一次性在線ph探測器,記錄引起的ph增加。ph值的增加是由于co2被從碳酸氫鹽基模擬培養基中去除而引起。為了驗證在線ph值讀數的準確性,頭5分鐘內每一分鐘,此后每5分鐘測量模擬培養基的離線ph值。通過繪制在線ph測量值對時間的圖像,最佳擬合線的斜率提供了ph值的變化速率,由此表明cellbagtm中co2從模擬培養基到頂部空間的傳質速率。
盡管其他研究人員已經表征了wavebioreactortm中o2的傳質(mikola等,2007;singh,1999),但我們沒有發現關于在具有wave誘導的攪動的細胞培養系統中co2傳質的報道。為了表征wavebioreactortm中co2的傳質,以和我們的細胞培養培養基中同樣的濃度(2.44g/l),我們使用了包含碳酸氫鈉的模擬培養基。在這種碳酸氫鹽緩沖的無細胞體系中,在無活躍ph值控制下,從液相中移出co2將會增加體系的ph值。代替依賴于co2探測器在模擬培養基中直接測量co2,我們使用了源于wavebioreactortm中在線ph探測器的ph曲線以估算相對co2剝離速度。
在該研究中,在wavebioreactortm中ph曲線被分成兩個階段(圖3a和3b)。在第一階段,在0-5分鐘之間,ph值以每小時~1-4ph單位,迅速增加。在第二階段,從5-60分鐘,ph值以每小時<0.5ph單位,更為逐漸地增加。在第二階段(5-60分鐘),不同的搖擺速度和搖擺角度對ph值增加速度有微不足道的影響:在恒定的0.2l/min的空氣流速下,ph值以每小時0.2單位增加,不論搖擺條件如何(圖3a)。相反,在第二階段(5-60分鐘),較高的氣流速增加了ph變化速率:當空氣流速由0l/min增加到0.6l/min時,ph值的變化速率由每小時0-0.1單位增加到每小時0.4單位(圖3b)。在無空氣流時(0l/min),在第二階段(5-60分鐘)觀察到最小ph增加(≤0.1單位每小時),表明在大約5分鐘內在cellbagtm中模擬培養基和頂部空間之間的co2交換達到平衡。為在頭5分鐘以外實現額外的ph值增加,可以通過增加空氣流速以增加頂部空間的清除速率并由此使頂部空間的co2濃度最小化,提高用于co2剝離的驅動力。
圖3c顯示了針對圖3a數據的計算出的ph變化速率。圖3d顯示的是針對圖3b數據的計算ph值變化速率。該兩相行為可以通過高氣體傳質速率來解釋,該高氣體傳質速率由波的高表面積和進入氣體對頂部空間的連續清掃引起。高表面積促進了從液相到氣相的迅速的co2傳質。快速的傳質是氣相和液相之間差異co2濃度的結果。這種濃度的差別在實驗開始階段是最高的,并且隨著更多的co2由液相傳質到氣相,這種差別持續減少。隨著氣相和液相之間的co2濃度差別減少,ph值變化速率也減少。圖3a中,相比第二階段(5-60分鐘),第一階段(0-5分鐘)的ph值變化速率非常高。在圖3a中顯示的情形下氣體流速保持相同。在co2開始傳質后,co2的傳質速率取決于頂部空間中的co2濃度。對于同樣的頂部空間清除速率,在開始5分鐘后的ph值變化速率是相同的,不管搖擺條件如何。ph值變化速率的計算值在圖3c中顯示。
當變化氣體流速時,也變化頂部空間的清除速率。對于不同氣體流速的ph值升高數據顯示在圖3b中。對于這些情況也觀察到兩相行為。然而,在具有相同氣體流速的情況和氣體流速變化的情況之間,差別在于第二階段(5-60分鐘)的ph值變化速率隨氣體流速的不同而變化,相比地在具有相同氣體流速的情況下這是類似的。由于改變氣體流速改變了頂部空間的清除速率,頂部空間的co2以不同的速度被移除。
初始快速的氣體傳質是一次性袋的性質造成大表面積的結果。初始氣體傳質主要依賴于搖擺條件(搖擺速度和搖擺角度)。然而,co2從培養基中的持續移出,依賴于頂部空間co2的濃度。頂部空間的清除速率取決于氣體流速。
實施例2:細胞生長特性研究
a.分批培養
1.初始實驗
細胞培養基:
無血清細胞培養基被用于中國倉鼠卵巢(cho)細胞生長。細胞培養基源自dmem和ham’sf-12的1:1混合物基培養基,其中改變某些組分如氨基酸、鹽、糖和維生素。該培養基缺乏甘氨酸、次黃嘌呤和胸苷。該培養基包括15mmhepes(4-(2-羥乙基)-1-哌嗪乙磺酸)和2.44g/l碳酸氫鈉。這些鹽的濃度可以變化。培養基用微量元素、重組人胰島素以及細胞保護劑lutrolf-68prill補充(可使用等價物)。
哺乳動物細胞培養:
自1ml或者10ml存儲在液氮中的瓶庫,生長轉染的中國倉鼠卵巢(cho)細胞。在轉瓶、搖瓶或者攪拌釜生物反應器中,將所選擇的冷凍小瓶融化到包含碳酸氫鈉的培養基中。每2-7天,傳代細胞。該培養物被稱為“seedtrain”。將來自seedtrain的細胞轉移到一次性袋中以在一次性袋中開始細胞培養。
分析:
血氣分析儀(nova
實施例3:使用幾種cho細胞系的詳細分析
a.分批工藝:
在分批培養的過程中通過降低向cellbagtm供應的氣體中的co2濃度,我們應該能夠降低起始的高ph值(>7.3),并且使wavebioreactortm系統中隨后的ph值降低最小化。在使用幾種cho細胞系在wavebioreactortm分批培養中測試不同co2氣體重疊策略后,我們確定了對于接種和放大階段的“8-5-2”分步策略:在第一天期間,泵入到cellbagtm中的空氣以8%(v/v)補充co2氣體,第二天以5%(v/v),隨后以2%(v/v)補充。
基于由無細胞研究得到的結果,我們選擇了下面的搖擺速度、搖擺角度和氣體流速作為我們wavebioreactortm分批培養的工藝設定點:21rpm、10°搖擺角和0.2l/min用于接種;23rpm、10°搖擺角和0.2l/min用于放大階段。為了測試這些工藝設定值的可靠性,我們設計了一種全因子實驗(表1)。當工藝條件偏離中心點時,對于被測試的兩種細胞系,我們觀察到微不足道的對細胞生長和pco2曲線的影響,并且培養ph值保持在6.8-7.2和do>50%(圖4)。
表1.在產生mabb和mabc的細胞系的wavebioreactortm分批培養中測試的條件(圖4)。圍繞3個工藝參數——搖擺速度、搖擺角度和進入頂部空間的空氣流速,設計了全因子實驗,用于分批培養中的接種和擴大階段。
b.灌流培養
我們在wavebioreactortm中灌流培養的開始嘗試中,在第6天灌流開始后,培養ph值通常跌倒6.8以下,do常跌倒30%空氣飽和度以下(圖5)。因為無細胞氣體傳質研究表明增加空氣流速增加了ph值(圖3),在不增加灌流速率下為了使ph的下降最小化,我們研究了增加進入cellbagtm的氣體流速的可行性。為了克服do值下降,在灌流開始后兩天,我們向進入cellbagtm的空氣流補充30%(v/v)o2。我們選擇這個時間是因為它和以前觀察到的do下降吻合(圖5)。
實施例4:分批-灌流工藝
該灌流工藝由兩個分批步驟和接著的灌流步驟組成。在接種步驟,以目標細胞密度5-7.5x105細胞/ml,在6l工作體積,接種50l一次性袋。接種后3天,添加新鮮的培養基以將一次性袋子的體積增加到20l用于放大階段。接種步驟和放大步驟構成分批步驟。如在分批工藝中所描述的,使用co2步降策略用于這些分批步驟。在3天的放大步驟結束時,開始灌流。向一次性袋連續加入新鮮培養基,并且廢培養基被連續地移出一次性袋子而留下細胞。細胞培養基以每天20公升(每天1體積)的速度灌流。灌流的培養基ph設定值是在7.2單位。灌流開始時,進入氣體中co2的濃度設定為0。增加頂部空間清除速率以促進co2移除。如圖7中所示,頂部空間清除速率的增加要么按照單個步驟增加或者按照多個步驟增加。搖擺速度范圍是在19-25rpm之間。搖擺角度范圍是在8-12度之間。溫度維持在37℃。在灌流開始后48小時補充氧氣以滿足細胞的氧氣需求。在灌流開始后48小時,進入氣體中氧氣的濃度設定在30%。
圖6顯示了分批-灌流工藝的細胞培養性能(分批步驟(第0-6天)以及灌流步驟(第6-14天)(圖6a)。圖6b顯示的是細胞存活力百分比。圖7a顯示的是用于三種不同實驗的頂部空間清除速率設定值。對于灌流步驟的頂部空間清除速率設定值遵循不同的曲線(第6-14天):(1)兩種恒定的空間清除速率:0.02hvm(-▲-)和0.1hvm(◆);以及(2)逐步增加的頂部空間清除速率:0.007hvm至0.013hvm至0.02hvm(-■-)。單個步驟增加以及多個步驟增加均被研究。圖7b顯示的是離線溶解co2濃度。圖6d顯示的是以活細胞數(vcc)計的細胞生長。用于圖6和7的圖例:◆,■,▲表示三種不同的運作。如圖6c中所示,通過清除頂部空間調節co2,ph可以維持在期望的范圍內。
實施例5:六種cho細胞系在“8-5-2”條件下的行為
為了測試該wavebioreactortm工藝在支持細胞生長和維持ph以及do在期望范圍內的可靠性,我們選擇了六種細胞系,覆蓋通常在我們的內部cho細胞系中觀察到的細胞生長以及代謝行為范圍。
以優化的工藝條件,在整個分批和灌流培養階段,所有六種細胞系生長,具有高生存力(圖8)。在所有情況下,ph值維持在期望的6.8-7.2范圍內,do超過20%空氣飽和度。
實施例6:“8-5-2”wavebioreactortm法和常規的攪拌釜生物反應器培養之間的比較
為了比較本發明wavebioreactortm工藝和具有ph和do控制的攪拌釜生物反應器工藝之間的培養性能,我們在兩個系統中進行了并行培養(圖9)。兩種生物反應器系統之間的生長和生活力曲線類似:在wavebioreactortm中和在攪拌釜生物反應器中的生長速度是相當的,~0.5天-1。盡管在wavebioreactortm系統中缺乏ph和do在線反饋控制,在兩種生物反應器培養中ph和do曲線沒有顯著差異。
本發明提供了一種工藝控制方法,用于在wavebioreactortm系統中——在分批和灌流模式下運作——將培養ph維持在6.8-7.2范圍內,do>20%空氣飽和度,而無需依靠ph和do反饋控制。在鑒定在沒有ph和do控制的wavebioreactortm系統中培養cho細胞的挑戰后,我們進行了無細胞研究以確定搖擺速度、搖擺角度和氣體流速對o2以及co2在wavebioreactortm系統中傳質的影響。通過調整這些工藝參數以及輸入氣體中co2和o2的濃度,對于六種重組cho細胞系的分批和灌流培養,我們維持了培養ph和do在我們的期望范圍內。通過消除對ph和do探測器的需求,該方法提供了一種在wavebioreactortm體系中更簡單、更有成本效率的培養細胞的方法。還提供了一種在裝有這些探測器的wavebioreactortm中在ph或者do探測器失效時用于細胞培養的替代方法。
應當理解的是,本文所描述的具體實例僅僅是舉例說明性的而不是對本發明范圍的限制。本發明僅僅由后附權利要求來限定。
參考文獻
cronincn,limkb,rogersj.2007.productionofselenomethionyl-derivatizedproteinsinbaculovirus-infectedinsectcells.proteinsci16:2023-2029.
dunnij,einseleaj.1975.oxygentransfercoefficientsbythedynamicmodel.japplchembiotechnol25:707-720.
dezengotitavm,schmelzerae,millerwm.2002.characterizationofhybridomacellresponsestoelevatedpco2andosmolality:intracellularph,cellsize,apoptosis,andmetabolism.biotechnolbioeng77:369-380.
haldankarr,lid,saremiz,baikalovc,deshpander.2006.serum-freesuspensionlarge-scaletransienttransfectionofchocellsinwavebioreactors.molbiotechnol34:191-199.
johnsonm,lanthiers,massieb,lefebvregandkamena.1996.useofthecentritechlabcentrifugeforperfusioncultureofhybridomacellsinprotein-freemedium.biotechprog12:855-864.
langheinrichcandnienowaw.1999.controlofphinlarge-scale,freesuspensionanimalcellbioreactors:alkaliadditionandphexcursions.
biotechnolbioeng66:171-179.
lina,kimurar,millerwm.1993.productionoftpainrecombinantchocellsunderoxygen-limitedconditions.biotechnolbioeng42:339-350.
lingwlw,dengl,leporej,cutlerc,connon-carlsons,wangy,volochm.2003.improvementofmonoclonalantibodyproductioninhybridomacellsbydimethylsulfoxide.biotechnolprog19:158-162.
linkt,
millerwm,blanchhw,wilkecr.1988.akineticanalysisofhybridomagrowthandmetabolisminbatchandcontinuoussuspensionculture:effectofnutrientconcentration,dilutionrate,andph.biotechnolbioeng32:947-965.
mikolam,setoj,amanullaha.2007.evaluationofanovelwavebioreactorcellbagforaerobicyeastcultivation.bioprocessbiosysteng30:231-241.
osmanjj,birchj,varleyj.2001.theresponseofgs-ns0myelomacellstophshiftsandphperturbations.biotechnolbioeng75:63-73.
osmanjj,birchj,varleyj.2002.theresponseofgs-ns0myelomacellstosingleandmultiplephperturbations.biotechnolbioeng79:398-407.
raog,moreiraa,brorsonk.2009.disposablebioprocessing:thefuturehasarrived.biotechnolbioeng102:348-356.
restelliv,wangmd,huzeln,ethierm,perreaulth,butlerm.2006.
theeffectofdissolvedoxygenontheproductionandglycosylationprofileofrecombinanthumanerythropoietinproducedfromchocells.
biotechnolbioeng94:481-494.
roycepnc,thornhillnf.1991.estimationofdissolvedcarbondioxideconcentrationsinaerobicfermentations.aichej37l1680-1686.
singhv.1999.disposablebioreactorforcellcultureusingwave-inducedagitation.cytotechnology30:149-158.
tangyj,ohashir,hameljfp.2007.perfusioncultureofhybridomacellsforhyperproductionofigg2amonoclonalantibodyinawavebioreactor-perfusionculturesystem.biotechnolprog23:255-264.
- 還沒有人留言評論。精彩留言會獲得點贊!