一種接枝視黃醇聚合物及采用其作為載體的喜樹堿化合物的制作方法
本發明涉及藥物領域,具體涉及一種接枝視黃醇聚合物及采用其作為載體的喜樹堿化合物、制備方法及其應用。
背景技術:
肝星狀細胞(hepatic stellate cell,HSC)的激活和大量擴增在肝纖維化發生過程中占有非常重要的地位;通過抑制炎癥反應、對抗氧化應激、調節相關細胞因子的活性、干擾細胞因子信號傳導等途徑抑制HSC的增殖、活化和誘導其凋亡已經成為治療肝纖維化的重要手段;目前相繼有人嘗試使用紫杉醇、姜黃素、NO類等藥物來抑制活化態HSC的增殖和ECM的沉積;HSC的激活和活化表型的維持需要旺盛的糖酵解代謝活動,抑制糖酵解代謝活動可以促使活化態HSC從肌成纖維母細胞(Myofibroblastic,MF)表型向靜息態表型逆轉;因此,本發明使用我國特有藥物喜樹堿來抑制糖酵解途徑關鍵調控蛋白缺氧因子(hypoxia-inducible-factor 1-alpha,HIF-1-α)的蛋白水平和活性、從而抑制其下游糖酵解途徑相關基因的表達和MF表型相關蛋白的表達;但是喜樹堿難溶于水、毒副作用大;若制成鹽則活性降低,進入體內又易為體循環系統清除;因此它在臨床中的應用受到很大限制。
技術實現要素:
本發明提供一種對HSC具有特異性靶向作用,并可以減輕喜樹堿對肝細胞等其它肝臟細胞和組織器官的非特異性毒副作用的采用接枝視黃醇聚合物納米載體的喜樹堿膠束、制備方法及其應用。
本發明采用的技術方案是:一種接枝視黃醇聚合物,化學結構式如下:
式中,n=20,m=40-44。
采用接枝視黃醇聚合物作為載體的喜樹堿化合物為接枝視黃醇聚合物物理包裹喜樹堿組成。
采用接枝視黃醇聚合物作為載體的喜樹堿化合物的制備方法,包括以下步驟:
(1)將喜樹堿與接枝視黃醇聚合物按質量比為1:5、1:10或1:20的比例溶于二甲基亞砜;
(2)將步驟(1)中得到的溶液放入透析袋中,透析48h后,將收集得到的膠束溶液冷凍干燥后得到所需要的化合物;其中透析袋截留分子量為3500。
接枝視黃醇聚合物作為載體的喜樹堿化合物可以降低纖維化肝組織中蛋白缺氧因子HIF-1-α的表達。
接枝視黃醇聚合物作為載體的喜樹堿化合物可以降低纖維化肝組織中糖酵解途徑限速酶基因的表達。
接枝視黃醇聚合物作為載體的喜樹堿化合物可以降低纖維化肝組織中肌成纖維母細胞性標記基因的表達。
接枝視黃醇聚合物作為載體的喜樹堿化合物能夠作為促使活化態肝星狀細胞向靜息態表型的逆轉的靶向性藥物。
接枝視黃醇聚合物作為載體的喜樹堿化合物能夠作為抑制肝纖維化的發生發展的靶向性藥物。
本發明的有益效果是:
(1)本發明采用的載體由雙親性嵌段聚合物形成,可以降低喜樹堿對肝臟細胞的毒副作用;
(2)本發明采用視黃醇修飾的載體,利用配體受體間特異性識別和結合實現對HSC的主動靶向作用;
(3)本發明的接枝視黃醇聚合物作為載體的喜樹堿化合物能延長其體循環時間、提高其在纖維化肝臟中的富集和對HSC的特異性靶向作用和降低使用劑量,并減少毒副作用;通過促使活化態HSC向靜息態表型的逆轉,具有溫和安全而有效的效果。
附圖說明
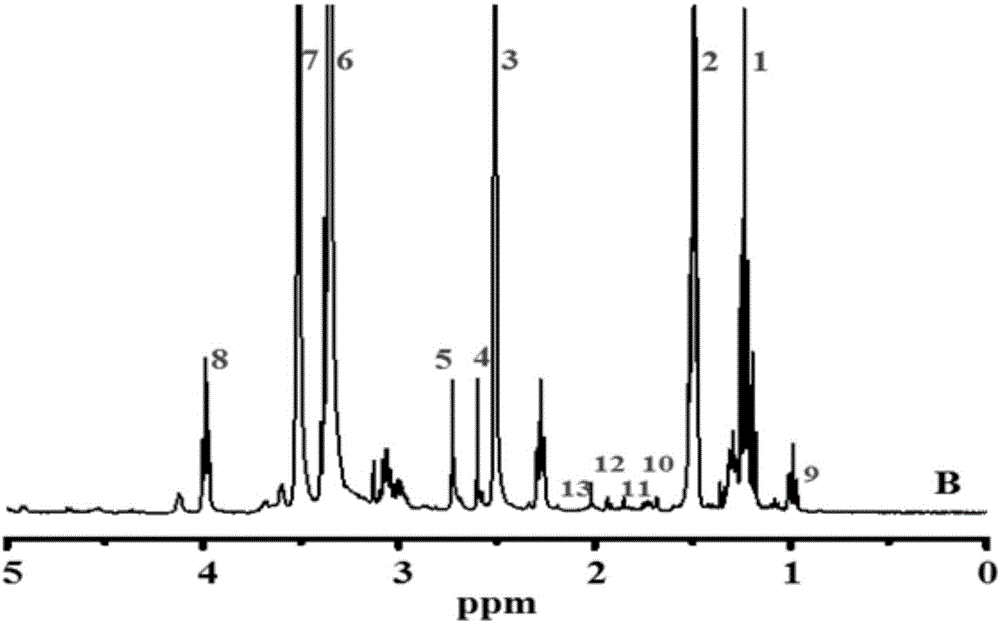
圖1本發明中PEG-PCL核磁1H-NMR圖譜。
圖2為本發明中VA-PEG-PCL核磁1H-NMR圖譜。
圖3為本發明中PEG-PCL和VA-PEG-PCL的TEM和粒徑表征。
圖4為大鼠原代活化態HSC細胞對本發明中PEG-PCL和VA-PEG-PCL裝載尼羅紅攝取行為熒光照片。
圖5為大鼠原代活化態HC細胞對本發明中PEG-PCL和VA-PEG-PCL裝載尼羅紅攝取行為熒光照片。
圖6為本發明中PEG-PCL和VA-PEG-PCL載尼羅紅膠束的組織分布。
圖7為本發明中慢性纖維化小鼠血清中ALT和AST水平變化。
圖8為本發明中慢性纖維化小鼠肝組織切片HE染色結果。
圖9為本發明對慢性纖維化小鼠肝組織切片Sirius Red染色結果。
圖10為本發明對慢性纖維化小鼠肝組織中基因水平影響。
圖11為本發明對慢性纖維化小鼠肝組織中蛋白表達影響。
圖12為Western Blot結果定量分析。
圖13為本發明對慢性肝纖維化小鼠肝組織切片免疫組化(PKM2)。
圖14為本發明對慢性肝纖維化小鼠肝組織切片免疫組化(α-SMA)。
圖15為本發明中VA-PEG-PCL制備流程圖。
具體實施方式
一種接枝視黃醇聚合物,化學結構式如下:
式中,n=20,m=40-44。
作為載體使用時,需制備成納米膠束,納米膠束顆粒為球形,粒徑的平均值為102nm;上述載體中親水段材料為聚乙二醇,其分子量為1800~2200,疏水段材料為聚已內脂,其分子量為3921~4570;接枝視黃醇聚合物為雙親性嵌段聚合物,本發明中采用聚乙二醇和聚已內脂,不限于上述兩種物質;可以是任何可藥用的兩嵌段聚合物膠束材料,這些載體材料包括但不限于,PEG、PEO、PVP、PEI和PLA。
采用接枝視黃醇聚合物作為載體的喜樹堿化合物,所述化合物為接枝視黃醇聚合物物理包裹喜樹堿組成。
一種采用接枝視黃醇聚合物作為載體的喜樹堿化合物的制備方法,包括以下步驟:
(1)將喜樹堿與接枝視黃醇聚合物按質量比為1:5、1:10或1:20的比例溶于二甲基亞砜;
(2)將步驟(1)中得到的溶液放入透析袋中,透析48h后,將收集得到的膠束溶液冷凍干燥后得到所需要的化合物;其中透析袋截留分子量為3500。
一種接枝視黃醇聚合物作為載體的喜樹堿化合物的應用,所述膠束可以降低纖維化肝組織中蛋白缺氧因子HIF-1-α的表達。
一種接枝視黃醇聚合物作為載體的喜樹堿化合物的應用,所述膠束可以降低纖維化肝組織中糖酵解途徑限速酶基因的表達。
一種接枝視黃醇聚合物作為載體的喜樹堿化合物的應用,所述膠束可以降低纖維化肝組織中肌成纖維母細胞性標記基因的表達。
一種接枝視黃醇聚合物作為載體的喜樹堿化合物的應用,所述膠束能夠作為促使活化態肝星狀細胞向靜息態表型的逆轉的靶向性藥物。
一種接枝視黃醇聚合物作為載體的喜樹堿化合物的應用,所述化合物能夠作為有效抑制肝纖維化的靶向性藥物。
試驗中用到的納米膠束載體材料VA-PEG-PCL和PEG-PCL制備方法如下:
(1)雙端羧基化的聚乙二醇(COOH-PEG-COOH)的制備
將聚乙二醇PEG2000、丁二酸酐、氯仿混合,油浴加熱至60度反應12h。得到雙端羧基化的聚乙二醇(COOH-PEG-COOH),保存至真空干燥箱;
(2)單端接枝視黃醇VA的聚乙二醇(VA-PEG-COOH)的制備
將視黃醇,雙羧基化的COOH-PEG-COOH按投料比1:1稱量,COOH-PEG-COOH加入適量4-二甲氨基吡啶DMAP及1-(3-二甲基胺丙基)-3-乙基碳二亞胺EDC,溶于二甲基亞砜DMSO,視黃醇VA充分溶于DMSO,在氬氣保護下避光反應。反應結束后將反應物轉移至MW3500的透析袋中透析,每2h換水一次,透析48h后進行凍干;
(3)二碳酸二叔丁酯保護的聚己內酯(Boc-PCL)的制備
稱取N-叔丁氧羰基乙二胺、蒸餾純化的己內酯單體、氯化亞錫置于單頸瓶中,置于40度水浴鍋中加熱攪拌并抽真空7h,達到真空度后置于140度烘箱反應7h;反應結束后向反應液中加入冰乙醇沉淀、攪拌、過濾、旋干,真空干燥得到N-叔丁氧羰基乙二胺聚己內酯(Boc-PCL);
(4)單端氨基化聚己內酯(NH2-PCL)的制備
稱取N-叔丁氧羰基己內酯溶于二氯甲烷,加入三氟乙酸并攪拌3h,旋蒸除去三氟乙酸,加飽和碳酸氫鈉水調至pH為中性,去離子水使三氟乙酸盡可能除去,真空干燥得到單端氨基化聚己內酯(NH2-PCL);
(5)偶聯視黃醇的聚乙二醇—聚己內酯(VA-PEG-PCL)的制備
稱取NH2-PCL、1-乙基-(3-二甲基氨基丙基)碳二亞胺鹽酸鹽EDC.HCL、N-N-羥基琥珀酰亞胺NHS溶于DMSO,滴加少量三乙醇胺TEA,充分溶解混勻,其后向其中加入VA-PEG-COOH,在氬氣保護下避光反應72h;其后將產物置于透析袋中(MW=3500)中避光透析48h,冷凍干燥得到白色固體VA-PEG-PCL。
(6)聚乙二醇—聚己內酯(PEG-PCL)的制備
稱取NH2-PCL、EDC.HCL、NHS溶于DMSO,充分溶解混勻2h,隨后向其中加入COOH-PEG-COOH,避光反應72h。其后將產物置于透析袋中(MW=3500)中避光透析48h,冷凍干燥得到PEG-PCL。
對制備的PEG-PCL和VA-PEG-PCL納米膠束材料采用1H-NMR分析,將適量待測樣品溶于氘代氯仿中,以四甲基硅烷為內標,通過核磁共振譜儀檢測各樣品中氫質子的位移,核磁測試結果見圖1(PEG-PCL)及圖2(VA-PEG-PCL);通過核磁圖分析可知,產物為PEG-PCL及VA-PEG-PCL,經過積分面積計算可得VA-PEG-PCL中VA的接枝率為91.7%。
聚合物納米膠束的制備
稱去5mg的VA-PEG-PCL完全溶解于5mL的二甲基亞砜中,利用注射器將其緩慢滴加至適量攪拌速度的去離子水中,然后轉移至透析袋(MW=3500)透析48h,備用;PEG-PCL納米膠束的制備方法如上;相關形貌、粒徑見圖3.合成的聚合物所制備的膠束形貌為球形,PEG-PCL及VA-PEG-PCL粒徑分別為107nm和103nm,分布較窄。
聚合物納米喜樹堿及載熒光分子尼羅紅膠束的制備
將喜樹堿與VA-PEG-PCL按分別1:5、1:10、1:20比例充分攪拌溶解于二甲基亞砜,隨后轉移至透析袋(MW3500)中,置于去離子水避光48h以上出去未包封的喜樹堿,其后收集膠束溶液冷凍干燥,得到膠束凍干粉末避光保存于4℃;聚合物載熒光分子尼羅紅膠束的制備方法和聚合物納米喜樹堿膠束制備方法相同;通過優化投料比,制備的膠束最大包封量為2.857%,包封率28.57%。
本發明采用CCl4對小鼠腹腔一周兩次重復注射以誘導肝纖維化發生,同時通過一周兩次尾靜脈注射對小鼠分別給予喜樹堿裸藥、PEG-PCL膠束載送的喜樹堿藥劑和視黃醇配體修飾的PEG-PCL納米膠束載體包裹的喜樹堿藥劑;實驗持續進行6周,采用細胞分子生物學、組化和組織免疫化學等手段對實驗組小鼠進行檢測。
實施例一 接枝視黃醇聚合物膠束的體外靶向性實驗
采用原位灌注法消化大鼠肝臟,對消化分離得到的原代大鼠肝星狀細胞(HSC)及肝細胞(HC)接種于24孔板上,采用高糖DMEM培養基(含15%-20%FBS,1%雙抗P/S)置于37℃,5%CO2細胞孵箱中培養;待HC生長2天、HSC生長7天后,加入包覆尼羅紅聚合物納米膠束繼續培養2h,磷酸鹽緩沖溶液(PBS)洗兩次,加入2.5%的戊二醛固定0.5h,PBS洗兩次,加入4',6-二脒基-2-苯基吲哚DAPI(1:600,V/V)約5min,再吸棄DAPI,清洗兩次后加適量PBS避光保存,利用熒光顯微鏡觀察HSC細胞及HC細胞攝取包覆尼羅紅的視黃醇靶向納米膠束(VA-PEG-PCL)及包覆尼羅紅的無靶向納米膠束(PEG-PCL)熒光分布,熒光照片結果如圖4和圖5;熒光分布檢測所用儀器為TS100倒置熒光相差顯微鏡,Nikon,Japan。
圖4顯示了載尼羅紅膠束同原代大鼠HSC細胞共孵育后細胞對尼羅紅的攝取情形;可以明顯看到,靶向性VA-PEG-PCL尼羅紅納米膠束所產生的熒光強度顯著高于較無靶向性的PEG-PCL尼羅紅膠束,表明接枝VA配體可顯著增強HSC細胞對膠束的攝取;與此不同的是,VA配體的接枝并不增強肝細胞對膠束的攝取;如圖5所示,兩種聚合物所制備的裝載尼羅紅納米膠束在原代肝細胞中所產生的熒光強度并無明顯差異;這一結果顯示視黃醇靶向納米膠束對原代大鼠活化態肝星狀細胞而非肝細胞具有特異性靶向。
實施例二 接枝視黃醇聚合物膠束在小鼠體內的靶向性實驗
取16只小鼠,每組8只隨機分成2組;通過腹腔分別向小鼠體內注射橄欖油(對照組)或20%CCl4-橄欖油(劑量2ml/kg)進行急性肝損傷;給藥兩日后,將各組動物再隨機均分成2組,通過尾靜脈向小鼠體內分別注射載尼羅紅VA-PEG-PCL和PEG-PCL膠束溶液;三小時后殺死小鼠,收集各小鼠心、肝、脾、肺、腎臟組織,勻漿后檢測組織樣品中尼羅紅的熒光強度以分析膠束藥物在體內的生物性分布情形,結果如圖6所示。
用到的小鼠為SPF級別雄性ICR小鼠,體重20-25g,由成都市達碩動物有限公司提供;CCl4為Sigma Aldrich產品,實驗對照用橄欖油為Aladdin(上海)公司藥用級橄欖油。
如圖6所示,載尼羅紅的VA-PEG-PCL膠束組和PEG-PCL膠束組在正常組和CCl4處理組小鼠的心肺肝脾腎幾大臟器均有分布,其中在肝臟中的尼羅紅的信號最強,其次是在腎臟,而在其它幾大主要器官中的熒光信號差異不大,表明靜脈注射的膠束材料主要進入肝腎;除此之外,在正常組小鼠各檢測臟器中兩組膠束材料的分布均未呈現顯著性差異;在CCl4處理組小鼠的心肺脾中,兩組材料的分布幾乎維持不變;然而,在處理組小鼠的肝腎中,盡管PEG-PCL組膠束材料的分布較在正常組小鼠肝腎中的分布未有明顯變化,靶向性VA-PEG-PCL膠束材料在肝臟中的熒光強度卻顯著增高,高出非靶向性PEG-PCL膠束組一倍多;靶向性載體材料在處理組小鼠腎臟中的分布也有較小幅度的的增高;考慮到一次性CCl4注射引起的急性肝臟損傷的顯著特征就是靜息態的HSC被激活而迅速增殖擴展,說明VA-PEG-PCL膠束材料的確可在體內有效地靶向活化的HSC,進一步確保其所載送的藥物在纖維化肝臟中的定向和富集。
實施例三 采用接枝視黃醇聚合物作為載體的喜樹堿膠束對慢性纖維化小鼠的治療實驗
取20只體重20-25g健康小鼠,每4只一組隨機分成5組;一組動物腹腔注射橄欖油作為正常組,其余四組小鼠腹腔注射20%CCl4-橄欖油(2ml/kg),每周注射兩次,持續共6周,誘導小鼠慢性肝纖維化發生;所有動物于川大華西醫院動物實驗中心SPF級別動物房飼養。
所用小鼠為SPF級別雄性ICR小鼠,由成都市達碩動物有限公司提供;CCl4為Sigma Aldrich產品,實驗對照用橄欖油為Aladdin(上海)公司藥用級橄欖油。
造模第三天開始通過尾靜脈向小鼠注射藥劑;五組小鼠的注射分別為:正常組注射PBS,CCl4模型組注射PBS,其它三組分別注射喜樹堿、PEG-PCL裝載的喜樹堿和接枝視黃醇聚合物作為載體的喜樹堿(氯化聚醚劑量1mg/kg);每次CCl4注射后第三天進行尾靜脈注射,持續6周,末次注射后第三天,摘除眼球取血,室溫靜置20min后離心收集血清備用;隨后剖取肝臟,迅速切取部分肝組織塊于10%福爾馬林液中浸泡固定48h以作后期石蠟包埋和組織切片,以備組化和免疫組化分析;將剩余肝組織切塊,在液氮中速凍后迅速轉移至-80℃凍存。
取凍存的血清,通過生化測試分別檢查血清中丙氨酸轉氨酶(ALT)和天門冬氨酸氨基轉移酶(AST)的酶活水平;如圖7所示,CCl4處理后ALT和AST兩種酶在血清中的水平分別升高了43倍及10倍;靜脈注射喜樹堿、PEG-PCL裝載的喜樹堿二者的水平略有降低但不顯著;而注射接枝視黃醇聚合物作為載體的喜樹堿后,二者的水平顯著下降,高出正常組5.8倍及1.3倍,說明肝臟的功能得到很好的恢復;檢測酶活性水平采用ELX800酶標儀,Biotek,USA。
取石蠟切片進行常規的HE染色和Sirius Red染色,然后在顯微鏡下檢查肝臟組織損傷修復情形和纖維化程度;圖8和9分別為肝組織切片的HE染色和Sirius Red染色結果;與正常組比較,肝纖維化模型組小鼠肝臟中可看到明顯壞死的肝組織,大量的炎性細胞浸潤受損部位,肝臟組織結構均有不同程度的破壞;Sirius Red染色也顯示,模型組小鼠肝臟中在匯管區、中央靜脈、門靜脈區均有較大程度的纖維組織增生、肝臟實質結構開始被間隔、假小葉逐漸形成,顯示慢性肝纖維化造模成功;肝臟的這些纖維化結構特征在注射喜樹堿和PEG-PCL裝載的喜樹堿后幾乎未有改善,只有在注射VA-PEG-PCL載送的喜樹堿后才被顯著減輕;肝臟中中央靜脈及門靜脈區僅有少量纖維束放散延伸,單無纖維間隔形成,肝小葉結構大部分保存;這些結果充分說明本發明的VA配體介導的靶向HSC的喜樹堿可以對CCl4誘導的小鼠肝纖維化疾病進行有效治療。
取小塊凍存肝組織進行勻漿、分別制備總RNA和總蛋白,然后進行定時熒光定量QRT-PCR和蛋白質印跡法Western Blot實驗分別分析肝組織中基因的RNA和蛋白表達水平。石蠟切片常規脫蠟、水化和內源性過氧化酶滅活;隨后置于pH6.0的0.01mol/L檸檬酸鈉鹽緩沖溶液中加熱進行抗原修復,以DAKO protein-free blocking reagent進行封閉;隨后分別和PKM2一抗(1:1000稀釋)、α-SMA一抗(1:500稀釋)和相應等量的I型collagen進行4℃孵育過夜,漂洗后進一步和耦合HRP的抗兔IgG二抗(DAKO)在室溫孵育1h;漂洗后以DAB+(DAKO)顯色、蘇木精復染、脫水、透明和封片,最后進行顯微鏡觀察;QRT-PCR實驗采用CFX96QRT-PCR儀,Bio-Rad,USA;Western Blot實驗采用Power Pac電泳儀,Bio-Rad,USA;α-SMA單克隆抗體為Abcam公司產品,PKM2單克隆抗體Cell signaling technology公司產品,免疫組化試劑盒、DAB顯色試劑盒均為Dako North America公司產品;如圖10、11、12所示,與注射橄欖油的正常組比較,肝纖維化模型組小鼠肝臟組織中HIF-1-α蛋白顯著增多,糖酵解限速酶基因PKM2的RNA和蛋白表達顯著升高,纖維化表型標記基因α-SMA和I型collagen基因的RNA和蛋白水平也隨之顯著增強;盡管未包裹的喜樹堿在體外可有效抑制以上這些蛋白的表達,直接通過靜脈注射到小鼠體內的喜樹堿在肝臟內則完全失去了對這些蛋白的抑制作用;特別值得注意的是,PEG-PCL包載的喜樹堿雖然能很好地保護喜樹堿,卻未能有效地恢復喜樹堿的這些抑制功能;而與此相反的是,經靶向性VA-PEG-PCL納米膠束包裹的喜樹堿,不僅極大地抑制了肝臟組織中的HIF-1-α蛋白,還顯著地降低了PKM2、I型collagen和α-SMA的RNA和蛋白的表達水平。
圖13-14分別顯示了CCl4處理后肝臟中PKM2和α-SMA陽性HSC細胞明顯擴增;喜樹堿和PEG-PCL包載的喜樹堿均未能有效遏制其擴增,唯有VA-PEG-PCL膠束載體包載的喜樹堿可顯著減少肝臟中的這些陽性HSC細胞;這些結果說明,本發明制備的VA-PEG-PCL膠束包載的喜樹堿不僅可定向作用于纖維化肝臟中活化HSC,還可通過降低該細胞中HIF-1-α蛋白來抑制其旺盛的糖酵解代謝活動,從而實現對其活化表型向靜息態的逆轉;HIF-1-α單克隆抗體為Affinity公司產品;ST 16R低溫臺式離心機,Thermo,USA;ChemiDoc凝膠成像系統,Bio-Rad,USA。
實驗中所有數據均采用統計軟件SPSS進行統計分析,以t檢驗分析組間差異,計量數據以平均數±標準差表示。
實驗結果表明,VA-PEG-PCL為載體的喜樹堿膠束可以富集于纖維化肝臟中、定向作用于肝臟中大量增殖的活化HSC,并通過抑制細胞中的HIF-1-α蛋白遏制細胞中旺盛的糖酵解代謝活動和逆轉細胞的纖維化表型,從而減少肝組織中膠原纖維的沉積、恢復肝臟的正常功能;本發明的化合物通過促使活化態肝星狀細胞向靜息態表型的逆轉來明顯改善肝纖維化的損傷,有效而安全,具有良好的臨床應用前景;本發明采用CCl4對小鼠腹腔一周兩次重復注射以誘導肝纖維化發生,同時通過一周兩次尾靜脈注射對小鼠分別給予喜樹堿、PEG-PCL膠束載送的喜樹堿和VA-PEG-PCL納米膠束載體包裹的喜樹堿;實驗持續進行6周;采用細胞分子生物學、組化和組織免疫化學等手段對實驗組小鼠進行檢測;結果顯示僅有VA靶向納米載體材料包裹的喜樹堿能顯著抑制肝組織中HIF-1-α、PKM2(HSC中)等糖酵解基因表達,有效降低α-SMA和I型Collagen等肝纖維化表型的標記基因的RNA和蛋白水平;肝組織中膠原纖維的沉積和血清中丙氨酸轉氨酶ALT及天門冬氨酸氨基轉移酶AST活性也受到明顯遏制;這些結果充分體現了本發明化合物具有有效而安全的治療肝纖維化作用。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 一種HDPE多單體接枝聚合物及其制備方法與制造工藝
- 接枝用的夾具的制作方法
- 一種兩嵌段低分子聚合物接枝納米二氧化硅粒子、制備方法和聚酯的制作方法
- 基于聚醚接枝改性的熱增黏聚合物及其制備方法
- 以馬鈴薯淀粉為原料一鍋法接枝聚合合成含鉀高吸水樹脂的方法
- 以馬鈴薯淀粉為原料氧化、堿糊化及接枝聚合一鍋法制備吸附Ni<sup>2+</sup>離子樹脂的方法
- 以馬鈴薯淀粉為原料氧化、堿糊化及接枝聚合一鍋法制備吸附Co<sup>2+</sup>離子樹脂的方法
- 以馬鈴薯淀粉為原料氧化、堿糊化及接枝聚合一鍋法制備吸附Ag<sup>+</sup>離子樹脂的方法
- 一種合成溫敏含糖聚合物接枝的納米金膠束的方法
- 一種基于點擊化學的超支化聚合物接枝碳納米管的制備方法
- 星形聚合物接枝多肽和聚乙烯亞胺的基因載體及制備方法與流程
- 一種木質纖維接枝丙烯酰胺聚合物及其制備方法與流程
- 使用新穎的陽離子性接枝聚合物的目標物分離濃縮方法與流程
- 含橡膠接枝聚合物粉體、以及含有其的太陽能電池用密封材料和夾層玻璃用中間膜的制作方法與工藝
- 一種原位制備黑磷混雜聚合物的制備方法與流程
- 附接到可降解的聚合物區的支撐件的制作方法與工藝
- 接枝聚合物、樹脂著色物、該樹脂著色物的制造方法和包含該樹脂著色物的樹脂組合物與流程
- 接枝聚合物、樹脂著色物、該樹脂著色物的制造方法和包含該樹脂著色物的樹脂組合物與流程
- 角蛋白接枝水性聚氨酯聚合物皮革復鞣填充材料的制備方法與流程
- 一種高接枝率聚烯烴接枝物的制備方法及該高接枝率聚烯烴接枝物的應用與流程
- 一種接枝視黃醇聚合物及采用其作為載體的喜樹堿化合物的制作方法與工藝
- 星形聚合物接枝多肽和聚乙烯亞胺的基因載體及制備方法與流程
- 一種木質纖維接枝丙烯酰胺聚合物及其制備方法與流程
- 棉織物用聚合物/Ag摻雜納米ZnO長效抗菌防霉整理劑及其制備方法與流程
- 含橡膠接枝聚合物粉體、以及含有其的太陽能電池用密封材料和夾層玻璃用中間膜的制作方法與工藝
- 一種抗菌納米碳溶膠、納米石墨輻照接枝改性錦綸單絲濾布及其制備方法與流程
- 附接到可降解的聚合物區的支撐件的制作方法與工藝
- 接枝聚合物、樹脂著色物、該樹脂著色物的制造方法和包含該樹脂著色物的樹脂組合物與流程
- 接枝聚合物、樹脂著色物、該樹脂著色物的制造方法和包含該樹脂著色物的樹脂組合物與流程
- 角蛋白接枝水性聚氨酯聚合物皮革復鞣填充材料的制備方法與流程
- 星形聚合物接枝多肽和聚乙烯亞胺的基因載體及制備方法與流程
- 一種木質纖維接枝丙烯酰胺聚合物及其制備方法與流程
- 含橡膠接枝聚合物粉體、以及含有其的太陽能電池用密封材料和夾層玻璃用中間膜的制作方法與工藝
- 附接到可降解的聚合物區的支撐件的制作方法與工藝
- 接枝聚合物、樹脂著色物、該樹脂著色物的制造方法和包含該樹脂著色物的樹脂組合物與流程
- 接枝聚合物、樹脂著色物、該樹脂著色物的制造方法和包含該樹脂著色物的樹脂組合物與流程
- 角蛋白接枝水性聚氨酯聚合物皮革復鞣填充材料的制備方法與流程
- 一種高接枝率聚烯烴接枝物的制備方法及該高接枝率聚烯烴接枝物的應用與流程
- 一種高抗沖聚丙烯接枝聚合物及其制備方法與流程
- 非硫化硅烷改性聚合物鋅粉膏及其用于懸索橋主纜的復合防護結構的制作方法與工藝