超聲酶提制備膠原蛋白的方法與流程
本發明涉及一種膠原蛋白制備方法。更具體地說,本發明涉及一種超聲酶提制備膠原蛋白的方法。
背景技術:
膠原蛋白是生物體內一種重要的蛋白質,也是結締組織的主要蛋白成分,具有保護機體和支撐器官的作用,主要存在于動物肌腱、韌帶、軟骨、血管壁、皮膚及結締組織中,占哺乳動物體內蛋白質總量的25%~30%。與陸生動物(如豬、牛等)比較,水生動物膠原蛋白具有優良的理化性質和生理活性功能,已引起人們的廣泛關注。中華鱉是我國傳統的名貴水產品,俗稱甲魚、團魚、水魚、王八、神守等。傳統醫學認為鱉類有活血消淤,滋補強身的功效,可作為重病或手術后身體虛弱者的保健食品。鱉甲周圍的結締軟組織通常被稱為“裙邊”,裙邊膠原蛋白含量豐富,是最具滋補的部分,具有極高的藥用價值和營養價值。目前對魚類等水產動物膠原蛋白(如魚皮、魚骨、魚鱗、魚鰭或魚翅的研究有很多,目前利用鱉類裙邊制備膠原蛋白的方法多采用常規酶輔助提取。但其操作復雜,用時較長,而且制備的膠原蛋白溶解度低。超聲輔助酶解反應雖然能夠大大縮短反應時間,但是其制備物質多為多肽類,無法保證制備的膠原蛋白的穩定結構。
技術實現要素:
本發明的一個目的是解決至少上述問題,并提供至少后面將說明的優點。
本發明還有一個目的是提供一種超聲酶提制備膠原蛋白的方法,其能夠制備穩定的螺旋結構Ⅰ型膠原蛋白,操作簡單,處理時間短、蛋白得率高、能耗較低。
為了實現根據本發明的這些目的和其它優點,提供了一種超聲酶提制備膠原蛋白的方法,其包括以下步驟:
步驟一,取新鮮或冷凍甲魚裙邊按照體積比1:10~30的比例加入質量濃度為0.3~0.6mol/L的酸溶液,按照體積百分比再加入0.25~1.5%的胃蛋白酶制得混合溶液;
步驟二,所述混合溶液進行超聲處理,其中超聲時間為30~50min;其中工作時間2s,停歇時間2~6s,超聲功率為50~300W;
步驟三,超聲結束后,經離心、純化以及干燥制得螺旋結構Ⅰ型膠原蛋白。
優選的是,所述步驟一中,所述酸溶液為檸檬酸溶液、鹽酸溶液或乙酸溶液中的一種。
優選的是,所述步驟三中,所述離心具體為:于1000~3000rmp離心3~6min后取上清液。
優選的是,所述步驟三中,離心后純化具體為:向所述上清液中添加NaCl至鹽濃度為0.6~1.2mol/L,靜置鹽析18~30h后過濾,蛋白沉淀用0.3~0.6mol/L的乙酸復溶后依次對0.1~0.5mol/L的乙酸和蒸餾水透析3~5天,每天更換透析水2~4次。
優選的是,所述步驟三中,純化后進行冷凍干燥,具體為:于-70~-80℃下預凍,最后在大氣壓力為10~100Pa、溫度為-55~-70℃條件下冷凍干燥24~72h。
優選的是,所述步驟一中,所述新鮮或冷凍甲魚裙邊需先進行預處理,具體為:切碎后除雜,去除脂肪,然后用蒸餾水反復洗滌,充分瀝干后備用。
優選的是,所述超聲酶提膠原蛋白的方法包括以下步驟:
步驟一,取新鮮或冷凍甲魚裙邊,按照體積比1:10~30的比例加入質量濃度為0.3~0.6mol/L的檸檬酸溶液,按照體積百分比再加入0.25~1.5%的胃蛋白酶制得混合溶液;
步驟二,所述混合溶液進行超聲處理,其中超聲時間為30~50min;其中工作時間2s,停歇時間2~6s,超聲功率為50~300W;
步驟三,超聲結束后,于1000~3000rmp離心3~6min后取上清液;向所述上清液中添加NaCl至鹽濃度為0.6~1.2mol/L,靜置鹽析18~30h后過濾,蛋白沉淀用0.3~0.6mol/L的乙酸復溶后依次對0.1~0.5mol/L的乙酸和蒸餾水透析3~5天,每天更換透析水2~4次;于-70~-80℃下預凍,最后在大氣壓力為10~100Pa、溫度為-55~-70℃條件下冷凍干燥24~72h,制得螺旋結構Ⅰ型膠原蛋白。
本發明至少包括以下有益效果:本發明所述超聲酶提制備膠原蛋白的方法,利用超聲輔助胃蛋白酶進行酶提反應,大大縮短了反應時間,時間僅僅需要30~50min。同時,因為較短的反應時間不僅可以縮短反應時間,同時可以保證后續制備的膠原蛋白螺旋結構Ⅰ型膠原蛋白,通過驗證僅僅對螺旋結構Ⅰ型膠原蛋白的二級結構進行了有益改進,提高了制備的螺旋結構Ⅰ型膠原蛋白的溶解性,改善了制備的膠原蛋白的品質。本發明所述超聲酶提制備膠原蛋白的方法具有操作簡單,處理時間短、蛋白得率高及能耗較低等優點。
本發明所述超聲輔助酶提可適當的對膠原蛋白的高級結構進行改性,所得的膠原蛋白得率提高了15.6~27.2%,同時其溶解性提高了11.5%~15.7%。
本發明的其它優點、目標和特征將部分通過下面的說明體現,部分還將通過對本發明的研究和實踐而為本領域的技術人員所理解。
附圖說明
圖1為本發明其中一個實施例和對比例制備的甲魚裙邊膠原蛋白的紫外掃描圖譜;
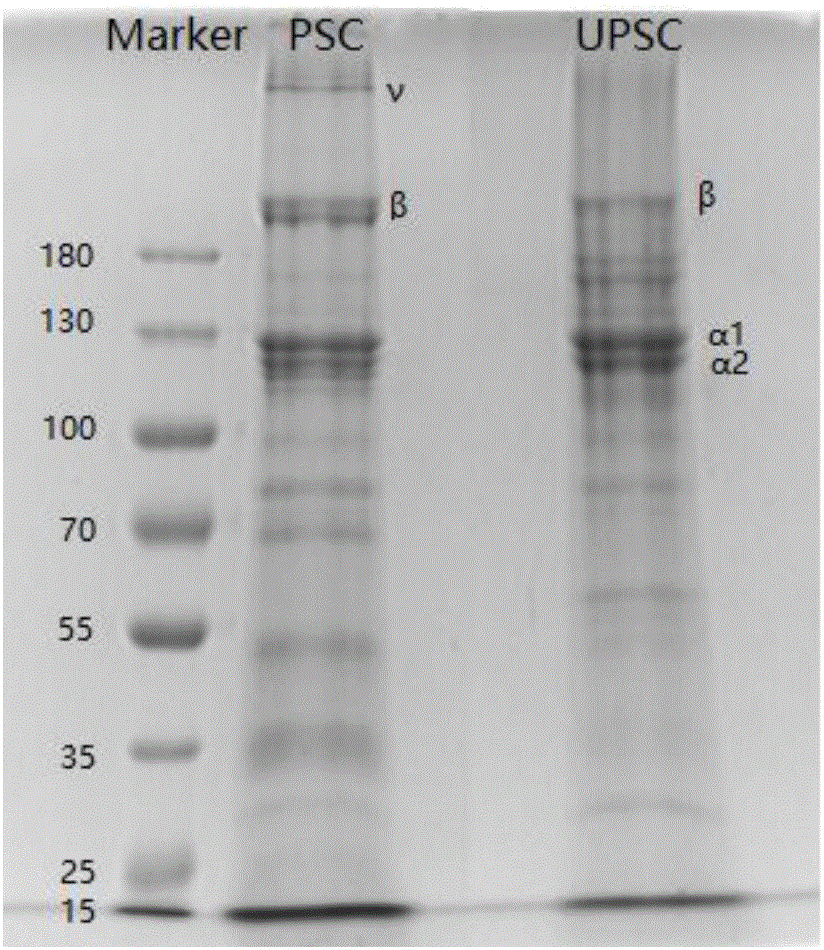
圖2為本發明其中一個實施例和對比例制備的甲魚裙邊膠原蛋白的電泳圖;
圖3為本發明其中一個實施例和對比例制備的甲魚裙邊膠原蛋白的圓二色譜圖;
圖4為本發明其中一個實施例和對比例制備的甲魚裙邊膠原蛋白的溶解度曲線圖。
具體實施方式
下面結合附圖對本發明做進一步的詳細說明,以令本領域技術人員參照說明書文字能夠據以實施。
應當理解,本文所使用的諸如“具有”、“包含”以及“包括”術語并不排除一個或多個其它元件或其組合的存在或添加。
本發明所述超聲酶提膠原蛋白的方法包括以下步驟:
步驟一,取新鮮或冷凍甲魚裙邊,切碎后除雜,去除脂肪,然后用蒸餾水反復洗滌,充分瀝干后備用。
按照體積比1:10~30的比例加入質量濃度為0.3~0.6mol/L的酸溶液,按照體積百分比再加入0.25~1.5%的胃蛋白酶制得混合溶液;所述酸溶液為檸檬酸溶液、鹽酸溶液或乙酸溶液中的一種。
步驟二,所述混合溶液進行超聲處理,其中超聲時間為30~50min;其中工作時間2s,停歇時間2~6s,超聲功率為50~300W;
步驟三,超聲結束后,于1000~3000rmp離心3~6min后取上清液;向所述上清液中添加NaCl至鹽濃度為0.6~1.2mol/L,靜置鹽析18~30h后過濾,蛋白沉淀用0.3~0.6mol/L的乙酸復溶后依次對0.1~0.5mol/L的乙酸和蒸餾水透析3~5天,每天更換透析水2~4次;于-70~-80℃下預凍,最后在大氣壓力為10~100Pa、溫度為-55~-70℃條件下冷凍干燥24~72h,制得螺旋結構Ⅰ型膠原蛋白。
實施例1
本發明所述超聲酶提膠原蛋白的方法包括以下步驟:
步驟一,取新鮮或冷凍甲魚裙邊,切碎后除雜,去除脂肪,然后用蒸餾水反復洗滌,充分瀝干后備用。
按照體積比1:10的比例加入質量濃度為0.3mol/L的檸檬酸溶液,按照體積百分比再加入0.25%的胃蛋白酶制得混合溶液;
步驟二,所述混合溶液進行超聲處理,其中超聲時間為30min;其中工作時間2s,停歇時間2s,超聲功率為100W;
步驟三,超聲結束后,于1000rmp離心3min后取上清液;向所述上清液中添加NaCl至鹽濃度為0.6mol/L,靜置鹽析18h后過濾,蛋白沉淀用0.3mol/L的乙酸復溶后依次對0.1mol/L的乙酸和蒸餾水透析3天,每天更換透析水2次;于-70℃下預凍,最后在大氣壓力為50Pa、溫度為-55℃條件下冷凍干燥24h,制得螺旋結構Ⅰ型膠原蛋白。
實施例2
本發明所述超聲酶提膠原蛋白的方法包括以下步驟:
步驟一,取新鮮或冷凍甲魚裙邊,切碎后除雜,去除脂肪,然后用蒸餾水反復洗滌,充分瀝干后備用。
按照體積比1:30的比例加入質量濃度為0.6mol/L的乙酸溶液,按照體積百分比再加入1.5%的胃蛋白酶制得混合溶液;
步驟二,所述混合溶液進行超聲處理,其中超聲時間為50min;其中工作時間2s,停歇時間6s,超聲功率為300W;
步驟三,超聲結束后,于3000rmp離心6min后取上清液;向所述上清液中添加NaCl至鹽濃度為1.2mol/L,靜置鹽析30h后過濾,蛋白沉淀用0.6mol/L的乙酸復溶后依次對0.5mol/L的乙酸和蒸餾水透析5天,每天更換透析水4次;于-80℃下預凍,最后在大氣壓力為100Pa、溫度為-70℃條件下冷凍干燥72h,制得螺旋結構Ⅰ型膠原蛋白。
實施例3
本發明所述超聲酶提膠原蛋白的方法包括以下步驟:
步驟一,取新鮮或冷凍甲魚裙邊,切碎后除雜,去除脂肪,然后用蒸餾水反復洗滌,充分瀝干后備用。
按照體積比1:20的比例加入質量濃度為0.5mol/L的檸檬酸溶液,按照體積百分比再加入1.0%的胃蛋白酶制得混合溶液;
步驟二,所述混合溶液進行超聲處理,其中超聲時間為40min;其中工作時間2s,停歇時間4s,超聲功率為200W;
步驟三,超聲結束后,于2000rmp離心5min后取上清液;向所述上清液中添加NaCl至鹽濃度為1.0mol/L,靜置鹽析25h后過濾,蛋白沉淀用0.5mol/L的乙酸復溶后依次對0.3mol/L的乙酸和蒸餾水透析4天,每天更換透析水3次;于-80℃下預凍,最后在大氣壓力為80Pa、溫度為-60℃條件下冷凍干燥48h,制得螺旋結構Ⅰ型膠原蛋白。
對比例
按照常規酶解提取甲魚膠原蛋白。
將實施例和對比例制備的膠原蛋白,進行下述實驗。
(1)得率
膠原蛋白得率(%)=(凍干后的樣品/甲魚裙邊濕重)×100
(2)膠原蛋白的紫外掃描
純化的膠原蛋白樣品溶液采用紫外分光光度計(UV-6100全波段紫外掃描分光光度計,美普達分析儀器有限公司,上海)進行掃描,波長間隔1nm,波長范圍為190~400nm。
(3)膠原蛋白的凝膠電泳(SDS-PAGE)
分離膠濃度為10%,濃縮膠濃度為4%,加入純化后的膠原蛋白于電泳儀200V電泳30min(PowerPacTM Basic,BIU RAD,Singapore),用考馬司亮藍R-250染色液(考馬斯亮藍R-250 1.0g,甲醇450mL,蒸餾水450mL,冰醋酸100mL)染色15min,脫色液(甲醇100mL,冰醋酸100mL,蒸餾水800mL)脫色并拍照。
(4)溶解性(氮溶解指數NSI)的測定
將膠原蛋白樣品0.4000g均勻分散于20mL蒸餾水中,室溫下放置30min,用0.1mol/LHCL或0.1mol/L NaOH溶液調節溶液pH值,用均質機在13400rpm下均質1min,定容至25mL,分散液以4000rpm的速度離心15min,取上清液及膠原蛋白樣品用凱氏定氮法測含氮量,公式如下:
NSI(%)=(上清液中的含氮量/樣品中總氮量)×100
結果見圖1、圖2、圖3和圖4。
與常規酶提相比,本發明所述超聲輔助酶提所制備的膠原蛋白得率提高了15.6~27.2%。
如圖1所示,對比例1和實施例1制備的裙邊膠原蛋白(PSC和UPSC)樣品溶液經紫外波譜掃描,均在220~240nm之間有強烈的吸收,符合膠原蛋白通常的紫外吸收特性,即存在膠原蛋白的特征吸收峰,且在230nm處有最大吸收峰,即為螺旋結構Ⅰ型膠原蛋白。
如圖2所示。從凝膠電泳圖譜上一次可清晰地看到在分子量130kD附近有有染色較深的2條帶(從左到右一次為Marker,常規酶提和超聲輔助酶提膠原蛋白樣品),對比例和實施例2制備的膠原蛋白均含有[(α1)2(α2)1],表明兩種方法所提裙邊膠原蛋白均為螺旋結構Ⅰ型膠原蛋白,即甲魚裙邊膠原蛋白經超聲處理后的螺旋結構并未改變。
由圖3可知,對比例1和實施例制備的兩種膠原蛋白在198nm處有負的吸收峰和220nm處有正的吸收峰。經超聲輔助提取的膠原蛋白在200~260nm的吸收強度低于常規酶提的膠原蛋白,表明超聲對膠原蛋白的二級結構產生了有一定的影響。
由圖4可知,本發明制備的膠原蛋白相較于對比例其溶解性提高了11.5%~15.7%。
盡管本發明的實施方案已公開如上,但其并不僅僅限于說明書和實施方式中所列運用,它完全可以被適用于各種適合本發明的領域,對于熟悉本領域的人員而言,可容易地實現另外的修改,因此在不背離權利要求及等同范圍所限定的一般概念下,本發明并不限于特定的細節和這里示出與描述的圖例。
- 還沒有人留言評論。精彩留言會獲得點贊!