安卡拉病毒毒株FAdV?HB及其滅活疫苗的制備和應用的制作方法
本發明涉及動物疫苗制備技術領域,具體地指一種安卡拉病毒毒株FAdV-HB及其滅活疫苗的制備和應用。
背景技術:
禽腺病毒(Fowl adenovirus)根據不同的群特異性抗原分為三個群:I群,II群和III群。I群禽腺病毒包括傳統的禽腺病毒(Fowl adenovirus,FAV)及其它禽類分離物,共12個血清型,代表株為雞胚致死孤兒病毒(chicken embryo lethal orphan,CELO)。Ⅱ群禽腺病毒包括火雞出血性腸炎病毒(HEV)、雉雞大理石脾病毒和雞大脾病毒,它們與I群禽腺病毒無抗原相關性(Domermuth et al.,1980)。Ⅲ群禽腺病毒是與減蛋綜合征(egg drop syndrome,EDS)有關的一類病毒,可從雞、雞、鵝體內分離得到,致病性差異很大(Russell W C.,1995),它們只是部分含有I群禽腺病毒的共同抗原(McFerran et al.,1978)。
I群禽腺病毒呈現世界性分布,可感染多種禽類,在鴨鵝體內多呈隱性感染,但是對雞的致病力較強。其所有12個血清型均能引起包涵體肝炎(IBH),只有血清4型禽腺病毒是心包積水肝炎綜合征(HHS)的主要病原。很多研究表明,腺病毒相關病毒(adeno-associated viruses,AAV)傳染性法氏囊病毒和雞傳染性貧血病毒可有效增強I群禽腺病毒的致病性(Fadly et al.,1976)。
心包積水-肝炎綜合征是由血清4型禽腺病毒(FAdV-4)引起的一種新型家禽疾病,其典型癥狀是導致3~5周齡肉雞突然死亡,并伴有嚴重的心包積水和肝炎,因此而得名。又因本病1987年首次于報道于巴基斯坦安卡拉地區,故該病又被稱為安卡拉病。隨后本病逐漸蔓延至世界各地,給養禽業造成巨大的經濟損失。FAdV-4具有明顯的致病年齡段,對3-5周齡的致病力最強,即可通過水平傳播也可通過垂直傳播。其主要病變為心包腔積有清亮或淡黃色的水樣或果凍狀液體,肝臟有局灶性壞死出血。病理組織切片觀察肝臟,肝細胞出現大量的嗜堿性核內包涵體。
本病主要發生于3~5周齡的肉雞、817麻雞,偶見于20周齡肉種雞和蛋雞,其中以3~7周齡的雞易發病。發病雞群多于感染后3周齡開始死亡,4~5周齡達高峰,高峰持續期4~8d,5~6周齡死亡減少。病程8~15d,死亡率高達80%。發病雞無明顯先兆而突然倒地,沉郁,羽毛成束,出現呼吸道癥狀,兩腿劃空。雞感染后可成為終身帶毒者,并可間歇性排毒。
自2014年江蘇省第一次報到禽腺病毒的爆發,本病已在全國多地集中爆發,尤其是河南湖北和山東等地,對養禽產業造成巨大損失。通過對我國流行的Ⅰ群禽腺病毒進行血清型和基因型分析,發現我國主要流行A、B、C三種基因型,共6個血清型(火雞1型、1型、4型、5型、8a/b型)。調查發現近期在豫南、皖北、蘇北、魯西北和膠東地區流行的禽腺病毒主要是血清4型和8a/b型,對雞群的致死率較高,發病急,蔓延迅速,對我國的養禽業造成了巨大的威脅。因此,研制安全有效的I群禽腺病毒滅活疫苗,為提高國內I群禽腺病毒疫苗的防控能力和防止I群禽腺病毒蔓延具有重要的使用意義。
技術實現要素:
本發明目的是提供一種安卡拉病毒毒株FAdV-HB及其滅活疫苗的制備和應用。該安卡拉病毒毒株FAdV-HB具有免疫原性好、增殖滴度高
該制備方法將FAdV-HB毒株接種在雞肝癌細胞(LMH)上,使病毒能在雞肝癌細胞(LMH)上增殖,制備出能產生較高抗體的安卡拉病毒滅活疫苗。疫苗的生產工藝、安全性、保護效果、免疫程序和有效期實驗研究表明該疫苗是安全有效的。
為實現上述目的,本發明提供的一株安卡拉病毒毒株FAdV-HB,從湖北應城發病雞場的肝臟組織樣品中分離得到,經PCR擴增,連接T載體進行測序檢測鑒定該病毒為安卡拉病毒。該毒株FAdV-HB命名為:I群禽腺病毒株FAdv-HB,該毒株于2017年1月3日送交中國.武漢.武漢大學中國典型培養物保藏中心(CCTCC)保藏,保藏編號為CCTCC NO:V201703。
上述毒株FAdV-HB的形態特征:
FAdV-HB屬于I群禽腺病毒,呈球形,病毒顆粒直徑70-90nm(電鏡圖),無囊膜,其基因組為單分子的、線狀、雙股DNA,二十面體對稱結構;DNA的分子量大小約45kb,占整個病毒粒子的11.3%~13.5%,其余部分為蛋白;病毒粒子具有252殼粒,其中二十面體的頂角殼粒為12個五鄰體(penton),每個五鄰體有二條纖維突起,長度為100A-370A,這些纖突以五鄰體為基底由衣殼表面伸出,纖突頂端形成頭節區;五鄰體和纖突的頭節區可與細胞表面的病毒受體結合,在病毒感染細胞過程中起著非常重要的作用;此外,二十面體上還有240個非頂角殼粒,稱為六鄰體(Hexon);六鄰體是病毒粒子內最大的蛋白,是禽腺病毒的主要表面抗原蛋白,含有型、型間特異性抗原表位及中和性抗原表位;病毒含有約14條多肽,多肽II為hexon,III為五鄰體;IIIa為五鄰體周圍蛋白;IV為纖維蛋白62K,V為核心蛋白;VI為六鄰體相關蛋白;VII為核心蛋白II;VIII為五鄰體相關蛋白;IX為9個六鄰體組的特異性蛋白;TP為DNA的末端蛋白。
利用上述安卡拉病毒毒株FAdV-HB制備滅活疫苗的方法,其特征在于:包括以下步驟:
1)將上述毒株FAdV-HB接種雞肝癌細胞上,培養,收獲病毒液,
2)經甲醛滅活后與礦物油佐劑混合乳化制成安卡拉滅活疫苗,用于預防安卡拉。
本發明還提供了一種上述制備得到的滅活疫苗在預防安卡拉病中的應用。
本發明的有益效果在于:
1、本發明提供FAdV-HB毒株,能在雞肝癌細胞(LMH)上穩定增殖。由這個毒株制備的毒株FAdv-HB滅活疫苗能有效預防安卡拉病。
2、本發明制備的疫苗穩定性好,試驗證明具有良好的安全性,免疫保護效果達到100%。
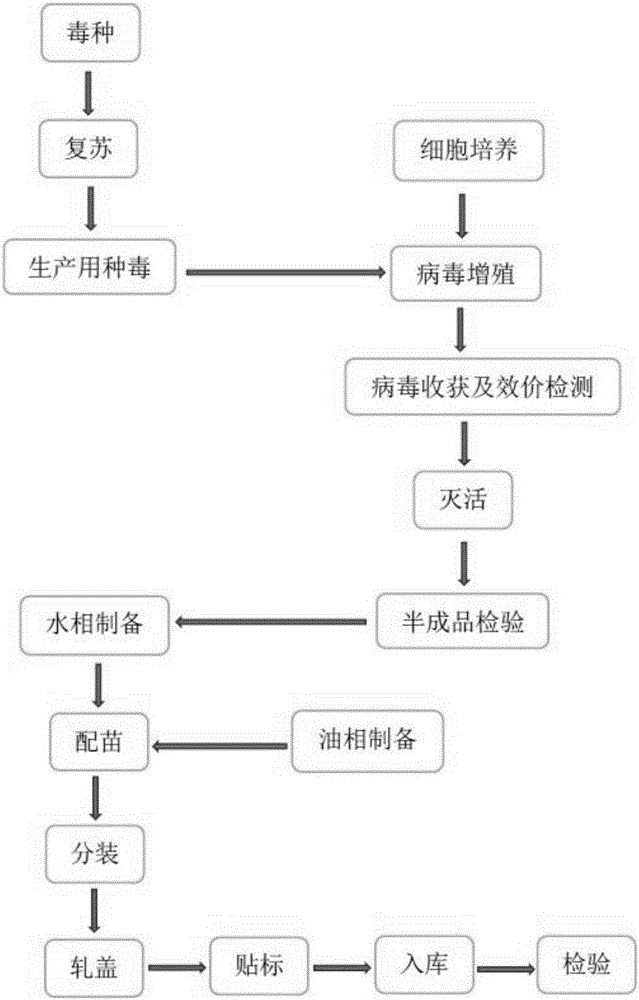
附圖說明
圖1為本發明的總體技術流程圖;
圖2為安卡拉病毒的電鏡圖;
圖3為凝膠電泳圖;
圖中,1:陰性對照、M:2000Plus Maker、2:PCR產物;
圖4為安卡拉病毒接種LMH細胞的細胞病變情況圖;
圖中,4A為正常細胞對照圖,4B為接毒后細胞病變圖
圖5為免疫雞與未免疫對照雞攻毒后剖解的病理變化圖;
圖6為遺傳進化分析圖。
具體實施方式
為了更好地解釋本發明,以下結合具體實施例進一步闡明本發明的主要內容,但本發明的內容不僅僅局限于以下實施例。
實施例1 安卡拉滅活疫苗的制備
1、FAdV-HB毒株的分離鑒定
自2013年以來,湖北,山東,河南多地肉雞場爆發一種致死率高達80%的禽病,該病多對3-5周齡肉雞致死,并且多數死雞剖檢呈現明顯心包積水和肝炎癥狀。2015年,發明人在湖北麻城雞場出現嚴重心包積水和肝炎的病死雞的臟器中成功分離到本株毒。
具體操作步驟如下:
1.1 病毒分離
無菌采集病死雞病變明顯的臟器(心臟、肝臟)剪碎勻漿后,按1:4(v/v)的比例加入滅菌PBS,反復凍融3次后3000r/min離心30min,取上清加入青鏈霉素,使終濃度均為10000單位/ml,4℃過夜。用0.22μm的濾器過濾除菌,濾過液無菌檢驗合格后-80℃低溫冰箱中保存備用。將上濾過液經卵黃囊接種6日齡SPF雞胚,0.2ml/胚,棄24h內死胚,取接種48h-168h內死亡雞胚的尿囊液和胎兒,用上述方法處理后連續傳3代,觀察第3代死胚肝臟和病變。死胚胚體縮小,出血,肝臟腫大出血。收集死胚胚體和尿囊液,-80℃保存備用。
1.2 空斑純化
將尿囊液用0.22μm的濾器過濾除菌。將LMH傳代細胞接6孔板,使其生長成無空隙的單層細胞。倒掉生長液,并用PBS液將已長好的單層細胞洗2次,2ml PBS/孔/次。加1000倍稀釋的尿囊液懸液0.5mL/孔,并使之均勻布滿于細胞表面,置37℃吸附1h。吸附結束后,用PBS液洗2次,2ml PBS/孔/次。加預溫至46~50℃的1.6%的低熔點瓊脂和2%的無酚紅的DMEM等體積混合液(加1%的胎牛血清),2mL/孔,并迅速使其均勻覆蓋于細胞層,然后4℃放置10min左右。待瓊脂完全凝固,置于37℃溫箱培養3天。當肉眼觀察到有局部病灶(即瓊脂下細胞層中有白色“斑點”)出現后,用中性紅染色液(配制濃度為1%,用時用無菌PBS 1:10稀釋,每孔加1-2mL。染色(避光操作),并使之均勻布滿于瓊脂層表面,37℃溫箱避光放置1h后,吸去中性紅染色液,即可見紅色背景下無色的蝕斑。
用白色無菌槍頭挑選較大的蝕斑于2%胎牛血清的F12維持液中,-80℃保存備用。同樣的方法接毒挑斑純化至少三代后保留毒液于-80℃備用。
1.2 病毒的鑒定
1.2.1 引物設計與合成 參照GENEBANK上公布的基因序列,設計39對引物擴增病毒全基因組,引物由武漢奧科鼎盛生物科技有限公司合成。
FADV-1F CATCATCTTATATAACCGCGTCT
FADV-1R CCTCCTCGGATCGTGTCAT
FADV-2F TTGAGCGAATCTTTACACCG
FADV-2R TCCACCATAGTTCCCTCCC
FADV-3F GTGGATTGGCGGAATAGGG
FADV-3R TTGGGTTGACGAAGTAAGAGCA
FADV-4F GCGTCCTTCTTGATCCTCG
FADV-4R CGTCCACCTGTCCTGCTTC
FADV-5F ACTTGTTCGTCTTCGGGTGTC
FADV-5R CCTGTTCCTCCAACTGCCTC
FADV-6F GGATGCTACTCTGGCGTTGT
FADV-6R CGACTCCTTTCGCTGGTG
FADV-7F GCGAGTCTGAGGGAGAAATG
FADV-7R CCACAACGAGCAGCTAACG
FADV-8F GGGGTGTTCGGTGTCGTA
FADV-8R TAGACATCATCACGCTTCACAA
FADV-9F GGGCGTTGCTGAGCATTT
FADV-9R CACCTTACCGTCCGATTTCTA
FADV-10F ATGAAACGCACAAAGACGG
FADV-10R AGACAAGTCGGGAGACATCG
FADV-11F GATGGTATCGCTGTTGGAAGTC
FADV-11R GTCACCGACAGATCCGGATTAC
FADV-12F TATCGCTGTTGGAAGTCGC
FADV-12R AGAGGAGTCGTCGTGGGTC
FADV-13F TCTATACGTGCTTTCGGTGGT
FADV-13R GCTGCGGGTTCAGTTTGA
FADV-14F TATCGCTCGGGACAGGTAGT
FADV-14R GCCGTAGTCGTAGAAGGTGC
FADV-15F TTGCTCCGCTTGTTCGTG
FADV-15R CGGTAAGTGTCCCTTAATAATGG
FADV-16F GCGGAATCAGAGGGTCGGGACT
FADV-16R ATCGGGCACCGTCAGCAAGG
FADV-17F AACGCTGCTCCCCTTTTA
FADV-17R GCCCGTAGTCAGGTCTCG
FADV-18F ACAGACAGGACGGACCAGC
FADV-18R TGCGAACCTAGACGAAACG
FADV-19F GAGATGGTGACGGAGGTG
FADV-19R CCAGTTTCTGTGGTGGTTG
FADV-20F CCAACGCCACTACCAACT
FADV-20R GAAAGCGGTGACGAGGAT
FADV-21F GTGGACCATCCCGTTCAGT
FADV-21R GCATCGAGCAGTGCGTGT
FADV-22F TGTGCGGGTGCTTGTGGT
FADV-22R GCGAGGTAGGAGGCGACTAA
FADV-23F CTGGTCGTCTTCTTCTTCGG
FADV-23R CAGAGTCGCTAGAGTGGCTAAA
FADV-24F CGGTTACTATTCGGCAGATGG
FADV-24R GATAAGCCTCGATGGTTTCCT
FADV-25F CCTTCCATCACGGTTTCG
FADV-25R TGCTCATCTGGTCCTCTTCC
FADV-26F GCCCGAAATCTACAATCCC
FADV-26R ACCTCCCATCATGCCTCC
FADV-27F CAGACCAACAGCCCTACGC
FADV-27R CGAGCACTTTGAGCACCC
FADV-28F GCCACTAAGCAAGCCAACG
FADV-28R CCTGATCCACGAGCAAGGT
FADV-29F ACGATGACTGGGAACTGGC
FADV-29R GGACAAATGGACGATCAATAAA
FADV-30F CCGCTACACCCTTCTATGCT
FADV-30R CGGTCCCTTCTGTGATTGC
FADV-31F CGGAGATTTGCGATTGTGAGT
FADV-31R TGACTCATCATGGGTGTGGC
FADV-32F ACACTAACTTCCTCATTGACCCTC
FADV-32R TGTCTGTCTGAACCTGCCTACC
FADV-33F ACGATGGCGTGATAGGCGGAGC
FADV-33R ATGAACCGTAGCCCCGCCCTTT
FADV-34F ACTACCGAGATCAGCCTGAAGA
FADV-34R CAGACTAAGGGAAAGTTGGAGAA
FADV-35F GAAATGCTTCCTCCTTCACG
FADV-35R AAGTTTATAGGGATCTCGGGTTA
FADV-36F AACCCGAGATCCCTATAAACTT
FADV-36R TAGTGCCTGTCCATTTGCC
FADV-37F TGGCAAATGGACAGGCACT
FADV-37R TTGATTCGGTGGAGGTCGT
FADV-38F CCCACTACCGCTACCACCAC
FADV-38R ATCACGCTGACGCTCCTCC
FADV-39F AGCATGAATCAACTCGGTGTC
FADV-39R CATCATCTTATATAACCGCGTCT。
1.2.2 病毒基因組的提取
取1ml收獲的雞胚尿囊液12,000r/min(4℃)離心10min,除去雜質,收集上清。參照北京全式金EsayPure Viral DNA/RNA Kit說明書提取病毒基因組,最后每200μl尿囊液的病毒DNA用20μlDEPC水溶解。
1.2.3 PCR擴增
PCR反應體系如下:基因組3μl,10×Trans Buffer 5μl,dNTP 3μl,TransTaq DNA Polymerase 1μl,上、下游引物各2μl,補H2O至50μl。按以下程序進行PCR擴增:95℃變性5min后進行94℃變性30s,55℃退火30s,72℃延伸3min的35個循壞,最后72℃延伸10min,保存于16℃。PCR產物用0.8%瓊脂糖凝膠電泳檢測。
1.2.4 PCR產物測序分析
將上述PCR擴增產物經1%瓊脂凝膠回收后,連接pMD-18T載體,篩選2個陽性克隆送武漢奧科鼎盛生物科技有限公司測序。測序結果經遺傳進化分析后,確定本發明的分離株為安卡拉病毒C種基因4型(進化分析圖)。將該毒株命名為I群禽腺病毒株FAdv-HB,于2017年1月3日送交中國.武漢.武漢大學中國典型培養物保藏中心(CCTCC)保藏,其保藏號為:CCTCC NO:V201703。
2 FAdV-HB株的特性
2.1 血凝特性試驗
紅細胞凝集特性:無菌采集SPF雞、雞以及大鼠的血液5ml,制備雞紅細胞和雞紅細胞以及鼠紅細胞,4℃備用。用常規方法檢測分離的病毒株是否具有凝集這些紅細胞的特性。結果:分離毒株對這些紅細胞均無凝集特性。
2.2 理化特性檢驗
分離毒株FAdV-HB株的理化特性:根據《動物病毒學》介紹的方法,將病毒液分別用5-溴尿嘧啶-2’-脫氧核苷(BUDR)、氯仿、乙醚、鹽酸(pH3.0)、氫氧化鈉(pH10.0)以及溫度(60℃,1h)處理后,另設PBS處理的病毒液為對照組,接種雞胚(0.2ml/胚),觀察雞胚病變,并4d后取尿囊液和組織PCR檢測。若雞胚無明顯病變,且PCR檢測為陰性則為陰性,否則為陽性。結果:分離毒株經BUDR、氫氧化鈉(pH10.0)和溫度(60℃,1h)處理后,PCR檢測結果為陰性,表明分離毒株的核酸類型為DNA,病毒不耐堿、不耐熱,60℃處理1h后即可被滅活;而經氯仿、乙醚、鹽酸(pH3.0)以及PBS處理后,PCR檢測結果為陽性,表明病毒沒有脂質囊膜,對乙醚和氯仿有抵抗力,耐酸。
2.3 瓊脂擴散試驗
按“中華人民共和國獸藥典”第三部(中國獸藥典委員會編,中國農業出版社,2010版,以下簡稱“中國獸藥典”)瓊脂擴散試驗用含0.01%硫柳汞的PBS制備1%瓊脂平板,并在其上按六角形方法打孔,孔徑為5mm,孔距為3mm。加樣時,中央孔滴加抗原,周圍孔滴加制備的安卡拉病毒標準陽性血清以及制備的標準陰性血清。抗原與陽性血清的滴加量均以孔滿為度。加樣后,將瓊脂平板置15~30℃反應48~72小時判定。抗原與制備的安卡拉病毒標準陽性血清形成明顯的沉淀線,與制備的安卡拉病毒標準陰性血清未形成沉淀線。
2.4 回歸試驗
選擇5周齡安卡拉病毒抗體陰性雛雞共10只對分離FAdV-HB株進行回歸試驗。選取5只雞大腿內側肌肉接種病毒,每只0.2ml(2.5×10-4TCID50/ml),選取5只雞做為空白對照組,注射等量的PBS。將感染試驗雞和空白對照雞分別置于不同雞欄飼養,每天觀察各組雞的采食飲水、精神狀態等,感染后第15日剖殺所有雞,觀察各個臟器的病理變化,無菌采集病料,對病料進行處理后提取病毒基因組進行PCR鑒定。
根據安卡拉病Hexon基因保守序列設計出一對鑒定引物,擴增片段為564bp,引物序列如下:
F:5’-TGCTCGTTG TGGATGGTGAA-3’
R:5’-CTC CGTGTTGGGCT GGTC-3’;
PCR反應體系如下:基因組2μl,10×Trans Buffer 2.5μl,TransTaq DNA Polymerase 0.5μl,上、下游引物各1μl,補H2O至25μl。反應程序如下:95℃變性5min后進行94℃變性30s,55℃退火30s,72℃延伸45s的35個循壞,最后72℃延伸10min,保存于16℃。PCR產物用0.8%瓊脂糖凝膠電泳檢測。
感染后逐日觀察,記錄雞的臨床表現。第3天開始部分感染雞逐漸出現臨床癥狀,主要表現為采食量下降,精神沉郁,站立不穩;病雞逐漸臥地不起,不再采食,突然倒地死亡,死亡多發生在夜間;第4天和第5天為死亡的高峰期,從第6天開始病雞群逐漸恢復精神和食欲,不再死亡。對照組雞食欲及精神狀況表現正常,未有死亡。對死亡的雞進行剖檢可觀察到:心包腔積有清亮或淡黃色的水樣,肝臟表面有局灶性壞死。第10天剖檢所有未死亡的感染試驗雞和空白對照雞,感染實驗組部分雞同樣可觀察到心包腔積有清亮或淡黃色的水樣,肝臟表面有局灶性壞死,而剖檢對照組未發現臟器病理變化。對所有試驗雞的臟器經過勻漿處理后,凍融三次,根據安卡拉病毒Hexon基因設計鑒定引物,并對組織進行PCR擴增,結果擴增出來564bp大小的目的片段,說明感染的病毒在雞體內得到了復制,是引起雞發病的致病原。
2.5 毒種傳代試驗
將分離到的安卡拉病毒株按常規方法在雞肝癌細胞(LMH)上進行傳代,當傳到第10代時,病毒的含量可達到107.5TCID50/ml。將LMH第10代的病毒液記為H1代,一直傳到H6代,并測定每一代病毒的含量,均可達到107.0TCID50/ml。
2.6 純凈性試驗
2.6.1 無菌檢驗 將上述步驟2.5得到的H6代毒種按照“中國獸藥典”規定的方法進行,利用硫乙酸鹽培養基(檢查T.G,參見中國獸藥典第三部)、酪胨瓊脂斜面(簡稱G.A,參見中國獸藥典第三部)和葡萄糖蛋白胨湯(簡稱G.P,參見中國獸藥典第三部)進行無菌檢驗。
2.6.2 支原體檢驗 將安卡拉病毒的H6代毒種接種改良Frey氏培養基(參見中國獸藥典第三部),按“中國獸藥典”規定方法進行檢驗。
2.6.3 外源病毒檢測 安卡拉病毒基礎種子批病毒液,進行適當稀釋,與安卡拉病毒高免陽性血清進行中和,中和后的病毒液按現行中國獸藥典規定的方法進行外源病毒檢測。
雞胚檢查法和細胞檢查法檢測禽流感病毒和新城疫病毒顯示安卡拉病毒基礎種子批血凝試驗為陰性,也未出現紅細胞吸附現象,表明該H6代次毒未受到禽流感病毒和新城疫病毒的污染;ELISA法檢測禽淋巴白血病病毒顯示安卡拉病毒基礎種子批S/P值小于0.2,表明該H6代次未受到禽淋巴白血病病毒的污染。結果表明安卡拉病毒基礎種子批無細菌、支原體、外源病毒污染。結果見表1,表明本發明所涉及的病毒是純凈的。
2.6.4 FAdV-HB株病毒含量測定 將LMH細胞用0.25%的胰酶消化,用含有10%胎牛血清的F12培養基將細胞吹打下來,取合適的細胞量鋪于96孔細胞培養板中,每孔100μl,置37℃、5%CO2細胞培養箱培養,待細胞形成單層后,用含有2%胎牛血清的F12細胞維持液在滅菌離心管中將病毒液作10-1~10-10連續10倍的稀釋,將稀釋好的病毒液接種到96孔微量培養板中,每一稀釋度接種一縱排共8孔,每孔接種100μl;同時設立不接毒的正常細胞對照,37℃培養3~4d,在倒置顯微鏡下觀察結果,按Reed-Muench法計算半數細胞培養感染量(TCID50)。
距離比例=(高于50%病變率的百分數-50%)/(高于50%病變率的百分數-低于50%病變率的百分數)
lgTCID50=距離比例×稀釋度對數之間的差+高于50%病變率的稀釋度的對數。
表1 安卡拉病毒HB株H6代毒種純凈、病毒含量檢測結果
2.6.5 免疫原性試驗取第H6代的病毒液,滅活前病毒含量應≥107.0TCID50/ml,滅活后按本規程制成疫苗。將20只3日齡白來航雞(SPF雞)隨機分成兩組,每組10只。免疫組頸部皮下接種該疫苗0.3ml/只,免疫四周后采血分離血清,并用ELISA方法檢測每只雞的抗體水平。采血分離血清后接種FAdV-HB株0.2ml(病毒含量為2.5×10-4.5TCID50)并觀察發病及死亡情況。在感染第10日剖殺所有雞,觀察記錄心臟及肝臟組織病理變化,根據發病判定標準統計發病情況。空白組同樣方法注射等量PBS。結果顯示免疫組10/10都能得到保護,而對照組有8/10發病。表明該代基礎種子病毒免疫原性良好,具有較好的保護效果。
發病判定標準:
(1)雞群出現精神沉郁、食欲減退,行動蹣跚、臥地不起等癥狀
(2)攻毒后10天內死亡。
(3)對攻毒后10天,未死的雞進行剖檢,出現心包積液或肝臟出血。
以上三項出現任意一項判為發病。
攻毒試驗結果見表2所述。
表2 安卡拉病毒HB毒株代免疫原性測定結果
注:“-”表示沒有發病,“+”表示發病
2.6.6 特異性試驗
經安卡拉病毒特異性血清中和后,FAdV-HB株H6代病毒液接種已長滿80%的雞肝癌細胞(LMH),72小時后細胞未出現病變,未經安卡拉病毒特異性血清中和的病毒液接種的細胞出現病變。表明病毒完全被安卡拉病毒特異性血清中和。分別經禽流感(H9)病毒特異性血清、新城疫病毒特異性血清、禽白血病病毒特異性血清中和后,FAdV-HB株H6代病毒液接種已長滿80%的LMH細胞,72小時后細胞出現病變,表明病毒不能被安卡拉病毒特異性血清中和,結果見表3。
表3 特異性試驗
2.6.7 對雞的毒力試驗
將已知病毒含量的H6代病毒液每0.2ml/只,(病毒含量為2.5×10-4.5TCID50),腿部肌肉接種3周齡雛雞10只,同時設立空白對照組10只。觀察感染后的試驗組合對照組的死亡情況,并在感染10日后剖殺所有試驗雞,觀察記錄心臟及肝臟病理變化,根據制定的發病判定標準統計發病情況,感染組發病數達到9/10,空白對照組發病數為0/10。結果表明FAdV-HB株H6代基礎種子病毒液有較強的毒力。試驗結果見表4。
表4 H6代病毒液對雞的毒力試驗結果
注:“-”表示沒有發病,“+”表示發病
3 安卡拉病毒病滅活疫苗的制備
3.1 制苗用病毒液的制備
3.1.1 傳代
制苗材料的選擇:選擇用雞肝癌細胞(LMH)作為制苗材料。
細胞傳代:將細胞從液氮罐中取出,37℃水浴使其融化,轉入細胞培養瓶中,加入細胞培養液,置37℃、5%CO2培養箱中培養,待細胞長滿單層時,加入0.25%EDTA的胰酶消化細胞,進行傳代擴大細胞。
選取長勢良好的細胞,待細胞長至80%時,棄掉原培養基,加入生產用毒種,37℃、5%CO2培養箱中培養。待細胞病變達到80%以上時,收獲細胞,-80度冰箱反復凍融3次備用。
3.1.2 病毒含量的測定 參照2.4.4測定病毒的含量,每毫升的病毒含量應≥107.0TCID50。
3.2 滅活 向檢測合格的病毒液中加入甲醛溶液,使甲醛溶液的終濃度為0.2%,邊加邊搖,使其充分混合,然后置37℃條件下滅活,從抗原液溫度升至37℃開始計時,滅活24小時。滅活完畢后,對滅活后的病毒液取樣,進行無菌檢驗及滅活檢驗,取樣后置2~8℃保存,應不超過30日。
3.3 半成品檢驗
3.3.1 無菌檢驗 取滅活的病毒液按現行《中國獸藥典》附錄進行檢驗,應無菌生長。
3.3.2 滅活檢驗
取滅活的病毒接種6日齡SPF雞胚,每枚0.2ml,置相對濕度60%-65%、溫度37℃條件下孵育。24h內死亡雞胚不計,收獲尿囊液。提取病毒基因組,PCR鑒定,應沒有預期條帶。同時設有同批未經滅活的病毒液作為對照,應出現預期大小的條帶。并盲傳1代,PCR鑒定如沒有預期條帶,即為滅活完全。
3.4 油乳劑滅活苗的制備
3.4.1 油相制備 取油94份(以毫升為單位),加入硬脂酸鋁2份(以克為單位),邊加熱邊攪拌,直到透明為止,再加入6份司本80(以毫升為單位),充分混勻,高壓滅菌后冷卻至室溫備用。
3.4.2 水相制備 取檢驗合格的滅活病毒液,使每羽份終產品中抗原含量≥1.7×107.0EID50。按每100份病毒液加入4份滅菌的吐溫80,直到吐溫80徹底溶解。
3.4.3 乳化 將1份油相注入乳化罐內,慢速攪拌同時緩緩加入1份水相,加完后,中速混合,然后高速乳化。在乳化終止前加入1%硫柳汞液,使其終濃度為0.01%。
3.4.4 分裝 將乳化好的疫苗定量分裝,加蓋密封。貼標簽,置2~8℃保存。
4 成品檢驗
4.1 性狀
外觀 乳白色乳狀液。
劑型 為油包水型。取一清潔吸管,吸取少量疫苗滴于冷水中,除第一滴呈云霧狀擴散外,以后各滴均不應擴散。
穩定性 取10ml疫苗裝于試管內,以3500r/min離心15分鐘,應不出現破乳現象,但允許出現輕微分層,管底析出水相層深度不超過0.5ml為合格。
粘度 用1ml吸管(下口內徑為1.2mm,上口內徑為2.7mm),吸取25℃左右的疫苗lml,令其垂直自然流出,記錄流出0.4ml所需時間,應不超過8秒。
4.2 無菌檢驗 按《中國獸藥典》附錄15頁進行檢驗,應無菌生長。
4.3 安全檢驗 頸部皮下免疫1-3日齡安卡拉病毒抗體陰性雞(S/P<0.5)10只,每只0.3ml,觀察14日,結果顯示無不良反應,且全部健活。
4.4 效力檢驗 可采用血清學方法和免疫保護性試驗進行檢驗。
血清學方法選取1-3日齡安卡拉病毒抗體陰性雞(S/P<0.5)10只,每只頸部皮下接種疫苗0.3ml。14日后,連同相同條件下飼養的非免疫對照雞10只,分別采血分離血清,用酶聯免疫吸附試驗(ELISA)測定血清抗體,10只免疫雞的抗體均為陽性(S/P≥0.5),10只非免疫對照雞的抗體均為陰性(S/P<0.5)。
免疫保護性試驗 選1-3日齡安卡拉病毒抗體陰性雞(S/P<0.5)10只,每只肌肉注射疫苗0.3ml。免疫14日后,連同非免疫對照雞10只用FAdV-HB株進行腿部部肌肉接種,每只0.2ml(病毒含量為2.5×10-4.5TCID50),感染后第10日剖殺所有雞觀察心臟及肝臟病理變化,統計發病情況。免疫雞應至少8只保護,對照組應至少8只發病。
發病判定標準:
(1)出現精神不振、行動蹣跚、臥地不起、羽毛雜亂等
(2)攻毒后10天內死亡。
(3)對攻毒后10天,未死的雞進行剖檢,出現心包積液或肝臟出血。
以上三項出現任意一項判為發病。
實施例2 安卡拉病毒病活疫苗的安全性試驗
1 疫苗與試驗動物
用本發明人試制的安卡拉滅活疫苗,批號分別為0101、0102、0103。供試用的雞品種為白來航,由山東濟南斯派福瑞禽業科技有限公司提供。
2 疫苗的安全性試驗
本實施例檢測了以上3批實驗室疫苗的安全性,對白來航雛雞進行免疫,用于檢測該批實驗室疫苗對白來航雛雞的安全性,包括疫苗對白來航雛雞一次單劑量接種的安全性、單劑量重復接種的安全性和一次超劑量接種的安全性。
2.1 對白來航雛雞一次單劑量接種的安全性
將三批疫苗以單劑量分別接種1-3日齡雛雞(白來航)后,雛雞采食、臨床癥狀等均表現正常,未見異常變化,疫苗免疫后14日接種部位也未見異常變化,說明該疫苗對白來航雛雞單劑量接種安全性好。(表5)
表5 三批疫苗單劑量接種白來航雛雞的安全性檢測
2.2 對白來航雛雞單劑量重復接種的安全性
將三批疫苗以單劑量分別接種1-3日齡白來航雛雞后,間隔14日后每只再以單劑量重復接種0.3ml疫苗,繼續觀察14日,觀察雞群的臨床癥狀及采食,結果顯示白來航雛雞在單劑量重復接種疫苗后采食、臨床癥狀等均表現正常,未見異常變化,疫苗免疫后28日接種部位也未見異常變化,說明該疫苗對白來航雛雞單劑量重復接種安全性好。(表6)
表6 三批疫苗單劑量重復接種白來航雛雞的安全性檢測
2.3 對白來航雛雞一次超劑量接種的安全性
將三批疫苗以超劑量分別接種1-3日齡白來航雛雞后,雛雞采食、臨床癥狀等均表現正常,未見異常變化,疫苗免疫后14日接種部位也未見異常變化,說明該疫苗對雛雞一次超劑量接種安全性好。(表7)
表7 三批疫苗一次超劑量劑量接種白來航雛雞的安全性檢測
實施例3 安卡拉滅活疫苗的疫苗效力試驗
1 安卡拉滅活疫苗與試驗動物
用本發明人試制的3批安卡拉滅活疫苗,批號分別為0101、0102、0103。安卡拉病毒抗體陰性的1-3日齡健康雛雞為實驗動物,由濟南斯派福瑞禽業科技有限公司提供。
2 實驗方法
將40只1-3日齡健康雛雞隨機分為4組,每組10只,實驗室制備的三批疫苗(批號為0101、0102、0103)每批免疫1組,每只腿部肌肉注射疫苗0.3ml。剩下1組為相同條件下的非免疫對照。
3 免疫保護性試驗
3.1 抗體水平檢測
免疫14日后對30只免疫抗體監測組雞群連同非免疫對照雞10只進行翅靜脈采血,待血清析出后3000rpm離心5min分離血清,血清-20℃保存或立即用I型禽腺病毒ELISA檢測方法檢測抗體水平。
結果顯示三批疫苗免疫雞的抗體水平(S/P值)都能達到0.5以上,其中0101批疫苗免疫雞平均抗體(S/P值)為2.209,0102批疫苗免疫雞平均抗體(S/P值)為2.187,0103批疫苗免疫雞平均抗體(S/P值)為2.172,表明三批疫苗都能產生較高的抗體水平,且三批疫苗免疫雞產生的抗體水平基本一致,無顯著批間差異(P>0.05)。(結果見表8)
3.2 免疫保護力試驗
免疫14日采血后,三個免疫組連同對照組共40只雞,于腿部肌肉接種FAdV雞胚適應毒株0.2ml(病毒含量為2.5×10-4.5TCID50)。感染10日后剖殺所有雞并觀察記錄心臟及肝臟的組織病理變化,根據制定的發病判定標準統計發病情況。非免疫對照組雞會出現采食量下降,精神沉郁,站立不穩;病雞逐漸臥地不起,不再采食等臨床癥狀,10日后剖殺雞會出現安卡拉的典型病理變化,如心包腔積有清亮或淡黃色的水樣,肝臟表面有局灶性壞死(見圖5)。根據制定的發病判定標準統計各組雞的發病情況以及疫苗的保護力。
統計數據顯示0101批次的疫苗能使8/10的試驗雞得到保護,0102批次的疫苗能使9/10的試驗雞得到保護,0103批次的疫苗能使8/10的試驗雞得到保護,而非免疫對照組8/10發病。結果表明三個批次的疫苗都能產生良好的免疫保護效果(結果見表8)。
發病判定標準:
(1)出現精神不振、行動蹣跚、臥地不起、羽毛雜亂等
(2)攻毒后10天內死亡。
(3)對攻毒后10天,未死的雞進行剖解觀察病變,若出現心包積液或肝臟出血。以上三項出現任意一項判為發病。
表8 三批疫苗免疫35日后ELISA抗體水平及攻毒保護情況
注:“-”表示沒有發病,“+”表示發病
其它未詳細說明的部分均為現有技術。盡管上述實施例對本發明做出了詳盡的描述,但它僅僅是本發明一部分實施例,而不是全部實施例,人們還可以根據本實施例在不經創造性前提下獲得其他實施例,這些實施例都屬于本發明保護范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!