志賀氏菌的IC?LAMP檢測引物組及其應用的制作方法
本發明屬于生物技術領域,具體涉及一種用于志賀氏菌檢測的引物組、試劑盒和志賀氏菌的ic-lamp檢測方法。
背景技術:
志賀氏菌為革蘭陰性桿菌,是人類細菌性痢疾最為常見的病原菌。志賀菌可穿入低位腸段的粘膜,引起粘液分泌、充血、白細胞浸潤、水腫,并常有表淺粘膜潰瘍。急性典型菌痢癥狀,有腹痛腹瀉、膿血粘便、里急后重、發熱等呈現嚴重的全身中毒癥狀。
志賀菌屬是主要的腸道病原菌之一,也是引起人類細菌性痢疾的病原體。本屬細菌分布于全世界,是炎癥性痢疾的典型病原菌,很多地區5%~10%的腹瀉性疾病是由該菌屬所致。弗氏志賀菌和宋內志賀菌比鮑氏志賀菌和毒力特別強的痢疾志賀菌分布更廣。志賀菌廣泛存在于食品中,大量食入,會引起嚴重后果。因此,快速準確地檢測出志賀氏菌就顯得尤為重要。
目前臨床應用的志賀氏菌的檢測方法包括細菌分離鑒定、免疫學方法、分子生物學檢測方法等,但這些方法都存在一些缺陷。傳統的檢測方法主要采用細菌前增菌培養、分離培養、菌落形態觀察和一系列的生化鑒定以及血清型鑒定等步驟,一般需4至7天,此方法培養時間長、工作量大、實驗步驟繁瑣,在很多突發事件中不能及時反映準確的數據。免疫學方法易污染,且交叉反應比較嚴重、假陽性多、靈敏度偏低。常規pcr方法檢測其靈敏度低,檢測時間長,需要昂貴的pcr儀器以及電泳儀、凝膠成像儀等配套儀器并且在檢測前還需要進行菌體的富集,dna的提取。免疫磁分離技術是將特異性抗體與一定大小的磁珠偶聯,利用特異性抗體能與細胞表面抗原相結合的原理,將磁球與細胞結合,在外磁場的作用下,將磁球-細胞復合物從環境中分離出來,達到獲取目標細胞的一項技術,但是單獨使用該技術時只能實現分離,還需結合其他手段進行檢測,而目前使用免疫磁分離技術進行分離的檢測方法的靈敏度仍有待提高。
技術實現要素:
本發明目的在于提供了一種用于檢測志賀氏菌的ic-lamp特異性引物組,它包括正向內引物fip、反向內引物bip、正向外引物f3、反向外引物b3,各引物序列如下:
fip:5'-ctgtcgaagctccgcagaggttttggattccgtgaacaggtcg-3';(如seoidno:1所示)
bip:5'-ctttcgctgttgctgctgatgcttttccggagattgttccatgtga-3';(如seoidno:2所示)
f3:5'-ataccgtctctgcacgca-3';(如seoidno:3所示)
b3:5'-gccttctgatgcctgatgg-3';(如seoidno:4所示)。
本發明另一目的是提供一種志賀氏菌的ic-lamp檢測試劑盒,其包括權利要求1所述的志賀氏菌的ic-lamp檢測引物組和結合有志賀氏菌特異抗體的proteina/g偶聯磁珠。
其中結合有志賀氏菌特異抗體的proteina/g親和磁珠是采用proteina/g可以特異性的與抗體fc段結合的原理制備的,具體參考proteina/g免疫沉淀磁珠(美國biotool,貨號:b23202)產品說明書所述方法制得。
本發明試劑盒還包括常規lamp檢測中所需的常規試劑,例如2×isothermalmastermix、無核酸酶水。
本發明將環介導等溫擴增技術(lamp)與免疫磁珠相結合,針對志賀氏菌重要的毒性基因ipah基因設計一套引物,優化反應條件,建立志賀氏菌ic-lamp檢測技術。
本發明另一目的是提供了一種志賀氏菌檢測的新方法,利用proteina/g免疫沉淀磁珠與志賀氏菌的多克隆抗體偶聯形成免疫磁珠去捕捉樣品中的志賀氏菌,然后通過直接裂解法獲得基因組,通過環介導等溫擴增,確認是否存在有志賀氏菌擴增產物。
所述的待測樣品可以是被志賀氏菌污染的水、食品及人和動物的糞便及咽拭子/肛拭子等。
檢測方法具體步驟如下:
(1)待測樣品的制備,將待測樣品用已經滅菌的lb液體培養基進行稀釋;
(2)在待測樣品中添加結合有志賀氏菌特異抗體的proteina/g偶聯磁珠,混勻后進行磁性分離,棄上清液,然后加入pbs-t溶液重懸后再進行磁性分離,重復2-3次;
(3)采用直接裂解法裂解步驟(2)中捕獲菌體的基因組dna,即在步驟(2)獲得的磁珠-抗體-抗原的復合物中加入裂解液進行裂解,然后加入終止液終止反應;
(4)采用針對志賀氏菌的ic-lamp檢測引物組對獲得基因組dna進行環介導等溫擴增,反應體系:15μl2×isothermalmastermix、2μl的10mm正向內引物fip、2μl的10mm反向內引物bip、0.25μl的10mm反向外引物b3、0.25μl的10mm正向外引物f3、步驟(3)裂解液模板1-6μl,加無核酸酶水補至終體積25μl;反應條件:65℃擴增30min,80℃-98℃變性10min,終止反應;
(5)擴增產物利用紫外檢測系統、色素法或熒光法檢測(根據不同的顯色法加入不同的顯色劑),判斷是否存在志賀氏菌;檢測方法均為常規檢測法。
例如擴增反應結束后,直接在紫外燈下觀察結果(擴增前顯色劑即加入擴增的pcr管中);結果判定:pcr管中樣品在紫外照射下出現綠色熒光,檢測結果為陽性,則說明樣品中含有志賀氏菌;pcr管中樣品在紫外照射下不出現綠色熒光,檢測結果為陰性,則說明樣品中不含有志賀氏菌。
實驗結果表明:采用本發明所公開的志賀氏菌的ic-lamp特異性引物組制備的試劑盒在檢測志賀氏菌方面ic-lamp具有良好的積極效果。
本發明公開的用于檢測志賀氏菌的試劑盒與現有技術相比所具有的積極效果在于:
(1)本發明采用的lamp技術具有操作簡便、快速、敏感等特點,其敏感性比常規pcr高數倍以上;而且檢測過程只需恒溫水浴鍋和便攜式磁力架即可完成,不需要pcr儀等昂貴的設備(恒溫水浴鍋即可),更適合于基層推廣應用。此外,本發明將lamp技術與免疫磁珠技術相結合,可以通過肉眼直接觀察和判定結果,僅需30min,比傳統的生化培養法節省3天,比提取基因組進行pcr方法(瓊脂糖凝膠電泳)縮短3h,且不需要對菌體進行富集,提取其基因組等,使檢測更為便捷、高效;
(2)基于ic-lamp方法的敏感、特異,成本低廉,便于操作等諸多優勢,本發明在一定程度上提高了我國志賀氏菌菌株的檢測能力,為志賀氏菌疾病的臨床實時快速診斷、動物和食品的出入境檢驗檢疫中該菌的快速準確檢測提供了新技術來源,對提高我國檢驗檢疫機構志賀氏菌的疫情監控和快速檢測水平,以及普及先進技術在基層檢驗檢疫機構的推廣應用均具有重要意義。特別對于糞便等特殊樣品的檢測,此方法解決了從糞便等特殊樣品中菌體的獲取、富集的難題,其靈敏度比利用普通檢測方法如pcr、多重熒光定量pcr等方法高。
附圖說明
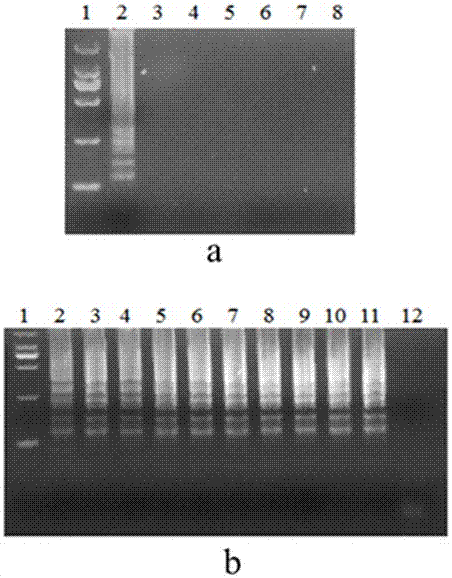
圖1(a)為利用正向外引物f3、反向外引物b3進行pcr鑒定體系的特異性檢測結果,泳道2的反應模板為志賀氏菌的基因組;泳道3至泳道7依次為大腸桿菌、金黃色葡萄菌、沙門氏菌、李斯特桿菌、銅綠假單胞桿菌基因組;泳道8為去核酸酶水作為模板的陰性對照;(b)利用正向外引物f3、反向外引物b3進行pcr鑒定體系的靈敏度檢測結果,其反應模板為質粒,泳道2-10其質粒濃度依次為109、108、107、106、105、104、103、102、101、100copies/ml,泳道11為去核酸酶水作為模板的陰性對照;
圖2(a)為利用正向外引物f3、反向外引物b3、正向內引物fip、正向反向內引物bip進行lamp鑒定體系的特異性檢測結果,泳道2的反應模板為志賀氏菌的基因組,泳道3至泳道7依次為大腸桿菌、金黃色葡萄菌、沙門氏菌、李斯特桿菌、銅綠假單胞桿菌基因組,泳道8為去核酸酶水作為模板的陰性對照;(b)為本發明lamp鑒定體系的靈敏度檢測結果,其反應模板為質粒,泳道2-11其濃度依次為100、101、102、103、104、105、106、107、108、109copies/ml,泳道12為去核酸酶水作為模板的陰性對照;
圖3為本發明ic-lamp鑒定體系的特異性檢測結果,曲線1-4的反應模板為利用免疫磁珠捕獲含有志賀氏菌的混合菌(分別混合大腸桿菌、金黃色葡萄菌、沙門氏菌、銅綠假單胞桿菌)的裂解液,曲線5-8為利用免疫磁珠捕獲混合菌種大腸桿菌、金黃色葡萄菌、沙門氏菌、銅綠假單胞桿菌的裂解液;
圖4為本發明ic-lamp鑒定體系的靈敏度檢測結果,其反應模板為污染樣品的裂解液,曲線1是未用免疫磁珠捕獲污染樣品的裂解液,菌濃度為8.7×100cfu/ml,曲線2-7是用免疫磁珠捕獲污染樣品的裂解液,菌濃度分是8.7×105,8.7×104,8.7×103,8.7×102,8.7×101,8.7×100cfu/ml,曲線8為去核酸酶水作為模板的陰性對照。
具體實施方式
下面結合附圖和實施例對本發明作進一步詳細說明,但本發明保護范圍不局限于所述內容,實施例中使用的試劑和方法,如無特殊說明,均采用常規試劑和使用常規方法。
實施例1:特異性靶基因的引物設計
1、本地blast分析
從ncbi(http://www.ncbi.nlm.nih.gov/genome/)中下載的志賀氏菌ipah基因,對本地的核酸數據庫進行本地blast檢索,獲取得到菌種各序列片段與數據庫比對結果。
2、引物設計
本試驗以基因名ipah,genbank登陸號為m32063.1(251..1849)的序列設計特異引物。針對ipah基因的3'端的f3c、f2c和flc區以及5'端的bl、b2和b3區6個不同的位點設計4種引物,包括一對內引物(fip、bip)和一對外引物(f3、b3),該引物用于lamp技術檢測,其中外引物還用作pcr反應的上、下游引物,用于志賀氏菌的鑒定。
實施例2:lamp檢測方法的建立
1、dna的提取
(1)用北京莊盟國際生物基因科技有限公司的細菌基因組dna小量提取試劑盒進行抽提回收,步驟如下:
1)取志賀氏菌培養液5ml,12000rpm離心1分鐘,盡量吸凈上清;
2)向留有菌體沉淀的離心管中加入500μl細胞懸浮液,使用移液器或渦旋振蕩器徹底懸浮細菌細胞沉淀,37℃溫浴30分鐘;每隔10分鐘顛倒混勻數次;12000rpm離心2分鐘,盡量吸凈上清;
3)向菌體沉淀中加入225μl緩沖液a,振蕩至菌體徹底懸浮;
4)向管中加入6μlrnasea溶液,振蕩15秒,室溫放置5分鐘;
5)向管中加入10μl蛋白酶k溶液,顛倒混勻;
6)加入25μl裂解緩沖液s,顛倒混勻;
7)加入250μl緩沖液b,振蕩10秒,70℃放置10分鐘。12,000rpm離心1分鐘,取上清放入一新管中,棄去沉淀;
8)加入250μl無水乙醇,充分振蕩混勻15秒,此時可能會出現絮狀沉淀,瞬時離心以去除管蓋內壁的水珠;
9)將上一步所得溶液和絮狀沉淀都加入一個吸附柱中(吸附柱放入收集管中),12000rpm離心30秒,倒掉廢液,將吸附柱放入收集管中;
10)向吸附柱中加入500μl緩沖液c,12000rpm離心30秒,倒掉廢液,將吸附柱放入收集管中;
11)向吸附柱中加入700μl漂洗液w2,12000rpm離心30秒,倒掉廢液,將吸附柱放入收集管中;
12)向吸附柱中加入500μl漂洗液w2,12000rpm離30秒,倒掉廢液,將吸附柱放回收集管中;然后12000rpm離心2分鐘,將吸附柱置于一個新的1.5ml離心管中,室溫放置數分鐘,以徹底晾干吸附材料中殘余的漂洗液;
13)將吸附柱轉入一個干凈的離心管中,向吸附膜的中間部位懸空滴加100μl洗脫緩沖液te,室溫放置2分鐘,12000rpm離心2分鐘,將溶液收集到離心管中。
(2)使用直接裂解液,其配方為:
溶液a:125mmnaoh、1mmedta、0.1%tween20;
溶液b:125mmhcl、10mmtrishcl;
取志賀菌樣加入10μl溶液a65℃孵育10min,加入10μl溶液b,混勻即可。
2、陽性質粒載體構建及獲得
(1)靶序列pcr擴增
以志賀氏菌的基因組dna為模板,對特異基因進行pcr擴增,將其擴增產物進行瓊脂糖凝膠電泳驗證。
(2)目的產物的回收
從脂糖凝膠中切下目的片段,用北京莊盟國際生物基因科技有限公司的小量瓊脂糖凝膠dna回收試劑盒進行抽提回收,步驟如下:
1)將單一的目的dna條帶從瓊脂糖凝膠中切下(盡量切除多余部分)放入干凈的離心管中,稱取重量;
2)向膠塊中加入2倍體積溶膠液,55℃水浴10分鐘,其間不斷溫和地上下翻轉離心管,以確保膠塊充分溶解;
3)將上一步所得溶液加入一個吸附柱中,12,000rpm離心1分鐘,倒掉收集管中的廢液,將吸附柱放入收集管中;
4)向吸附柱中加入700μl漂洗液w2,12,000rpm離心1分鐘,倒掉收集管中的廢液,將吸附柱放入收集管中;
5)向吸附柱中加入50μl漂洗液w2,12,000rpm離心1分鐘,倒掉收集管中的廢液,將吸附柱放入收集管中;
6)將吸附柱放入收集管中,12,000rpm離心2分鐘,盡量除去漂洗液;
7)將室溫吸附柱置于室溫放置數分鐘,徹底晾干。將吸附柱放入到一個干凈離心管,向吸附柱中間懸空滴加30μl的洗脫緩沖液te,室溫放置2分鐘。12,000rpm離心2分鐘,收集dna溶液。
(3)連接、轉化及篩選
1)大腸桿菌dh5α感受態細胞的制備
①挑取單個dh5α菌落,接種于3ml不含氨芐青霉素的lb培養基中,37℃培養過夜,次日取上述菌液按比例1:100再接種于50mllb培養基中,37℃振蕩2小時。當od600值達到0.35時,收獲細菌培養物;
②將細菌轉移到一個50ml預冷的無菌聚丙烯管中,冰上放置10分鐘,使培養物冷卻;
③于4℃下4100rpm離心10分鐘,吸出培養液,并將管倒置l分鐘以使殘留的培養基流盡;
④每50ml初始培養液用30ml預冷的0.1mol/lcacl2-mgcl2溶(80mmol/lmgcl2,20mmol/lcacl2)重懸細胞沉淀;
⑤于4℃下4100rpm離心10分鐘,吸出上清液,并將管倒置l分鐘以使殘留的液體流盡;
⑥每50ml初始培養物用2ml預冷的0.1mol/lcacl2溶液重懸細胞沉淀,分裝后備用。
2)連接到pmd19-tsimple
①在微量離心管中加入1μltakarapmd19-tsimple載體、4μl目的基因基因pcr產物及5μl的連接酶緩沖混合物;
②16℃反應過夜。
3)轉化dh5α
①全量(10μl)加入至100μldh5α感受態細胞中,冰中放置30分鐘;
②42℃加熱90秒后,再在冰中放置1分鐘;
③加入37℃溫浴過的lb培養基890μl,37℃緩慢振蕩培養60分鐘;
④取200μl涂布于含有氨芐青霉素的lb培養基上,37℃培養16h以形成單菌落;
(4)陽性克隆的篩選
挑取上述單菌落于含氨芐青霉素的lb培養基中,37℃緩慢振蕩培養4h,以m13f(tgtaaaacgacggccagt)和m13r(caggaaacagctatgacc)為引物進行菌落pcr擴增。對擴增產物用1.5%瓊脂糖凝膠電泳后紫外觀察,將經pcr驗證正確的陽性克隆送昆明碩擎生物科技有限公司進行測序。
(5)陽性質粒提取
挑取上述單菌落于lb培養基中,37℃緩慢振蕩培養4h,進行pcr擴增;擴增引物f3(ataccgtctctgcacgca)、b3(gccttctgatgcctgatgg),擴增條件:95℃,5min;95℃,30s;46℃,30s;72℃,30s;72℃,7min;16℃,∞;將經pcr確證的陽性克隆,接種于lb液體培養基,37℃,160rpm培養過夜。取每個菌株過夜培養液5ml,用北京莊盟國際生物基因科技有限公司小量質粒提取試劑盒進行質粒抽提,具體操作步驟如下:
1)取5ml過夜培養的菌液,加入離心管中,12,000rpm離心1分鐘,盡量吸除上清;
2)向留有菌體沉淀的離心管中加入250μl溶液1,使用移液器或渦旋振蕩器徹底懸浮細菌沉淀;
3)向離心管中加入250μl溶液2,溫和地上下翻轉6-8次使菌體充分裂解;
4)向離心管中加入350μl溶液3,立即溫和地上下翻轉6-8次,充分混勻,即出現白色絮狀沉淀。12,000rpm離心10分鐘,此時在離心管底部形成沉淀。將上一步收集的上清液用移液器轉移到吸附柱中,12,000rpm離心60秒,倒掉收集管中的廢液,將吸附柱放入收集管中;
5)向吸附柱中加入700μl漂洗液w2,12,000rpm離心30-60秒,倒掉收集管中的廢液,將吸附柱放入收集管中;
6)向吸附柱中加入500μl漂洗液w2,12,000rpm離心60秒,倒掉收集管中的廢液,將吸附柱放入收集管中;
7)將吸附柱放入收集管中,12,000rpm離心2分鐘,置于室溫放置數分鐘,以徹底晾干吸附材料中殘余的漂洗液;
8)將吸附柱置于一個干凈的離心管中,向吸附膜的中間部位滴加60μl洗脫緩沖液te,室溫放置2分鐘,12,000rpm離心1分鐘將質粒溶液收集到離心管中。
(6)陽性質粒濃度測定
打開thermoscientificbiomate3s紫外分光光度計,預熱15分鐘;選定mode方式為dsdna,將比色杯用超純水反復洗幾次后加入100μlte緩沖液調零;將te緩沖液完全吸出,然后加入待測樣品(1μl樣品加入99μlte緩沖液),選定稀釋倍數為100倍進行測定,讀取質粒dna濃度。
(7)質粒數目換算及梯度稀釋
陽性質粒測完濃度后,分別根據其所測濃度換算成質粒數目。質粒數目換算公式為
3、菌落計數
(1)菌液的培養
配制lb固體培養基,用高壓蒸汽滅菌鍋滅菌121℃,20min。將在-80℃冰箱中保藏的志賀氏菌種接種于新鮮的lb液體培養基,37℃震蕩培養12小時。
(2)稀釋平板計數法計數及其步驟
1)熔化培養基;
2)倒平皿;
3)梯度稀釋法稀釋原菌樣品;
4)涂平皿:
選取1/106,1/107,1/108三個稀釋度計數,每皿取菌液0.1ml,用玻璃刮鏟涂布均勻,每個稀釋度做一個重復;
5)37℃倒置培養1天;
6)計數:
每1ml原菌樣品中微生物的活細胞數(菌落形成數,cfu=(同一稀釋度平板上菌落平均數×稀釋倍數)/原菌樣品體積(ml);
結果:圖1(a)為利用正向外引物f3、反向外引物b3進行pcr鑒定體系的特異性檢測結果,泳道2的反應模板為志賀氏菌的基因組;泳道3至泳道7依次為大腸桿菌、金黃色葡萄菌、沙門氏菌、李斯特桿菌、銅綠假單胞桿菌基因組;泳道8為去核酸酶水作為模板的陰性對照;(b)利用正向外引物f3、反向外引物b3進行pcr鑒定體系的靈敏度檢測結果,其反應模板為質粒,泳道2-10其質粒濃度依次為109、108、107、106、105、104、103、102、101、100copies/ml,泳道11為去核酸酶水作為模板的陰性對照;
圖2(a)為利用正向外引物f3、反向外引物b3、正向內引物fip、正向反向內引物bip進行lamp鑒定體系的特異性檢測結果,泳道2的反應模板為志賀氏菌的基因組,泳道3至泳道7依次為大腸桿菌、金黃色葡萄菌、沙門氏菌、李斯特桿菌、銅綠假單胞桿菌基因組,泳道8為去核酸酶水作為模板的陰性對照;(b)為本發明lamp鑒定體系的靈敏度檢測結果,其反應模板為質粒,泳道2-11其濃度依次為100、101、102、103、104、105、106、107、108、109copies/ml,泳道12為去核酸酶水作為模板的陰性對照。
4、建立ic-lamp鑒定體系
(1)志賀氏菌的培養
取出凍存的菌液進行lb平板劃線,于37℃恒溫培養箱培養過夜。第二天挑取單克隆于lb液體培養基中37℃,180轉/小時培養4-5小時。
(2)志賀氏菌多克隆抗體的制備
將培養好的菌液稀釋到108cfu/ml,并進行滅活,取100μl與等體積的弗氏完全佐劑混合均勻免疫bab/c小鼠;第一次免疫后14天進行第二次免疫,取100μl與等體積的弗氏不完全佐劑混合均勻免疫bab/c小鼠;第三,四次免疫與第二次免疫相同;第四次免疫4天后摘眼球取血分離多抗血清。
(3)利用免疫磁珠捕獲抗原
(a)抗原的準備:分別用巴氏滅菌的脫脂奶粉稀釋菌液至終濃度8.7×105、8.7×104、8.7×103、8.7×102、8.7×101和8.7×100cfu/ml。
(b)磁珠預處理:將免疫沉淀磁珠(proteina/g偶聯磁珠)漩渦振蕩1min,使磁珠充分振蕩重懸;取25~50μl(相當于25~50μg)磁珠懸液置于1.5mlep管中;加入200μl磷酸鹽緩沖液(pbs:nacl137mmol/l、kcl2.7mmol/l、na2hpo410mmol/l、kh2po42mmol/l、ph7.4)洗滌,進行磁性分離(將ep管放置于磁力架上,使磁珠被吸附在管壁至溶液澄清;該操作描述以下省略),棄上清液,從磁性分離器上取下ep管,重復洗滌一次,最后加入200μl結合緩沖液重懸磁珠以備用。
(c)抗體結合反應:將步驟(b)預處理的磁珠懸液進行磁性分離加入300μl的志賀氏菌抗體(1:1000),于37℃100轉/分鐘反應2小時。然后進行磁性分離,加入1ml的pbs-t重懸后磁性分離(此步驟重復3次)。
(d)抗原沉淀反應:將步驟(a)抗原加入步驟(c)的結合有志賀氏菌特異抗體的proteina/g偶聯磁珠溶液中,于37℃100轉/分鐘反應0.5小時;然后進行磁性分離,加入1ml的pbs-t重懸后磁性分離(此步驟重復3次)。
(e)抗原的裂解:將步驟(d)中的磁珠-抗體-抗原的復合物中加入10μl的a液(125mmnaoh、1mmedta、0.1%tween20)于65℃反應10分鐘,最后加入10μl溶液b終止反應。
(4)特異性檢測
分別用免疫磁珠(結合有志賀氏菌特異抗體的proteina/g偶聯磁珠)捕獲含有志賀氏菌、大腸桿菌、金黃色葡萄菌、沙門氏菌、銅綠假單胞桿菌混合菌液及不含有志賀氏菌的混合菌液,捕獲完成后進行直接裂解;各取6μl作為模板進行ic-lamp反應。在儀器genieii中的反應體系為:15μl2×isothermalmastermix、2μl的10mm正向內引物fip、2μl的10mm反向內引物bip、0.25μl的10mm反向外引物b3、0.25μl的10mm正向外引物f3,模板(裂解液)6μl,加去核酸酶水補足25μl。反應條件:65℃擴增30min,98℃-80℃變性10min;
結果:混合菌中(含有志賀氏菌)均能被ic-lamp檢測出來,pcr管在紫外照射下出現綠色熒光,檢測結果為陽性,其擴增曲線如圖3中曲線1、2、3、4所示;而混合菌中(不含有志賀氏菌)均不能被ic-lamp檢測出來,pcr管在紫外照射下不出現綠色熒光,檢測結果為陰性,其擴增曲線如圖3中的曲線5、6、7、8所示。
(5)靈敏度檢測
取1-6μl步驟(3)中裂解液進行lamp反應。在儀器genieii中的反應體系為:15μl2×isothermalmastermix,內游引物fip和bip各20μm,外游引物b3和f3各2.5μm,模板(裂解液)6μl,加去核酸酶水補足25μl。反應條件:65℃擴增30min,98℃-80℃變性10min;結果:利用ic-lamp檢測方法,可將污染樣本中志賀氏菌快速準確的檢測出來,且檢測下限達到8.7×100cfu/ml,pcr管在紫外照射下出現綠色熒光,檢測結果為陽性,其擴增曲線如圖4。其中曲線2、3、4、5、6、7分別表示利用ic-lamp檢測含有志賀氏菌的樣本(樣本菌濃度依次為8.7×105,8.7×104,8.7×103,8.7×102,8.7×101,8.7×100cfu/ml),曲線1為普通lamp檢測污染志賀氏菌樣本(樣本菌濃度為8.7×100cfu/ml)。從圖4中擴增曲線出峰的時間可以看出同樣檢測同一污染樣品,利用ic-lamp檢測方法其擴增曲線7比普通lamp檢測方法的擴增曲線1出峰時間早,說明利用免疫磁珠捕獲抗原能更有效地富集抗原,在實際檢測中更能準確、靈敏的檢測出志賀氏菌。
實施例3:ic-lamp臨床樣本的檢測
(1)磁珠預處理
將免疫沉淀磁珠(proteina/g偶聯磁珠)漩渦振蕩1min,使磁珠充分振蕩重懸。取25~50μl(相當于25~50μg)磁珠懸液置于1.5mlep管中。加入200μl結合緩沖液洗滌,進行磁性分離(將ep管放置于磁力架上,使磁珠被吸附在管壁至溶液澄清;該操作描述以下省略),棄上清液,從磁性分離器上取下ep管,重復洗滌一次,最后加入200μl結合緩沖液重懸磁珠以備用。
(2)抗體結合反應
將步驟(1)預處理的磁珠懸液進行磁性分離加入300μl的抗體(1:1000),于37℃100轉/分鐘反應2小時;然后進行磁性分離,加入1ml的pbs-t重懸后磁性分離(此步驟重復3次)。
(3)抗原捕獲反應
在含有志賀氏菌的猴子糞便檢測樣品中,加入1ml的lb液體培養基漩渦振蕩10s,加入步驟(2)中預處理好的磁珠抗體的混合物中,輕輕混勻后于37℃100轉/分鐘反應0.5小時。然后進行磁性分離,加入1ml的pbs-t重懸后磁性分離(此步驟重復3次)。
(4)抗原的裂解
將步驟(3)中的磁珠-抗體-抗原的復合物中加入10μl的a液(125mmnaoh、1mmedta、0.1%tween20)于65℃反應10分鐘,最后加入10μl溶液b(125mmhcl、10mmtris-hcl)終止反應。
(5)ic-lamp反應
取1-6μl步驟(4)中的裂解液進行ic-lamp反應。反應體系為:2μl的10mm正向內引物fip、2μl的10mm反向內引物bip、0.25μl的10mm反向外引物b3、0.25μl的10mm正向外引物f3,模板(裂解液)6μl,2.5μl10×lampbuffer,150mmmg2+,40μmdntpsmixtures,1μlbstdnapolymerase加去核酸酶水補足25μl。反應條件:63.5℃擴增50min,80℃變性2min。
(6)ic-lamp結果分析
46個猴子糞便樣本經過傳統的生化鑒定以及血清凝集法檢測,共檢測出12個陽性樣本,34個陰性樣本與ic-lamp檢測結果一致。利用兩個不同的檢測方法驗證了ic-lamp能快速準確的檢測出志賀氏菌,并具有快速、靈敏、高特異性等特點,適合于臨床樣本的檢測。
本發明和傳統經典方法的在臨床樣本檢測結果的符合情況
序列表
<110>昆明理工大學
<120>志賀氏菌的ic-lamp檢測引物組及其應用
<160>6
<170>patentinversion3.3
<210>1
<211>43
<212>dna
<213>人工序列
<400>1
ctgtcgaagctccgcagaggttttggattccgtgaacaggtcg43
<210>2
<211>46
<212>dna
<213>人工序列
<400>2
ctttcgctgttgctgctgatgcttttccggagattgttccatgtga46
<210>3
<211>18
<212>dna
<213>人工序列
<400>3
ataccgtctctgcacgca18
<210>4
<211>19
<212>dna
<213>人工序列
<400>4
gccttctgatgcctgatgg19
<210>5
<211>18
<212>dna
<213>人工序列
<400>5
tgtaaaacgacggccagt18
<210>6
<211>18
<212>dna
<213>人工序列
<400>6
caggaaacagctatgacc18
- 還沒有人留言評論。精彩留言會獲得點贊!
- 用于檢測AEDs引起的SJS/TEN的引物、試劑盒及方法與制造工藝
- 檢測植原體的LAMP引物組及其試劑盒和應用的制造方法與工藝
- 用于多重PCR檢測致腹瀉寄生蟲的引物組及試劑盒的制造方法與工藝
- 使用重疊非等位基因特異性引物和等位基因特異性阻斷劑寡核苷酸的組合物進行等位基因特異性擴增的制造方法與工藝
- 一種基于特異性SS-COI引物的麗草蛉PCR快速檢測方法與制造工藝
- 一種利用線粒體D-loop區特異區域鑒定黿的標記引物及方法
- 一種用于檢測大豆擬莖點種腐病菌的特異性lamp引物組合物及其應用
- 一種針對膨脹污泥中Eikelboom Type 0092型絲狀菌群特異性引物和方法
- 紫苑石斛的分子特異性標記引物及檢測方法
- 一種檢測牛hcd攜帶者的特異性pcr引物、試劑盒及檢測方法
- 檢測植原體的LAMP引物組及其試劑盒和應用的制造方法與工藝
- 用于多重PCR檢測致腹瀉寄生蟲的引物組及試劑盒的制造方法與工藝
- 使用重疊非等位基因特異性引物和等位基因特異性阻斷劑寡核苷酸的組合物進行等位基因特異性擴增的制造方法與工藝
- 一種利用線粒體D-loop區特異區域鑒定黿的標記引物及方法
- 一種用于檢測大豆擬莖點種腐病菌的特異性lamp引物組合物及其應用
- 一種針對膨脹污泥中Eikelboom Type 0092型絲狀菌群特異性引物和方法
- 紫苑石斛的分子特異性標記引物及檢測方法
- 一種檢測牛hcd攜帶者的特異性pcr引物、試劑盒及檢測方法
- 用于檢測牛源性成分的lamp引物及其設計方法
- 七種不同種屬來源細胞的pcr檢測引物和檢測方法與應用