具有因子VII活性的融合蛋白質的制作方法
本申請是申請號為201180027707.6的中國專利申請的分案申請,原申請是2011年06月07日提交的pct國際申請pct/kr2011/004131于2012年12月04日進入中國國家階段的申請。本發明涉及具有因子vii(fvii)活性的融合蛋白質;以及,更特別地,涉及包含fvii和轉鐵蛋白并且與未融合天然型fvii相比具有0.7或更高的fvii比活性(specificactivity)的融合蛋白質、為其編碼的dna、包含所述dna的重組載體、以及包含所述重組載體的宿主細胞。
背景技術:
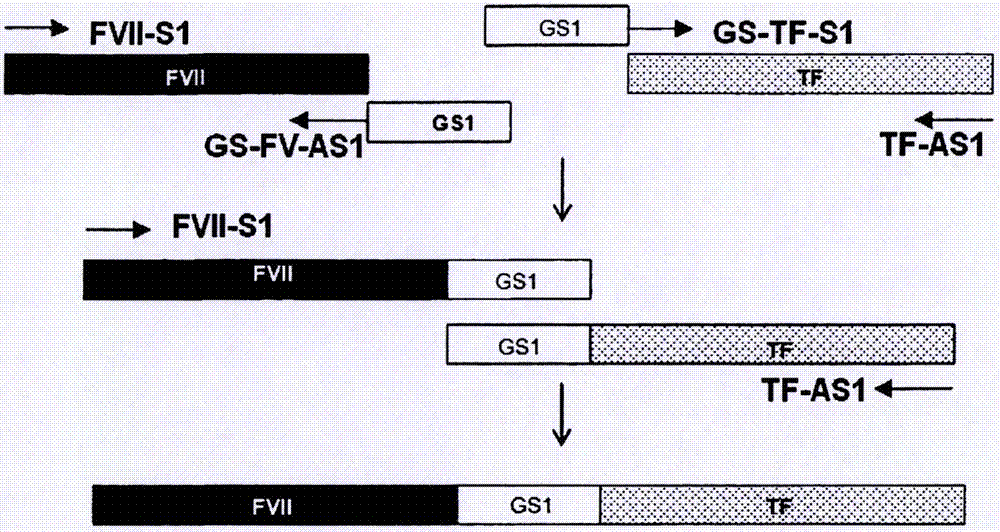
:多種出血性疾病由缺乏凝血因子引發。最常見的疾病是分別由凝血因子viii和ix缺乏或異常引發的血友病a和b。血友病a是由有缺陷的因子viii基因的x連鎖隱性特征(x-linkedrecessivetrait)所引起的遺傳性出血性疾病。血漿源性或重組的因子viii的濃縮物已被用于治療血友病a。血友病b是由因子ix缺乏或功能不良而引起的,通過使用血漿源性或重組的因子ix的濃縮物對其進行治療。但是,出現針對替代因子(replacementfactor)的同種抗體仍是血友病a和b的治療中嚴重的醫學問題。在高至30%的血友病a患者中產生針對因子viii的抗體。盡管針對因子ix的抗體產生的較少,但它們對免疫耐受誘導治療較不敏感,導致更嚴重的結果。凝血由血管壁損傷之后暴露于循環血液的組織因子與激活形式的因子vii(fviia)之間形成復合物而引發。這樣的復合物激活因子ix和因子x,并且所產生的因子xa產生有限量的凝血酶。在正反饋環中,凝血酶激活凝血級聯的多種因子(例如,因子viii、因子v、因子xi等),并且所激活的因子構成因子x酶復合物(factorxasecomplex)或前凝血素酶復合物。這些復合物還擴增其自身的生成并且產生凝血酶。這種被稱為“凝血酶爆發(thrombinburst)”的足夠量的凝血酶將出血部位的纖維蛋白原轉化為纖維蛋白,從而實現完全止血。但是,在具有針對因子viii或因子ix的高濃度中和抗體的血友病患者的情況中,因為不能產生上述因子x酶復合物,所以達不到足夠的止血。fviia已用作主要的治療劑,用于具有針對因子viii或因子ix的中和抗體的患者,因為fviia可激活因子x(甚至在不存在因子viii和因子ix時),從而最終產生足夠量的凝血酶以實現期望的治療效果。fvii是由406個氨基酸組成的單鏈糖蛋白,分子量為50kda,并且作為酶原而被分泌到血流中。fvii由四個不同的結構域組成,即,氨基末端-羧基谷氨酸(gla)結構域、兩個表皮生長因子(egf)樣結構域、以及絲氨酸蛋白酶結構域(hagenfs等,proc.natl.acad.sci.usa,83(8):2412-2416,1986)。經過蛋白水解位于arg152-ile153的單個肽鍵,通過形成由二硫鍵連接的兩個多肽鏈(即,n末端輕鏈(24kda)和c末端重鏈(28kda)),fvii被轉化為其激活形式fviia。fvii以500ng/ml的濃度存在于血漿中,并且1%(即,5ng/ml)的fvii作為fviia而存在。同時,已報道血漿中fvii的半衰期為約4小時(3~6小時),而fviia的半衰期為約2.5小時。由于半衰期短,需要通過多次靜脈內注射或連續注射來施用fviia。然而,就高治療費用和使患者不適而言,這會限制fviia的治療應用。為了克服這些問題,已提供方法用于制備包含fvii以及與其相連的融合伴侶的融合蛋白質,但是所產生的蛋白質具有喪失其生物活性的問題,盡管與非融合蛋白質相比,較短的體內半衰期有所提高。因此,有需要提供和獲得具有提高的體內半衰期同時保持天然型fvii的生物活性的fvii融合蛋白質。技術實現要素:技術問題本發明的一個目的是提供具有天然型fvii的生物活性的融合蛋白質。本發明的另一個目的是提供編碼所述融合蛋白質的基因。本發明的另一個目的是提供包含所述基因的重組載體。本發明的另一個目的是提供包含所述重組載體的宿主細胞。問題的解決方案根據本發明的一個方面,提供了包含因子vii(fvii)和轉鐵蛋白的融合蛋白質,其中所述轉鐵蛋白與所述fvii的c末端相連接。根據本發明的另一個方面,提供了編碼所述融合蛋白質的dna。根據本發明的另一個方面,提供了包含所述dna的重組載體。根據本發明的另一個方面,提供了包含所述重組載體的宿主細胞。發明的有益效果根據本發明的融合蛋白質具有與天然型fvii相比提高的體內半衰期同時保持fvii的高生物活性,因此可有效地用于使用fvii的治療。附圖說明當與附圖結合時,通過以下對發明的描述,本發明的上述和其他目的及特征將變得顯而易見,所述附圖分別示出:圖1是示意圖,其示出用于由包含編碼fvii序列的cdna的載體以及包含編碼轉鐵蛋白(tf)序列的cdna的載體構建fvii-tf表達載體的克隆流程;圖2是示意圖,其示出用于通過重疊pcr構建fvii-gs1(接頭)-tf表達載體的流程;圖3是示意圖,其示出包含gs3、gs5、gs7、gs9、gs11、gs13、gs15或gs-1-t作為接頭的fvii-gs接頭-tf表達載體的構建流程;圖4顯示了本發明的vii-tf、fvii-gs1-tf、fvii-gs3-tf、fvii-gs5-tf、fvii-gs7-tf、fvii-gs9-tf、fvii-gs11-tf、fvii-gs13-tf、fvii-gs15-tf、fvii-gs1-t-tf和fvii-螺旋-tf(fvii-helix-tf)融合蛋白質,fvii-白蛋白融合蛋白質(fvii-alb)和fvii(諾其tm(novoseventm))的western印跡結果;圖5是圖表,其示出本發明的fvii-tf、fvii-gs1-tf、fvii-gs3-tf、fvii-gs5-tf、fvii-gs7-tf、fvii-gs9-tf、fvii-gs11-tf、fvii-gs13-tf、fvii-gs15-tf、fvii-gs1-t-tf和fvii-螺旋-tf融合蛋白質、以及fvii-白蛋白融合蛋白質(fvii-alb)的比活性(specificactivity);圖6呈現接頭和fvii-gs1-t-tf融合蛋白質中兩個末端處的限制性識別序列的結構;以及圖7示出經純化的本發明fvii-tf、fvii-gs1-tf、fvii-gs1-t-tf、fvii-gs3-tf以及fvii-gs15-tf融合蛋白質,novoseventm和fvii的western印跡結果。具體實施方式發明的最佳實施方式本發明提供包含因子vii(fvii)和轉鐵蛋白的融合蛋白質。本發明的融合蛋白質的fvii和轉鐵蛋白可源自任何哺乳動物,優選人。更具體地,本發明中所使用的fvii和轉鐵蛋白可分別具有與見于人血液中那些天然型蛋白質不少于95%的序列同源性。最優選地,fvii具有seqidno:1的氨基酸序列并且轉鐵蛋白具有seqidno:2的氨基酸序列。此外,用于本發明的融合蛋白質的fvii或轉鐵蛋白可以是其天然型的功能等價物或功能衍生物,其具有基本等價的功能活性。示例性的功能等價物包括由分別在seqidno:1和2所示的氨基酸序列中缺失、插入或者非保守性或保守性替換任何氨基酸殘基或者其組合所誘導的突變體,其中這樣的改變基本不改變提供對fvii的生物活性的活性位點或結構域。在一些情況中,可例如通過磷酸化(phosphorylation)、硫酸化(sulfation)、丙烯酰化、糖基化、甲基化、法尼基化、乙酰化、酰胺化等來修飾本發明的融合蛋白質,用于提高或降低其物理或化學特性,并且只要基本保持fvii的生物活性,這樣的功能衍生物也落入本發明的范圍之內。在本發明的融合蛋白質中,轉鐵蛋白優選地與fvii的c末端相連接。采用fvii-轉鐵蛋白順序的融合蛋白質優于采用轉鐵蛋白-fvii順序的融合蛋白質,可能是由于fvii的n末端的暴露(見表3)。本發明的融合蛋白質還可在fvii與轉鐵蛋白之間包含限制酶的識別序列以利于插入以下所描述的接頭。限制性識別序列可以是本領域技術人員已知的任何限制性識別序列,并且可優選地使用agei識別序列(a/ccggt)。換句話說,融合蛋白質(其中限制性識別序列與fvii的c末端相連接并且轉鐵蛋白與限制性識別序列相連接)包括在本發明的范圍之內。本發明提供在fvii與轉鐵蛋白之間包含接頭的融合蛋白質。所述接頭可具有1至100個氨基酸,優選1至75個氨基酸,更優選5至25個氨基酸,并且所述接頭可以是可將fvii與轉鐵蛋白功能性分離的任何肽。所述接頭可具有穩定的二級結構(例如螺旋)或者可源自igg鉸鏈區。優選地,所述接頭在水溶液中可自由旋轉,并且不具有固定結構,因此,所述接頭可以是非免疫原性的并且可通過使兩個融合伴侶之間的潛在干擾最小化而提高融合蛋白質的fvii活性。例如,這樣的接頭可以是氨基酸序列seqidno:11所示的螺旋接頭。此外,這樣的柔性接頭可包含重復或隨機模式的甘氨酸(g)和絲氨酸(s)。例如,所述接頭包含(ggggs)n(其中n是1至20的整數),并且優選具有選自seqidno:3至11的任一氨基酸序列(見表1)。此外,具有與所述接頭不低于80%同源性(優選具有不低于85%同源性)的任何氨基酸序列也可用于本發明的融合蛋白質。此外,所述接頭還可包括蛋白酶切割位點,其可被損傷組織中豐富的蛋白酶識別。所述切割位點可被選自凝血酶、因子xa、因子ixa和因子viia的蛋白酶切割。具有這種蛋白酶切割位點的融合蛋白質在工作位點處被切割以產生每種蛋白質(即,fvii和轉鐵蛋白),并且所產生的蛋白質作為個體蛋白質而發揮功能。優選地,所述接頭具有seqidno:12的氨基酸序列(見表1)。可更容易地通過位于fvii與轉鐵蛋白之間的限制酶識別序列將所述接頭插入到融合蛋白質中。因此,所述限制酶識別序列可存在于所述接頭的任一端或兩端,并且繼而被翻譯成由所述序列編碼的氨基酸。例如,當使用agei限制酶識別序列時,thr可存在于所述接頭的n末端,并且thr-gly可存在于所述接頭的c末端。即,當使用接頭(ggggs)3時,所述識別序列和接頭可以以--t(ggggs)3tg--的形式存在。在所述接頭的n末端和c末端處翻譯的氨基酸可根據所使用的限制酶識別序列而有所不同,但其存在并不影響融合蛋白質的活性(見表5)。本發明的融合蛋白質表現出不低于0.7的與未融合天然型fvii相比的fvii比活性。在本發明的一個方面中,所述融合蛋白質(其包含由seqidno:1的氨基酸序列所示的fvii和由seqidno:2的氨基酸序列所示的轉鐵蛋白)具有約0.82至約0.92的與未融合天然型fvii相比的fvii比活性(見表2和表3)。此外,所述融合蛋白質(其包含由seqidno:1的氨基酸序列所示的fvii、由seqidno:3的氨基酸序列所示的接頭以及由seqidno:2的氨基酸序列所示的轉鐵蛋白)具有約0.97的與未融合天然型fvii相比的fvii比活性(見表2)。根據本發明的融合蛋白質(其中另一些接頭插入fvii與轉鐵蛋白之間)也具有約0.74至約1的與未融合天然型fvii相比的fvii比活性(見表2)。此外,本發明的融合蛋白質具有比其上沒有連接轉鐵蛋白的fvii長3~4倍的半衰期(見表6)。本發明還提供編碼所述融合蛋白質的dna。由于密碼子簡并性或者考慮生物體中優選的密碼子,可對編碼融合蛋白質的dna進行多種改變和修改以表達所述融合蛋白質,除非所述融合蛋白質的氨基酸序列實質地改變,經修改的dna也包括在本發明的范圍之內。在本發明中,編碼所述融合蛋白質的dna可優選地由seqidno:13至24的任一核苷酸序列所示。可通過用于表達所述dna的載體來提供本發明編碼所述融合蛋白質的dna。本發明提供包含編碼所述融合蛋白質的dna的重組載體。本文中使用的術語“載體”是指用于將編碼所述融合蛋白質的dna引入宿主細胞并在其中表達所述融合蛋白質的工具(means)。所述載體可包括常規載體,例如質粒載體、粘粒(cosmid)載體、噬菌體載體、病毒載體等,優選質粒載體。合適的表達載體包含表達調節元件(例如,啟動子、起始密碼子、終止密碼子、聚腺苷酸化信號和增強子),以及用于膜導向或分泌的信號序列或前導序列,并且可根據目的而多樣地制備。應確保所述起始密碼子和終止密碼子在施用基因構建體的生物體中運作,并且處于編碼序列的閱讀框中(in-frame)。此外,所述表達載體包含用于選擇含有所述載體的宿主細胞的選擇標記,以及復制起點(如果所述表達載體是可復制的)。所述載體可自身復制或可被整合到宿主細胞的dna中。具體地,可通過將編碼所述融合蛋白質的dna插入到pcdna3.1-hygro載體而制備根據本發明的重組表達載體。此外,本發明提供通過用所述重組表達載體轉化而產生所述融合蛋白質的宿主細胞。因為,所述蛋白質的表達水平和修飾根據宿主細胞的類型而有所不同,優選選擇最適于目的的宿主細胞。宿主細胞的實例包括哺乳動物細胞,例如中國倉鼠卵巢(cho)細胞、人胚腎細胞(hek293)、倉鼠腎細胞(bhk21)、人肝癌細胞(hepg2)等,但不限于此。為了用根據本發明的重組表達載體轉化宿主細胞,可使用本領域技術人員已知的任何方法,此類方法的實例包括但不限于電穿孔、原生質體融合、磷酸鈣(capo4)沉淀、氯化鈣(cacl2)沉淀等。發明的實施方式以下實施例僅為舉例說明的目的而給出,并不旨在限制本發明的范圍。實施例1:制備因子vii(fvii)質粒載體(pcdna3.1-hygro-fvii)將從hepg2細胞(kclbno.88065)純化的總rna用作模板用于逆轉錄。通過使用fvii基因特異性引物fvii-f和fvii-r(seqidno:25和26)的pcr擴增互補dna(cdna)以獲得人fvii-f基因的開放閱讀框。在以下條件下通過處理50μl的反應溶液(0.5μlcdna、0.4μm(10pmol/μl)seqidno:25和26的引物、0.2mmdntp、5單位的taqdna聚合酶和水)而進行pcr:在94℃下5分鐘的1個變性循環,在94℃下1分鐘、60℃下1分鐘、以及在72℃下2.5分鐘的35個擴增循環,以及在72℃下5分鐘的1個最終延伸循環。將經純化的pcr產物克隆到pgem-t易載體(pgem-teasyvector)(promega,cat#:a1360)中。通過使用ecori和ncoi的限制性酶切選擇陽性克隆。通過dna測序進一步核實所選擇的克隆。為了將fvii的orf(fvii-orf)轉移至表達載體,通過t4dna聚合酶使以noti切割的fvii-orf成平末端(blunt),并與以hindiii/xbai酶切并且成平末端的pcdna3.1-hygro載體(invitrogen)相連接。通過用apai、xbai、ecori、ncoi、psti限制性酶切和dna測序而確證經連接的載體。該載體被定名為“pcdna3.1-hygro-fvii”。實施例2:構建fvii-tf表達載體(pcdna3.1-hygro-fvii-tf)將實施例1中制備的fviicdna與人轉鐵蛋白(tf)cdna融合以作為動物細胞中的單一酶原而表達。人轉鐵蛋白cdna購自origene(cat#:sc322130)并且核實其與genbank登錄號:nm_001063.2的序列是否相同。設計融合中所使用的引物以除去fvii的終止密碼子以及轉鐵蛋白的信號肽。為了利于在fvii與tf之間插入多種大小的接頭,向連接引物中添加agei位點(accggt),其將被翻譯成蘇氨酸(thr)和甘氨酸(gly)。所產生的融合蛋白質可具有以下結構:(前導肽)-(成熟fvii)-(thr-gly)-(成熟tf)(其中前導肽由成熟fvii中不存在的信號肽(前肽(prepeptide))和待通過加工酶切割的肽原(propeptide)組成,由38個氨基酸構成,并且與seqidno:1氨基酸序列中的1至38位置的氨基酸相對應)。通過使用引物fvii-s1、fvii-as1、tf-s1和tf-as1(seqidno:27至30)擴增fvii以及tf的cdna,并且使用實施例1中所描述載體。seqidno:27和30的引物分別包含nhei和xhoi位點。圖1中描述了用于將fviicdna與tfcdna相連接的克隆策略。首先,通過pcr從pcdna3.1-hygro-fvii載體擴增fviicdna。在以下條件下通過處理50μl的反應溶液(1μl載體模板、1μl引物對、fvii-s1和fvii-as1(10μm)、10μl5xphusionhf緩沖液、200μmdntp、0.5μlphusiondna聚合酶(finnzymes,#f-530s,2單位/μl)和35.5μl水)而進行pcr:在98℃下30秒的1個變性循環,在98℃下10秒、60℃下45秒、以及在72℃下30秒的30個擴增循環,以及在72℃下7分鐘的1個最終延伸循環。接下來,使用轉鐵蛋白cdna作為模板擴增tf。重復上述pcr操作,不同之處在于使用引物對(tf-s1:10μm;tf-as1:10μm)。通過一系列的限制性酶切(restriction)和連接而將經擴增的fvii和tfcdna相連接。用agei和xhoi或者用nhei酶切通過pcr擴增的每種dna。將經酶切的dna純化并以1∶1的摩爾比連接。將經連接的dna亞克隆到用nhei/xhoi酶切的pcdna3.1-hygro載體(invitrogen)中。通過dna測序進一步核實插入物的大小和序列。實施例3:構建fvii-gs接頭-tf表達載體使用包含甘氨酸和絲氨酸的由5個氨基酸組成的肽作為基本接頭單位。所述基本接頭單位包含四個甘氨酸和一個絲氨酸,具有以下序列:“ggggs”。應用所述基本接頭單位(下文中稱為“gs-x接頭”,其中x是重復數目的基本gs接頭單位)以構建更長的gs接頭。在該實施例中,構建gs-1至gs-15的接頭。1)構建fvii-gs-1接頭-tf表達載體合成一組包含基本gs接頭單位的引物gs-fv-as1和gs-tf-s1(seqidno:31和32),并通過重疊pcr將其插入到fvii與tf之間(見圖2)。通過使用一組引物fvii-s1和gs-fv-as1(seqidno:27和31)以及phusiondna聚合酶(finnzymes,#f-530s)的pcr將所述gs-1接頭與fvii相連接。通過在以下條件下處理50μl的反應溶液(1μlpcdna3.1-hygro-fvii-tf載體、1μlfvi1-s1(10pmole/1μl)、1μlgs-fv-as1(10pmole/μl)、1μl10mmdntp、10μl5xphusionhf緩沖液、35.5μl水和0.5μlphusiondna聚合酶(2單位/μl))而進行pcr:在98℃下30秒的1個變性循環,在98℃下10秒、64℃下30秒、以及在72℃下45秒的35個擴增循環,以及在72℃下7分鐘的1個最終延伸循環。同時,為了將gs-1接頭與tf相連接,重復上述pcr操作,不同之處在于使用一組引物gs-tf-s1和tf-as1(seqidno:32和30)。使用經擴增的pcr產物作為重疊pcr的模板。通過在以下條件下處理反應溶液(1μl經擴增的pcr產物、1μlfvii-s1(10pmole/μl,seqidno:27),1μl反義引物(tf-as110pmole/μl,seqidno:30)、10μl5xphusionhf緩沖液、1μl10mmdntp、34.5μl水、0.5μlphusiondna聚合酶(2單位/μl))而進行重疊pcr:在98℃下1分鐘的1個變性循環,在98℃下10秒、66/68℃下30秒、以及在72℃下45秒的45個擴增循環,以及在72℃下7分鐘的1個最終延伸循環。將進擴增的重疊pcr產物克隆到用nhei和xhoi酶切的pcdna3.1-hygro-lacz中。2)構建fvii-gs-3接頭-tf表達載體合成包含gs-3和agei位點的引物對gs3-s和gs3-as(seqidno:33和34)。為了制造gs-3雙鏈接頭,通過在98℃下加熱混合物(5μlgs3-s(100pmole/μl)、5μlgs3-as(100pmole/μl)、2μl10x退火緩沖液(100mmtris-cl[ph8.0]、1mnacl、10mmedta)和8μl水)10分鐘并在25℃下冷卻1小時而使引物退火。用agei酶切經退火的接頭,并且還用agei酶切實施例2中制備的pcdna3.1-hygro-fvii-tf載體。在37℃下用1μlcip(小牛腸磷酸酶;neb,#m0290s)處理經酶切的載體1小時,并對其進行凝膠提取操作(qiagen,#28704),隨后使用t4dna連接酶(takara,#2011a)以1∶3的摩爾比(載體∶插入物)連接。3)構建fvii-gs-5接頭-tf至fvii-gs-15接頭-tf的表達載體為了構建包含gs-5接頭的融合蛋白質表達載體,實施了新的策略。通過以下兩個步驟構建包含接頭經延長的fvii-tf融合載體。第一步是向以前獲得的接頭中添加合成的雙鏈(ds)gs2接頭。確保延長接頭之后,將所述接頭切出并將其插入pcdna3.1-hygro-fvii-tf載體中的fvii基因與tf基因之間。例如,為了將gs-3接頭延長至gs-5接頭,用bglii酶切seqidno:35的經合成dsgs-2接頭單位,并與用bamhi和stui處理的pcdna3.1-hygro-fvii-gs3-tf載體連接。接下來,在通過bamh1和agei酶切確證延伸所述接頭之后,用agei將經延長的接頭切出,并將其克隆到用agei和cip處理的pcdna3.1-hygro-fvii-tf載體中。通過相同的策略構建包含gs-7、gs-9、gs-11、gs-13和gs-15接頭的fvii-tf融合表達載體(見圖3)。實施例4:構建含有包含凝血酶切割位點的接頭的fvii-tf表達載體(pcdna3.1-hygro-fvii-gs1-t-tf)通過使gs-1單位與凝血酶識別序列(下文中稱為“gs1-t接頭”)的兩端鄰接而制備包含凝血酶切割位點的接頭。設計并合成seqidno:36(有義)的dsgs1-t接頭以在兩端包含agei位點。用agei酶切dsgs1-t接頭,并使用pcr純化試劑盒(qiagen,cat#:28104)進行純化。將經純化的接頭連接到用cip/agei處理的pcdna3.1-hygro-fvii-tf載體中。實施例5:構建包含螺旋接頭的fvii-tf表達載體(pcdna3.1-hygro-fvii-螺旋-tf)通過美國公開(laid-openpublication)no.2009/0170163中公開的方法制備螺旋接頭dna。通過使用引物向所制備螺旋接頭dna(螺旋接頭s和螺旋接頭as(seqidno:37和38))的兩端添加agei位點。將引物螺旋接頭s和螺旋接頭as退火并用agei酶切,隨后插入用agei和cip處理的pcdna3.1-hygro-fvii-tf載體中。通過dna測序確證所構建的載體。比較例1:構建fvii-白蛋白融合表達載體(fvii-alb)構建歐洲專利no.1816201中所公開的fvii-白蛋白融合蛋白質。通過使用人肝mrna(clontech)作為模板以及白蛋白基因特異性引物白蛋白-s和白蛋白-as(seqidno:39和40)的rt-pcr獲得人白蛋白cdna。根據制造商的說明書通過使用accuscript高保真rt-pcr系統試劑盒(cat#600180)進行rt-pcr。首先,將10μl的逆轉錄反應溶液(1μl10x逆轉錄酶緩沖液、0.6μl寡-dt引物、1μldntp、0.4μl水、5μl人肝mrna(10ng/μl))在65℃下保持5分鐘,并在室溫下保持5分鐘,并在42℃下與1μl100mmdtt和1μl逆轉錄酶反應1小時。通過使用合成cdna作為模板以及引物白蛋白-s和白蛋白-as的pcr獲得人白蛋白序列。在以下條件下通過處理50μl的反應溶液(1μlcdna模板、10μl5xphusionhf緩沖液、分別1μl引物白蛋白-s和白蛋白-as、1μl10mmdntp、0.5μlphusiondna聚合酶(finnzymes,#f-530s;2單位/μl)和35.5μl水)而進行pcr:在98℃下1分鐘的1個變性循環,在98℃下10秒、60℃下30秒、以及在72℃下60秒的30個擴增循環,以及在72℃下7分鐘的1個最終延伸循環。將合成的seqidno:41和42的寡核苷酸退火至歐洲專利no.1816201中所公開的gs接頭[ss(ggs)9gs](seqidno:45)。為了將實施例1中制備的fviicdna連接至上述接頭,通過使用引物mutfvii(xhoi)-s和mutfvii(xhoi)-as(seqidno:43和44)的基于pcr的誘變,用xhoi位點替換pcdna3.1-hygro-fvii載體中的fvii終止密碼子。使用xhoi/apai位點,將gs接頭[ss(ggs)9gs]融合至pcdna3.1-hygro-fvii載體中fviicdna的3′端。最終,將用bamhi酶切的人白蛋白cdna插入到pcdna3.1-hygro-fvii-gs-接頭載體中。通過dna測序核實所制備的pcdna3.1-hygro-fvii-gs-接頭-白蛋白表達載體。表1中示出實施例2至5以及比較例1中所構建表達載體的特征。表1[表1]實驗例1:測量fvii-融合蛋白質的比活性在穩定表達vkorc1(維生素k環氧化物還原酶復合物亞單位1)的cho細胞(cho(vk2))中表達實施例2至5以及比較例1中所構建的fvii-融合蛋白質。通過使用無內毒素質粒大量提取試劑盒(endo-freeplasmidmaxikit)(qiagen,#27104)純化實施例2至5以及比較例1中所構建的表達載體。使用β-半乳糖苷酶作為轉染的內對照。在6孔板中以1.5×106個細胞/孔的密度接種cho(vk2)細胞。在補充了10%fbs(lonza,#14-501f)、1xht(invitrogen,#11067-030)、4mml-谷氨酰胺(lonza,#17-605e)和200μg/ml潮霉素(invitrogen,#10687-010)的α-mem(lonza,#12-169f)中孵育細胞24小時,隨后根據制造商的說明書使用lipofectamine2000(invitrogen)轉染。轉染之后四小時,替換為無血清培養基(optimem),并補充5μg/ml維生素k。孵育48小時之后,對培養基進行取樣并貯藏于-70℃。分別使用coatest因子vii測定試劑盒(chrmogenix,#821900-63)和fviielisa試劑盒(cedarlenelab,#cl20030k)分析所表達fvii-融合蛋白質的發色活性和抗原量。根據制造商的說明書進行所述測定。將相對于who標準歸一化的標準入血漿用作這兩種測定中的對照fvii。通過western印跡分析評估蛋白質的表達。基于elisa結果加載等量的fvii融合蛋白質。發現所表達的fvii-融合蛋白質具有預期的大小,沒有可檢出的片段化(見圖4)。同時,fvii-轉鐵蛋白融合蛋白質的比活性為0.74至1,這高于fvii-白蛋白融合蛋白質的比活性(0.52)(見表2)。包含接頭的fvii-轉鐵蛋白融合蛋白質還保留了不低于70%的fvii活性。接頭長度與比活性之間沒有關系,但具有較短gs接頭的fvii融合蛋白質表現出比具有較長gs接頭的融合蛋白質稍微更高的比活性。尤其是fvii-gs1-tf和fvii-gs1-t-tf融合蛋白質表現出相當的比活性(見圖5)。表2[表2]實施例6:根據tf融合方向表征fvii融合蛋白質在該實施例中,制備了其中人轉鐵蛋白(tf)連接至fvii的n末端的融合蛋白質,并與其中轉鐵蛋白連接至fvii的c末端的融合蛋白質相比較,以檢測根據融合蛋白質中融合方向的特征的改變。詳細的操作如下。<6-1>構建tf-fvii和tf-gs1-t-fvii表達載體tf連接至fvii的n末端的兩種融合蛋白質設計如下:(1)(tf的前導肽)-(成熟tf)-(thr-gly)-(成熟fvii);和(2)(tf的前導肽)-(成熟tf)-(thr)-(gs1-t;seqidno:12)-(thr-gly)-(成熟fvii)。首先,為了獲得包含前導肽的tf基因序列,設計正向引物(nhe-tf:seqidno:46)以包含用于克隆的目的的nhei位點,并且設計反向引物(tf-age:seqidno:47)以包含用于除去轉鐵蛋白終止密碼子以及克隆的目的的agei位點。對于克隆除去了前導肽的成熟fvii,設計正向引物(age-fvii:seqidno:48)以包含agei位點,并且設計反向引物以包含xhoi位點。對于tf基因,cdna購自origene(cat#:sc322130),在實施例2中用作pcr模板。在以下條件下通過處理50μl的反應溶液(1μl載體模板、2μl引物nhe-tf和tf-agei(10μm)、10μl5×phusionhf緩沖液、1μl10mmdntp、0.5μlphusiondna聚合酶(finnzymes,#f-530s,2單位/μl)和33.5μl水)而進行pcr:在98℃下30秒的1個變性循環,在98℃下10秒、70℃下30秒、以及在72℃下36秒的25個擴增循環,以及在72℃下10分鐘的1個最終延伸循環。如實施例4中那樣通過使用pcdna3.1-hygro-fvii-gs1-t-tf載體作為模板的pcr擴增fvii。pcr條件與上述tfpcr條件相同,不同之處在于施用引物age-fvii(10μm)和vii-xho(10μm)。通過使用nhei/agei將所擴增的tf基因插入到pcdna3.1-hygro-fvii-gs1-t-tf載體中以獲得pcdna3.1-hygro-tf-tf載體。用agei/xhoi酶切并連接pcdna3.1-hygro-tf-tf載體和fviipcr產物以構建包含pcdna3.1-hygro-tf-fvii融合蛋白質的表達載體。通過經由agei將插入實施例4中所合成的dsgs1-t序列而構建pcdna3.1-hygro-tf-gs1-t-fvii表達載體。通過限制酶切作圖和dna測序確證所構建的表達載體。<6-2>表達融合蛋白質并表征為了表征具有連接至fviin末端的tf的融合蛋白質,將其表達載體(即,pcdna3.1-hygro-fvii-tf、pcdna3.1-hygro-fvii-gs1-tf-vii、pcdna3.1-hygro-tf-fvii和pcdna3.1-hygro-tf-gs1-t-fvii)瞬時表達于cho細胞中。使用無內毒素質粒大量提取試劑盒分離所構建的4種質粒dna。轉染前一天,通過胰蛋白酶分離在t75瓶中培養的cho(dg44)細胞,并以1.5×106個細胞/孔的密度接種在6孔板中。24小時之后,根據制造商的說明書轉染細胞。轉染四小時之后,除去每孔中的培養基并替換為2ml補充有5μg/ml維生素k的培養基。轉染之后,在37℃、5%co2的培養箱中孵育6孔板,并在48小時之后收獲培養基。將所收獲的上清液轉移至1.5ml管中并在-70℃下貯藏,用于fvii的發色測定和elisa。用每孔2mlhbss清洗除去了培養基的板并用250μl裂解液(tropix,#abx210lm,添加1mmdtt)裂解,隨后貯藏在-70℃,用于β-半乳糖苷酶測定。按照實驗例1進行發色測定和fviielisa。通過在實驗之前融化轉染之后冷凍貯藏的培養基并通過離心獲得上清液而制備用于分析的樣品。在測定中使用標準人血漿(dadebehring,#orkl13,lot#503216f)作為標準物。測量結果示于表3中。對于tf連接至fviin末端的tf-fvii和tf-gs1-t-tf,未測量出活性,不同于tf連接至fviic末端的fvii-tf和fvii-gs1-t-tf。此外,在fviielisa中檢出了少量tf連接至n末端的融合蛋白質。但是,在使用tf的多克隆抗體的western印跡結果中,無論融合方向如何,所述融合蛋白質表現出了相似的檢測靈敏度。結果表明,當將tf連接至fvii的n末端時,即便正常地進行了氨基酸的翻譯,也生成沒有fvii活性的融合蛋白質。表3[表3]實施例7:根據融合中使用的限制酶識別序列缺失而表征融合蛋白質在實施例2中,使用限制酶(agei)識別序列以利于在fvii與tf之間插入多種接頭。結果,一些融合蛋白質變得在接頭的兩端具有由上述限制酶多編碼的thr和gly。在該實施例中,檢測了融合蛋白質的特性是否通過存在限制酶(agei)識別序列而改變。通過使用誘變引物的基于pcr的位點定向誘變,使限制酶識別序列從包含gs1-t接頭的fvii-gs1-t-tf融合蛋白質中缺失。如圖6所示,設計該實驗以在n末端缺失“thr”并且在c末端缺失“thr-gly”,實驗中使用的引物列在表4中。表4[表4]<7-1>缺失thr-gly進行基于pcr的誘變。在以下條件下通過處理50μl的反應溶液(1μlpcdna3.1-hygro-fvii-gs1-t-tf載體、0.2μl有義引物(tgdel-s10μm)、0.2μl反義引物(tgdel-as10μm)、1μl10mmdntp、4μl5xpcr緩沖液、14μl水和0.2μlphusiondna聚合酶(finnzymes,#f-530s))而進行pcr:在98℃下30秒的1個變性循環,在98℃下10秒、58℃下30秒、以及在72℃下3分鐘的18個擴增循環,以及在72℃下7分鐘的1個最終延伸循環。為了除去初始的模板dna,用1μldpni(neb,#r0176s)處理經擴增的pcr產物,并在37℃下孵育1小時。使用10μl經dpni-處理的dna轉化50μlhit感受態細胞(dh5α,rh617),并在lb+amp(10mg/ml)固體培養基中過夜孵育。通過dna測序分析如此獲得的4個克隆,并且核實了兩個克隆為突變體。<7-2>缺失thr為了缺失thr,通過使用不同引物而進行與<7-1>中類似的方法。簡單地說,在相同的條件下通過使用1μl克隆的質粒dna作為模板(其中在實施例<7-1>中確證突變)和1μl有義引物(tdel-s;10pmole)以及1μl反義引物(tdel-as;10pmole)而進行基于pcr的誘變。通過對所選擇的四個克隆進行dna測序,確證了三個克隆具有突變。將所獲得的表達載體命名為“pcdna3.1-hygro-fvii-gs1-t-tf(m3)”。<7-3>表征具有限制酶識別序列缺失的融合蛋白質用fvii-gs1-t-tf和fvii-gs1-t-tf(m3)表達載體轉染cho細胞,并以fvii-alb表達載體作為對照,獲得培養基的上清液。對所獲得的上清液進行fvii發色測定(chromogenix)和fviielisa(cedarlane)以核實活性/抗原比值的改變。如表5所示,fvii-gs1-t-tf和fvii-gs1-t-tf(m3)融合蛋白質的抗原量和活性幾乎彼此相等,并且比值(比活性)也沒有改變。此外,確證了比活性顯著高于fvii-alb融合蛋白質的比活性。表5[表5]實施例8:測量融合蛋白質的半衰期為了測定根據本發明的融合蛋白質半衰期的提高,將fvii-tf、fvii-gs1-tf、fvii-gs3-tf、fvii-gs15-tf和fvii-gs1-t-tf用作實驗組,并將野生型fvii和市售的fviia(novonordisk)用作對照組。<8-1>樣品制備1)獲得表達培養基在freestyletmcho-s細胞系(invitrogen,cat.no.r800-07)中表達野生型fvii蛋白質和五種融合了tf的fvii融合蛋白質。在具有補充有8mml-glu(gibco,l-谷氨酰胺200mm(100x),cat.no.25030-081)的freestylecho表達培養基的旋轉瓶(spinnerflask)中懸浮培養cho-s細胞。在轉染前24小時,以4×105個細胞/ml的密度接種所培養的細胞,并且當密度變為1×106個細胞/ml時進行轉染。通過使用無內毒素大量制備試劑盒(endo-freemaxiprepkit)(qiagen,cat.no.12362)或無內毒素質粒宏量制備試劑盒(endo-freeplasmidmegaprepkit)(qiagen,12381)制備轉染中使用的dna,并且參照freestylemax試劑(invitrogen,cat.no.16447-100)的轉染方案進行轉染。向8mloptiprosfm(invitrogen,cat.no.12309-019)中添加500μgdna并混合。向另一管中添加8mloptiprosfm(invitrogen,cat.no.12309-019)和500μlfreestylemax試劑,隨后將上述兩種混合物緩慢混合并在室溫下貯藏10分鐘。10分鐘之后,用所述混合物轉染freestyletmcho-s細胞。在37℃,5%co2的培養箱中孵育經轉染的細胞3~5天,隨后獲得上清液。2)純化表達培養基將通過旋轉瓶獲得的培養基過濾通過0.22μm濾器(corning)以除去剩余的細胞和碎片。通過使用切向流動式膜(tangential-flowmembrane)(satorious,30kda)的超濾將經過濾的培養基濃縮10倍。將經濃縮的培養基加至裝有陶瓷羥磷灰石(ceramichydroxyapatite)(bio-rad,157-0040)樹脂的xk16/20柱(gehealthcare)。用超過10個柱體積的平衡緩沖液(25mm咪唑、0.02%吐溫80和150mmnacl,ph6.5)平衡該陶瓷羥磷灰石柱。加載了經濃縮培養基之后,用平衡緩沖液和清洗緩沖液-1(25mm咪唑、0.02%吐溫80、100mm磷酸鈉,ph6.3)和清洗緩沖液-2(25mm咪唑、0.02%吐溫80、100mm磷酸鈉、1mnacl,ph6.3)清洗所述柱。清洗之后,用洗脫緩沖液(25mm咪唑、0.02%吐溫80、500mm磷酸鈉,ph6.3)洗脫捕獲至所述柱的融合蛋白質。通過fvii-發色測定、fviielisa測定和sds-page/western印跡分析經洗脫的蛋白質。<8-2>western印跡測定通過sds-page/考馬斯藍染色確證了通過兩步柱而部分純化的fvii和fvii/tf融合蛋白質具有45%或更高的純度。通過western印跡評估經純化蛋白質中源自fvii的片段的存在,因為經純化的融合蛋白質中的片段化fvii可能具有比完整fvii融合蛋白質更短的半衰期,并且誤導對每種fvii融合蛋白質的半衰期的測定。以0.1iu(fvii活性)/10μl制備(novonordisk,1.2mg/小瓶,60kiu)和經純化樣品,隨后通過使用nupage4-12%bis-tri凝膠(invitrogen)進行sds-page。完成電泳之后,將凝膠轉移至pvdf膜,并在室溫下通過添加10ml封閉緩沖液(25mmtris、150mmnacl(ph7.2)、5%脫脂乳和0.1%吐溫80)而封閉1小時。傾瀉掉封閉液,以1∶5000和1∶500的比例添加抗fvii抗體(cat.no.f8146,sigma)或小鼠抗轉鐵蛋白抗體(sc52256,santacruz),并在翹板搖床(rockingshaker)中孵育1小時。用清洗溶液(25mmtris、150mmnacl,ph7.2)將所述膜清洗四次,并在10ml(pbs-t中的5%脫脂乳)溶液(其中已添加比例為1∶50,000的山羊抗小鼠igg-hrp抗體(cat.no.g21040,invitrogen)作為二抗)中孵育1小時。用清洗溶液(25mmtris、150mmnacl,ph7.2)將所述膜清洗四次之后,向其上添加2mlsuper-signalwestfemtomix(thermo)5分鐘。反應完成之后,使膜顯影。圖7中顯示western印跡的結果。如圖7所示,在經純化的蛋白質中未檢出源自fvii的片段。在所探查的印跡上通過抗轉鐵蛋白抗體未檢出片段化的轉鐵蛋白。<8-3>測量半衰期在大鼠中測量以下蛋白質的半衰期并彼此比較:不具有接頭的融合蛋白質,具有四種接頭(gs1、gs1-t、gs3和gs15)的融合蛋白質,以及表達的和在相同條件下純化的野生型fvii,并且用市售的novoseven作為對照。根據制造商的說明書,通過人fviielisa(cedarlane,用于對因子vii進行elisa的成對抗體,#cl20030k)進行對待施用樣品以及從動物實驗中所采集樣品中的fvii量進行定量分析。通過對來自三個不同稀釋度的樣品的值求平均值而測定待施用樣品的濃度。施用稀釋溶液(administrationdilutionsolution)(nacl3mg/ml、cacl2二水合物1.5mg/ml、甘氨酰甘氨酸1.3mg/ml、聚山梨酯800.1mg/ml和甘露醇30mg/ml,ph5.5)被用作稀釋劑。fviielisa定量之后,用施用稀釋溶液稀釋每種蛋白質,通過尾靜脈以基于實驗當天所測量的大鼠體重150iu/kg向大鼠(250~300g的spraguedawley,每組三只大鼠)靜脈內施用經稀釋的樣品。在總共11個時間點取血,即施用藥物之后0分鐘、5分鐘、15分鐘、30分鐘、60分鐘、1.5小時、2小時、4小時、6小時、8小時和24小時。將225μl血液與25μl3.2%檸檬酸鈉混合,并在4℃下以13,000rpm離心1分鐘,隨后將上清液貯藏在-70℃。通過用fviielisa試劑盒(cedarlane)中使用的清洗緩沖液稀釋1/50或1/100而分析大鼠血漿。通過對人fvii抗原濃度的對數相對于取樣時間點進行作圖而獲得回歸曲線。通過根據公式“半衰期=ln2/回歸曲線的斜率”計算而確定每種fvii的半衰期。如表6所示,與野生型fvii相比,本發明的融合蛋白質顯示出3~4倍提高的半衰期。表6[表6]類型半衰期(分鐘)fvii-gs1-tf254.2±19.1fvii-gs3-tf227.4±23.5fvii-gs1-t-tf235.4±27.4fvii-gs15-tf257.0±23.9fvii-tf277.0±24.5諾其(novoseven)80.3±27.4天然型fvii59.6±2.9以下內容對應于母案申請中的原始權利要求書,現作為說明書的一部分并入此處:1.包含因子vii(fvii)和轉鐵蛋白的融合蛋白質,其中所述轉鐵蛋白與所述fvii的c末端相連接。2.項1的融合蛋白質,其中所述fvii是氨基酸序列seqidno:1所示的多肽或其功能等價物。3.項2的融合蛋白質,其中所述功能等價物具有與所述fvii的功能活性基本等價的功能活性,并且在seqidno:1所示的氨基酸序列中具有氨基酸殘基的缺失、插入或替換。4.項1的融合蛋白質,其中所述轉鐵蛋白是氨基酸序列seqidno:2所示的多肽或其功能等價物。5.項4的融合蛋白質,其中所述功能等價物具有與所述fvii的功能活性基本等價的功能活性,并且在seqidno:2所示的氨基酸序列中具有氨基酸殘基的缺失、插入或替換。6.項1的融合蛋白質,其在所述fvii的c末端與所述轉鐵蛋白之間還包含限制酶識別序列。7.項1的融合蛋白質,其在所述fvii與所述轉鐵蛋白之間還包含接頭。8.項7的融合蛋白質,其中所述接頭由1至100個氨基酸組成。9.項7的融合蛋白質,其中所述接頭由1至75個氨基酸組成。10.項7的融合蛋白質,其中所述接頭由5至25個氨基酸組成。11.項7的融合蛋白質,其中翻譯自限制酶識別位點的一個或更多個氨基酸存在于所述接頭的一端或兩端。12.項7的融合蛋白質,其中所述接頭是seqidno:3至11的任一氨基酸序列所示的肽。13.項7的融合蛋白質,其中所述接頭包含蛋白酶切割位點,其能夠被選自凝血酶、因子xa、因子ixa和因子viia的蛋白酶切割。14.項13的融合蛋白質,其中所述接頭是由seqidno:12的氨基酸序列所示的肽。15.項1至14中任一項的融合蛋白質,其中所述融合蛋白質具有與未融合天然型fvii相比不低于0.7的fvii比活性。16.編碼項1至14中任一項的融合蛋白質的dna。17.項16的dna,其中所述dna由seqidno:13至24的任一核苷酸序列所示。18.包含項16的dna的重組載體。19.包含項18的重組載體的宿主細胞。20.項19的宿主細胞,其選自:cho細胞、bhk21細胞、hek293細胞和hepg2細胞。當前第1頁12
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1