5型磷酸二酯酶抑制劑及其制備方法和用途與流程
本發明屬于醫藥制藥領域,具體涉及一類β-四氫咔啉和一類吡咯并[3,4-b]喹啉酮的化合物的制備方法及其作為5型磷酸二酯酶抑制劑用于治療相關的醫學病癥。
背景技術:
5型磷酸二酯酶特異性水解cgmp,負責調節細胞內cgmp的水平,參與很多體內關鍵性的生物生理學過程。pde5抑制劑的作用的主要功能是通過抑制pde5對cgmp的水解,使細胞內cgmp的蓄積。因此pde5是治療與cgmp水平相關的如男性勃起功能障礙(maleerectiledysfunction,med)、肺動脈高壓(pulmonaryhypertension,pah)等疾病的理想藥物靶點。
目前用作pde5抑制劑商品化的藥物產品有吡唑并嘧啶酮類化合物西地那非(sildenafil)、伐地那非(vardenafil),β-咔啉類化合物他拉達非(tadalafl),以及0。在研的小分子化合物也常見報道。其中,美國強生公司的sui等人曾在j.med.chem.,2002,45,4094-4096;j.med.chem.,2003,46,441-44;j.med.chem.,2005,48,2126-33報道了一系列的吡咯并[3,4-b]喹啉酮類化合物、合成方法及其對pde5的體內及體外的抑制活性,指出了該類化合物具有較好的pde5的抑制作用,并對各磷酸二酯酶亞型具有較好的選擇性。因此,吡咯并[3,4-b]喹啉酮類化合物對于發現新型pde5抑制劑類藥物具有極大的發展潛力。
天然產物因其具有種類多樣、結構復雜、手性明確、構象固定等特點,是研發新藥的重要來源。因此以廉價易得的天然產物作為起始原料或藥物前體,對其進行結構改造和修飾,可以迅速構建并大規模制備藥物,同時還可有效降低生產成本。蒺藜(tribulusterrestrisl.)是一種傳統中藥,其中蒺藜總皂苷對心血管系統具有重要的作用,能夠顯著增加缺血部位的血供,起到改善腦循環、保護缺血腦組織。此外,蒺藜也被認為具有提高性功能的作用。因此,對從蒺藜中分離出的活性天然產物進行結構改造和修飾對設計新型pde5抑制劑類藥物具有重要意義。
技術實現要素:
發明人研究發現,蒺藜已分離提取的一種天然產物tribulusterine(c16h12n2o2,
具體的,本發明涉及以下技術方案:
一種如式(i)或式(ii)所示的化合物或其藥學上可接受的鹽,
其中,
x代表硫原子或氧原子;
y代表碳原子或氮原子;
r1代表氫原子,氯原子,甲基或甲氧基;
r2代表氫原子,溴原子,吡啶,氟取代的吡啶或甲氧基取代的苯環;
r3代表氫原子,c1-c10的烷基,c1-c10的烷氧基或c1-c4的烷基醇,r3取代基的位置為c-3、c-4或c-5位。
上述化合物的實例如下:
通式(i)所示化合物為:
1-(5-乙基噻吩-2-基)-2-(5-(吡啶-2-基)嘧啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚;
1-(5-乙基呋喃-2-基)-2-(5-(吡啶-2-基)嘧啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚;
1-(5-乙基噻吩-2-基)-2-(5-(吡啶-3-基)嘧啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚;
1-(5-乙基噻吩-2-基)-2-(5-(吡啶-4-基)嘧啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚;
1-(5-乙基噻吩-2-基)-2-(5-(2-氟吡啶-3-基)嘧啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚;
2-([2,3'-聯吡啶]-6'-基)-1-(5-乙基噻吩-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚;
2-(5-(3,4-二甲氧基苯基)嘧啶-2-基)-1-(5-乙基噻吩-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚;
1-(5-乙基噻吩-2-基)-2-(嘧啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚;
1-(5-乙基噻吩-2-基)-2-(吡啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚;
1-(5-乙基噻吩-2-基)-2-(5-(甲氧基苯基)嘧啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚;
2-(5-溴嘧啶-2-基)-1-(5-乙基噻吩-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚;
1-(5-乙基噻吩-2-基)-6-甲基-2-(嘧啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚;
1-(5-乙基噻吩-2-基)-6-甲氧基-2-(嘧啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚;
6-氯-1-(5-乙基噻吩-2-基)-2-(嘧啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚;
1-(4,5-二甲基噻吩-2-基)-2-(嘧啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚;
1-(3-甲基噻吩-2-基)-2-(嘧啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚;
1-(4-甲基噻吩-2-基)-2-(嘧啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚;
1-(5-甲基噻吩-2-基)-2-(嘧啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚;
1-(5-丙基噻吩-2-基)-2-(嘧啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚;
1-(5-丁基噻吩-2-基)-2-(嘧啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚;
2-(嘧啶-2-基)-1-(噻吩-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚;
1-(5-(2-丙氧基乙基)噻吩-2-基)-2-(嘧啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚;
1-(5-(2-丁氧基甲基)噻吩-2-基)-2-(嘧啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚;
1-(5-(2-(異戊氧基)乙基)噻吩-2-基)-2-(嘧啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚;
3-(3-(羥甲基)呋喃-2-基)--2-(嘧啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚;
1-(5-甲基呋喃-2-基)-2-(嘧啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚;
1-(5-乙基呋喃-2-基)-2-(嘧啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚;
1-(5-戊基呋喃-2-基)-2-(嘧啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚;
1-(呋喃-2-基)-2-(嘧啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚,
及通式(ii)所示的化合物:
3-(5-乙基噻吩-2-基)-2-(5-(吡啶-2-基)嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
(r)-3-(5-乙基噻吩-2-基)-2-(5-(吡啶-2-基)嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
(s)-3-(5-乙基噻吩-2-基)-2-(5-(吡啶-2-基)嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
3-(5-乙基呋喃-2-基)-2-(5-(吡啶-2-基)嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
(r)-3-(5-乙基呋喃-2-基)-2-(5-(吡啶-2-基)嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
(s)-3-(5-乙基呋喃-2-基)-2-(5-(吡啶-2-基)嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
3-(5-乙基噻吩-2-基)-2-(5-(吡啶-4-基)嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
3-(5-乙基噻吩-2-基)-2-(5-(吡啶-3-基)嘧啶-2-基)--1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
3-(5-乙基噻吩-2-基)-2-(5-(2-氟吡啶-3-基)嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;2-([2,3'-聯吡啶]-6'-基)-3-(5-乙基噻吩-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
2-(5-(3,4-二甲氧基苯基)嘧啶-2-基)-3-(5-乙基噻吩-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
3-(5-乙基噻吩-2-基)-2-(嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
3-(5-乙基噻吩-2-基)-2-(吡啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
3-(5-乙基噻吩-2-基)-2-(5-(4-甲氧基苯基)嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
2-(5-溴嘧啶-2-基)-3-(5-乙基噻吩-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
3-(5-乙基噻吩-2-基)-7-甲基-(嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
3-(5-乙基噻吩-2-基)-7-甲氧基-2-(嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
7-氯-3-(5-乙基噻吩-2-基)-2-(嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
3-(5-(羥甲基)噻吩-2-基)-2-(嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
3-(5-(2-羥乙基)噻吩-2-基)-2-(嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
3-(5-(2-丙氧基乙基)噻吩-2-基)-2-(嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
3-(5-(2-丁氧基甲基)噻吩-2-基)-2-(嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
3-(5-(2-(異戊氧基)乙基)噻吩-2-基)-2-(嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
3-(4,5-二甲基噻吩-2-基)-2-(嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
3-(3-甲基噻吩-2-基)-2-(嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
3-(4-甲基噻吩-2-基)-2-(嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
3-(5-甲基噻吩-2-基)-2-(嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
3-(5-丙基噻吩-2-基)-2-(嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
3-(5-丁基噻吩-2-基)-2-(嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
2-(嘧啶-2-基)-3-(噻吩-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
3-(3-(羥甲基)呋喃-2-基)-2-(嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
3-(4-(羥甲基)呋喃-2-基)-2-(嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
3-(5-甲基呋喃-2-基)-2-(嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
3-(5-乙基呋喃-2-基)-2-(嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
3-(5-戊基呋喃-2-基)-2-(嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮;
3-(呋喃-2-基)-2-(嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮。
上述化合物藥學上可接受的鹽優選為上述化合物與無機酸,如鹽酸、硫酸、硝酸或氫溴酸形成的鹽;或有機酸,如甲磺酸、甲苯磺酸或三氟乙酸形成的鹽。
本發明還提供上述化合物或其藥學上可接受的鹽的制備方法,所述化合物的制備合成路線如下:
其中,
x代表硫原子或氧原子;
y代表碳原子或氮原子;
r1代表氫原子,氯原子,甲基或甲氧基;
r2代表氫原子,溴原子,吡啶,氟取代的吡啶或甲氧基取代的苯環;
r3代表氫原子,c1-c10的烷基,c1-c10的烷氧基或c1-c4的烷基醇,r3取代基的位置為c-3、c-4或c-5位;
式(viii)為有機硼試劑,優選為雜環化合物的2-硼酸鹽、硼酸酯或硼酸,進一步優選為雜環-2-氟硼酸鉀化合物,所述雜環-2-氟硼酸鉀化合物結構式如下:
本發明還提供一種藥物組合物,該藥物組合物包含上述的化合物或其藥學上可接受的鹽,既可以作為單體使用,也可以作為異構體的混合物使用。
優選的,所述藥物組合物還包含一種或多種藥學上可接受的載體、賦形劑和/或稀釋劑。
優選的,所述藥物組合物包含一種或多種藥學上或食品學上可接受的輔料。所用輔料可為固態或液態。固態形式的制劑包括粉劑、片劑、分散顆粒、膠囊、藥丸及栓劑。粉劑及片劑可包含約0.1%至約99.9%的活性成分。適當的固體輔料可以是碳酸鎂、硬脂酸鎂、滑石粉、糖或者乳糖。片劑、粉劑、藥丸及膠囊為適于口服用的固態劑型。液態形式的制劑包括溶液、懸浮液及乳液,其實施例為非經腸注射用水溶液或水-丙二醇溶液,或添加甜味劑及造影劑的口服溶液。此外,還可制成注射用小水針、注射用凍干粉針、大輸液或小輸液。
優選的,所述藥物組合物為固體口服制劑、液體口服制劑或注射劑。
進一步優選的,所述藥物組合物為片劑、分散片、腸溶片、咀嚼片、口崩片、膠囊、糖衣劑、顆粒劑、干粉劑、口服溶液劑、注射用小水針、注射用凍干粉針、大輸液或小輸液。
本發明還公開了上述化合物及其藥學上可接受的鹽或者含有其任何一種實體的藥學上可接受的藥物組合物用于制備治療、緩解或預防哺乳動物與pde5相關的疾病或疾病狀態的藥物中的用途。例如制備pde5抑制劑的用途。所述疾病包括但不限于男性勃起功能障礙(med)、女性性功能障礙(fsd)、早產、痛經、良性前列腺增生(bph)、膀胱出口阻塞、失禁、穩定型、不穩定型和變異型(普林茲默托爾氏)心絞痛、高血壓、肺動脈高壓(pah)、充血性心力衰竭、動脈硬化、中風、外周血管疾病、減少血管全開的疾病、慢性哮喘、支氣管炎、變應性哮喘、過敏性鼻炎、青光眼或其特征為腸動力紊亂的疾病。
優選的,所述疾病為男性勃起功能障礙(med)或肺動脈高壓(pah)。
根據本發明制備得到的式(i)或式(ii)所示化合物和其藥學上可接受的鹽或者含有其任何一種實體的藥學上可接受的藥物組合物是可以用于制備預防和/或治療男性勃起功能障礙(med)、女性性功能障礙(fsd)、早產、痛經、良性前列腺增生(bph)、膀胱出口阻塞、失禁、穩定型、不穩定型和變異型(普林茲默托爾氏)心絞痛、高血壓、肺動脈高壓(pah)、充血性心力衰竭、動脈硬化、中風、外周血管疾病、減少血管全開的疾病、慢性哮喘、支氣管炎、變應性哮喘、過敏性鼻炎、青光眼或其特征為腸動力紊亂的疾病的藥劑。
有鑒于此,本發明的另一主題是,一種治療遭受男性勃起功能障礙(med)、女性性功能障礙(fsd)、早產、痛經、良性前列腺增生(bph)、膀胱出口阻塞、失禁、穩定型、不穩定型和變異型(普林茲默托爾氏)心絞痛、高血壓、肺動脈高壓(pah)、充血性心力衰竭、動脈硬化、中風、外周血管疾病、減少血管全開的疾病、慢性哮喘、支氣管炎、變應性哮喘、過敏性鼻炎、青光眼或其特征為腸動力紊亂的疾病的方法,所述方法包括施用治療有效量的如式(i)或式(ii)所示化合物或其藥學上可接受的鹽或者含有其任何一種實體的藥學上可接受的藥物組合物。
本文使用的術語“治療有效量”表示治療、改善靶向的疾病或病癥或者表現出可檢測的治療效果所需的治療劑的量。
本發明的化合物在相當寬的劑量范圍內是有效的。實際服用本發明式(i)或式(ii)所示化合物,其藥學上可接受的鹽者含有其任何一種實體的藥學上可接受的藥物組合物的劑量可由醫生根據有關的情況來決定。這些情況包括:被治療者的身體狀態、給藥途徑、年齡、體重、對藥物的個體反應,癥狀的嚴重程度等。
在治療過程中,上述式(i)或式(ii)所示化合物、其藥學上可接受的鹽或者所述藥物組合物還可以與至少一種其它用于治療、緩解或預防哺乳動物與pde5相關的疾病或疾病狀態的藥物合用。這些藥物可用于治療包括但不限于男性勃起功能障礙(med)、女性性功能障礙(fsd)、早產、痛經、良性前列腺增生(bph)、膀胱出口阻塞、失禁、穩定型、不穩定型和變異型(普林茲默托爾氏)心絞痛、高血壓、肺動脈高壓(pah)、充血性心力衰竭、動脈硬化、中風、外周血管疾病、減少血管全開的疾病、慢性哮喘、支氣管炎、變應性哮喘、過敏性鼻炎、青光眼或其特征為腸動力紊亂的疾病。
本發明的有益效果:
本發明制備得到的化合物具有靶點明確、安全性高,活性效果突出,在制備治療與pde5相關的疾病特別是男性勃起功能障礙(med)或肺動脈高壓(pah)的藥物中具有很好的應用前景;
同時,本發明化合物制備方法簡單,反應條件溫和,原料廉價易得,僅通過2至3步的結構修飾和改造,即可快速、大規模制備并獲得多種具有全新結構的化合物,同時具有良好的經濟性,極具大規模工業化生產價值。
附圖說明
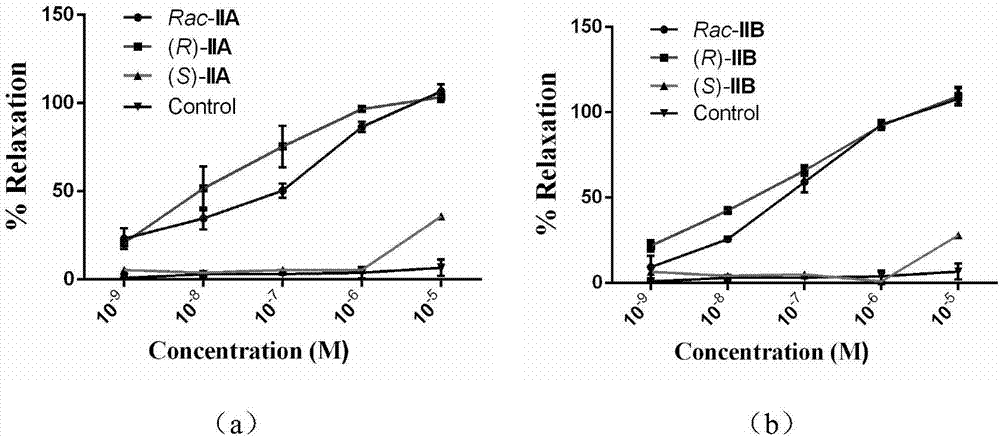
圖1(a)為化合物iia及其光學純的對映異構體對由去甲腎上腺素引起的動脈收縮的舒張作用;圖1(b)為化合物iib及其光學純的對映異構體由去甲腎上腺素引起的動脈收縮的舒張作用;
圖2(a)為化合物ii-a光學異構體(r)-iia的hplc色譜圖;圖2(b)為化合物ii-a光學異構體(s)-iia的hplc色譜圖;
圖3(a)為化合物ii-b光學異構體(r)-iib的hplc色譜圖;圖3(b)為化合物ii-b光學異構體(s)-iib的hplc色譜圖;
圖4(a)為不同濃度化合物ii-a對pde5的抑制率;圖4(b)為不同濃度西地那非對pde5的抑制率。
具體實施方式
應該指出,以下詳細說明都是例示性的,旨在對本申請提供進一步的說明。除非另有指明,本文使用的所有技術和科學術語具有與本申請所屬技術領域的普通技術人員通常理解的相同含義。
需要注意的是,這里所使用的術語僅是為了描述具體實施方式,而非意圖限制根據本申請的示例性實施方式。如在這里所使用的,除非上下文另外明確指出,否則單數形式也意圖包括復數形式,此外,還應當理解的是,當在本說明書中使用術語“包含”和/或“包括”時,其指明存在特征、步驟、操作、器件、組件和/或它們的組合。
本發明的一種具體實施方式中,提供一種如式(i)或式(ii)所示的化合物:
其中,
x代表硫原子或氧原子;
y代表碳原子或氮原子;
r1代表氫原子,氯原子,甲基或甲氧基;
r2代表氫原子,溴原子,吡啶,氟取代的吡啶或甲氧基取代的苯環;
r3代表氫原子,c1-c10的烷基,c1-c10的烷氧基或c1-c4的烷基醇,r3取代基的位置為c-3、c-4或c-5位;
除通式(i)和通式(ii)表示的化合物外,本發明還包括這些化合物的藥學上可接受的鹽、前藥化合物和活性代謝產物;
同時,由于式(i)及式(ii)化合物物分別含有一個不對稱手型碳原子,分別以兩種對映異構體的形式存在,對映體的抑制活性存在顯著差別。因此本發明包括式(i)及式(ii)的單獨的對映異構體,外消旋體或其任意比例的混合物。對映異構體的分離可以通過常規技術來完成。例如,式(ii)化合物ii-a及ii-b可以通過手型hplc色譜柱進行拆分或其適當的鹽或衍生物進行分級結晶;式(ii)化合物也可以通過光學純的式(i)化合物進行相應的化學反應制備得到,而式(i)化合物的單一對映體則可以通過hplc色譜柱進行拆分或將外消旋體與適當光學活性的酸或堿反應生成的非對映異構體鹽分級結晶;光學純的式(i)化合物也可以在適當的催化條件下通過化學反應制備得到。因此,式(i)或式(ii)所示化合物的立體異構形式將包括在本發明保護范圍內。
本發明的又一具體實施方式中,公開了上述化合物的制備方法,本發明提供的合成路線如下,使用該制備方法可以快速的合成式(i)及式(ii)化合物或其類似物,特別適合合成c-1位取代的β-四氫咔啉及其相關的衍生物,如吡咯并[3,4-b]喹啉酮類化合物。
1)式(iii)化合物一般可以直接購買商品化的產品,如無法購得,可使用相應的原料,如吲哚-3-甲醛按照文獻進行制備。如前所述,r1可以是氫原子,氯原子,甲基或甲氧基;
2)式(iv)的化合物可參照文獻,以式(iii)化合物色胺鹽酸鹽經pictet-spengler反應得到相應β-四氫咔啉,反應收率一般大于90%。
3)化合物(v)可經由化合物(iv)與相應的鹵代芳環原料制備得到,其中y和r2表示含義如前所述,具體的,y表示碳原子或氮原子,r2表示氫原子,溴原子,吡啶環或苯環,其中r2引入吡啶環或苯環主要通過鈀催化的suzuki偶聯、stille偶聯進行。合成化合物(v)主要通過以下3種方式:
i)鹵代芳烴的準備:大部分鹵代芳烴可商購或照如下的suzuki偶聯反應制備。當硼酸為苯基硼酸或取代的苯基硼酸時,轉化率一般大于90%,可以通過重結晶得到相應化合物;當硼酸為吡啶-4-硼酸或吡啶3-硼酸時,需要進行柱層析分離得到相應純品,產率分別為42%和46%;其中鈀催化劑也可以使用pd2(dba)3、醋酸鈀、二氯化鈀等催化劑。
ii)n-芳基化的過程:當芳環為嘧啶環時,主要通過化合物iv與鹵代化合物進行芳香親核取代反應制備得到;當芳環為吡啶環,即y表示碳原子時,類似的芳香親核取代反應只有小于5%的產率,因此一般通過buchwald-hartwig反應條件制備得到。在鈀催化的偶聯反應中,磷配體可以為binap或其類似的衍生物。
iii)制備r2基團為2-吡啶基的化合物,則需要通過r2為br的中間體與2-三丁基錫吡啶通過stille反應得到。其中鈀催化劑也可以使用pd(dppf)2cl2、二氯化鈀等催化劑。
4)化合物v與相應的有機硼試劑viii在氧化條件進交叉脫氫偶聯,生成相應的c-1位取代的咔啉衍生物i。如前所述,x代表硫原子或氧原子;r3代表c1-c10的烷基,c1-c10的烷氧基或c1-c4的烷基醇,取代基的位置為c-3、c-4或c-5位。
在該化學過程中,氧化劑選用二氯二氰基苯醌,四甲基哌啶氮氧化物,三苯甲基鹽,過氧化叔丁醇或羥基鄰苯二甲酰亞胺;有機硼試劑viii可以選用雜環化合物的2-硼酸鹽、硼酸酯或硼酸;氧化劑tempo四氟硼酸鹽的制備方法參照文獻j.med.chem.2016,59,5063-5076。具體的制備氟硼酸鉀鹽試化合物的過程和交叉脫氫偶聯的化學反應過程如下所述:
i)氟硼酸鹽化合物的制備可參照相應的文獻制備得到,取代基復雜的五元雜環衍生物也可以按照文獻制備。
ii)化合物v與雜環-2-氟硼酸鉀化合物viii在tempo存在的條件下反應得到。
5)式(ii)化合物主要以式(i)化合物為原料經由winterfeldt氧化得到。該化學過程可以在叔丁醇鉀/氧氣存在的條件下反應或在18-冠醚-6/超氧化鉀的存在的條件下進行。其中堿可以更換為氫化鈉。需要特別指出,當r3表示的分子內含有硅醚化的烷基醇時,叔丁醇鉀的堿性反應條件可以同時將硅保護基脫除。
本發明的又一具體實施方式中,公開了所述式(i)或式(ii)化合物,或者它們的藥學可接受的鹽或者含有其任何一種實體的藥學上可接受的藥物組合物用于制備哺乳動物與pde5相關的疾病或疾病狀態的藥物用途。通過相應的給藥方式,改用途用于治療或預防性治療男性勃起功能障礙(med)、女性性功能障礙(fsd)、早產、痛經、良性前列腺增生(bph)、膀胱出口阻塞、失禁、穩定型、不穩定型和變異型(普林茲默托爾氏)心絞痛、高血壓、肺動脈高壓(pah)、充血性心力衰竭、動脈硬化、中風、外周血管疾病、減少血管全開的疾病、慢性哮喘、支氣管炎、變應性哮喘、過敏性鼻炎、青光眼或其特征為腸動力紊亂的疾病。優選的治療疾病是男性勃起功能障礙(med)和肺動脈高壓(pah)。
本發明參照文獻j.biomol.screen.,2002,7,215-222的方法,測定了化合物對pde5的體外抑制活性,并指出上述化合物或其藥物可接受的鹽在制備用于治療和/或預防哺乳動物的與pde5相關的疾病或疾病狀態的藥物中的用途,其中抑制pde5的過程被認為是有益的。
特別優選的單體化合物i-f,iia-iiq對pde5的抑制率如下表。其中,式(i)和式(ii)化合物結構和x、y、r1、r2、r3各符號的含義如前所述。
特別優選的通式(ii)所示的單體化合物a-i對pde5抑制作用的ic50值及部分化合物對其他pde亞型的選擇性倍數值如下。
a未測定bsn=sidenafil,西地那非,pde5-6為實驗數據,pde1-4的選擇性數據參考文獻j.med.chem.2002,45,4094-4096;pde11的選擇性數據參考文獻int.j.clin.pract.2006,60,967-975.
本發明同樣涉及優選化合物iia,iib對血管擴張的作用。參考文獻am.j.respir.crit.care.med.2004,169,227-234.制作家兔離體離體動脈血管環,測定優選的化合物對去甲腎上腺素(ne)預收縮的主動脈環張力的影響,并計算iia,iib及其光學純的對映異構體作用后血管環的舒張率。結果如圖1所示,在10-6m的濃度下,化合物iia,(r)-iia,iib,(r)-iib可以使離體動脈環完全舒張,而其對映體的藥效活性則較差。
此外,本發明同樣提供了優選化合物(r)-iia,(r)-iib的藥物動力學參數。參考文獻j.chromatogr.b2016,1011,62-68,對(r)-iia,(r)-iib在wistar大鼠體內的藥物代謝動力學過程進行了研究,結果如下表所示。
以下實施例進一步解釋了本發明的化合物及中間體的合成、制備方法,化合物體內、體外的活性測定及藥代動力學的研究方法,但并不限制本發明的范圍。
實施例1
5-乙基呋喃-2-三氟硼酸鉀的制備。向圓底燒瓶中先后加入以下試劑和溶劑2-乙基呋喃(1.9g,20mmol,1eq);四氫呋喃15ml。氮氣保護的條件下,0℃滴加10ml的正丁基鋰溶液(2.5m,己烷溶液,繼續攪拌3h。將反應液在-78℃的條件下滴加至硼酸三甲酯(2.28g,22mmol,1.1eq)的四氫呋喃(5ml)中。滴加完成后,恢復至室溫攪拌0.5h后重新冷卻至0℃,滴加1m的鹽酸20ml至ph為5-6。用乙酸乙酯萃取后蒸干,重結晶得5-乙基呋喃-2-硼酸純品1.25g。0℃下向圓底燒瓶中加入5-乙基呋喃-2-硼酸(610mg,4.35mmol,1eq),khf2(1.1g,13.05mmol,3eq);甲醇1.5ml,水3.8ml。反應攪拌10min后蒸干,高真空過夜抽干。固體加入丙酮回流0.5h,過濾,蒸干濾液,用乙醚重結晶的標題化合物,460mg,2步產率為23%。1hnmr(400mhz,dmso)δ5.89(d,j=2.8hz,1h),5.74(d,j=2.3hz,1h),2.60–2.51(m,2h),1.14(t,j=7.5hz,3h).13cnmr(101mhz,dmso)δ155.6,111.1,103.4,21.4,13.1.19fnmr(376mhz,dmso)δ-138.2。
實施例2
5-乙基噻吩-2-三氟硼酸鉀的制備。向圓底燒瓶中先后加入以下試劑和溶劑2-乙基噻吩(5g,44.6mmol,1eq);四氫呋喃60ml,氮氣保護的條件下,-78℃滴加21ml的正丁基鋰溶液(2.5m,己烷溶液),攪拌0.5h后緩慢升溫至-20℃后攪拌1h。反應液重新冷卻至-78℃后,滴加硼酸三甲酯(5g,50mmol,1.1eq)的四氫呋喃(25ml)溶液中。滴加完成后,反應恢復至室溫并繼續攪拌1h。向燒瓶中滴加khf2(20.8g,267.6mmol,6eq)的水溶液并攪拌1h后蒸干,高真空過夜抽干。固體加入丙酮回流0.5h,過濾,蒸干濾液,用乙醚重結晶的標題化合物3.5g,產率為36%。1hnmr(400mhz,dmso)δ6.63(d,j=12.9hz,1h),2.75(q,j=7.5hz,1h),1.23(t,j=7.5hz,2h),13cnmr(101mhz,dmso)δ145.2,127.0,123.5,23.2,16.9。
實施例3
2-氯-5-(4-甲氧基苯基)嘧啶的制備。向微波反應管中加入以下試劑和溶劑5-溴-2-氯嘧啶(400mg,2.06mmol,1eq),對甲氧基硼酸(343mg,2.3mmol,1.1eq),四三苯基膦鈀(120mg,0.1mmol,0.05eq)和碳酸鉀(855mg,6mmol,3eq);甲苯12ml,甲醇3ml。向其中通氮氣約15min,置于微波反應器中,110℃條件下反應30min。將反應冷卻后,過濾除去碳酸鉀固體,減壓條件下將濾液蒸干,剩余物用乙酸乙酯溶解,隨后分別用水和飽和nacl溶液各洗滌一次,有機相用無水mgso4干燥,過濾,減壓濃縮至干,得到粗產品,用乙酸乙酯重結晶后得到330mg純品。1hnmr(400mhz,cdcl3)δ8.80(s,2h),7.52(d,j=8.8hz,2h),7.07(d,j=8.7hz,2h),3.89(s,3h)。
實施例4
2-氯-5-(吡啶-3-基)嘧啶的制備。按照實施例3相同的方法,以吡啶-3-硼酸與5-溴-2-氯嘧啶反應,柱層析得到純品化合物。1hnmr(400mhz,cdcl3)δ8.83-8.73(m,3h),8.67(dd,j=4.7,1.3hz,1h),7.82(dt,j=7.9,1.9hz,1h),7.41(dd,j=7.8,5.0hz,1h)。
實施例5
化合物2-([2,3'-聯吡啶]-6'-基)-1-(5-乙基噻吩-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚的制備。
1,2,3,4-四氫-β-咔啉。向圓底燒瓶中先后加入如下的預先配制的溶液,色胺鹽酸鹽(4.9g,24.9mmol,1eq)溶于78ml水,乙醛酸一水合物(2.6g,27.4mmol,1.1eq)溶于6ml水,koh(1.38g,24.9mmol,1eq)溶于6ml水。反應室溫下攪拌1小時后,生成白色固體,將反應液過濾并用6.5ml水洗固體。將固體烘干后轉移至燒瓶中,加入48.75ml水和6.63ml濃鹽酸,回流0.5h后補加6.63ml濃鹽酸,再繼續繼續回流0.5h后冷至室溫并析出大量晶體。反應液過濾并用6.5ml水洗固體,固體溶于78ml水并轉移至圓底燒瓶中,加熱至55℃后加入20%koh溶液至ph值大于12,恢復至室溫,過濾并用6.5ml水洗固體。白色固體高真空抽干得目標化合物3.1g,產率72.6%。1hnmr(400mhz,dmso)δ10.67(s,1h),7.35(d,j=7.7hz,1h),7.27(d,j=7.9hz,1h),7.05–6.96(m,1h),6.96–6.86(m,1h),3.87(s,2h),2.99(t,j=5.6hz,2h),2.60(t,j=5.6hz,2h).13cnmr(101mhz,dmso)δ135.9,134.5,127.7,120.6,118.6,117.6,111.2,107.3,43.8,43.1,22.6.esi-msm/z173[m+h]+。
2-(5-溴吡啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚。向圓底燒瓶中加入以下試劑和溶劑,1,2,3,4-四氫-β-咔啉(172mg,1mmol,1eq),2,5-二溴吡啶(260mg,1.1mmol,1.1eq),叔丁醇鈉(135mg,1.4mmol,1.4eq),dppp(33mg,0.08mmol,0.08eq),pd2(dba)3(37mg,0.04mmol,0.04eq),二甲基甲酰胺6ml。n2條件下,80℃反應18h。蒸干反應液,過濾除去固體雜質,濾液蒸干后行柱層析分離得到產品,85mg,產率為26%。1hnmr(400mhz,cdcl3)δ8.14(d,j=2.2hz,1h),7.93(s,1h),7.51(dd,j=9.1,2.5hz,1h),7.42(d,j=7.7hz,1h),7.26(d,j=7.9hz,1h),7.09(td,j=8.1,7.6,1.3hz,3h),7.06–6.99(m,2h),6.65(d,j=9.1hz,1h),4.74(s,2h),3.86(t,j=5.7hz,2h),2.90–2.78(m,2h).esi-msm/z328[m+h]+。
2-([2,3'-聯吡啶]-6'-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚。向圓底燒瓶中加入以下試劑和溶劑,2-(5-溴嘧啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚(0.987g,3mmol,1eq),2-三丁基錫吡啶(1.27g,5.7mmol,1.9eq),三苯基膦鈀(346mg,0.3mmol,0.1eq);二氧六環9ml。n2條件下,加熱至105℃反應20h,tlc檢測反應完全。反應冷卻后,減壓條件下條件下將反應液蒸干,柱層析分離得到580mg純品,產率為59%。1hnmr(400mhz,dmso)δ10.92(s,1h),8.88(d,j=2.3hz,1h),8.60(ddd,j=4.8,1.7,0.9hz,1h),8.27(dd,j=9.0,2.5hz,1h),7.88(d,j=8.0hz,1h),7.81(td,j=7.7,1.8hz,1h),7.41(d,j=7.7hz,1h),7.33(d,j=8.0hz,1h),7.26(ddd,j=7.3,4.8,1.1hz,1h),7.13–6.90(m,3h),4.88(s,2h),4.03(t,j=5.6hz,2h),2.82(t,j=5.4hz,2h).13cnmr(101mhz,dmso)δ159.4,154.9,149.9,146.7,137.5,136.4,136.1,132.7,127.1,123.8,122.0,121.1,119.3,118.9,117.9,111.5,107.5,107.3,43.5,43.4,20.8.esi-msm/z327[m+h]+。
2-([2,3'-聯吡啶]-6'-基)-1-(5-乙基噻吩-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚。圓底燒瓶中加入以下試劑和溶劑,2-([2,3'-聯吡啶]-6'-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚(326mg,1mmol,1eq),5-乙基噻吩-2-三氟硼酸鉀(327mg,1.5mmol,1.5eq),tempo(243mg,1mmol,1eq);二氯甲烷20ml。反應室溫下攪拌30min后,加入飽和的na2co3溶液終止,分出有機相,用飽和nacl洗滌一次,分液。有機相用無水mgso4干燥,過濾,濃縮至干。柱層析分離得到純品320mg,產率為74%。1hnmr(400mhz,dmso)δ11.07(s,1h),8.91(d,j=1.4hz,1h),8.60(d,j=4.3hz,1h),8.27(d,j=8.9hz,1h),7.90(d,j=7.9hz,1h),7.82(t,j=7.6hz,1h),7.46(d,j=7.7hz,1h),7.32(d,j=8.0hz,1h),7.30–7.20(m,2h),7.14(d,j=9.0hz,1h),7.08(t,j=7.5hz,1h),6.99(t,j=7.4hz,1h),6.74(d,j=2.8hz,1h),6.68(s,1h),4.49(d,j=10.7hz,1h),3.53–3.40(m,1h),2.97–2.76(m,2h),2.72(q,j=7.4hz,2h),1.17(t,j=7.5hz,3h).13cnmr(101mhz,dmso)δ157.9,154.8,149.8,146.9,146.7,141.6,137.6,136.6,136.4,133.6,126.7,126.6,123.8,123.2,122.1,121.7,119.3,119.0,118.4,111.7,108.5,107.1,50.3,38.9,23.3,20.9,16.3.esi-msm/z437[m+h]+。
實施例6
化合物3-(5-乙基噻吩-2-基)-2-(5-(吡啶-2-基)嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮的制備
2-(5-溴嘧啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚。向圓底燒瓶中加入以下試劑和溶劑,1,2,3,4-四氫-β-咔啉(10g,58mmol,1eq),5-溴-2氯嘧啶(12.35g,64mmol,1.1eq),diea(15g,116mmol,2eq);二甲基甲酰胺100ml。反應在n2條件下,加熱至120℃并反應6h。冷卻至室溫后加入水并用乙酸乙酯萃取多次,有機相用無水mgso4干燥,過濾,減壓條件下蒸干得粗產品,用乙酸乙酯打漿后過濾,得16g目標化合物純品,產率為84%。1hnmr(400mhz,dmso)δ10.93(s,1h),8.52(s,2h),7.40(d,j=7.7hz,3h),7.32(d,j=8.0hz,3h),7.17–7.01(m,3h),7.01–6.81(m,3h),4.91(s,2h),4.12(t,j=5.7hz,2h),2.77(t,j=5.5hz,2h).13cnmr(101mhz,dmso)δ160.3,158.6,136.4,132.0,127.0,121.2,118.9,118.0,111.5,107.4,106.0,42.8,42.4,20.8.esi-msm/z329[m+h]+。
1-(5-乙基噻吩-2-基)-2-(5-(吡啶-2-基)嘧啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚。按照實施例5中步驟3和步驟4相同的方法,以2-(5-溴嘧啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚為反應原料,經過兩步反應后,柱層析分離得到純品化合物360mg。兩步反應的收率分別為71%和84%。1hnmr(400mhz,dmso)δ12.19(s,1h),9.12(s,2h),8.62(d,j=4.1hz,1h),8.17(d,j=8.0hz,1h),7.94(d,j=7.9hz,1h),7.85(t,j=6.9hz,1h),7.64(dt,j=14.5,7.9hz,2h),7.41–7.30(m,2h),7.12(d,j=3.2hz,1h),6.71(s,2h),4.88(d,j=14.1hz,1h),4.73(dd,j=13.8,2.2hz,1h),2.69(q,j=7.4hz,2h),1.13(t,j=7.5hz,3h).13cnmr(101mhz,dmso)δ173.6,159.5,156.9,153.3,153.0,150.1,150.0,147.3,141.0,140.4,137.7,132.2,127.1,125.6,125.3,123.7,122.7,122.3,119.5,119.1,118.9,114.0,61.8,50.2,23.2,16.0.esi-msm/z438[m+h]+。
3-(5-乙基噻吩-2-基)-2-(5-(吡啶-2-基)嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮法a,圓底燒瓶中加入以下試劑和溶劑,1-(5-乙基噻吩-2-基)-2-(5-(吡啶-2-基)嘧啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚(178mg,0.4mmol,1eq),t-buok(136mg,0.3mmol,3eq);二甲基甲酰胺8ml。向燒瓶內不斷通入氧氣,反應攪拌12h后加水終止反應。反應液加入乙酸乙酯萃取3次,蒸干,柱層析分離得到標題化合物38mg,產率為21%。1hnmr(400mhz,dmso)δ12.19(s,1h),9.12(s,2h),8.62(d,j=4.1hz,1h),8.17(d,j=8.0hz,1h),7.94(d,j=7.9hz,1h),7.85(t,j=6.9hz,1h),7.64(dt,j=14.5,7.9hz,2h),7.41–7.30(m,2h),7.12(d,j=3.2hz,1h),6.71(s,2h),4.88(d,j=14.1hz,1h),4.73(dd,j=13.8,2.2hz,1h),2.69(q,j=7.4hz,2h),1.13(t,j=7.5hz,3h).13cnmr(101mhz,dmso)δ173.6,159.5,156.9,153.3,153.0,150.1,150.0,147.3,141.0,140.4,137.7,132.2,127.1,125.6,125.3,123.7,122.7,122.3,119.5,119.1,118.9,114.0,61.8,50.2,23.2,16.0.esi-msm/z452[m+h]+。
法b,向圓底燒瓶中小心的加入以下試劑和溶劑,1-(5-乙基噻吩-2-基)-2-(5-(吡啶-2-基)嘧啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚(180mg,0.4mmol,1eq),18-冠醚-6(105mg,0.4mmol,1eq),k2o2(170mg,2.4mmol,6eq);二甲基甲酰胺8ml。反應攪拌8h后小心的加水終止反應,反應液加入乙酸乙酯萃取3次,蒸干,柱層析分離得到產品15mg,產率為8%。
實施例7
3-(5-乙基呋喃-2-基)-2-(5-(吡啶-2-基)嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮的制備。按照實施例6中相同的方法,以2-(5-(吡啶-2-基)嘧啶-2-基)-2,3,4,9-四氫-1h-吡啶并[3,4-b]吲哚,5-乙基呋喃-2-三氟硼酸鉀為反應原料,柱層析分離得到標題化合物。1hnmr(400mhz,dmso)δ12.17(s,1h),9.11(s,2h),8.63(d,j=4.3hz,1h),8.17(d,j=8.0hz,1h),7.94(d,j=7.9hz,1h),7.85(t,j=7.5hz,1h),7.75–7.56(m,2h),7.34(dt,j=12.3,6.7hz,2h),6.53(s,1h),6.48(d,j=1.8hz,1h),6.06(s,1h),4.87(d,j=13.9hz,1h),4.76(dd,j=13.9,2.2hz,1h),1.06(t,j=7.5hz,3h).13cnmr(101mhz,dmso)δ173.5,159.7,157.6,156.9,153.0,150.1,149.7,148.4,141.0,137.7,132.1,125.7,125.2,123.7,122.7,122.2,119.4,119.1,114.6,110.3,105.6,60.2,50.4,21.2,12.1.esi-msm/z436[m+h]+。
實施例8
3-(5-乙基噻吩-2-基)-2-(5-(吡啶-3-基)嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮的制備。按照實施例6中相同的方法,以1,2,3,4-四氫-β-咔啉,2-氯-5-(吡啶-3-基)嘧啶,5-乙基噻吩-2-三氟硼酸鉀為反應原料,柱層析分離得到標題化合物。1hnmr(400mhz,dmso)δ12.14(s,1h),8.91(d,j=2.0hz,1h),8.86(s,2h),8.54(dd,j=4.7,1.4hz,1h),8.18(dd,j=7.8,0.8hz,1h),8.09(dt,j=8.0,1.9hz,1h),7.71–7.56(m,2h),7.46(dd,j=7.9,4.8hz,1h),7.35(dd,j=14.5,1.5hz,1h),7.13(d,j=3.5hz,1h),6.72(d,j=3.5hz,1h),6.67(d,j=2.7hz,1h),4.86(d,j=14.1hz,1h),4.74(dd,j=14.1,2.8hz,1h),2.69(q,j=7.5hz,2h),1.13(t,j=7.5hz,3h).13cnmr(101mhz,dmso)δ173.6,159.1,156.7,150.1,148.7,147.2,147.1,141.0,140.7,133.4,132.1,131.1,127.0,125.6,125.2,124.3,123.7,120.6,119.0,113.9,61.8,50.1,23.2,16.0.esi-msm/z452[m+h]+。
實施例9
3-(5-乙基噻吩-2-基)-2-(嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮的制備。按照實施例6中相同的方法,以1,2,3,4-四氫-β-咔啉,2-氯嘧啶,5-乙基噻吩-2-三氟硼酸鉀為反應原料,柱層析分離得到標題化合物。1hnmr(400mhz,dmso)δ12.16(s,1h),8.45(d,j=3.9hz,2h),8.17(d,j=8.0hz,1h),7.80–7.55(m,2h),7.35(t,j=7.1hz,1h),7.09(d,j=3.3hz,1h),6.75(t,j=4.7hz,1h),6.70(d,j=3.2hz,1h),6.62(d,j=2.5hz,1h),4.80(d,j=14.1hz,1h),4.66(dd,j=14.1,2.7hz,1h),2.68(q,j=7.5hz,2h),1.13(t,j=7.5hz,3h).13cnmr(101mhz,dmso)δ173.6,159.6,158.5,150.2,147.1,140.8,132.1,126.8,125.6,125.2,123.7,119.1,114.1,111.5,61.6,49.9,23.2,16.0.esi-msm/z361[m+h]+。
實施例10
3-(5-羥甲基)噻吩-2-基)-2-(嘧啶-2-基)-1,2,3,4-四氫-9h-吡咯并[3,4-b]喹啉-9-酮的制備。按照實施例1和實施例6中相同的方法,以1,2,3,4-四氫-β-咔啉,2-氯嘧啶,5-羥甲基噻吩為反應原料,柱層析分離得到標題化合物。1hnmr(400mhz,dmso)δ12.17(s,1h),8.44(d,j=4.1hz,2h),8.22–8.11(m,1h),7.71–7.58(m,2h),7.35(t,j=7.2hz,1h),7.14(d,j=3.5hz,1h),6.81(d,j=3.5hz,1h),6.75(t,j=4.8hz,1h),6.63(d,j=2.8hz,1h),5.36(t,j=5.7hz,1h),4.81(d,j=14.1hz,1h),4.68(dd,j=14.1,3.1hz,1h),4.50(d,j=5.3hz,2h).13cnmr(101mhz,dmso)δ173.6,159.5,158.5,150.2,146.6,142.7,141.0,132.1,126.4,125.6,125.2,124.0,123.7,119.0,114.0,111.5,61.6,58.8,50.0.esi-msm/z363[m+h]+。
實施例11
化合物ii-a和ii-b的手性拆分。采用hplc法,使用大賽璐的制備設備和大賽璐手性柱對手性異構體分離,收集其相應組分。旋轉蒸發除去溶劑,得到光學異構體的純品,化合物ii-a和ii-b光學異構體色譜圖如圖2、圖3所示。相應的色譜條件如下表所示:
實施例12
化合物ii-a對ped-5的抑制活性的測定。配制45μl的酶促反應體系,各組分濃度如下:40mmmops,ph7.5,0.5mmedta,15mmmgcl2,0.15mg/mlbsa,1mmdtt,0.05%proclin200,15ng/mlpde5,100nmfam-cyclic-3’,5’-amp和100nm化合物ii-a(或等濃度的dmso)。反應體系在25℃條件下保持1h后,加入100μl稀釋的imap溶液并在25℃條件下低速振動1h。讀取樣品的在360nm和480nm激發光下的熒光數值,重復實驗3次。計算pde5的酶活和化合物ii-a對pde5的抑制率。化合物ii-a在100nm濃度下對ped-5的抑制作用實驗結果如下,西地那非為陽性對照。
測定化合物ii-a在0.03nm-1μm共計8個濃度下對pde5的抑制率,將劑量和抑制率經一定變換后用非線性回歸方程擬合,用prismgraphpad軟件計算,得到相應ic50數值。化合物ii-a和陽性對照西地那非的結果如下,計算化合物ii-a的ic50值為0.60±0.01nm,西地那非的ic50值為3.1±0.57nm。
實施例13
化合物ii-b對其他pde亞型的抑制活性的測定。按照實施例12中相同的方法,pde酶亞型分別改為pde1,pde2,pde3,pde4,pde6和pde11與相應的底物fam-cyclic-3’,5’-amp或fam-cyclic-3’,5’-gmp反應,計算化合物ii-a在相應的濃度倍數下對各pde亞型的抑制作用,結果如下表所示:
apde1-4相應濃度下的抑制率%(濃度)bpde6,pde11的ic50值
實施例14
化合物(r)-iia在wistar大鼠中的藥物代謝動力學研究。配制0.5mg/ml的生理鹽水注射液和2.5mg/ml的水溶口服液,分別按照靜脈注射或口服給藥的方式處理每組6只大鼠。在給藥后0.1,0.25,0.5,0.75,1,2,4,6,12,24h采血后制備得到血漿樣品。取血漿樣品50μl與5μl內標樣品混勻后,經3min的渦旋震蕩和10min的離心(14000轉/分鐘)后,吸取10μl上清液用于lc-ms/ms分析。計算藥物含量后使用drugandstatisticssoftwareversion2.0軟件進行分析得相應的藥物動力學參數。結果如下表。
化合物iia:
化合物iib:
以上所述僅為本申請的優選實施例而已,并不用于限制本申請,對于本領域的技術人員來說,本申請可以有各種更改和變化。凡在本申請的精神和原則之內,所作的任何修改、等同替換、改進等,均應包含在本申請的保護范圍之內。
- 還沒有人留言評論。精彩留言會獲得點贊!