一種受光或生長素誘導的啟動子HLP3的制作方法
本發明屬于植物生物工程育種和分子生物學技術領域,涉及一種植物的啟動子,具體說,涉及擬南芥的一個受光或生長素誘導的啟動子hlp3及其應用。
背景技術:
植物的生長發育過程離不開光的影響,光不但能提供能量,也作為一種外源信號提供了季節變化和位置信息。植物感受光信號,并將信號傳遞到下游,影響植物的光形態建成。植物光形態建成與外界環境相協調(溫度、庇蔭、生物及非生物脅迫),與自身生物鐘相協調,使植物在改變的內外環境中更好地生存。而生長素作為植物體內一種至關重要的內源激素信號,其代謝和分布都直接關乎到植物的生長發育。在植物生長過程中,外界的光信號往往與內源的生長素信號協同作用于植物,例如植物的向光性生長就是光和生長素共同作用的結果。目前已有的研究了解到,光信號會影響植物生長素的合成與分布,生長素含量高低將直接關系到作物生長于發育。生長素能夠整合各種環境信號,控制下游相關基因響應,影響作物器官大小,結實率等性狀。可見,光和生長素是控制植物生長發育的兩大關鍵要素。
既然光對植物的生長如此重要,那么光無論作為能源還是作為信號,在農業生產上都將對作物的產量構成影響。同樣,生長素或者具有生長素活性的生長調節劑在目前也被廣泛應用于農業生產中,用來調節瓜果蔬菜的生長與發育。從另一方面講,如果能夠通過作物改良,改變作物對光和生長素的感應,就有可能培育出更加高產穩產的新品種。隨著分子生物學的迅速發展,轉基因技術已為作物新品種的培育提供了新思路和新方法,具有方便快捷、目標定向、周期短等種種優勢。目前在國內外商業化種植的轉基因抗蟲棉、抗蟲玉米、抗除草劑大豆、抗病番木瓜等就是新一代育種技術的成功案例。這種技術依賴于發掘并克隆植物重要的抗逆功能基因和調控元件,進而進行作物的分子設計與遺傳改良,以提高作物對不良環境的適應性,已經成為保證糧食安全的有效措施。
如果通過轉基因技術改變作物對光和生長素的感應能力,光信號或生長素信號誘導型的啟動子的發現和利用將變得尤為重要。然而,在目前作物遺傳改良中能夠被廣泛使用的啟動子非常有限,在單子葉植物主要使用來自玉米泛素(ubiquitin)基因的啟動子和水稻肌動蛋白(actin)基因啟動子,在雙子葉植物主要使用來自花椰菜花葉病毒(camv)的35s啟動子(yeetal.2012)。這些啟動子都屬于組成型啟動子,也就是說在這些啟動子的調控下,目標基因每時每刻都在表達。這種類型的啟動子不會對光和生長素做出響應,也就無法保證作物對光和生長素做出適當的反應。因此,針對光和生長素的作物遺傳改良來講,光信號或生長素信號誘導型啟動子的發現、克隆、功能分析和利用已成為當前一個重要的創新研究方向。將功能明確的光信號或生長素信號誘導型啟動子成功應用到轉基因作物育種中將是未來遺傳育種的重要方向。
申請人在相關研究中從擬南芥克隆到一種光或者生長素誘導的啟動子,命名為啟動子hlp3。該啟動子功能揭示它在糧食作物、瓜果蔬菜等遺傳育種上的應用將具有重要價值。迄今為止,未見該啟動子克隆和應用的相關報道。
技術實現要素:
針對目前的技術現狀,本發明的目的是提供一種來源于擬南芥基因組的受光或生長素誘導的啟動子及其應用。
本發明所述的擬南芥的一種受光或生長素誘導的啟動子,命名為啟動子hlp3;其特征在于:該啟動子的核苷酸序列是下列核苷酸序列之一:
(1)序列表中seqidno:1所示的dna序列。
(2)與序列表中seqidno:1所示的dna序列具有90%以上同源性,且具有相同功能的dna序列。
(3)對上述(1)或(2)所示dna序列進行一個或多個堿基的取代、缺失和/或添加且具有相同啟動子功能的dna。
進一步優選的實施方式是:所述啟動子命名為啟動子hlp3,其核苷酸序列是序列表中seqidno:1所示的dna序列。
上述啟動子hlp3可以利用seqidno.2和seqidno.3所示的引物序列,通過pcr技術從擬南芥基因組dna中克隆獲得。
鑒于本領域專業人員很容易通過定向優化或者點突變等方法對本發明專利中所述的啟動子序列進行修飾或突變,那些經過人工修飾改造后具有與本發明所提供的啟動子堿基序列同源性≧60%且仍具有啟動子活性的核苷酸序列均為本發明中所述啟動子序列衍生物,等同于本發明所述序列,屬于本專利的保護范疇。
含有上述啟動子的載體、轉基因組織或細胞系、重組菌株和轉基因植株等均屬于本發明的保護范圍。
本發明所述擬南芥的一個受光或生長素誘導的啟動子在植物基因研究或基因工程育種中的應用。
其中,所述應用的方法是:所述啟動子hlp3為光或生長素誘導型啟動子,將其作為啟動子分別與功能基因融合構建植物表達載體,并轉入植物中,以實現在轉基因植物體內的誘導型高表達。
其中,所述植物優選是農作物、經濟林木、牧草或草坪草;所述植物體是指在植株器官、組織、細胞或整株水平。
進一步的,所述農作物優選是棉花、大豆、煙草、油菜、白菜、甘藍、芥菜、玉米、小麥或水稻。
本發明利用seqidno.2和seqidno.3所示的引物序列,通過pcr技術從擬南芥基因組dna中克隆啟動子hlp3,然后利用該啟動子構建報告基因gus的植物表達載體,進行植物轉基因操作,獲得轉基因植物。試驗檢測表明:本發明的啟動子hlp3能夠明顯增強報告基因在不同光照強度或生長素處理條件下的表達水平(見附圖)。
本發明的突出效果是:在當前作物育種中缺少理想的誘導型啟動子的背景下,本發明為植物基因功能研究和基因工程育種提供了植物來源的誘導型強啟動子,并可以將其廣泛用于培育作物新品種,實現了明顯增強功能基因在不同光照或生長素處理條件下的表達水平的目的,在農作物基因工程育種中具有重要的應用價值和很好的開發前景。
附圖說明
圖1.hlp3啟動子pcr擴增產物的電泳圖,其中:m為分子量marker,泳道1-4為啟動子dna。
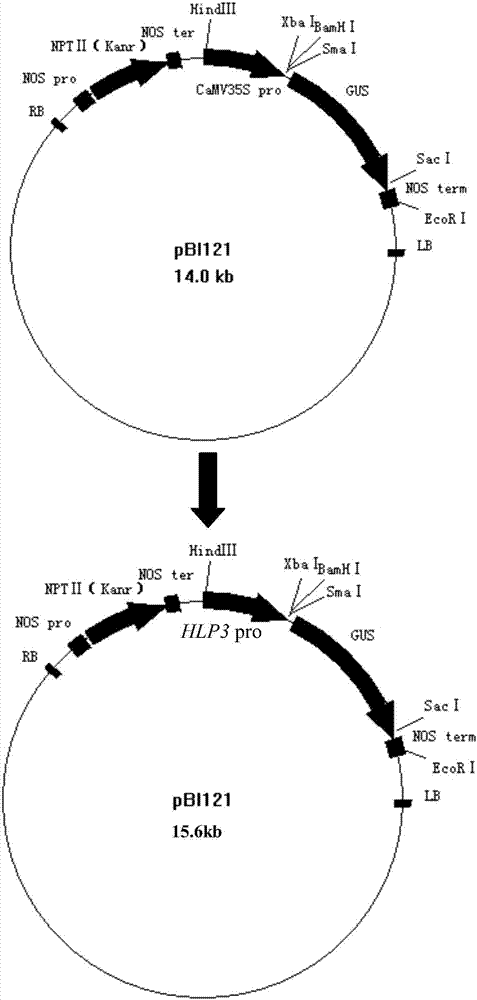
圖2.hlp3啟動子與gus報告基因連接示意圖。用hlp3啟動子替換pbi121載體中的camv35s啟動子,即得到hlp3啟動子連接gus報告基因的植物表達載體。
圖3.hlp3-gus轉基因擬南芥的下胚軸在照光后gus染色明顯加深,表明hlp3是一個受光照強烈誘導的啟動子。
圖4.hlp3-gus轉基因擬南芥在黑暗、光照不同時間后葉片中gus基因表達的水平變化。再次表明hlp3是一個受光照強烈誘導的啟動子。
圖5.hlp3-gus轉基因擬南芥在生長素iaa或者iba處理前后,葉片中gus酶活的染色對比圖。證明hlp3是一個生長素強烈誘導的啟動子。
具體實施方式
下述將通過具體實施例子對本發明作進一步的說明,但本發明并不僅限于以下具體實施例子。下面實施例子中所描述的方法內容若無特殊說明,均為常規實驗方法。
實施例1擬南芥hlp3啟動子的獲得
為了得到誘導型啟動子,本發明人從擬南芥基因組克隆了100多個基因的啟動子,逐一對這些啟動子活性進行大規模篩選。發現hlp3啟動子具有很強的受光或生長素誘導的活性。下面敘述它的具體克隆過程。
1)首先根據擬南芥tair數據庫,選定hlp3基因的翻譯起始密碼子atg上游約1.6kb的調控序列作為hlp3啟動子序列。
2)依據上述序列,利用primer5.0軟件設計pcr擴增引物如下。
hlp3-f:5'aagcttaggattagttttgctatcggtta3';
hlp3-r:5'ggatcctttcttcttcttatctttttcttttc3'。
上游引物5'末端添加hindiii酶切位點,下游引物5'末端添加bamhi酶切位點,便于后續的啟動子克隆。
3)采用ctab法提取擬南芥基因組dna,具體參見《分子克隆實驗指南ⅲ》,以提取的dna為模板進行pcr擴增,反應體系如下所示:
pcr反應體系:10mmtris·cl,1.5mmmgcl2,50mmkcl,200μmdntpeach,0.8μm引物,0.8u高保真dnapolymerase,1μldna模板,無菌水補足25μl。
pcr反應程序:95℃預變性5min;95℃變性40s,55℃退火40s,72℃延伸1min30s,循環35次;72℃延伸5min。擴增產物進行瓊脂糖凝膠電泳。
4)電泳結束后,利用天根公司生產的dna片段回收試劑盒(tiangenbiotechco,ltd)回收目的條帶,凝膠回收具體步驟參見其說明書。回收的目的條帶通過t-a連接直接連入中間載體pmd-t18。連接產物轉化大腸桿菌感受態細胞dh5α。向轉化的大腸桿菌管中加入約1mllb培養基37℃200rpm振蕩培養1小時,4000rpm離心5min收菌,涂布在含有100μg/ml氨芐青霉素lb固體平板上過夜培養,挑單克隆在含有50mg/l氨芐青霉素的液體lb培養基中振蕩培養6-8小時后提取質粒dna,經pcr鑒定插入片段的大小,然后送華大科技股份有限公司進行測序確認,以確保啟動子的正確性。
實施例2擬南芥hlp3啟動子的植物表達載體構建和農桿菌轉化
目的是獲得hlp3啟動子驅動葡萄糖苷酸酶報告基因(gus)表達的載體,同時獲得含有該載體的農桿菌,為后續的轉化擬南芥做準備。
1)將hlp3啟動子從pmd-t18中間載體上用hindiii和bamhi兩種限制性內切酶切出,pbi121植物表達載體也用同樣的兩種酶切開(內切酶購自takara公司,具體酶切的條件和程序參見其說明書)。酶切產物經瓊脂糖凝膠電泳后使用天根公司的凝膠回收試劑盒回收(參考說明書)。
2)將獲得的酶切后的啟動子片段與載體進行連接(使用thermo公司的t4dna連接酶,連接體系參照公司說明書)。連接反應體系輕輕混勻,置于22℃恒溫水浴鍋連接0.5h,隨后將連接產物直接用于轉化大腸桿菌。
3)大腸桿菌的轉化。融化固體lb培養基,待冷卻到50℃左右時加入kan抗生素至50mg/l,混勻后倒平板;-80℃冰箱中取出約50μl感受態大腸桿菌置于冰上,加入連接產物后輕輕混勻;冰浴30分鐘,同時42℃熱激90s,隨后迅速冰浴2min;向管中加入800μl液體lb培養基(不含抗生素)混勻后放入搖床,37℃,200rpm,1h復蘇;復蘇結束后,5000rpm,離心3min,將上清吸至剩余約100μl左右,輕輕將菌懸浮;將其涂布于上述準備好的平板上,倒置平板,放入培養箱中37℃過夜培養;挑單克隆搖菌,提取質粒進行酶切鑒定和測序,確認大腸桿菌中含有構建正確的hlp3-gus表達載體。
4)農桿菌的轉化。農桿菌gv3101具有侵染植物和轉移基因的能力,故需要將構建的hlp3-gus表達載體轉入農桿菌。取80μl農桿菌液接種到含50μg/ml利福平(rif)的lb培養基中,28℃培養一夜;取1ml菌液,加至50ml含50μg/mlrif的lb培養基中,28℃震蕩培養,至od600=0.5;菌液冰浴30min,4℃,4500rpm,離心10min,收集菌體;將菌液重新懸于預冷的10ml0.15mol/l的cacl2中,4℃,4500rpm,離心10min,收集菌體;將菌液重新懸于冰浴的1ml20mmol/l的cacl2溶液中,用1.5ml的ep管進行分裝,液氮速凍1min,儲存于-70℃作為農桿菌感受態備用;從上述大腸桿菌中提取hlp3-gus表達載體,取100μl農桿菌感受態細胞在冰上化開,把表達載體10μl加入其中,輕輕混合均勻,冰上放置30分鐘;液氮速凍1min,迅速移至37℃水浴5min,立即冰浴2-3min;加入lb培養基(未添加抗生素)1ml,28℃培養3h;7000rpm,離心1min,收集菌體,涂于含50μg/ml利福平、50μg/mlkan的lb平板上,28℃倒置暗培養3天。挑取農桿菌單菌落,用添加了50μg/mlkan的lb培養基擴增培養,從農桿菌中提取質粒,進行后續pcr驗證,以確定hlp3-gus表達載體轉入了農桿菌gv3101。
實施例3hlp3啟動子轉化擬南芥驗證其受光或生長素強烈誘導
目的是將hlp3啟動子-gus表達載體轉入擬南芥,獲得轉基因植物,用于驗證hlp3啟動子是否能夠被光或者生長素誘導。
1)利用浸花法(一種公開的通用方法),使含有植物表達載體的農桿菌gv3101浸染擬南芥花蕾。待其長出的角果成熟之后,收集t1代種子并在篩選培養基(ms培養基附加30mg/l卡那霉素)上進行篩選,將能夠正常生長的綠色轉化苗移栽至營養土中培養,分別收獲其t2代種子再進行下一輪的卡那霉素篩選,挑選出綠苗:白苗為3:1的培養皿。將此培養皿上的綠苗移栽,單株收獲種子(t3代)。對每一單株的種子部分用于卡那霉素平皿篩選,直到選出在篩選培養基上為全綠的株系,即為純合轉基因株系。
2)為了分析hlp3啟動子對光信號或生長素的響應情況,對hlp3-gus轉基因擬南芥進行了相應處理。具體做法如下:
光照處理:在黑暗中生長4days的hlp3-gus轉基因幼苗,暴露在光下0h、12h和24h;分別取材進行gus染色或者進行qrt-pcr分析gus基因的表達水平。
iaa處理:將在ms固體培養基中培養兩周的hlp3-gus轉基因幼苗,用鑷子小心夾取部分幼苗,移植到外源添加10μmiaa(或iba)的ms液體培養基中,對照組僅用ms液體培養基在常溫下處理。在處理3h、6h、12h、24h后,分別取材進行gus染色。
3)gus染色的具體做法是:將植物材料放入離心管中,倒入冰預冷的90%丙酮沒過植物材料,插到冰上放置30min。用現配的gus染色緩沖液(公知的配方)清洗材料,置于冰上20分鐘,倒掉緩沖液再加入新的緩沖液重復洗一次,再倒掉染色緩沖液。倒入配好的染色液(染色緩沖液中加入終濃度為2mm的x-gluc),保證植物材料完全沒入其中。根據染色情況在37℃溫箱中染色6-12h。75%乙醇清洗材料,去除染色液,倒入無水乙醇浸泡材料直至完全脫色。實體解剖顯微鏡下觀察并拍照。
上述gus表達和gus染色結果表明,hlp3啟動子是一個受光或生長素強烈誘導的啟動子(附圖3,附圖4,附圖5)。該啟動子的發現將會在在光和生長素調控生長的農作物遺傳改良中顯示出巨大的應用潛力。
序列表
<110>山東大學
<120>一種受光或生長素誘導的啟動子hlp3
<141>2017-7-3
<160>3
<210>1
<211>1570
<212>dna
<213>擬南芥
<221>啟動子hlp3的核苷酸序列
<222>(1)…(1570)
<400>1
aggattagttttgctatcggttataggattcctggtaaaaaaatgtcttattattttcta60
agcaatattaaagatgaggtaatgagtaaaaattattatttttctccagattctagatta120
gatgagccagtgacagagcttccacctttgaaagtgaaggatcttccggtaatggaaacg180
aatgagccggaggaactttaccgggtagttaacgacatggtggaaggagccaagtcttct240
tcaggagtcatatggaacacatttgaagatcttgaaagactatcacttatgaattgtagc300
agcaaattacaagttccatttttcccgatcggaccgtttcacaaatatagcgaagatcct360
acaccgaagacagagaacaaggaagataccgattggctcgacaagcaagacccacagtcg420
gtggtctatgcgagtttcggaagccttgcagctatagaagagaaggagtttctcgagatt480
gcttggggtctaagaaacagtgaacgaccgtttttgtgggtggttaggccggggtctgtc540
agggggaccgagtggctcgagtcattgcctttagggtttatggaaaacattggagataag600
ggaaaaatcgtgaaatgggcgaatcagttagaggtattggcgcatcctgccattggagcg660
ttttggacacattgtggatggaactcgacactagagagcatatgtgaaggtgttcctatg720
atatgtacgtcatgtttcacggaccagcatgtgaacgcgagatacatcgttgatgtatgg780
cgagtcgggatgttgttagagagaagtaagatggaaaagaaggagattgaaaaggtgcta840
agaagtgtaatgatggagaagggagatggattgagggaaaggagtttgaagttgaaagag900
agagctgatttttgcttaagtaaagatgggtcttcttccaagtatttagacaaacttgtg960
agtcatgtcctgtcttttgattcttatgcttttgcaagttaagaaaacttatgaatgagt1020
aacgtattctaagcactctccaaaagttccaaaaccattggatgttttgtttcttcaaat1080
aataatgttcttgagttaattgttttttttcagattaaagtcaaaatttattgaatttta1140
ttttacgaatttaccgtttcatattatttctaatatttacttaggatccaataaattttg1200
accataataggttgataatattatgttgaatctgaatataccaaataacatttatttatt1260
tttccctaatgttttaaagtaatgtgtggaacaaacgtgtgtaccaagcggcgacgaaag1320
ttgaatgtgtgatgggtacaacttaaatggcccatgatcctatcataggattcctatgta1380
aagtcgacagctttcctagctgcatgtgagaagaaaaataagattttagctaggatttgt1440
gacgatgctcgcggacagacagtgacttgagagagcctttgtttggccgaaagtgttcaa1500
caacaaatccaatatatccttgaagtctagatcccacataattagaaaagaaaaagataa1560
gaagaagaaa1570
<210>2
<211>29
<212>dna
<213>人工序列
<221>hlp3-f
<222>(1)…(29)
<400>2
aagcttaggattagttttgctatcggtta29
<210>3
<211>32
<212>dna
<213>人工序列
<221>hlp3-r
<222>(1)…(32)
<400>3
ggatcctttcttcttcttatctttttcttttc32
- 還沒有人留言評論。精彩留言會獲得點贊!
- 大豆低溫誘導型啟動子、包含該啟動子的重組表達載體及應用的制作方法與工藝
- 受植物激素調控的啟動子及其應用的制作方法與工藝
- 一種受鹽誘導的特異性誘導型啟動子DNA序列及應用的制作方法與工藝
- 受維甲酸調控的具有濃度依賴效應的重組啟動子及其使用的制作方法與工藝
- 一種磷酸鹽誘導啟動子降低黑曲霉β?葡萄糖苷酶表達酶活的方法與流程
- 一種疫霉誘導性人工合成啟動子PMP1及其重組表達載體和應用的制作方法與工藝
- 一種植物鹽/干旱誘導型啟動子soyEQ及其應用的制作方法與工藝
- 新型的L-蘇氨酸-誘導型啟動子及其應用的制作方法與工藝
- 一種植物茉莉酸甲酯誘導表達啟動子PosMeJ1及其應用的制作方法與工藝
- 一個逆境誘導啟動子SlWRKY31P的克隆及應用的制造方法與工藝