使用血液結合素的組合物和治療方法與流程
與本申請相關的序列表以電子形式通過EFS-Web提交并且因此其全部內容通過引用并入本說明書。本申請中使用的小節標題僅用于組織目的并且不應將其解釋為限制以任何方式描述的主題。
背景技術:
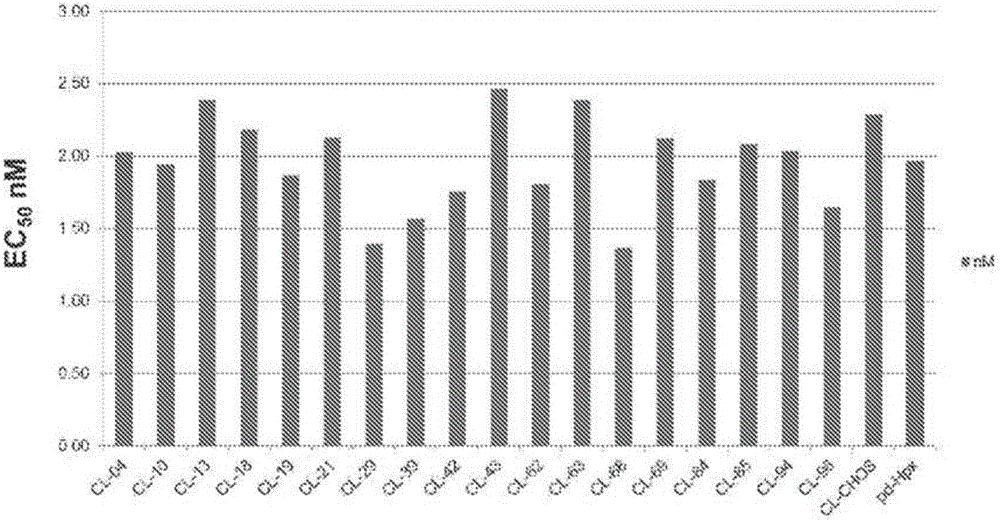
:血紅素在生物有機體內具有多種功能。其是血紅素蛋白如細胞色素、DNA合成酶、肌紅蛋白和血紅蛋白的關鍵組成。然而,較高水平的游離血紅素可能是有毒的,并且失控的游離血紅素能夠導致多種疾病和病癥。在具有加速溶血的疾病中,如鐮狀細胞病(SCD)和β-地中海貧血(BThall),與正常對照相比血紅素水平升高。升高的血紅素水平是由于裂解的紅細胞釋放血紅蛋白所致,其在輕度氧化后釋放出血紅素部分。游離的血紅蛋白和血紅素清除一氧化氮并催化具有細胞毒性的活性氧中間體形成以及在細胞中誘導促炎性應答。肝臟在輔助調節血紅素水平方面起著至關重要的作用。肝臟與各種蛋白(包括FLVCR)聯合作用,將過量的血色素運出到膽汁和糞便中。在正常個體中,有兩種蛋白觸珠蛋白和血液結合素分別清除游離的血紅蛋白和血紅素,并因而降低相關的細胞毒性和促炎性作用。血液結合素是一種基于血漿的糖蛋白,其防止出現與溶血性和感染性疾病相關的血紅素介導的細胞毒性。這種蛋白在一些臨床環境中變得嚴重耗竭,例如鐮狀細胞病(SCD)和地中海貧血。血液親和素具有已知最高的與血紅素的結合親和性(據報道為Kd<1pM)。而且,除了降低游離血紅素的毒性作用外,血液結合素能夠降低游離血紅蛋白的負面效應,據推測是由于其能夠清除相關的毒性血紅素。在溶血性疾病中,觸珠蛋白和血液結合素兩者變得嚴重耗竭,留下血紅蛋白和血紅素任意發揮其負面效應。血液結合素還能夠作為血紅素清除劑,以減輕在溶血性疾病中游離血紅素的毒性作用。例如,人血漿來源的血液結合素在SCD和Bthall小鼠模型中已顯示出降低細胞毒性和促炎性作用并改善血管功能。血液結合素已顯示出結合并螯合血管內的血紅素并降低其相關毒性。人血漿來源的血液結合素是全唾液酸化的血漿糖蛋白,其具有7天的循環半衰期。在與血紅素結合后,在血液結合素中發生構象改變,這增加了其在肝細胞中對LRP受體的親和力,導致該復合物從循環中迅速移除(T1/2=7小時)。血液結合素被N和O-連接的碳水化合物廣泛地糖基化。N-連接聚糖上半乳糖殘基適當唾液酸化可以對體內蛋白的清除性質具有顯著影響。唾液酸化不足可以通過肝細胞上的去唾液酸糖蛋白受體導致更迅速的清除,從而使其在有機會發揮治療效果之前將其從循環中移除。當爭取高表達水平,其中糖基化和唾液酸化途徑可能無法跟上蛋白質產生的速率時,這對于重組蛋白可能特別有問題。蛋白的生物利用度是影響或減輕特定疾病或其相關癥狀的關鍵因素。而且,對于治療性治療的另一限制因素是使用血液結合素似乎需要施用較高水平的蛋白。這可能是由于在加速溶血的疾病中看到的高周轉速率所致。當來源于血漿的血液結合素可能作為臨床開發的來源時,其具有固有的風險,如將疾病(例如HCV、HIV)傳播給患者的可能性。重組血液結合素生產工藝的改進能夠提高使用商業上可行的方法制備此類蛋白的可能性。仍需要用于治療性治療和從生物有機體的細胞和血漿中除去血紅素的有效組合物和方法。而且,從細胞和血漿中輸出血紅素以降低過量血紅素的毒性并防止與這些失衡有關的各種生物病癥是必要的。技術實現要素:提供了用于治療性治療的組合物和方法,所述組合物和方法包括具有充分唾液酸化和/或足夠低水平或缺乏中性聚糖以使得其充分循環以便從生物有機體除去游離血紅素的重組血液結合素分子。在一些實施方式中,提供了用于治療性治療的重組血液結合素分子,所述重組血液結合素分子包含在使用熒光探針2-氨基苯甲酸標記后通過HPLC測得的中性聚糖占總聚糖的百分數在從約百分之2至約百分之30的范圍。在至少一個實施方式中,重組血液結合素分子可以由CHO細胞表達,如CHO-K1細胞。在至少一個實施方式中,重組血液結合素分子可以包含哺乳動物血液結合素分子。在至少一個實施方式中,用于治療性治療的重組血液結合素分子包含在使用熒光探針2-氨基苯甲酸標記后通過HPLC測得的中性聚糖的百分數在從約百分之2至約百分之30的范圍,單唾液酸化聚糖的百分數在從約百分之2至約百分之40的范圍以及二/三唾液酸化聚糖的百分數在從約百分之20至約百分之90的范圍。在至少一個實施方式中,血液結合素分子用于治療疾病中血紅素的毒性效應,如鐮狀細胞病或β-地中海貧血。在至少一個實施方式中,所述血液結合素分子包含在使用熒光探針2-氨基苯甲酸標記后通過HPLC測得所述中性聚糖占總聚糖的百分數小于百分之30。在至少一個實施方式中,在使用熒光探針2-氨基苯甲酸標記后通過HPLC測得所述中性聚糖占總聚糖的百分數小于百分之20,或小于百分之10。在其他實施方式中,提供了與SEQIDNO:1具有90%或更高同源性的重組血液結合素分子,其中在使用熒光探針2-氨基苯甲酸標記后通過HPLC測得的中性聚糖占總聚糖的百分數在從約百分之2至約百分之30的范圍。還提供了制備重組血液結合素分子的方法。在一些實施方式中,制備具有使用熒光探針2-氨基苯甲酸標記后通過HPLC測得的中性聚糖占總聚糖的百分數在從約百分之2至約百分之30范圍的重組血液結合素分子的方法包括將適宜的插入物和載體插入CHO細胞中;以及從該CHO細胞表達重組血液結合素分子,其中使用熒光探針2-氨基苯甲酸標記后通過HPLC測得重組血液結合素的中性聚糖百分數在從約百分之2至約百分之30的范圍。在該方法的至少一個實施方式中,CHO細胞包括CHO-K1細胞。在其他實施方式中,還提供了使用血液結合素的治療性治療的方法。在一些實施方式中,治療方法包括向對象施用重組血液結合素分子,所述重組血液結合素分子具有使用熒光探針2-氨基苯甲酸標記后通過HPLC測得的中性聚糖占總聚糖的百分數在從約百分之2至約百分之30的范圍。在至少一個實施方式中,重組血液結合素分子以足以結合游離血紅素的半衰期在血液中循環。在本公開的另一個方面,重組血液結合素分子用于減少血管內和/或細胞內的血紅素以治療選自下組的疾病:鐮狀細胞病、β-地中海貧血、缺血再灌注、紅細胞生成性原卟啉癥、遲發性皮膚卟啉癥、瘧疾、類風濕性關節炎、與炎癥相關的貧血、血色素沉著癥、陣發性夜間血紅蛋白尿(PNH)、葡萄糖-6-磷酸脫氫酶缺乏癥、溶血性尿毒癥綜合征(HUS)、血栓性血小板減少性紫癜(TTP)、先兆子癇、敗血癥、急性出血和與血液或血液代用品輸血相關的并發癥以及與器官移植相關的器官保存。在本公開的另一個方面,重組血液結合素分子用于從細胞輸出血紅素的方法中,所述方法包括將細胞與重組血液結合素分子結合,所述重組血液結合素分子包含使用熒光探針2-氨基苯甲酸標記后通過HPLC測得的中性聚糖占總聚糖的百分數在從約百分之2至約百分之30的范圍。在至少一個實施方式中,重組血液結合素分子用于治療與游離血紅素的毒性相關的病癥的方法中,所述方法包括向需要其的對象施用有效量的重組血液結合素分子,所述重組血液結合素分子包含使用熒光探針2-氨基苯甲酸標記后通過HPLC測得的中性聚糖占總聚糖的百分數在從約百分之2至約百分之30的范圍。優選地,病癥選自:鐮狀細胞病、β-地中海貧血、紅細胞生成性原卟啉癥、遲發性皮膚卟啉癥、缺血再灌注和瘧疾。在至少一個實施方式中,重組血液結合素分子用于在治療與血管內或細胞內血紅素過量相關的病癥的方法中,所述方法包括向需要其的對象施用有效量的重組血液結合素分子,所述血液結合素分子包含使用熒光探針2-氨基苯甲酸標記后通過HPLC測得的中性聚糖占總聚糖的百分數在從約百分之2至約百分之30的范圍。優選地,病癥選自:鐮狀細胞病、β-地中海貧血、類風濕性關節炎、與炎癥相關的貧血以及其中血紅素沉積在細胞中的其他狀況。在本申請中闡述了本教導的這些和其他特征。附圖說明本領域技術人員應理解,下文中描述的附圖僅用于說明目的。附圖并非旨在以任何方式限制本教導或權利要求的范圍。圖1顯示了在所選擇的高表達CHOK1和CHO-S克隆中重組人血液結合素的表達。通過抗人血液結合素ELISA試劑盒確定表達水平。圖2顯示了使用來自來源于不同高表達CHOK1和CHO-S的血液結合素的條件培養基測定的抑制血紅素依賴性過氧化物的EC50。使用市售的血紅素依賴性過氧化物酶測定法進行測定。圖3顯示了總結聚糖分析的流程圖。圖4顯示了來自篩選的克隆子集的唾液酸化N-聚糖MALDI分析。圖5顯示了來自篩選的克隆子集的中性N-聚糖MALDI分子。圖6顯示了針對不同CHOK1和CHOS克隆的基于2AA分析的中性聚糖%。圖7是顯示來源于CHOK1克隆對比CHO-S的血液結合素的中性聚糖%的圖。圖8顯示了中性聚糖%對CHOK1克隆表達水平的曲線。所選擇的克隆為圓形。CHOK1-76克隆以箭頭指出。圖9顯示了對用于藥代動力學分析的來源于血漿的(pd-HPX)、兩個批次CHOK1克隆76(CHOK1批次A和B)以及來源于CHOS的血液結合素進行的中性N-聚糖MALDI分析。圖10顯示了對用于藥代動力學分析的來源于血漿的(pd-HPX)、兩個批次CHOK1克隆76(CHOK1批次A和B)以及來源于CHOS的血液結合素進行的唾液酸化N-聚糖MALDI分析。圖11顯示了對用于藥代動力學分析的來源于血漿的(pd-HPX)、兩個批次CHOK1克隆76(CHOK1批次A和B)以及來源于CHOS的血液結合素進行的顯示中性聚糖%的2AA分析。圖12顯示了對來自生物反應器培養的在第7、11和14天收集的來源于CHOK1克隆76的血液結合素純化蛋白進行的顯示中性、單唾液酸化以及二和三唾液酸化N-聚糖%的2AA分析。圖13顯示了在Sprague-Dawley大鼠中的來源于重組(r-HPX)和血漿(pd-HPX)的血液結合素的藥代動力學分析。具體實施方式本公開提供了使用血液結合素和/或重組血液結合素的組合物和治療方法。可以將該組合物和方法施予具有一種或多種疾病或癥狀的對象。在特定情況下,疾病可能與升高的血紅素水平相關。出于解釋本說明書的目的,將適用下述定義。除非明確地有一定相反意義的意圖(例如在最初使用該術語的文件中),否則在以下所述的任何定義與任何其他文件包括通過引用并入本申請的任何文件中的詞語用法有相抵觸的情況下,出于解釋本說明書及其相關權利要求的目的,應以下述的定義為準。只要適宜,單數使用的術語也將包括復數形式且反之亦然。除非另有說明或者“一個或多個”的用法是明顯不適宜的,否則本申請中“一個”的用法指“一個或多個”。除非另有說明,“或”的用法指“和/或”。“包含”(comprise、comprises、comprising)、“包括”(include、includes、including)的用法可以互換使用并且不受顯示。術語“如”(suchas)也并非旨在限制。例如,術語“包括”(including)應指“包括,但不限于”。如在本申請中所使用的,術語“約”指所提供的單位值的+/-10%。如在本申請中所使用的,術語“基本上”指顯示有關特征或性質的總計或大約程度的定性狀況。生物領域的普通技術人員將理解,生物和化學現象很少有(即使有)達到或避免絕對結果,因為有很多影響生物和化學組分和材料的測試、生產和儲存的變量,以及因為在生物和化學組分和材料的測試、生產和儲存中所用的儀器和設備中存在固有誤差。因此,在本申請中使用術語基本上以捕捉很多生物和化學現象中固有的可能缺乏的完整性。如在本申請中所使用的術語“血液結合素”或“來源于血漿的血液結合素”或“HPx”或“pd-HPX”指血液結合素的任意變體、同種型和/或物種同源物,所述血液結合素的形式是由細胞天然表達的并且存在于血漿中并且與重組血液結合素不同。如在本申請中所使用的術語“重組血液結合素”或“rHPx”指血液結合素的任意變體、同種型和/或物種同源物,所述血液結合素的形式是由細胞表達的并且不同于來源于血漿的血液結合素。術語“治療有效量”指血液結合素或蛋白組合物的量是在體內有效除去過量血紅素所需的,或者另外對需要其的對象在體內產生可測量的益處的。精確的量將取決于多種因素,包括但不限于治療組合物的組分和生理特性、意向患者人群、個體患者考慮等,并且能夠容易地由本領域技術人員確定。有很多因素限制了使用血液結合素作為治療性治療的分子或組合物的能力。限制血液結合素用于治療性治療用途的第一個因素是需要施用較高水平的蛋白。這可能是由于在加速溶血的疾病中看到的高周轉速率所致。現有方法通過從血漿中提取、純化和濃縮蛋白來獲得血液結合素。這是一個產生有限蛋白的耗時且繁瑣的過程。限制來源于血漿的血液結合蛋白用途的第二個因素是涉及疾病傳播所產生的可能問題。例如,來源于血漿的血液結合素能夠用作臨床開發來源的同時,這些組合物具有固有的風險,如可能將疾病(例如HCV、HIV)傳播給患者。另外,來源于血漿的樣品和組合物包括具有各種導致疾病的病毒和細菌的可能性。存在在擴大生產之前未將這些病原除去和/或過濾的潛在風險。限制血液結合素作為治療劑的用途的第三個因素涉及無法以有效的生產方法在高水平表達蛋白的同時保持蛋白類以似于體內或天然存在的蛋白發揮功能和/或操作所必需的固有性質。已報道來源于游離血漿的血液結合素具有7天的血漿半衰期。在與血紅素結合后,血液結合素的構象改變,使其與肝細胞上LRP的親和力增加,導致更加迅速從循環移除(T1/2=7小時)。來源于血漿的血液結合素廣泛糖基化,其含有5個N-連接的糖基化位點和1個或2個O連接的糖基化位點。對于來源于血漿的血液結合素而言,在末端半乳糖碳水化合物上的N-連接的碳水化合物完全唾液酸化,以防止其在肝臟中被去唾液酸糖蛋白受體(ASGPR)識別和移除。在重組生產的血液結合素中N-連接的碳水化合物上末端半乳糖的不完全唾液酸化預期將產生更加迅速從循環中除去的蛋白。由于不適宜的唾液酸化的血液結合素通過ASGPR的清除將更加迅速,與血紅素結合無關,這預計將導致血液結合素分子具有降低的治療效能。由2AA分析確定的中性N-聚糖(基于總N-聚糖)的百分數與唾液酸化的程度成反比并且因此中性聚糖百分數降低的組合物具有增加的唾液酸化水平。在本申請中,我們描述了高水平生產充分唾液酸化的血液結合素的表達系統,發現唾液酸化對清除性質的負面影響,并且顯示出具有低于30%、低于25%、低于20%、低于15%和低于10%的中性N-聚糖百分數的血液結合素是用于治療患者對有用的組合物。因此,本組合物和方法提供了無法由pd-HPX分子和其他組合物獲得的預料不到的益處。例如,重組血液結合素生產方法的改進能夠提高使用商業上可行的方法生產這種蛋白的可能性。然而,使用一般表達系統導致血液結合素或組合物不充分的唾液酸化。而且,因此,降低中性聚糖在分子中相對于總聚糖的存在水平以改進血液結合素分子的總體組成和在體內的循環次數可能是所需要的。由肝臟接觸和除去電荷為中性的分子和/或組合物。因此,其在血流中的循環時間將較短并且其清除將較少被與游離血紅素形成的復合物所驅動。而且,還應注意的是,治療分子或組合物必需與來源于血漿的或野生型的血液結合素具有足夠相似的特征以便緊密結合在血流中游離的血紅素。因此本組合物和方法提供了無法由pd-HPX分子和組合物獲得的預料不到的益處。因此,N-連接的聚糖上半乳糖殘基的適宜唾液酸化對體內蛋白的清除性質具有顯著影響。不充分的唾液酸化可以導致通過肝細胞上的去唾液酸糖蛋白受體更加迅速地清除。當爭取高表達水平時,這對于重組蛋白可能特別有問題。天然存在的和重組血液結合素廣泛地糖基化,其具有N-連接的和O-連接的碳水化合物。使用分析方法如2AA分析能夠確定中性聚糖的百分數。這樣確定的中性N-聚糖百分數將與唾液酸化的程度成反比。在單一碳水化合物鏈上存在具有一個以上的未唾液酸化半乳糖的聚糖結構,預計其對ASGPR應具有最高的親和性且最快被清除。在重組血液結合素的生產中,生產未充分唾液酸化材料的細胞導致產生血液結合素的快速清除形式。而相反的是,我們已經發現當在產生具有更高唾液酸化程度材料的細胞中表達材料時觀察到清除率降低。在生產充分唾液酸化材料的細胞中表達結合生產具有低于30%、低于25%、低于20%、低于15%和低于10%的中性N-聚糖百分率的重組血液結合素的純化方法將對于患者的治療更加有用。可以使用多種方法以進一步降低血液結合素分子或組合物中的中性聚糖水平并增加唾液酸化水平。這些方法包括使用各種定義的細胞系、加入特定賦形劑或營養物質改良培養基、使用抑制劑包括但不限于金屬或其衍生物以阻斷從N-聚糖中除去唾液酸的唾液酸酶以及將突變引入多肽序列以工程化加入或移除各種氨基酸以便影響N-糖基化類型和唾液酸化程度。我們已經發現可以使用具有增加的將唾液酸加入N-聚糖傾向的細胞系以及可以使用從具有增加的將唾液酸加入N-聚糖傾向的轉染細胞群中選擇克隆。使用編碼已知影響唾液酸化過程的蛋白的DNA對細胞的修飾包括但不限于唾液酸轉運體、唾液酸轉移酶、唾液酸抑制劑或siRNA以及等同的技術。使用重組生產蛋白的補充療法是一項挑戰,至少部分是由于需要較高水平的蛋白。而且,血液結合素具有與正確折疊結合的廣泛的翻譯后修飾,其可能會差異化影響和改變這種蛋白的個別性質。本申請的發明涉及血液結合素的產生和使用和/或使用重組血液結合素治療疾病。重組血液結合素分子可以具有與SEQIDNO:1具有90%或更高同源性的序列。序列中的偏差可能是由如缺失、添加、取代或插入的因素導致,無論其是天然存在的還是由定向誘變或者其他合成或重組技術引入的。而且,同源性指在各核酸分子或由其編碼的蛋白之間具有功能和/或結構上的等同性。在至少一個實施方式中,與SEQIDNO:1同源的核酸分子與SEQIDNO:1具有相同的生物功能。醫藥用途血液結合素可用于治療目的,用于治療血紅素調節的遺傳性和獲得性缺乏或缺陷。例如,上文所述實施方式中的蛋白能夠用于從血液或血漿中除去過多的血紅素。血液結合素在血紅素病癥的治療中具有治療用途,所述病癥包括涉及過量游離血管血紅素的病癥和涉及過量細胞內血紅素的病癥。游離血紅素毒性病癥包括鐮狀細胞病、β-地中海貧血、缺血性再灌注、紅細胞生成性原卟啉癥、遲發性皮膚卟啉癥和瘧疾。過量游離血紅素能夠通過催化活性氧物質的形成導致器官、組織和細胞損傷或功能障礙。與過量細胞內血紅素相關的病癥包括類風濕性關節炎、與炎癥相關的貧血以及鐵在巨噬細胞中沉積且不能再循環至紅細胞的其他狀況。能從血液結合素的治療用途獲益的具有過量鐵/鐵負載的其他疾病包括:血色素沉著癥、陣發性夜間血紅蛋白尿(PNH)、葡萄糖-6-磷酸脫氫酶缺乏癥或繼發現象(例如溶血性尿毒癥綜合征(HUS))、血栓性血小板減少性紫癜(TTP)、先兆子癇、敗血癥以及其他感染和/或炎性疾病、急性出血和與血液或血液代用品輸血相關的并發癥以及與器官移植相關的器官保存。在任何其中具有廣泛的細胞裂解特別是紅細胞裂解的疾病中將具有潛在的益處。與釋放較高量肌球蛋白的廣泛肌肉破壞相關的疾病也將從血液結合素給藥中獲益。可以通過向需要其的對象施用治療有效量的血液結合素治療此類病癥。血液結合素分子和組合物還在罕見疾病如SCD的治療中具有治療用途。因此,還提供了用于治療SCD和其他相關疾病的方法。可以將血液結合素制劑以供胃腸外施用(例如通過注射,例如推注或連續輸注)并且其可以以單位劑型存在于安瓿、預充式注射器、小量輸注或加入防腐劑的多劑量容器中。組合物可以采取此類形式如混懸劑或溶液,且可以含有配制劑如混懸劑、穩定劑和/或分散劑。如在本申請中所使用的,術語“胃腸外”包括皮下、靜脈內、肌內、關節內、滑膜內、胸骨內、鞘內、肝內、病灶內和顱內施用。可以將血液結合素蛋白用作單一療法或者與其他用于血紅素病癥的療法合用。可以以某一劑量和頻率向患有血紅素缺陷的對象胃腸外施用藥物組合物,該劑量和頻率能夠隨著疾病的嚴重程度而改變,或者在預防性治療的情況下,能夠隨著鐵缺乏的嚴重程度而改變。可以以推注或通過連續或間歇性輸注向有需要的患者施用組合物。例如,血液結合素蛋白的推注施用通常可以通過輸注30分鐘至3小時的一段時間施用。施用頻率將取決于狀況的嚴重程度。頻率的范圍可以從每日一次或兩次至每兩周至每六個月一次。此外,可以通過皮下注射向患者施用組合物。例如,可以通過皮下注射每日、每周、每兩周或每月向患者施用1至8000mg劑量的血液結合素。實施例1重組血液結合素的表達、純化和分析證明了使用DNA2.0優化的血液結合素cDNA序列(SEQIDNO:3)和天然血液結合素信號序列在CHO細胞中高水平的表達。將鑒定高表達克隆的類似方法用于CHOS和CHOK1細胞。用于CHOK1克隆的方法如下:使用含有密碼子優化的血液結合素cDNA的表達載體轉染CHOK1細胞。通過限制稀釋克隆在96孔板中選擇總計300個CHPK1克隆。使用市售的血液結合素ELISA試劑盒(ALPCO,41-HMPHU-E01)測定來自克隆的條件培養基。從最初的300個克隆中鑒定出21個高產者并且隨后使用小規模分批補料表達法(50ml)使用來自GEHealthcareLifeSciences公司的ActiCHO培養基進行評估。使用包括離子交換層析(Q-Sepharose,GEHealthcareLifeSciences)或金屬螯合層析(Ni-IMAC)后接體積排阻層析(SD200,GEHealthcareLifeSciences)的兩步法純化血液結合素(至>95%純度)。使用SDSPAGE(4-12%BisTris)凝膠和分析體積排阻層析(SD200,10/300)評估純化蛋白的純度。還使用競爭性血紅素結合測定(基于血紅素依賴性過氧化物酶)分析純化樣品的血紅素結合情況并且然后進行聚糖分析(方法概述如下)。在CHOK1和CHO-S這兩個細胞系中達到了相似的最大蛋白表達水平(圖1)。使用市售試劑盒確定血紅素依賴性過氧化物測定的抑制的EC50。所有克隆以相似的效能抑制血紅素依賴性過氧化物酶的活性(圖2)。對純化蛋白進行聚糖分析。將市售來源的純化的來源于血漿的血液結合素(AthensResearchTechnologies)也包括在聚糖分析中作為對照。聚糖分析包括MALDI分析以鑒定中性和帶電荷的N-聚糖結構,包括2AA分析以鑒定中性聚糖%以及在一些情況下包括總唾液酸分析以確定總唾液酸含量(參見圖3,進一步的細節見實施例2)。意外的是,對CHO-S和21CHOK1克隆的純化血液結合素進行的Maldi和2AA聚糖分析顯示了在聚糖性質上的顯著差異(見圖4、5和6)。MALDI唾液酸化的N-聚糖分析顯示了與CHOK1克隆相比來源于CHO-S的血液結合素具有更加多樣化的聚糖類型。而且,在來源于CHO-S的材料中存在的中性聚糖百分數與從來源于CHOK1的材料中獲得的該結果(6.3%至24.6%)顯著增加(47.8%)。中性聚糖百分數的減少情況與唾液酸化程度成反比。因此,根據這項分析可知來自CHOK1克隆的材料具有更高的唾液酸化程度。所有克隆的中性聚糖%如圖7中的圖表所示。根據中性N-聚糖的百分數和表達水平選擇進行附加評估的克隆(圖8)。使用CHO-S克隆和CHOK1克隆76生產用于藥代動力學研究的材料。顯示這兩個制備物(以及來源于AthensResearchPlasma)中性和帶電荷N-聚糖的MALID分析如圖9和10所示。來自2AA分析的中性聚糖%數據如圖11中所示。CHO-S生產的材料具有52%的中性聚糖和CHOK1-76(A批次)生產的材料具有10%的中性聚糖。根據2AA分析,從克隆CHOK1-76條件培養基純化的第二批次血液結合素具有增加水平的中性聚糖百分數(19%)。匯總四個重組生產制備物和市售獲得的來源于血漿的血液結合素的中性聚糖百分數的表如下表1所示。具有較低總中性N-聚糖百分數的制備物也具有較高水平的完全唾液酸化N-聚糖和降低水平的含有兩個或多個不帶電末端半乳糖部分的N-聚糖。表1對在藥代動力學分析中使用的制備物的中性聚糖%(2AA)和Maldi帶電N-聚糖分析匯總在如下所示的藥代動力學分析中對來自這些制備物的蛋白進行了評估。對CHOK1克隆76進一步的分析表明在使用來自生物反應器培養物的條件培養基純化的蛋白中中性聚糖百分數的水平取決于所進行的培養時間的長度。我們使用在第7、11和14天時從克隆76獲得的條件培養基孵育10L生物反應器(ActiCHOP培養基)。從在這些天收集的培養基中純化血液結合素并且然后評估中性聚糖%。數據(圖12)表明在生物反應器運行期間中性聚糖%呈時間依賴性增加。這可能是由于關鍵培養基成分的消耗或者在培養基中存在導致唾液酸隨時間除去的唾液酸酶所致。可以通過使用改良的培養條件、在進料中加入培養基成分或將唾液酸酶抑制劑加入培養基中的組合對條件進行進一步優化以降低產品中的中性聚糖%。此外,還可以想到某些已知的方法或技術用于將能夠增加唾液酸化的各種基因加入這些高產細胞中。這可以包括但不限于唾液酸轉移酶和CMP-唾液酸轉運蛋白。實施例2聚糖分析2AA分析-在使用熒光探針2-氨基苯甲酸標記后通過HPLC對中性和唾液酸化的N-聚糖進行分析。通過使用糖苷酶F(OxfordGlycosystem)釋放N-聚糖,隨后使用2-氨基苯甲酸標記。在NH2P40-2D柱上對標記樣品進行分析,使用在乙腈中的2%乙酸/1%四氫呋喃作為溶劑A和在水中的5%乙酸/1%四氫呋喃/3%三乙胺作為溶劑B,使用熒光檢測(激發360nm,發射425nm)。MALDI分析-對于確定聚糖的結構而言,通過使用糖苷酶F釋放N-聚糖,隨后進行MALDI-MS分析。對于中性聚糖分析而言,使用2,5-二羥基苯甲酸作為基質,同時使用2',4',6'-三羥基苯乙酮一水合物進行唾液酸化的聚糖分析。對于中性N-聚糖分析而言,數據采集參數如下:離子源1:20kV,離子源2:17kv,透鏡9kv,反射鏡1:26,反射鏡2:14。對于唾液酸化的N-聚糖分析而言,數據采集參數如下:離子源1:20kv,離子源2:19kv,透鏡:5kv。實施例3PK研究在清醒的、雄性Sprague-Dawley大鼠中評估了重組的(來源于CHO-S和CHOK1的)和來源于血漿的(AthensResearchTechnologies)血液結合素的藥代動力學和處置性質。重組的來源于CHO-K1的血液結合素經過聚糖修飾以降低中性聚糖百分數。重組的來源于CHO-S的血液結合素未經過聚糖修飾。將血液結合素以3mg/kg的劑量單次靜脈給予股靜脈。這項研究使用CulexTM自動血液取樣系統(BioanalyticalSystems,Inc.,Lafayette,IN)進行。給藥后,在預定時間點通過頸靜脈將血液樣品連續收集至含有5%檸檬酸鈉作為抗凝劑的收集管中,直到72小時。隨后,從這些樣品中獲得血漿并且在-80℃下保存直至進行分析。使用夾心ELISA法確定血漿中人血液結合蛋白的水平,使用抗人血液結合素抗體作為捕獲抗體和HRP-抗人血液結合素抗體作為檢測抗體測定大鼠血漿中人血液結合素的總量。各批次的中性聚糖百分數與在大鼠藥代動力學分析中確定的清除性質具有明確的相關性(參見圖13)。具有增加的中性聚糖(唾液酸化降低)的血液結合素制備物具有較快的α相和清除速率、增加的分布溶劑和降低的AUC(圖13和表2)。據推測這是由于未充分唾液酸化的分子通過去唾液酸糖蛋白受體更迅速地清除。不當唾液酸化的材料通過去唾液酸糖蛋白受體的清除能夠導致游離血液結合素在清除游離血紅素之前從循環中迅速清除。具有提高的唾液酸化的血液結合素分子可以更加緩慢的清除直至其與血紅素結合。在與血紅素結合后,與LRP受體的親和性增加,導致血液結合素-血紅素復合物從循環中除去。通過降低通過去唾液酸糖蛋白受體的清除率能夠改善血液結合素的體內效能。表2重組的和來源于血漿的血液結合素在Sprague-Dawley大鼠中的藥代動力學參數CHOSCHOK1克隆76ACHOK1克隆76BpdHXAUCnorm(kg.h/L)40142237280Cl(mL/h/kg)255.74.23.4Vss(mL/kg)690230170130T1/2(h)28363333盡管已參考特定實施方式和實施例對本實施方式進行了描述,但是應當理解,在不脫離所附權利要求的真實精神和范圍的前提下,可以進行各種修改和改變并且可以替代為等同物。因此,將說明書和實施例認為是說明性的而非限制性的。而且,在本申請中引用的所有文章、書籍、專利申請和專利所公開的內容通過引用整體并入本申請。序列表<110>McLean,KirkFeldman,RickHermiston,TerryBrooks,Alan<120>使用血液結合素的組合物和治療方法<130>17207.0009USP1<140>新提交<141>2014-09-29<160>4<170>PatentIn3.5版<210>1<211>462<212>PRT<213>智人<400>1MetAlaArgValLeuGlyAlaProValAlaLeuGlyLeuTrpSerLeu151015CysTrpSerLeuAlaIleAlaThrProLeuProProThrSerAlaHis202530GlyAsnValAlaGluGlyGluThrLysProAspProAspValThrGlu354045ArgCysSerAspGlyTrpSerPheAspAlaThrThrLeuAspAspAsn505560GlyThrMetLeuPhePheLysGlyGluPheValTrpLysSerHisLys65707580TrpAspArgGluLeuIleSerGluArgTrpLysAsnPheProSerPro859095ValAspAlaAlaPheArgGlnGlyHisAsnSerValPheLeuIleLys100105110GlyAspLysValTrpValTyrProProGluLysLysGluLysGlyTyr115120125ProLysLeuLeuGlnAspGluPheProGlyIleProSerProLeuAsp130135140AlaAlaValGluCysHisArgGlyGluCysGlnAlaGluGlyValLeu145150155160PhePheGlnGlyAspArgGluTrpPheTrpAspLeuAlaThrGlyThr165170175MetLysGluArgSerTrpProAlaValGlyAsnCysSerSerAlaLeu180185190ArgTrpLeuGlyArgTyrTyrCysPheGlnGlyAsnGlnPheLeuArg195200205PheAspProValArgGlyGluValProProArgTyrProArgAspVal210215220ArgAspTyrPheMetProCysProGlyArgGlyHisGlyHisArgAsn225230235240GlyThrGlyHisGlyAsnSerThrHisHisGlyProGluTyrMetArg245250255CysSerProHisLeuValLeuSerAlaLeuThrSerAspAsnHisGly260265270AlaThrTyrAlaPheSerGlyThrHisTyrTrpArgLeuAspThrSer275280285ArgAspGlyTrpHisSerTrpProIleAlaHisGlnTrpProGlnGly290295300ProSerAlaValAspAlaAlaPheSerTrpGluGluLysLeuTyrLeu305310315320ValGlnGlyThrGlnValTyrValPheLeuThrLysGlyGlyTyrThr325330335LeuValSerGlyTyrProLysArgLeuGluLysGluValGlyThrPro340345350HisGlyIleIleLeuAspSerValAspAlaAlaPheIleCysProGly355360365SerSerArgLeuHisIleMetAlaGlyArgArgLeuTrpTrpLeuAsp370375380LeuLysSerGlyAlaGlnAlaThrTrpThrGluLeuProTrpProHis385390395400GluLysValAspGlyAlaLeuCysMetGluLysSerLeuGlyProAsn405410415SerCysSerAlaAsnGlyProGlyLeuTyrLeuIleHisGlyProAsn420425430LeuTyrCysTyrSerAspValGluLysLeuAsnAlaAlaLysAlaLeu435440445ProGlnProGlnAsnValThrSerLeuLeuGlyCysThrHis450455460<210>2<211>1410<212>DNA<213>智人<400>2atggctagggtactgggagcacccgttgcactggggttgtggagcctatgctggtctctg60gccattgccacccctcttcctccgactagtgcccatgggaatgttgctgaaggcgagacc120aagccagacccagacgtgactgaacgctgctcagatggctggagctttgatgctaccacc180ctggatgacaatggaaccatgctgttttttaaaggggagtttgtgtggaagagtcacaaa240tgggaccgggagttaatctcagagagatggaagaatttccccagccctgtggatgctgca300ttccgtcaaggtcacaacagtgtctttctgatcaagggggacaaagtctgggtataccct360cctgaaaagaaggagaaaggatacccaaagttgctccaagatgaatttcctggaatccca420tccccactggatgcagctgtggaatgtcaccgtggagaatgtcaagctgaaggcgtcctc480ttcttccaaggtgaccgcgagtggttctgggacttggctacgggaaccatgaaggagcgt540tcctggccagctgttgggaactgctcctctgccctgagatggctgggccgctactactgc600ttccagggtaaccaattcctgcgcttcgaccctgtcaggggagaggtgcctcccaggtac660ccgcgggatgtccgagactacttcatgccctgccctggcagaggccatggacacaggaat720gggactggccatgggaacagtacccaccatggccctgagtatatgcgctgtagcccacat780ctagtcttgtctgcactgacgtctgacaaccatggtgccacctatgccttcagtgggacc840cactactggcgtctggacaccagccgggatggctggcatagctggcccattgctcatcag900tggccccagggtccttcagcagtggatgctgccttttcctgggaagaaaaactctatctg960gtccagggcacccaggtatatgtcttcctgacaaagggaggctataccctagtaagcggt1020tatccgaagcggctggagaaggaagtcgggacccctcatgggattatcctggactctgtg1080gatgcggcctttatctgccctgggtcttctcggctccatatcatggcaggacggcggctg1140tggtggctggacctgaagtcaggagcccaagccacgtggacagagcttccttggccccat1200gagaaggtagacggagccttgtgtatggaaaagtcccttggccctaactcatgttccgcc1260aatggtcccggcttgtacctcatccatggtcccaatttgtactgctacagtgatgtggag1320aaactgaatgcagccaaggcccttccgcaaccccagaatgtgaccagtctcctgggctgc1380actcaccaccatcaccaccatcatcaccat1410<210>3<211>1451<212>DNA<213>智人<400>3accggtgaattcgccgccaccatggctcgcgttcttggtgcccctgttgccctcggtctt60tggtccctctgttggtcacttgctattgccactccgctgcctccgaccagcgcgcacgga120aatgtggccgaaggcgaaactaagccagaccctgacgtgaccgagagatgcagcgacgga180tggagcttcgacgctactaccctggatgataacggcactatgctgttctttaagggggag240ttcgtgtggaagtcgcataagtgggaccgggagctcatctcagaaaggtggaagaacttt300ccgtccccggtcgacgctgcatttcggcagggacacaattccgtgttcctgatcaagggg360gacaaagtgtgggtgtacccacctgagaaaaaggagaaaggttacccaaagctgctccaa420gatgagttcccgggcatcccctcgcccctcgacgcggcagtggaatgccatagaggcgaa480tgccaagcagaaggcgtgctgtttttccaaggggacagagaatggttctgggacctggct540acgggaaccatgaaggaacgctcctggccagccgtgggaaattgctccagcgcactgcga600tggctgggaagatactactgtttccaaggaaatcagtttcttcgcttcgatcctgtccgc660ggagaggtgcccccacggtacccgcgggacgtgcgcgactattttatgccgtgtccggga720cggggccatggccaccggaacggaaccgggcatggaaactcgactcatcacggacctgag780tacatgaggtgcagcccgcatctcgtgctgtccgccctcacctccgacaaccatggggct840acctatgcattctcgggtactcactactggaggctggatacctcacgggatggatggcac900tcgtggccgatcgcgcaccagtggccacagggcccctcagcagtcgatgccgctttctca960tgggaggaaaagctctacctggtgcagggtacccaagtctacgtgttcctcactaaggga1020ggctacacgctcgtgtcgggctacccaaagagactggagaaggaggtggggactccccat1080ggaatcatcctggactcggtcgatgctgcattcatctgcccgggaagctcgcggctgcac1140attatggcgggacgccgcctttggtggttggacttgaaatccggcgcccaggcgacttgg1200actgaacttccgtggcctcacgagaaggtcgacggagcgttgtgcatggaaaaatctctg1260ggaccaaactcctgcagcgccaacggaccgggattgtacctgatccacggaccgaatctg1320tactgctactcggatgtcgaaaaattgaacgcggccaaggcgctccctcagccgcagaac1380gtgacctcgctgcttggatgtacacaccaccaccatcaccatcatcaccaccattaggcg1440gccgcgctagc1451<210>4<211>462<212>PRT<213>智人<400>4MetAlaArgValLeuGlyAlaProValAlaLeuGlyLeuTrpSerLeu151015CysTrpSerLeuAlaIleAlaThrProLeuProProThrSerAlaHis202530GlyAsnValAlaGluGlyGluThrLysProAspProAspValThrGlu354045ArgCysSerAspGlyTrpSerPheAspAlaThrThrLeuAspAspAsn505560GlyThrMetLeuPhePheLysGlyGluPheValTrpLysSerHisLys65707580TrpAspArgGluLeuIleSerGluArgTrpLysAsnPheProSerPro859095ValAspAlaAlaPheArgGlnGlyHisAsnSerValPheLeuIleLys100105110GlyAspLysValTrpValTyrProProGluLysLysGluLysGlyTyr115120125ProLysLeuLeuGlnAspGluPheProGlyIleProSerProLeuAsp130135140AlaAlaValGluCysHisArgGlyGluCysGlnAlaGluGlyValLeu145150155160PhePheGlnGlyAspArgGluTrpPheTrpAspLeuAlaThrGlyThr165170175MetLysGluArgSerTrpProAlaValGlyAsnCysSerSerAlaLeu180185190ArgTrpLeuGlyArgTyrTyrCysPheGlnGlyAsnGlnPheLeuArg195200205PheAspProValArgGlyGluValProProArgTyrProArgAspVal210215220ArgAspTyrPheMetProCysProGlyArgGlyHisGlyHisArgAsn225230235240GlyThrGlyHisGlyAsnSerThrHisHisGlyProGluTyrMetArg245250255CysSerProHisLeuValLeuSerAlaLeuThrSerAspAsnHisGly260265270AlaThrTyrAlaPheSerGlyThrHisTyrTrpArgLeuAspThrSer275280285ArgAspGlyTrpHisSerTrpProIleAlaHisGlnTrpProGlnGly290295300ProSerAlaValAspAlaAlaPheSerTrpGluGluLysLeuTyrLeu305310315320ValGlnGlyThrGlnValTyrValPheLeuThrLysGlyGlyTyrThr325330335LeuValSerGlyTyrProLysArgLeuGluLysGluValGlyThrPro340345350HisGlyIleIleLeuAspSerValAspAlaAlaPheIleCysProGly355360365SerSerArgLeuHisIleMetAlaGlyArgArgLeuTrpTrpLeuAsp370375380LeuLysSerGlyAlaGlnAlaThrTrpThrGluLeuProTrpProHis385390395400GluLysValAspGlyAlaLeuCysMetGluLysSerLeuGlyProAsn405410415SerCysSerAlaAsnGlyProGlyLeuTyrLeuIleHisGlyProAsn420425430LeuTyrCysTyrSerAspValGluLysLeuAsnAlaAlaLysAlaLeu435440445ProGlnProGlnAsnValThrSerLeuLeuGlyCysThrHis450455460當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1