用于脂肪源性干細胞臨床即用型活性保存方法與流程
本發明涉及短時間運輸儲存過程中最佳的保存溫度及最適合的細胞保存介質,特別涉及一種用于脂肪源性干細胞臨床即用型活性保存方法。
背景技術:
脂肪源性干細胞在臨床的應用中短期儲存方法關系到細胞治療的效果和安全性,細胞產品從制備完畢到治療使用前的這一時間段(包括細胞產品的運輸)保持細胞產品仍處于活力最佳狀態或進入人體后能發揮較好的治療效果。有關文獻報道關于細胞體外保存技術主要包括4℃非冷凍保存、程控降溫液氮(196℃)保存、-80℃直接冷凍保存。凍存細胞的方法主要集中在關于細胞的長期保存,但不管是直接-196℃液氮保存,還是“慢凍快融”技術冷凍保存都需要加入冷凍保護劑來減少細胞“胞內冰晶形成”等冷凍傷害,因為低溫凍存細胞會導致細胞膜不可逆性的破壞(Saragusty J,Arav A.Current progress in oocyte and embryo cryopreservation by slow freezing and vitrification[J].Reproduction,2011,141(1):1-19.),而多數的冷凍保護劑對人體是有毒性的,所以并不適合用于臨床實踐中。4℃是可移植脂肪存放的最佳溫度,保存24h內脂肪細胞活性基本不變(Daisuke Matsumoto,M.D,Tomokuni Shigeura,M.S,Katsujiro Sato,M.D.Influences of Preservation at Various Temperatures on Liposuction Aspirates[J].Plastic and Reconstructive Surgery.2007,120(6):1510-1517.)(陳苑雯,鐘鴻展,劉宏偉.顆粒脂肪體外處理方法對其存活質量影響的研究進展[J].中國美容醫學,2013,22(1):204-207.)。因此在獲取抽脂組織中,我們將脂肪收集在低溫收集裝置中,4℃條件下無菌低溫保存。細胞體外生存環境越接近自身細胞原始生長環境則最能維持細胞活性,因此臨床上多選擇一些對人體有益或無害的輸注液體作為干細胞治療的介質。在我們前期的探索研究工作中,我們猜測血清或是PRP可能是較好的保存介質(李朦,劉宏偉.不同保存方法對“臨床即用型”脂肪源性干細胞活性影響的評估[J].中國美容醫學,2013,25(4):100-103.),因此何種來源的保存介質極度顯現安全問題。即用型脂肪源性干細胞最佳保存介質需具備無免疫源性,且制備簡易,符合臨床使用規范及經濟效益。
技術實現要素:
為了克服現有技術的缺點與不足,本發明的目的在于提供一種用于脂肪源性干細胞臨床即用型活性保存方法。
細胞產品安全和正確的應用于臨床,必須滿足外在條件及內在因素各方面的要求,包括細胞提取的環境、細胞保存的條件等方面,首先細胞必須在符合cGMP標準的實驗室或者臨床生產體系下完成,然后在細胞分離后細胞必須保存在完全無菌且最適合ADSCs存活的環境下保存,直至安全的用于人體,才能保證手術的安全性和成功率。然而根據現階段的國情、大多數的醫療機構的條件和人才儲備來看,能夠符合上述要求的臨床機構甚少,這就存在手術和細胞處理可能不在同一個空間或區域內完成,因而涉及到細胞運輸期間及使用前的短期保存問題,即“即用型”ADSCs臨床用產品的準備問題。臨床治療過程有其特殊性,如病人抽脂后出現不適,醫院器械、設備故障或其它原因不能及時使用細胞產品,那么在治療前這段時間怎樣保存才能即保持了ADSCs的最佳活性又便于安全有效的使用細胞產品是值得研究的問題。對于即用型ADSCs臨床運用研究中,細胞存活率及細胞活力是細胞治療的關鍵,在細胞產品從符合GMP標準的實驗室環境下提取之后,在其被分離后而未使用時或在運輸過程中,將細胞保存在能保證其安全性、療效性的溫度及細胞保存介質懸液中,即細胞的短期儲存更具有實際的臨床意義。我們經試驗反復驗證設計研制出ADSCs在運輸或短時間儲存過程中最佳的保存溫度及最適合的細胞保存介質。
本發明的目的在于將細胞保存在能保證其安全性、療效性的溫度及細胞保存介質懸液中,即細胞的短期儲存更具有實際的臨床意義。
本發明的目的通過下述技術方案實現:
一種用于脂肪源性干細胞臨床即用型活性保存方法,包括如下步驟:
將脂肪源性干細胞懸浮于10±0.5%(v/v)無免疫源性人源性血清(HumanSerum,HS)或人富血小板血漿(Platelet-rich plasma,PRP)中,4℃靜置保存。
所述的脂肪源性干細胞懸浮液的濃度為105~106個/mL;
所述的保存的時間優選為2~4h。
具有包括如下步驟:
(1)脂肪源性干細胞分離及溫度、細胞保存液分組:
①取6例25~40歲女性大腿、腹部脂肪抽吸術的脂肪組織,用相同0.1%膠原酶消化和離心的方法提取脂肪源性干細胞,以同樣細胞密度種植并傳代培養,得到P2代細胞;
②取生長良好的P2代細胞,每培養瓶以PBS洗滌后用1mL 0.25%胰蛋白酶后,置37℃溫箱消化5min,加入3mL PBS緩沖液稀釋,以300g離心10min,棄上清,加入1mL PBS緩沖液,輕輕吹打后細胞計數板進行計數,并記錄;
③在超凈臺中準備14支試管,每一管分別以5×105細胞密度懸浮于1.8mL生理鹽水中,放入4℃冰箱備用;
④取7支ADSCs的試管,于管上標記0~6號,離心去上清,分別依次序加入0.5mL生理鹽水、0.5mL生理鹽水、0.5mL 10%(v/v)無免疫源性人源性血清(HumanSerum,HS)、0.5mL 10%(v/v)人PRP、0.5mL生理鹽水、0.5mL 10%(v/v)無免疫源性人源性血清、0.5mL 10%(v/v)人PRP。1~3號管放于室溫下(25~28℃)靜置保存,4~6號管放入4℃冰箱靜置保存。
(2)不同保存溫度及保存介質條件下ADSC存活率及生長情況:
①取0號管立即進行流式細胞儀存活細胞數量檢測,作為對照組。輕輕搖晃試管,混合均勻,將500μL的細胞懸液轉移至流式試管中,加入5μL/mg.mL-1PPI,輕輕吹打后避光染色10min,采用AnnexinV-FITC/PI雙染色檢測,根據實際情況調節電子體積(EV)及側向散射光(SS)的值使細胞群位于合適的位置,并分別調節EV圖及SS圖中Counting的范圍去除碎片干擾,再根據PI的熒光強度(FL3)設定死活細胞范圍,并保存程序為CHOcellcounting,讀取數據。細胞計數為SS圖的統計值,細胞存活率為FL3圖的統計值,記錄結果。
②在細胞分別保存2h、4h、6h之后,對各組細胞按同樣方法進行流式細胞儀存活細胞數量的檢測,并將各組細胞計數和細胞存活率的統計圖轉換成柱狀示意圖,并記錄比較結果。
(3)不同保存溫度及保存介質條件下ADSCs增殖能力檢測:
①取0號管細胞,在分離之后立即進行CCK8細胞增殖能力檢測,作為對照組。取多個96孔培養板,按細胞密度為10000細胞分別種植于96孔板中,放置37℃恒溫培養箱中培養。24h后待細胞貼壁,取出一個96孔板,去除培養液后PBS洗滌,每孔加入100μL細胞培養液,再每孔依次加入1μL CCK8配制液;輕輕搖晃96孔板混勻,放入37℃恒溫箱中直至培養液為橘紅色,即可上酶標儀(波長450nm)檢測,讀取每個孔光吸收值,并記錄結果。
②其他各組,分別在細胞保存2h、4h、6h時取各組細胞以上述方法進行檢測,根據各組種植時間,每日重復檢測步驟直至培養至1周;以時間為橫坐標,吸光值為縱坐標繪制各組細胞生長曲線及比較各組差異。
本發明的機理是:本發明是適用于即用型ADSCs臨床治療運用技術中,細胞存活率及細胞活力是細胞治療的關鍵,在細胞產品從符合GMP標準的實驗室環境下提取之后,在其被分離后而未使用時或在運輸過程中,將細胞保存在能保證其安全性、療效性的溫度及細胞保存介質懸液中,這使得細胞的短期儲存更具有實際的臨床意義。ADSCs在運輸或短時間儲存過程中最佳的保存溫度及最適合的細胞保存介質,使臨床即用型ADSCs在使用于人體之前保持最佳細胞活力,提高臨床脂肪源性干細胞應用的有效性及安全性,以便自體脂肪源性干細胞的臨床應用及臨床技術的推廣。
脂肪源性干細胞(SVF/ADSCs)作為成體干細胞家族成員具有來源豐富、取材容易、增殖迅速、多項分化潛能、低免疫原性和免疫調節作用,在再生醫學領域展現了廣闊的應用前景,并作為一種新的細胞產品或新技術用于臨床研究及治療。由于臨床治療的特點和需要,作為細胞產品從制備完畢到治療使用前的這一時間段(包括細胞產品的運輸)如何保持細胞產品仍處于活力最佳狀態或進入人體后能發揮較好的治療效果,同時對于移植入人體的ADSCs我們對其安全性、細胞存活力及增殖能力要求更高,所以除了溫度影響,細胞保存介質的選擇或配制也是儲存的關鍵因素,必須考慮到它對細胞安全性和療效性的影響,并且必須符合臨床的使用規范標準。文獻報道體外長期保持細胞活性合適的溫度是﹣80℃或﹣196℃低溫保存,但低溫凍存細胞需加入帶有毒性的冷凍保護劑以免導致細胞膜不可逆性的破壞。根據細胞產品臨床運用需要,我們尋找出一種ADSCs被提取后即將使用前或運輸過程中的短時間內能夠維持細胞最佳生物學活性的保存方法,以確保細胞在用于人體治療之前處于最佳狀態,進入人體靶器官后發揮較好治療作用。本臨床即用型細胞產品保存方法具有符合臨床規范,經濟、簡便、且能較好保持細胞活性的優點。它的推廣使用可提高細胞產品臨床運用的有效性及安全性,具有極大的經濟和社會效益。
本發明相對于現有技術具有如下的優點及效果:
(1)全血及PRP中PLT計數:
全血PLT計數為(3.09±0.5)×105個/μL,PRP中PLT計數為(17.1±1.5)×105個/μL,其PLT濃度約為全血的5倍多。
(2)不同保存溫度及保存介質條件下ADSC存活率結果:
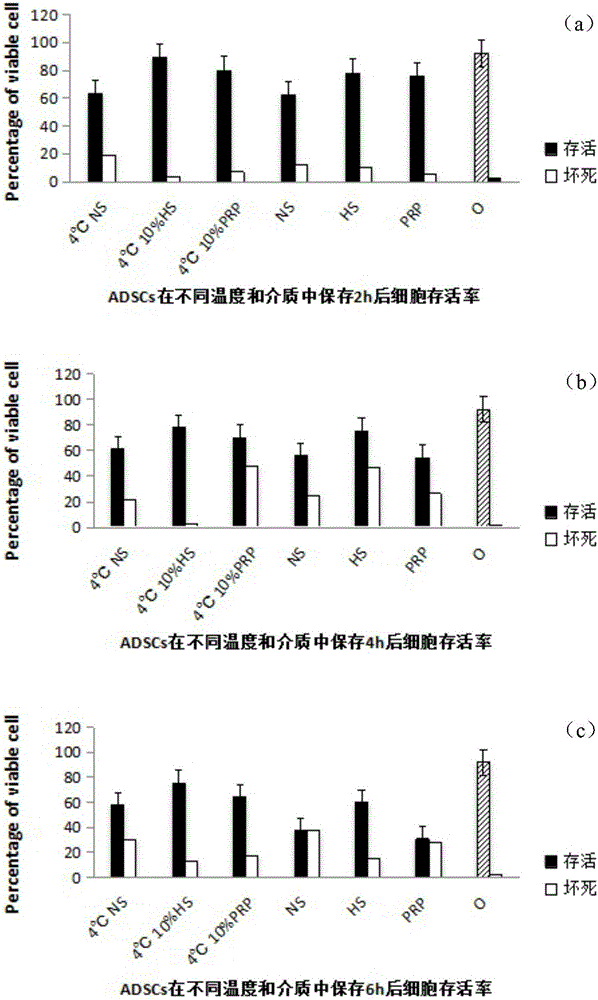
對照組的細胞流式細胞結果顯示(圖1):正常存活細胞占全部細胞的92.16%,死亡細胞僅占2.60%,早期凋亡、晚期凋亡各占0.75%和4.49%。各組ADSCs隨保存時間的延長,細胞存活率呈進行性下降。比較室溫及4℃的細胞存活率,6h內各時間段各組細胞存活率均有明顯差異(P<0.05),4℃條件下保存細胞存活率均較高,細胞死亡及凋亡率均較低,有明顯優勢。不同溶液下保存2h后各組細胞存活率均有小幅度下降,但都維持在65%以上,壞死細胞不超過20%,以4℃10%(v/v)無免疫源性人源性血清組為最佳(P<0.05),幾乎接近對照組,細胞存活率89.18%,細胞死亡率4.06%,細胞凋亡率6.75%左右;其次是4℃10%hPRP組,正常細胞在80%以上。當細胞保存4小時后,相對保存兩小時后的細胞存活率都有所下降(P<0.05),4℃10%hHS組細胞存活率仍最高,占總細胞量77.87%,較保存2小時時細胞存活率下降但死亡細胞變化不大,主要為細胞早期凋亡的增加。4℃與室溫下同一介質下差別最大的為hPRP(P<0.05),由4℃時存活率為70.15%,室溫下細胞存活率只有54.21%。細胞保存6h后各組間均有明顯差異(P<0.05),4℃10%hHS組細胞存活率雖有下降但變化不明顯,細胞存活率仍有75.41%,其他各組細胞存活率均明顯下降,細胞死亡及凋亡明顯增加,室溫下10%hPRP組細胞存活率僅剩30.70%。由此可見,如果要保證細胞存活率在80%以上和極低細胞壞死率,應在細胞提取后2h內盡快使用細胞,盡量不要超過4h,短時間內保存在4℃10%hHS條件下最佳。
(3)不同保存溫度及保存介質條件下ADSCs增殖能力檢測:
經過CCK8細胞增殖實驗的結果顯示(圖2):各組ADSCs增殖能力均隨保存時間遞增而減弱,4℃與室溫下細胞增殖情況有明顯差異,同種保存溶液在4℃條件下保存的各組細胞增殖能力均高于室溫下(P<0.05);細胞保存2h與4h后4℃10%hPRP組與對照組最相近(P>0.05),甚至在保存2h后的細胞增殖能力明顯超過對照組細胞;4℃10%HS組雖然不及4℃10%hPRP組細胞增值力明顯上升,但與對照組相比無明顯差異(P>0.05),4℃10%hPRP但隨時間增長,4℃10%hPRP組呈下降趨勢,直至保存6h后與4℃10%hHS組相近,均與對照組有明顯差異(P<0.05),而4℃10%hHS組雖然在保存2h和6h后不及對照組細胞增殖能力強,但相比4℃10%hPRP較穩定。由此可見,為了保持細胞最佳增殖能力應盡量在細胞提取后4h內使用,并盡量保存在4℃條件下,4℃10%hHS和4℃10%hPRP對ADSCs短期保存的增殖能力均有促進作用。
附圖說明
圖1是不同介質中的ADSCs保存在室溫和4℃條件下2h、4h、6h內細胞變化圖。
圖2是ADSCs在不同溫度和介質中保存2h、4h、6h內細胞增殖變化圖。
具體實施方式
下面結合實施例及附圖對本發明作進一步詳細的描述,但本發明的實施方式不限于此。
實施例1
一種用于脂肪源性干細胞臨床即用型活性保存方法,具有包括如下步驟:
(1)脂肪源性干細胞分離及溫度、細胞保存液分組:
①取6例25~40歲女性大腿、腹部脂肪抽吸術的脂肪組織,用相同0.1%膠原酶消化和離心的方法提取脂肪源性干細胞,以同樣細胞密度種植并傳代培養,得到P2代細胞;
②取生長良好的P2代細胞,每培養瓶以PBS洗滌后用1mL 0.25%胰蛋白酶后,置37℃溫箱消化5min,加入3mL PBS緩沖液稀釋,以300g離心10min,棄上清,加入1mL PBS緩沖液,輕輕吹打后細胞計數板進行計數,并記錄;
③在超凈臺中準備14支試管,每一管分別以5×105細胞密度懸浮于1.8mL生理鹽水中,放入4℃冰箱備用;
④取7支ADSCs的試管,于管上標記0~6號,離心去上清,分別依次序加入0.5mL生理鹽水、0.5mL生理鹽水、0.5mL 10%(v/v)無免疫源性人源性血清(HumanSerum,HS)、0.5mL10%(v/v)人PRP、0.5mL生理鹽水、0.5mL 10%(v/v)無免疫源性人源性血清、0.5mL 10%(v/v)人PRP。1~3號管放于。室溫下(25~28℃)靜置保存,4~6號管放入4℃冰箱靜置保存。
(2)不同保存溫度及保存介質條件下ADSC存活率及生長情況:
①取0號管立即進行流式細胞儀存活細胞數量檢測,作為對照組。輕輕搖晃試管,混合均勻,將500μL的細胞懸液轉移至流式試管中,加入5μL/mg.mL-1PPI,輕輕吹打后避光染色10min,采用AnnexinV-FITC/PI雙染色檢測,根據實際情況調節電子體積(EV)及側向散射光(SS)的值使細胞群位于合適的位置,并分別調節EV圖及SS圖中Counting的范圍去除碎片干擾,再根據PI的熒光強度(FL3)設定死活細胞范圍,并保存程序為CHOcellcounting,讀取數據。細胞計數為SS圖的統計值,細胞存活率為FL3圖的統計值,記錄結果。
②在細胞分別保存2h、4h、6h之后,對各組細胞按同樣方法進行流式細胞儀存活細胞數量的檢測,并將各組細胞計數和細胞存活率的統計圖轉換成柱狀示意圖,并記錄比較結果。
(3)不同保存溫度及保存介質條件下ADSCs增殖能力檢測:
①取0號管細胞,在分離之后立即進行CCK8細胞(BestBio-貝博)增殖能力檢測,作為對照組。取多個96孔培養板,按細胞密度為10000細胞分別種植于96孔板中,放置37℃恒溫培養箱中培養。24h后待細胞貼壁,取出一個96孔板,去除培養液后PBS洗滌,每孔加入100μL細胞培養液(細胞培養液為DMEM培養液,Sigma公司),再每孔依次加入1μL CCK8配制液;輕輕搖晃96孔板混勻,放入37℃恒溫箱中直至培養液為橘紅色,即可上酶標儀(波長450nm)檢測,讀取每個孔光吸收值,并記錄結果。
②其他各組,分別在細胞保存2h、4h、6h時取各組細胞以上述方法進行檢測,根據各組種植時間,每日重復檢測步驟直至培養至1周;以時間為橫坐標,吸光值為縱坐標繪制各組細胞生長曲線及比較各組差異。
試驗結果如下:
(1)全血及PRP中PLT計數:
全血PLT計數為(3.09±0.5)×105個/μL,PRP中PLT計數為(17.1±1.5)×105個/μL,其PLT濃度約為全血的5倍多。
(2)不同保存溫度及保存介質條件下ADSC存活率結果:
對照組的細胞流式細胞結果顯示(圖1):正常存活細胞占全部細胞的92.16%,死亡細胞僅占2.60%,早期凋亡、晚期凋亡各占0.75%和4.49%。各組ADSCs隨保存時間的延長,細胞存活率呈進行性下降。比較室溫及4℃的細胞存活率,6h內各時間段各組細胞存活率均有明顯差異(P<0.05),4℃條件下保存細胞存活率均較高,細胞死亡及凋亡率均較低,有明顯優勢。不同溶液下保存2h后各組細胞存活率均有小幅度下降,但都維持在65%以上,壞死細胞不超過20%,以4℃10%(v/v)無免疫源性人源性血清(hHS)組為最佳(P<0.05),幾乎接近對照組,細胞存活率89.18%,細胞死亡率4.06%,細胞凋亡率6.75%左右;其次是4℃10%人PRP(hPRP)組,正常細胞在80%以上。當細胞保存4小時后,相對保存兩小時后的細胞存活率都有所下降(P<0.05),4℃10%hHS組細胞存活率仍最高,占總細胞量77.87%,較保存2小時時細胞存活率下降但死亡細胞變化不大,主要為細胞早期凋亡的增加。4℃與室溫下同一介質下差別最大的為hPRP(P<0.05),由4℃時存活率為70.15%,室溫下細胞存活率只有54.21%。細胞保存6h后各組間均有明顯差異(P<0.05),4℃10%hHS組細胞存活率雖有下降但變化不明顯,細胞存活率仍有75.41%,其他各組細胞存活率均明顯下降,細胞死亡及凋亡明顯增加,室溫下10%hPRP組細胞存活率僅剩30.70%。由此可見,如果要保證細胞存活率在80%以上和極低細胞壞死率,應在細胞提取后2h內盡快使用細胞,盡量不要超過4h,短時間內保存在4℃10%hHS條件下最佳。
(3)不同保存溫度及保存介質條件下ADSCs增殖能力檢測:
經過CCK8細胞增殖實驗的結果顯示(圖2):各組ADSCs增殖能力均隨保存時間遞增而減弱,4℃與室溫下細胞增殖情況有明顯差異,同種保存溶液在4℃條件下保存的各組細胞增殖能力均高于室溫下(P<0.05);細胞保存2h與4h后4℃10%hPRP組與對照組最相近(P>0.05),甚至在保存2h后的細胞增殖能力明顯超過對照組細胞;4℃10%HS組雖然不及4℃10%hPRP組細胞增值力明顯上升,但與對照組相比無明顯差異(P>0.05),4℃10%hPRP但隨時間增長,4℃10%hPRP組呈下降趨勢,直至保存6h后與4℃10%hHS組相近,均與對照組有明顯差異(P<0.05),而4℃10%hHS組雖然在保存2h和6h后不及對照組細胞增殖能力強,但相比4℃10%hPRP較穩定。由此可見,為了保持細胞最佳增殖能力應盡量在細胞提取后4h內使用,并盡量保存在4℃條件下,4℃10%hHS和4℃10%hPRP對ADSCs短期保存的增殖能力均有促進作用。
良好的細胞保存條件和細胞保存微環境決定了ADSCs的活性,當壞死細胞和凋亡細胞增多時,細胞釋放毒素相應增多,細胞微環境會被破壞,細胞存活率及活性隨之減弱,引起更多的細胞壞死或停止生長。細胞凋亡一般由生理或病理性因素引起,而細胞壞死則主要因為缺氧造成,在短期保存或運輸過程中,細胞保存溫度和保存介質溶液是構成細胞生存微環境的主要因素。通過本實驗可以看出,制備完畢的臨床即用性ADSCs短時間內保存在4℃的細胞活力明顯比室溫條件下保存更強。4℃是臨床最常用的低溫保存方法,不僅操作簡單、無需特殊的儀器設備,相對比較其他低溫保存,不需要涉及添加冷凍保護劑、細胞復蘇等特殊操作,避免了引起細胞毒性反應或細胞膜不可逆性破壞,更減少了細胞污染的風險,綜合比較各保存溫度,4℃是最適合臨床使用型細胞保存的溫度,更能維持其相對穩定的微環境,從而減慢了細胞凋亡和壞死的速度,盡可能維持了細胞的活性。而在4℃保存條件下,細胞存活率、增殖能力最佳的一組細胞保存介質是10%HS溶液,其次是10%PRP溶液,兩者皆比臨床使用的生理鹽水溶液組強。10%HS和10%PRP溶液的確是短期保存臨床即用性ADSCs的保存介質較為合適的選擇,相對比較10%HS略占優勢的原因,可能是對于細胞的微環境來說,血清的成分更接近細胞生長的必需成分,使細胞的活力更穩定;而PRP被激活后釋放出的生長因子可能使ADSCs在很短時間內細胞生長迅速,增殖能力短時間內達到高峰,但作用持續時間不長,ADSCs過早的消耗能量,提早衰老導致細胞凋亡率的增加,造成細胞迅速生長甚至衰老,從而凋亡細胞增多,保存時間一長細胞微環境被破壞,加速細胞死亡,再加上ADSCs體外培養屬于貼壁生長傳代的細胞,而臨床用細胞存放的狀態處于懸浮狀態以至于細胞無法穩定、有規律的生長、增殖,總括而言,10%HS溶液比10%PRP溶液作為細胞保存介質更穩定,而且HS的配制較PRP簡單,用血量較少,不需要經過多次離心,減少感染風險,臨床也更用以實現,所以用10%HS溶液作為臨床即用性脂肪源性干細胞的保存介質更為合適。那么如果在臨床即用型脂肪源性干細胞需要運輸或短期內保存時,將ADSCs保存在4℃下10%(v/v)無免疫源性人源性血清的保存介質溶液中是目前較佳的選擇。
上述實施例為本發明較佳的實施方式,但本發明的實施方式并不受上述實施例的限制,其他的任何未背離本發明的精神實質與原理下所作的改變、修飾、替代、組合、簡化,均應為等效的置換方式,都包含在本發明的保護范圍之內。
- 還沒有人留言評論。精彩留言會獲得點贊!