球孢白僵菌脫乙酰幾丁質酶BbCSN在防治植物病原真菌中的用途的制作方法
本發明屬于微生物技術領域,尤其是涉及球孢白僵菌脫乙酰幾丁質酶bbcsn在防治植物病原真菌中的用途。
背景技術:
植物病害是嚴重危害農業生產的自然災害之一,發生于植物生長的各個時期,各個生長部位,種類繁多,形成危害的因素復雜(張越等,2015)。化學防治是目前農業生產上解決植物病害所采取的主要措施,具有見效快、殺菌譜廣、成本低、使用簡便等優點(吳金平等,2009)。但是隨著時間的推移,化學防治也逐漸的暴露出很多弊端,如長期使用同一類農藥造成的定向選擇,使防治對象產生抗藥性,從而降低或失去防治效果;而且使用不易降解的農藥造成糧食、果品、土壤、水域殘留量超標,嚴重污染環境,威脅人類健康;除少數幾種農藥有選擇性外,多數化學農藥對害蟲及其天敵都有較大的殺傷作用,長期使用此類農藥會削弱天敵環。
針對農業方面的這種現狀,人們迫切需要尋找一種對人類和環境無害并具有良好防治效果的植物病害防治方法。選育抗病品種是防治植物病害最經濟、最有效的途徑,人類己利用植物抗病品種控制了多種大范圍流行的毀滅性病害。利用抗病品種還可以避免或減輕因過分倚重農藥而出現的耐藥和環境污染問題,但是這種方法育種年限長。而轉基因育種則能夠對具體基因進行操作和選擇,不受物種的限制,擴大可利用的基因范圍,大大地提高植物品種改良的效率(劉珊,2012)。隨著生物技術的迅猛發展,轉基因技術得到廣泛應用,為農作物病害的防治開辟了新的道路。而轉基因技術的關鍵是表達什么基因能夠提高植物的抗病能力。
植物病原真菌的細胞壁主要由幾丁質、甘露聚糖、葡聚糖等組成。有研究指出,植物病原真菌在侵入植物的過程中,為了躲避植物幾丁質酶對胞壁幾丁質的降解,會將幾丁質轉化為脫乙酰幾丁質(kouzaytaiyetal.,2012)。因此,在植物中導入脫乙酰幾丁質酶基因,利用脫乙酰幾丁質酶對入侵真菌胞壁的降解,可提高植物對對真菌病害的抗性。此外,脫乙酰幾丁質酶降解脫乙酰幾丁質后產生的脫乙酰幾丁質寡聚體,可誘導植物自身的防御反應,比如氣孔關閉(leesetal.,1999)、木質化作用(vanderpetal.,1998;moerschbacherbmetal.,1988)、病原相關(pr)基因的表達等(jabstetal.,1997)。因此發掘高效降解脫乙酰幾丁質的水解酶,利用其提高植物的抗病能力是植物抗病基因工程研究的一個重要領域。球孢白僵菌是一種國內外應用廣泛的昆蟲病原真菌。除致病昆蟲外,球孢白僵菌還是一種重要的植物內生菌,可提高植物的抗病能力。體外實驗表明,來自球孢白僵菌的水解酶,如幾丁質酶、蛋白酶等被認為與拮抗植物病原真菌的能力相關。
技術實現要素:
本發明要解決的技術問題為防治植物病原真菌提供一種新選擇。
本發明提供了球孢白僵菌脫乙酰幾丁質酶bbcsn在防治植物病原真菌中的用途。
具體的,所述的球孢白僵菌脫乙酰幾丁質酶具有如seqidno.2所示的氨基酸序列。
具體的,所述的球孢白僵菌脫乙酰幾丁質酶的編碼基因具有如seqidno.1所示的核苷酸序列。
具體的,所述的植物病原真菌為毛霉菌、稻瘟病菌或灰葡萄孢霉。
本發明還提供一種植物病原真菌抑制劑,其主要活性成分為球孢白僵菌脫乙酰幾丁質酶bbcsn。
其中,所述的植物病原真菌為毛霉菌、稻瘟病菌或灰葡萄孢霉菌。
本發明還提供了表達球孢白僵菌脫乙酰幾丁質酶bbcsn的載體的構建方法,包括如下步驟:
a、設計引物擴增bbcsn,t/a克隆,進行驗證;
b、雙酶切驗證為陽性的轉化子和表達載體骨架,然后回收bbcsn片段和載體骨架片段,連接,驗證;
c、驗證正確的表達載體轉入根癌農桿菌。
具體的,步驟a中的引物序列具有如seqidno.3和seqidno.4所示的核苷酸序列。
本發明的有益效果:本發明公開了一種具有抑制植物病原真菌生長的脫乙酰幾丁質酶bbcsn基因,來源于昆蟲病原真菌球孢白僵菌。將該bbcsn基因轉入煙草后,與野生型煙草葉片總蛋白相比,轉基因煙草葉片總蛋白對毛霉及灰葡萄孢霉孢子萌發均有抑制作用,對稻瘟病菌及灰葡萄孢霉菌絲的生長抑制作用較野生型強。本發明為植物病害的防治提供了有效的抗性基因,具有廣闊的應用前景。
附圖說明
圖1plgn-bbcsn農桿菌質粒酶切驗證。圖中m表示marker2000;泳道1-5表示不同plgn-35s-bbcsn農桿菌轉化子經過限制性內切酶ecorⅰ和bamhⅰ酶切的結果。
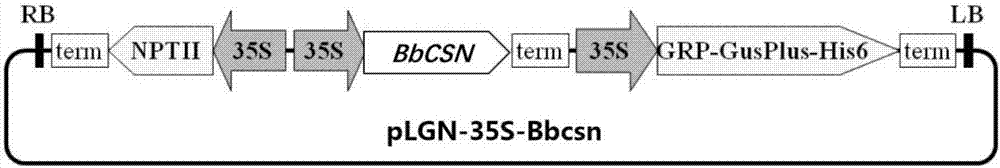
圖2表達載體plgn-35s-bbcsn的載體圖。其中grp-gusplus-his6代表gusplus報告基因,該基因在n端融合了grp信號肽,在c端融合了his6序列標簽;nptii代表新霉素磷酸轉移酶基因,具有卡那霉素抗性;nosterm:nos終止子;camv35s:來源于花椰菜花葉病毒的植物組成性啟動子;lb:t-dna左邊界;rb:t-dna右邊界。
圖3轉基因煙草葉片pcr驗證。m表示marker2000;泳道1以無菌水為模板,泳道2以野生型煙草dna為模板,泳道3以農桿菌plgn-bbcsn質粒為模板,泳道4-22表示gus染色陽性的煙草葉片dna。
圖4bbcsn在轉基因煙草中表達量分析。橫坐標表示轉基因煙草植株編號,wt代表野生型煙草植株。
圖5轉基因煙草葉片總蛋白處理毛霉菌孢子23h。wt為野生型煙草葉片總蛋白提取液;2、12、27分別為bbcsn-2、bbcsn-12、bbcsn-27轉基因煙草煙草葉片總蛋白提取液。
圖6轉基因煙草葉片總蛋白處理灰葡萄孢霉孢子30h。wt為野生型煙草葉片總蛋白;bbcsn為bbcsn-27轉基因煙草葉片總蛋白。
圖7轉基因煙草葉片總蛋白對稻瘟病菌菌絲生長的影響。wt表示野生型煙草葉片總蛋白;csn-2、csn-12、csn-27表示為bbcsn-2、bbcsn-12、bbcsn-27轉基因煙草葉片總蛋白。
圖8轉基因煙草葉片總蛋白對灰葡萄孢霉菌絲生長的影響。control表示0.1mph5.2乙酸鈉緩沖液,wt表示野生型煙草葉片總蛋白;csn-2、csn-12、csn-27表示為bbcsn-2、bbcsn-12、bbcsn-27轉基因煙草葉片總蛋白。
圖9離體轉基因煙草葉片抗病實驗。圖中wt為野生型煙草葉片;csn-2,csn-12,csn-27均為為bbcsn-2、bbcsn-12、bbcsn-27轉基因煙草葉片,煙草赤星病菌孢子濃度為107個/ml。
具體實施方式
實驗材料:
實驗中使用的主要的試劑盒:質粒提取試劑盒為omega公司產品;瓊脂糖dna回收試劑盒從bioflux公司購買;easyspin植物rna快速提取試劑盒為aidlab(中國北京)公司產品;rna反轉錄試劑盒revertaidtmfirststrandcdnasynthesiskit為takara公司產品,real-timepcr試劑盒為bio-rad公司產品。
實驗中使用的主要儀器:s1000tm型pcr儀、dna電泳系統、凝膠成像系統、離心機為thermo公司產品、電轉化儀及cfx96實時定量pcr為bio-rad公司產品、酶標儀為tecan公司產品、可見分光光度計為上海菁華科技儀器有限公司產品、滅菌鍋為tomy公司產品、倒置顯微鏡及光學顯微鏡為olympus產品。
實驗中使用的化學試劑:限制性內切酶購自fermentas公司;dna聚合酶購自takara公司;dna連接酶購自promega公司;x-gal(5-溴-4-氯-3-吲哚-β-d-半乳糖)及iptg(異丙基硫代-β-d-半乳糖)購自gibco公司;pcr引物由上海英駿生物技術公司合成;其他常規試劑均為進口或國產分析純試劑。
實施例1bbcsn基因的克隆
bbcsn的核苷酸及氨基酸序列分別如seqidno.1和seqidno.2所示。以p1/p2為引物(p1:5’-ggatccatggcttctcttcgctctac-3’;p2:5’-gaattcttaaccacgggcacacttgc-3’,下劃線分別為bamhⅰ和ecorⅰ位點)從球孢白僵菌的cdna中擴增得到bbcsn基因。反應體系:5μl10×labuffer,4μldntpmix(2.5mmeach),2.5μl25mmmgcl2,上下游引物各1μl(10mm),0.2μllataq聚合酶,1μlcdna模版,加水至25μl。pcr反應參數:95℃(5min);94℃(30s),56℃(30sec),72(1min),32個循環;72℃(5min)。pcr反應參數:95℃(5min);94℃(30s),56℃(30sec),72(1min),32個循環;72℃(5min)。回收bbcsn片段(約900bp),克隆進peasy-blunt載體(全式金公司產品)。測序正確的載體命名為peasy-bbcsn。
所使用的植物表達載體為pcambia載體改造的,該載體的hptii基因用xhoi單酶切后替換為nptii基因(設計引物從pbi121載體中擴增獲得,引物設計兩端帶xhoi位點),限制性酶切和測序結果驗證了nptii基因的方向。在pbi121載體中擴增獲得camv35s啟動子和nos終止子,同時這兩個元件兩端也引入了相應的酶切位點,這兩個元件最后分別導入pcambia的多克隆位點,形成camv35s::mcs::nos單元。該植物表達載體含有1套2×camv35s啟動子控制nptii基因的植物表達元件、1套camv35s啟動子控制報告基因grp-gusplus-his6的植物表達元件和一套camv35s啟動子控制目標基因的植物表達元件,可實現kan和gus活性的雙標記篩選。在多克隆位點(multiplecloningsite,mcs)插入外源基因,可以實現外源基因的超量表達。
bamhⅰ和ecorⅰ雙酶切peasy-bbcsn,回收bbcsn片段,克隆進植物表達載體,獲得正確的plgn-35s-bbcsn轉化子(圖1)。其中grp-gusplus-his6代表gusplus報告基因,該基因在n端融合了grp信號肽,在c端融合了his6序列標簽;nptⅱ代表新霉素磷酸轉移酶基因,具有卡那霉素抗性;nosterm:nos終止子;camv35s:來源于花椰菜花葉病毒的植物組成性啟動子;lb:t-dna左邊界;rb:t-dna右邊界。利用電擊法將plgn-35s-bbcsn轉入根癌農桿菌lba4404感受態,經驗證獲得正確的農桿菌轉化子,并用于下一步的煙草遺傳轉化。
實施例2煙草遺傳轉化
煙草遺傳轉化用培養基
種子萌發培養基:msb+蔗糖30g/l+普通瓊脂6g/l,ph=6.8;上述濃度均為所述物質在配制好的培養基中的質量濃度。
共培養基:msb+蔗糖10g/l+6-ba(6-芐氨基嘌呤)2mg/l+naa(吲哚乙酸)0.1mg/l+普通瓊脂6g/l,ph=5.4;上述濃度均為所述物質在配制好的培養基中的質量濃度。
篩選培養基:msb+蔗糖30g/l+6-ba(6-芐氨基嘌呤)2mg/l+naa(吲哚乙酸)0.1mg/l+km(卡那霉素)1000mg/l+cef(頭孢霉素)1000mg/l+普通瓊脂6g/l,ph=5.8;上述濃度均為所述物質在配制好的培養基中的質量濃度。
繼代培養基:msb+蔗糖30g/l+km(卡那霉素)75mg/l+cef(頭孢霉素)1000mg/l+普通瓊脂6g/l,ph=5.8;上述濃度均為所述物質在配制好的培養基中的質量濃度。
生根培養基:msb+蔗糖30g/l+cef(頭孢霉素)1000mg/l+普通瓊脂6g/l,ph=6.8;上述濃度均為所述物質在配制好的培養基中的質量濃度。
(1)轉化用農桿菌浸染液的制備
挑取plgn-35s-bbcsn農桿菌單菌落于ysk液體培養基(含125mg/mlsm和50mg/mlkm的yeb液體培養基)中,28℃,200rpm搖床培養過夜,再次吸取少量上述農桿菌菌液于20ml左右ysk液體培養基中,28℃,200rpm培養至od600為0.8-1.2。取10ml農桿菌菌液于1.5ml離心管中(1ml/管),10000rpm1min收集plgn-35s-bbcsn農桿菌菌體,用10ml液體共培養基重懸菌體,重懸液體即為煙草外植體的浸染液。
(2)轉化用煙草材料的準備
先用75%乙醇漂洗大煙草種子1min,棄乙醇;然后在0.1%的升汞中漂洗6-8min,棄升汞溶液;最后用無菌水漂洗6次以上,然后將煙草種子于裝有適量無菌水的三角瓶中搖床培養,待煙草種子萌發出小芽后移于萌發培養基上生長,約1個月后得到無菌煙草苗,將煙草幼苗健壯的嫩葉去掉葉脈和葉邊緣后將剩余部分在無菌條件下切成0.5cm×0.5cm大小,作為農桿菌介導遺傳轉化的外植體。
(3)農桿菌侵染轉化及轉基因煙草植株的獲得
用農桿菌浸染液浸染外植體40min后傾去浸染液,無菌吸水紙吸去外植體表面多余菌液,然后將外植體正面朝上平鋪到固體共培養基上,暗培養2d。共培養完成后,將外植體轉入篩選培養基中進行分化培養十天左右,然后將外植體轉入繼代培養基誘導愈傷生成,每2周繼代一次。產生km抗性幼芽后,將幼芽切下插入生根培養基,獲得km抗性再生植株。待其長成根長3-5cm的再生幼苗,移栽入溫室生長成苗。
最終,獲得50株煙草幼苗。gus染色結果顯示,46株為陽性,僅有4株為陰性,進一步利用pcr技術對煙草植株進行驗證。引物為p1和p2,采用標準的pcr擴增程序。圖3所示為部分轉基因植株的擴增結果。結果顯示,gus陽性植株均能擴增出預期大小的目標條帶,9、15、18、21擴增條帶較弱。
實施例3轉基因煙草中bbcsn的表達情況
選取相對較嫩的葉片,提取葉片rna,并反轉錄成cdna(primescriptrtreagentkitwithgdnaeraser,takara),然后以cdna為模板,用real-timepcr的方式測定各轉化子中bbcsn的表達情況,所用引物為(p3:5’-gacctcgatgcctttatcca-3’;p4:5‘-tgccgtaaatcagcttgttg-3’)。rt-pcr反應體系:5.0μluniversalsybrgreensupermix(bio-rad),4.0μlcdna,0.5μlp3,0.5μlp4,總體積10μl。rt-pcr反應參數:95℃(3min);36循環:95℃(10sec),56℃(20sec),72℃(30sec)。結果顯示,轉基因材料為2號,12號,27號煙草植株中bbcsn基因的表達量較高(圖4)。
實施例4轉基因煙草葉片總蛋白抗菌活性分析
真菌培養:在馬鈴薯固體培養基(pda)平板接種毛霉菌,在rm平板灰葡萄孢霉,將平板置于28℃培養箱中培養7天左右至產孢。用0.05%的tween-80準備孢懸液,并稀釋孢子濃度到107個/ml。
葉片總蛋白提取:稱取2.5g煙草幼嫩葉片于10ml離心管中,加入液氮以錐形研磨棒研磨,向研磨后的葉片粉末中加入4ml乙酸鈉(0.1mph5.2)溶液,顛倒混合均勻后冰上放置30min。勻漿液于4℃,10000rpm離心20min,將上清液轉移到新的離心管中,以bradford法對總蛋白提取液進行定量。
真菌孢子萌發分析:在150mm培養皿底部鋪上一層濾紙,加入5ml一級水使整張濾紙保持濕潤。然后在濾紙上放上牙簽,將干凈的載破片置于牙簽上,培養皿高溫滅菌處理。將3μl真菌孢懸液(107個/ml)、3μl馬鈴薯液體培養基(pdb)或rm液體培養基和10μl濃度一致的煙草總蛋白提取液(煙草總蛋白濃度約為200ug/ml),混合均勻后置于培養皿中的載玻片上(滅菌處理),28℃培養箱中培養。處理23h(毛霉菌)或30h(灰葡萄孢霉菌)后于顯微鏡下觀察拍照。結果如圖5(毛霉菌)和圖6(灰葡萄孢霉菌)所示,與野生型葉片總蛋白相比,煙草葉片總蛋白對毛霉菌和灰葡萄孢霉菌的孢子萌發均有較強的抑制效果。
平板抑菌分析:在馬鈴薯固體培養基平板上接種稻瘟病菌,于28℃培養箱中培養1-2天,直到平板上長出直徑約3㎝的菌落。在距離菌落邊緣約0.5cm的地方放置直徑約8mm的無菌濾紙片,每個濾紙片上加入40ul濃度一致的煙草葉片總蛋白提取液(煙草葉片總蛋白濃度分別約為200ug/ml(圖7)和600ug/ml(圖8))。將平板放于28℃培養箱中培養2-3天后,觀察煙草葉片總蛋白對菌落生長的抑制。從圖7(稻瘟病菌)和圖8(灰葡萄孢霉)中可以看出轉基因煙草葉片總蛋白對稻瘟病菌菌絲和灰葡萄孢霉菌絲生長的抑制作用較野生型更強,
實施例5離體轉基因煙草葉片抗病分析
真菌培養及孢懸液準備按照前述的方法進行。取新鮮的bbcsn轉基因和野生型煙草葉片,包括一個野生型煙草葉片對照組和三個bbcsn轉基因煙草葉片實驗組(2號、12號、27號),每組設置三個重復,用濕潤的吸水紙包住煙草葉柄部位;將煙草赤星病菌孢懸液(108個/ml)均勻噴灑在葉片上,將處理后的煙草葉片置于敞口的塑料筐中,并在塑料框上覆蓋上一層透明薄膜以保持筐中的濕度,使葉片不至于因失水而快速枯萎。26℃放置15天左右觀察煙草葉片的發病情況。結果如圖9所示,處理15天后,野生型煙草葉片出現變黃、萎焉等癥狀并且產生病斑;而bbcsn轉基因煙草葉片未出現明顯的發病現象。表明在煙草中表達bbcsn有效提高了植株的抗病效果。
以上所述的具體實施方式,對本發明的目的、技術方案和有益效果進行了進一步詳細說明,所應理解的是,以上所述僅為本發明的具體實施方式而已,并不用于限定本發明的保護范圍,凡在本發明的精神和原則之內,所做的任何修改、等同替換、改進等,均應包含在本發明的保護范圍之內。
sequencelisting
<110>西南大學
<120>球孢白僵菌脫乙酰幾丁質酶bbcsn在防治植物病原真菌中的用途
<130>2017
<160>6
<170>patentinversion3.3
<210>1
<211>903
<212>dna
<213>artificial
<220>
<223>脫乙酰幾丁質酶bbcsn基因的編碼序列
<400>1
atggcttctcttcgctctactcttctcctgtccctggcggcgcttgcgacagcccgcgac60
gtaccgtccaacgtccgcgacttttacaacagcctaaagagcaagggccagtgcagcaac120
aagctcaagtctggcttccacagcatcgacggcgacaatggctcattctcgtactgcggt180
gaccaccttgacgactaccgcgtcctgtacctccagggcaagaacggcaactttgtcaac240
atggacattgactgcgacggcatccagcatggccccgccgacgacggccgctgcggtagc300
tccgacgacacccagtccgtcacctcgttccagagcatcgtccagggctacggtaccggc360
caaaaggacctcgatgcctttatccacccctacgtggtctttggcaacgagggctcccga420
agcggctaccccaacttcaacccgcaagactacggcattgagccgctgtccgtcatggcc480
gtcgtctgcaacaacaagctgatttacggcatctggggtgacaccaacggtgatgacggc540
tctcaggccatggtcggcgaggcctccatttctctggccaccgcctgctacggcaagtcc600
gtcaatggcaacagcggccacgacgacaacgacgtgctctttattgcctttcccggctcc660
gacgccgtgcccggcaaaaacggcgccaagtggcacgccagcagctacagccagtttgag720
agcagcatcaccggcctcggcgacaagctcatccagcgcatcggcggcggcggcggtggc780
ggcaaccctccgaccggcggcgactgctcatggcagggccattgtgaaggcgctcgctgc840
aagaacgaaaacgactgttctgacgaccttgtttgcaagtctggcaagtgtgcccgtggt900
taa903
<210>2
<211>300
<212>prt
<213>artificial
<220>
<223>脫乙酰幾丁質酶
<400>2
metalaserleuargserthrleuleuleuserleualaalaleuala
151015
thralaargaspvalproserasnvalargaspphetyrasnserleu
202530
lysserlysglyglncysserasnlysleulysserglyphehisser
354045
ileaspglyaspasnglyserphesertyrcysglyasphisleuasp
505560
asptyrargvalleutyrleuglnglylysasnglyasnphevalasn
65707580
metaspileaspcysaspglyileglnhisglyproalaaspaspgly
859095
argcysglyserseraspaspthrglnservalthrserpheglnser
100105110
ilevalglnglytyrglythrglyglnlysaspleuaspalapheile
115120125
hisprotyrvalvalpheglyasngluglyserargserglytyrpro
130135140
asnpheasnproglnasptyrglyilegluproleuservalmetala
145150155160
valvalcysasnasnlysleuiletyrglyiletrpglyaspthrasn
165170175
glyaspaspglyserglnalametvalglyglualaserileserleu
180185190
alathralacystyrglylysservalasnglyasnserglyhisasp
195200205
aspasnaspvalleupheilealapheproglyseraspalavalpro
210215220
glylysasnglyalalystrphisalasersertyrserglnpheglu
225230235240
serserilethrglyleuglyasplysleuileglnargileglygly
245250255
glyglyglyglyglyasnproprothrglyglyaspcyssertrpgln
260265270
glyhiscysgluglyalaargcyslysasngluasnaspcysserasp
275280285
aspleuvalcyslysserglylyscysalaarggly
290295300
<210>3
<211>26
<212>dna
<213>artificial
<220>
<223>引物p1
<400>3
ggatccatggcttctcttcgctctac26
<210>4
<211>26
<212>dna
<213>artificial
<220>
<223>引物p2
<400>4
gaattcttaaccacgggcacacttgc26
<210>5
<211>20
<212>dna
<213>artificial
<220>
<223>引物p3
<400>5
gacctcgatgcctttatcca20
<210>6
<211>20
<212>dna
<213>artificial
<220>
<223>引物p4
<400>6
tgccgtaaatcagcttgttg20
- 還沒有人留言評論。精彩留言會獲得點贊!