可降解鎂基骨內植物可載藥高分子/鈣磷復合涂層及制備的制作方法
本發明屬于生物醫用材料制備技術領域,具體為一種可降解鎂基骨內植物可載藥高分子/鈣磷復合涂層及制備。
背景技術:
在骨科內植入物領域,鎂及鎂合金內植入物材料有希望替代傳統醫學中的不銹鋼、鈦及鈦合金等骨科內植入材料。與其它醫用金屬材料相比,鎂及鎂合金具有如下的優勢:1)可降解性。鎂合金具有較低的腐蝕電位,在含有氯離子的體內環境下易發生腐蝕,并以緩慢腐蝕的方式在體內完全降解,可實現鎂在人體中的降解吸收。2)生物安全性高。Mg作為人體必需的營養元素,在人體內含量僅次于Ca、K、Na排第四。3)生物力學相容性好。鎂是目前所有金屬材料中生物力學性能與人體骨最接近的金屬材料。鎂及其合金的密度約為1.7g/cm3,與人體骨組織的密度(1.75g/cm3)接近。同時,純鎂的彈性模量44.1GPa,稍高于一般骨12-20GPa,同齒骨40-80GPa水平相當,抗拉強度為120-160MPa。由此可見,鎂的物理機械性能更接近于生物骨,可有效緩解應力遮擋效應。但是鎂及鎂合金應用到臨床上作為骨科內植入物材料尚存在一些技術難題,主要是鎂及鎂合金在體內降解太快,在修復器官恢復功能前難以維持其必要的強韌性,并且其生物相容性有待進一步提高,因此有必要對鎂及鎂合金材料進行表面改性以滿足其臨床應用。通過在鎂及鎂合金表面構筑生物活性鈣-磷涂層,是鎂及鎂合金骨內植入材料表面改性的一個重要方向。構筑生物活性鈣-磷涂層不僅能提高植入物的生物相容性,促使植入體與骨組織間形成直接的化學鍵性結合,對骨組織在鎂及鎂合金表面沉積有積極的誘導作用,促進骨的生長,有利于植入體早期穩定,縮短手術后的愈合期,而且可以延緩基體在體液中的腐蝕和降解速率。
近年來,國內外關于在鎂及鎂合金表面構筑生物活性鈣-磷涂層已經進行了大量的研究,研究表明構筑鈣-磷涂層確實提高了鎂及鎂合金生物相容性,顯著降低了鎂及鎂合金的腐蝕速率。隨著骨科疾病在日常中越來越普遍,傳統的截肢手術治療手段已經逐漸向保肢手術治療方向發展。鎂合金內植入物生物活性鈣-磷涂層能顯著提高植入物的 生物相容性,促進骨的生長,延緩基體在體液中的腐蝕和降解速率,但是生物活性鈣-磷涂層存在無法有效載藥達到長期緩慢釋藥功效的問題。目前遇到的最大挑戰是如何在降低鎂合金在體內環境中的降解速度,確保在修復器官恢復功能前維持其必要的強韌性前提下,同時在骨內植入物材料上載藥,對骨科疾病進行治療。
技術實現要素:
本發明的目的在于針對現有技術存在的上述不足,提供一種用于可降解鎂合金骨內植物表層的載藥高分子載體及生物活性鈣-磷復合涂層及其制備方法。本發明的制備聚合物(載藥高分子載體)及生物活性鈣-磷復合涂層的方法,具體是指在骨內植物用鎂及鎂合金合金表面先后依次修飾載藥的可降解聚合物涂層及在聚合物涂層表面繼續沉積生物活性鈣-磷層的復合涂層的制備方法。本發明解決了目前生物活性鈣-磷涂層無法有效載藥的問題,在生物活性鈣-磷涂層與基體之間加入一層高分子藥物載體涂層,能夠在滿足外層生物活性鈣-磷涂層提高植入物的生物相容性,促使植入體與骨組織間形成直接的化學鍵性結合,促進骨的生長,延緩基體在體液中的腐蝕和降解速率的情況下,又能在鎂合金表面載入藥物,治療一系列骨病變疾病,并且可以通過改變聚合物涂層厚度、載藥量及生物活性鈣-磷涂層厚度來調節藥物釋放速度;操作工藝簡單、易行,制備的涂層與基體結合力強,厚度可控。
本發明的目的是通過以下技術方案來實現:
將骨內植入物用鎂或鎂合金置于氫氟酸恒溫浸泡,將生物可降解高分子材料溶解在有機溶劑中,形成聚合物溶液,然后采用浸涂法將聚合物溶液均勻涂覆在氟化處理鎂合金表面,真空干燥,形成均勻的聚合物涂層,最后對涂覆聚合物涂層的鎂合金進行紫外臭氧預處理后,置于磷酸鹽混合液中恒溫浸泡,制備得到用于載藥的高分子載體及生物活性鈣-磷復合涂層。
第一方面,本發明涉及一種可降解鎂基(鎂或鎂合金)骨內植物的可載藥高分子/鈣磷復合涂層,所述復合涂層由里至外包括氟化膜、生物可降解高分子涂層和生物活性鈣-磷涂層,所述氟化膜設于所述骨內植物表層。
作為優選技術方案,所述氟化膜厚度為150nm~3μm;所述生物可降解高分子涂層的厚度為0.1μm~100μm;所述生物活性鈣-磷涂層的厚度為100nm~500μm。
作為優選技術方案,所述生物可降解高分子涂層與氟化膜結合力≥10MPa,所述生物活性鈣-磷涂層中Ca/P原子比為1~1.2∶1,所述生物活性鈣-磷涂層與生物可降解高分子涂層結合力≥10MPa,復合涂層的成骨細胞毒性在0級。
作為優選技術方案,所述生物可降解高分子涂層為聚乳酸、聚己內酯、聚三亞甲基碳酸酯、聚乳酸-三亞甲基碳酸酯共聚物、聚己內酯-三亞甲基碳酸酯共聚物、聚羥基乙酸或聚乳酸-羥基乙酸共聚物載體涂層。
第二方面,本發明涉及一種可降解鎂基(鎂或鎂合金)骨內植物的可載藥高分子/鈣磷復合涂層的制備方法,所述制備方法包括如下步驟:
A、將鎂或鎂合金骨內植物置于氫氟酸中恒溫浸泡;
B、將生物可降解高分子材料溶解在有機溶劑中,形成聚合物溶液;所述聚合物溶液中生物可降解高分子材料的質量百分比濃度為0.1%~10%;
C、將所述聚合物溶液涂覆在步驟A處理后的骨內植物表面,真空干燥,形成生物可降解高分子載體涂層(未載藥時,稱為生物可降解高分子載體涂層;載藥時,稱為生物可降解高分子載藥涂層);
D、對步驟C處理后的骨內植物進行紫外臭氧或氧氣、空氣等離子體預處理后,置于磷酸鹽混合液中恒溫浸泡,取出干燥,即得所述復合涂層。
作為優選技術方案,所述復合涂層載藥時,步驟B是將生物可降解高分子材料和藥物溶解在有機溶劑中,形成聚合物溶液;所述聚合物溶液中藥物的質量百分比濃度為0.1%~50%,所述藥物為除生物大分子藥物以外的各類有機小分子藥物,包括但不限于紫杉醇、雷帕霉素、地塞米松、慶大霉素等。
作為優選技術方案,所述骨內植物是指:骨板、骨釘或骨組織工程支架等骨修復相關的內固定物。
作為優選技術方案,所述鎂為純鎂,所述鎂合金為Mg-Al系、Mg-Zn系、Mg-Ca系、Mg-Mn系或Mg-RE系等未經任何處理的裸金屬鎂合金系列。
作為優選技術方案,步驟A中,所述恒溫浸泡為在4~40℃(更優選20℃)下在20wt.%~40wt.%氫氟酸中浸泡6~48h。形成的氟化膜,可作為鎂或鎂合金基體表面的保護膜,減慢基體的腐蝕速度。
作為優選技術方案,所述生物可降解高分子材料的重均分子量為5000~500000;所述生物可降解高分子材料為具有良好生物相容性以及可生物降解性能的聚乳酸(包括PLLA、PDLA和PDLLA)、聚己內酯(PCL)、聚三亞甲基碳酸酯(PTMC)、聚乳酸-三亞甲基碳酸酯共聚物(P(LA-TMC))、聚己內酯-三亞甲基碳酸酯共聚物(P(CL-TMC))、聚羥基乙酸(PGA)、聚乳酸-羥基乙酸共聚物(PLGA)中的一種。聚合物溶液中生物可降解高分子材料的質量百分比濃度控制為0.1%~10%,聚合物濃度過高會造 成溶液粘度過大,且會造成涂層厚度過大且不均勻。
作為優選技術方案,所述有機溶劑為乙酸乙酯、二氯甲烷、三氯甲烷、甲醇、乙醇、丙酮中的一種。
作為優選技術方案,步驟C中,所述涂覆采用浸涂法。
作為優選技術方案,步驟C中,所述真空干燥是在20℃~50℃真空干燥箱中干燥12h~48h。干燥溫度不宜過高。
作為優選技術方案,所述紫外臭氧或氧氣、空氣等離子體預處理的時間為0.5min~60min。
作為優選技術方案,所述磷酸鹽混合液為6~8重量份的磷酸鹽與2~4重量份的無機堿的混合水溶液。
作為優選技術方案,所述磷酸鹽為Ca3(PO4)2、CaHPO4或CaHPO4·2H2O、Ca(H2PO4)2或Ca(H2PO4)2·H2O中的一種或其組合。
作為優選技術方案,所述無機堿為NaOH、KOH、NH3·H2O中的一種。更優選無機堿為NaOH。
作為優選技術方案,所述磷酸鹽混合液具體為任一配方:
a)Ca3(PO4)2∶NaOH∶H2O=8∶2∶90(wt.%);
b)CaHPO4∶NaOH∶H2O=6∶4∶90(wt.%);
c)Ca(H2PO4)2∶NaOH∶H2O=7∶3∶90(wt.%);
d)Ca(H2PO4)2·H2O∶NaOH∶H2O=8∶2∶90(wt.%)。
作為優選技術方案,所述生物活性鈣-磷涂層與基底(生物可降解高分子載體/載藥涂層)的結合力≥10MPa,生物相容性較好,成骨細胞毒性在0級。
與現有技術相比,本發明具有如下有益效果:
(1)本發明提出一種鎂及鎂合金表面具備載藥特性及表面生物活性的涂層,該涂層由化學轉化膜、生物可降解高分子藥物涂層和生物活性鈣-磷涂層組成。
(2)本發明解決了目前生物活性鈣-磷涂層無法載藥的問題,在生物活性鈣-磷涂層與基體之間加入一層生物可降解高分子藥物載體涂層,能夠在滿足外層生物活性鈣-磷涂層提高植入物的生物相容性,促使植入體與骨組織間形成直接的化學鍵性結合,促進骨的生長,延緩基體在體液中的腐蝕和降解速率的情況下,又能在內層鎂合金表面高分子藥物載體涂層載入藥物,治療一系列骨病變疾病。
(3)本發明采用簡便、快捷的紫外-臭氧或等離子體表面處理方法解決了大部分載 藥可降解高分子層上難以復合鈣-磷無機涂層的技術難題,并提高了界面結合力。
(4)本發明可以通過改變聚合物涂層厚度、載藥量及生物活性鈣-磷涂層厚度來調節藥物釋放速度。
(5)本發明工藝簡單、易操作,成本低。
(6)本發明適用范圍廣,適用于目前所有的鎂及鎂合金。
附圖說明
通過閱讀參照以下附圖對非限制性實施例所作的詳細描述,本發明的其它特征、目的和優點將會變得更明顯:
圖1為可降解鎂基骨內植物材料表面的可載藥高分子、鈣磷復合涂層的結構示意圖;其中,1為生物活性鈣-磷涂層,2為生物可降解高分子涂層,3為氟化膜,4為鎂基底;
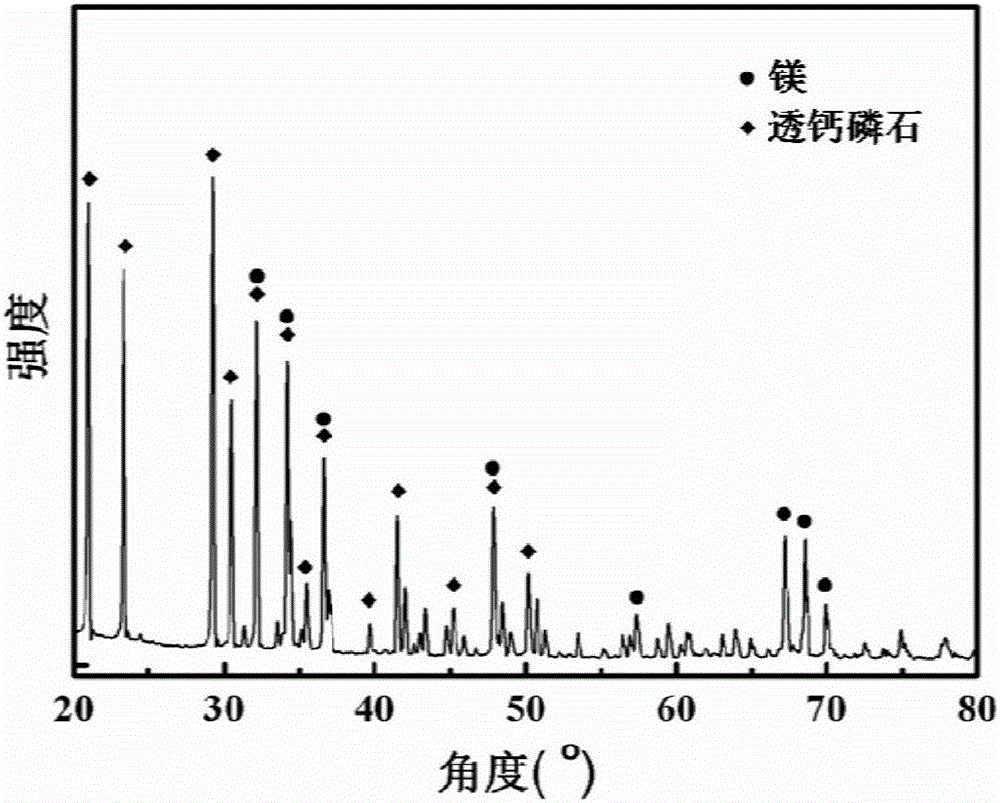
圖2為純鎂表面制備的用于載藥的高分子載體及生物活性鈣-磷(CaHPO4·2H2O)復合涂層的XRD衍射圖譜;
圖3為優化工藝下得到的鎂表面制備的用于載藥的高分子載體及生物活性鈣-磷復合涂層的表面SEM形貌圖;
圖4為優化工藝下得到的AZ31鎂合金表面制備的用于載藥的高分子載體及生物活性鈣-磷復合涂層的截面SEM-EDX譜圖;
圖5為優化工藝下得到的ZK60鎂合金表面制備的高分子載體及生物活性鈣-磷復合涂層的成骨細胞MC3T3粘附實驗的熒光顯微鏡照片,其中,(a)為陰性對照組樣品(TCPS培養皿);(b)為未修飾的鎂合金,(c)為表面修飾了高分子/鈣磷復合涂層的鎂合金樣品;
圖6為優化工藝下得到的AZ31鎂合金表面制備的載2wt.%紫杉醇藥物的聚乳酸高分子載體及生物活性鈣-磷復合涂層的一周釋藥曲線。
具體實施方式
下面結合附圖及具體實施例對本發明進行詳細說明。以下實施例將有助于本領域的技術人員進一步理解本發明,但不以任何形式限制本發明。應當指出的是,對本領域的普通技術人員來說,在不脫離本發明構思的前提下,還可以進行若干變形和改進,這些都屬于本發明的保護范圍。
實施例1
在純Mg表面制備用于載藥的可降解高分子載體及生物活性鈣-磷復合涂層,最終形成的復合涂層,其結構示意圖見附圖1,包括鎂基底4、氟化膜3、生物可降解高分 子涂層2和生物活性鈣-磷涂層1。制備時,首先將純鎂制作成的試樣,依次用320目、1200目和3000目的水砂紙打磨。用無水乙醇和丙酮分別超聲清洗10min,吹干。將試樣放在40%HF溶液中室溫浸泡24h,先后用去離子水、無水乙醇清洗,吹干。取重均分子量為80000~100000的聚三亞甲基碳酸酯(PTMC),按8wt.%的比例溶于乙酸乙酯溶劑中,采用浸涂法把聚三亞甲基碳酸酯均勻涂覆在氟化處理純鎂表面,將涂覆有聚三亞甲基碳酸酯涂層的純鎂放入真空干燥箱35℃干燥48h,即得到以聚三亞甲基碳酸酯涂層為藥物載體的樣品。將該涂覆有生物可降解高分子涂層的樣品放入紫外臭氧儀器紫外輻照0.5~60min,然后將試樣放入CaHPO4∶NaOH=6∶4(wt.%)的溶液中水浴恒溫(20℃)浸泡48h,取出后用超純水清洗兩次,吹干,即可得到用于載藥的高分子載體及生物活性鈣-磷復合涂層。掃描電鏡觀察到化學轉化膜厚度為2μm,成分分析結果表面該化學轉化膜為MgF2,觀察到高分子涂層厚度為12μm,觀察到Ca-P涂層厚度約為50μm,Ca/P原子比為1∶1,進一步XRD檢測顯示該鈣磷涂層為透鈣磷石Brushite(附圖2)。掃描電鏡檢測可見高分子層上完備的覆蓋了一層片狀的鈣磷晶體,晶體尺寸在100微米左右(附圖3)。力學性能測試結果表明聚合物涂層與基體的結合力及生物活性鈣磷涂層與聚合物涂層結合力均較強,超過12MPa。該復合涂層的細胞毒性0級,滿足細胞相容性要求。
實施例2
在AZ31(Mg-Al系)合金表面制備用于載藥的可降解高分子載體及生物活性鈣-磷復合涂層。首先將AZ31鎂合金制作成的試樣,依次用320目、1200目和3000目的水砂紙打磨。用無水乙醇和丙酮分別超聲清洗10min,吹干。將試樣放在40%HF溶液中水浴恒溫(20℃)浸泡14h,先后用去離子水、無水乙醇清洗,吹干。取重均分子量為100000~150000的外消旋聚乳酸(PDLLA),按6wt.%的比例溶于乙酸乙酯溶劑中,同時取紫杉醇按2wt.%的比例溶解,采用浸涂法把混有紫杉醇藥物的聚乳酸溶液均勻涂覆在氟化處理鎂合金表面,將涂覆有載紫杉醇的聚乳酸涂層的鎂合金放入真空干燥箱35℃干燥48h,即得到以聚乳酸涂層為藥物載體的鎂合金樣品。將涂覆有載藥生物可降解高分子涂層(載紫杉醇藥物的聚乳酸涂層)的樣品放入氧氣等離子體表面處理器預處理0.5~60min,然后將試樣放入Ca(H2PO4)2·H2O:NaOH=8:2(wt.%)的溶液中在25℃浸泡10h,取出后用超純水清洗兩次,吹干,即可得到載藥的高分子層及生物活性鈣-磷復合涂層,其結構如圖4所示。掃描電鏡觀察到化學轉化膜厚度為1μm,成分分析結果表面該化學轉化膜為MgF2,截面SEM-EDX檢測(附圖4)顯示鎂合金基體上一層厚度約為5μm的高分子層(距離表面8-13微米處C,O峰顯著增高) 上繼續復合了一層厚度約為8μm的鈣磷涂層(距離0-8微米處Ca,P,O峰顯著增高)。Ca/P原子比為1.2:1。測試結果表明聚合物涂層與基體的結合力及生物活性鈣磷涂層與聚合物涂層結合力強,超過10MPa。該復合涂層的成骨細胞毒性在0-1級間,滿足細胞相容性要求。涂層載紫杉醇藥物量約80μg,一周內累計釋放藥物量約23%,并且沒有出現明顯的藥物突釋現象(附圖6)。
實施例3
在Mg-Nd-Zn-Zr合金表面制備用于載藥的可降解高分子載體及生物活性鈣-磷復合涂層。首先將Mg-Nd-Zn-Zr鎂合金制作成的試樣,依次用320目、1200目和3000目的水砂紙打磨。用無水乙醇和丙酮分別超聲清洗10min,吹干。將試樣放在20%HF溶液中水浴恒溫(20℃)浸泡8h,先后用去離子水、無水乙醇清洗,吹干。取重均分子量為80000~100000的聚乳酸-羥基乙酸共聚物(PLGA),按8wt.%的比例溶于乙酸乙酯溶劑中,同時取紫杉醇按2wt.%的比例溶解,采用浸涂法把混有紫杉醇藥物的PLGA溶液勻涂覆在氟化處理鎂合金表面,將涂覆有PLGA涂層的鎂合金放入真空干燥箱35℃干燥48h,即得到以PLGA涂層為藥物載體的鎂合金。將涂覆有載藥生物可降解高分子涂層的樣品放入紫外臭氧儀器紫外輻照0.5~60min,然后將試樣放入Ca3(PO4)2∶NaOH=8∶2(wt.%)的溶液中在4℃浸泡6h,取出后用超純水清洗兩次,吹干,即可得到用于載藥的高分子載體及生物活性鈣-磷復合涂層。掃描電鏡觀察到化學轉化膜厚度為800nm,成分分析結果表面該化學轉化膜為MgF2。觀察到高分子涂層厚度約為10μm,觀察到Ca-P涂層厚度約為6μm,Ca/P原子比為1.1∶1。測試結果表明聚合物涂層與基體的結合力及生物活性鈣磷涂層與聚合物涂層結合力強,超過10MPa。該復合涂層的成骨細胞毒性在0-1級間,滿足細胞相容性要求。涂層載紫杉醇藥物量約150μg,一周內累計釋放藥物量約39%,并且沒有出現明顯的藥物突釋現象。
實施例4
在ZK60(Mg-Zn系)合金表面制備用于載藥的可降解高分子載體及生物活性鈣-磷復合涂層。首先將ZK60鎂合金制作成的試樣,依次用320目、1200目和3000目的水砂紙打磨。用無水乙醇和丙酮分別超聲清洗10min,吹干。將試樣放在20%HF溶液中水浴恒溫(20℃)浸泡24h,先后用去離子水、無水乙醇清洗,吹干。取重均分子量為80000~100000的聚乳酸-三亞甲基碳酸酯共聚物(P(LA-TMC)),按10wt.%的比例溶于乙酸乙酯溶劑中,同時取雷帕霉素按10wt.%的比例溶解,采用浸涂法將混 有雷帕霉素藥物的聚乳酸-三亞甲基碳酸酯共聚物均勻涂覆在氟化處理鎂合金表面,將涂覆有P(LA-TMC)涂層的鎂合金放入真空干燥箱35℃干燥48h,即得到以P(LA-TMC)涂層為藥物載體的鎂合金。將涂覆有生物可降解高分子涂層的樣品放入紫外臭氧儀器紫外輻照15min,然后將試樣放入Ca(H2PO4)2∶NaOH=7∶3(wt.%)的溶液中水浴恒溫(20℃)浸泡24h,取出后用超純水清洗兩次,吹干,即可得到用于載藥的高分子載體及生物活性鈣-磷涂層。掃描電鏡觀察到化學轉化膜厚度為1.5μm,成分分析結果表面該化學轉化膜為MgF2,觀察到高分子涂層厚度為15μm,觀察到Ca-P涂層厚度為40μm,Ca/P原子比為1∶1。成骨細胞粘附實驗顯示修飾復合涂層的樣品(附圖5c)比陰性對照組(TCPS培養皿,附圖5a)及未修飾的ZK60鎂合金(附圖5b)具有更高的粘附細胞密度,說明制得的Ca-P表面涂層具有更優異的生物相容性。測試結果表明聚合物涂層與基體的結合力及生物活性鈣磷涂層與聚合物涂層結合力均較強,超過11MPa。該復合涂層的細胞毒性在0-1級間,滿足細胞相容性要求。涂層載雷帕霉素藥物量約450μg,一周內累計釋放藥物量約28%,并且沒有出現明顯的藥物突釋現象。
以上對本發明的具體實施例進行了描述。需要理解的是,本發明并不局限于上述特定實施方式,本領域技術人員可以在權利要求的范圍內做出各種變形或修改,這并不影響本發明的實質內容。
- 還沒有人留言評論。精彩留言會獲得點贊!